连花急支片在慢性支气管炎大鼠中的药效学研究
2017-03-01冯娜娜陈翠翠宋元林白春学金先桥
周 霞 冯娜娜 李 静 陈翠翠 宋元林 白春学 金先桥 周 建△
(1复旦大学附属中山医院呼吸科 上海 200032; 2复旦大学附属华山医院呼吸科 上海 200040)
连花急支片在慢性支气管炎大鼠中的药效学研究
周 霞1,2冯娜娜1李 静1陈翠翠1宋元林1白春学1金先桥2周 建1△
(1复旦大学附属中山医院呼吸科 上海 200032;2复旦大学附属华山医院呼吸科 上海 200040)
目的 评价连花急支片在慢性支气管炎中的药效学作用。方法 将72只SD大鼠分6组:对照组、吸烟组、吸烟+连花高剂量组、吸烟+连花中剂量组、吸烟+连花低剂量组、吸烟+乙酰半胱氨酸组。采用吸烟法复制慢性支气管炎模型后给予不同药物治疗。采用肺功能检测仪分析气道反应性。肺组织HE染色评价各组大鼠气道炎症程度及病理改变情况。ELISA法检测血清和肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中炎性细胞因子的浓度,对连花急支片的药效学作用进行综合评价。结果 连花急支片和乙酰半胱氨酸可以改善吸烟大鼠怠倦、咳嗽等一般状况;连花急支片和乙酰半胱氨酸能明显改善吸烟大鼠气道弹性阻力和肺顺应性;连花急支片和乙酰半胱氨酸能减轻吸烟大鼠支气管黏膜炎性细胞浸润和管壁水肿等病理改变; 连花急支片和乙酰半胱氨酸能显著降低吸烟大鼠BALF中IL-4、IL-13和IFN-γ水平;连花急支片和乙酰半胱氨酸可不同程度降低大鼠血清IL-6和TNF-α水平。结论 连花急支片可以通过调节炎性细胞因子的平衡,减少大鼠支气管黏膜炎性细胞浸润和病理改变,改善肺功能,从而达到治疗效果。
连花急支片; 慢性支气管炎; 慢性阻塞性肺疾病; 药效学; 大鼠
支气管炎是指气管、支气管黏膜及其周围组织的慢性非特异性炎症。支气管炎主要原因为病毒和细菌的反复感染形成了支气管的慢性非特异性炎症。当气温下降、呼吸道小血管痉挛缺血、防御功能下降时,易于致病;烟雾粉尘、污染大气等慢性刺激也可发病;吸烟使支气管痉挛、黏膜变异、纤毛运动降低、黏液分泌增多有助于感染;过敏因素也有一定关系。慢性支气管炎进一步发展即为慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)。已有研究证明连花急支片具有清宣肺热,化痰止咳的功能[1],主要用于痰热壅肺型急性气管-支气管炎,但在慢性支气管炎中的疗效还不明确。慢性支气管炎具有缓慢进行性发展、反复急性发作的特点,临床上常规给予抗感染、止咳化痰平喘等对症治疗,其防治也一直是中医药界研究的课题之一。
本研究旨在评价连花急支片治疗慢性支气管炎的效果,为慢性哮喘症状的控制以及临床综合治疗提供更多的选择。本实验拟建立大鼠慢性支气管炎模型,观察连花急支片对慢性支气管炎大鼠血清、支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)、肺组织病理情况及肺功能的影响,以探讨其对支气管炎性介质及细胞因子的作用机制。
材 料 和 方 法
主要材料与试剂 清洁级SD大鼠72只,雄性,体质量200~250 g,购于上海斯莱克实验动物有限责任公司,实验前适应性饲养1周。连花急支片,购自石家庄以岭药业股份有限公司;大前门牌香烟(烤烟型香烟,焦油量11 mg,烟气烟碱量0.8 mg,烟气一氧化碳量13 mg),购自上海烟草集团有限责任公司;乙酰半胱氨酸,购自美国Sigma公司;IL-4、IL-13、IFN-γ、TNF-α、IL-6 ELISA试剂盒,购自武汉博士德生物工程有限公司。小动物肺功能分析仪(型号BUXCO RC),购于美国DSI公司。
实验方法
模型制作与分组 将大鼠按随机数字表法分为6组,即对照组、吸烟组、吸烟+连花高剂量组、吸烟+连花中剂量组、吸烟+连花低剂量组、吸烟+乙酰半胱氨酸组,每组12只。吸烟法是构建支气管炎最常用的方法,我们根据彭红星等[2]的方法进行改进,自制70 cm×60 cm×58 cm的烟熏箱,四边各留一个直径2 cm左右的通气孔,除对照组外,其余60只大鼠置于烟熏箱内。每天烟熏2次,5支/次,每次30 min,连续60天,正常对照组不做任何处理。
给药方法 给药组自造模第60天起灌胃给药。每天1次,共7 天。连花急支片大剂量治疗组(7.4 g/kg)、连花急支片中剂量治疗组(3.7 g/kg)、连花急支片小剂量治疗组(1.9 g/kg)、乙酰半胱氨酸治疗组(200 mg/kg)。对照组和吸烟组给予等体积的生理盐水。
一般情况观察 实验过程中,每天同一时间观察1次,记录动物的外观、行为活动、步态、精神状态、体重、食欲、尿、大便、呼吸(咳嗽)、瞳孔、皮毛、有无流涎、恶心、呕吐、死亡或濒死情况等。
气道反应性分析 最后一次给药后24 h,用小动物肺功能测定仪测定气道反应性指标(肺顺应性和肺弹性阻力)。
血清TNF-α、IL-6水平检测 最后一次给药后24 h,腹腔注射2 %戊巴比妥钠40 mg/kg麻醉后,进行腹主动脉取血,置于促凝管中,4 ℃下以3 000 r/min(离心半径为15 cm)离心5 min后取血清置-80 ℃冰箱中冷藏,ELISA方法测定TNF-α,IL-6。
支气管肺泡灌洗液IL-4,IL-13,IFN-γ水平检测 取血后,分离出完整的气管、支气管和肺组织,气管插管,结扎右侧主支气管,于主气管喉软骨下0.5 cm处切一倒T 型口,插入18号灌胃针头(达1 cm处) ,用手术丝线扎紧,接5 mL注射器(去针头) ,每次注入3 mL生理盐水,停留30 s,缓慢吸出,重复5次,回收率>80%。将支气管BALF置于冰上,4 ℃,3 000 r/min(离心半径为15 cm)离心15 min,收集的上清移至另一干净EP管中,置于-80 ℃。ELISA方法测定支气管BALF中的IL-4、IL-13、IFN-γ。
肺组织病理学观察 常规留取右肺组织,保留右肺门动脉及气管,将其放入缓冲中性4%甲醛溶液,固定48 h后常规石蜡包埋切片,肺组织HE染色,用于镜下观察肺内支气管损伤情况,支气管周围炎性细胞浸润情况,管腔内是否有渗出物,支气管是否扩张等。

结 果
一般情况观察 对照组一般状态没有明显改变,呼吸平稳,状态活跃,吸烟组小鼠烟熏后典型表现为:咳嗽,倦怠,食欲减退,活动明显减少。随着吸烟时间的延长,上述症状逐渐加重,且出现痰鸣音、呼吸困难等现象,体质量增长缓慢,差异具有统计学意义(表1,P<0.01)。连花各剂量组和乙酰半胱氨酸组痰鸣音减轻,咳嗽等症状得到缓解,体质量增长速度较吸烟组有不同程度加快,但差异没有统计学意义(表1,P>0.05)。
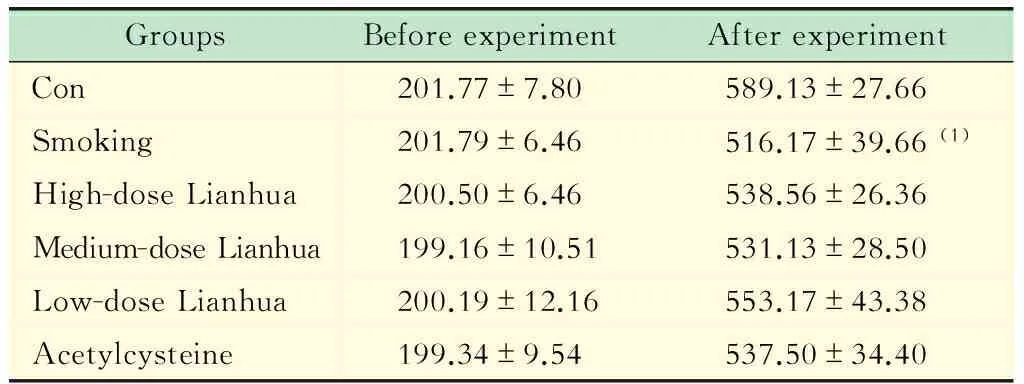
各组大鼠气道反应性的比较 与对照组相比,吸烟组肺弹性阻力增加,肺顺应性下降;连花高、中、低剂量组和乙酰半胱氨酸组肺弹性阻力较吸烟组均有不同程度降低,肺顺应性也稍有增高,但差异没有统计学意义(图1,P>0.05)。
各组大鼠肺组织病理学改变的比较 对照组可见小支气管管腔规则,气管黏膜上皮完整,纤毛未见脱落,管壁未增厚,管腔内无渗出,肺泡结构正常。
表1 各组大鼠体质量的改变
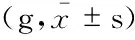
GroupsBeforeexperimentAfterexperimentCon201.77±7.80589.13±27.66Smoking201.79±6.46516.17±39.66(1)High-doseLianhua200.50±6.46538.56±26.36Medium-doseLianhua199.16±10.51531.13±28.50Low-doseLianhua200.19±12.16553.17±43.38Acetylcysteine199.34±9.54537.50±34.40
(1)vs. control group,P<0.01.
图1 大鼠气道反应性检测
吸烟组大鼠支气管纤毛柱状上皮变性、坏死脱落,支气管管壁充血水肿伴有不同程度炎性细胞浸润,以淋巴细胞为主,管壁平滑肌增厚明显,支气管管腔变狭窄,肺泡腔大小不一,肺泡间隔增宽。连花各剂量组尤其是高剂量组以及乙酰半胱氨酸组,可见气管、细支气管炎性细胞浸润吸收较明显,管壁充血水肿现象减轻,纤毛柱状上皮变性、坏死脱落现象较吸烟组有所改善(图2)。
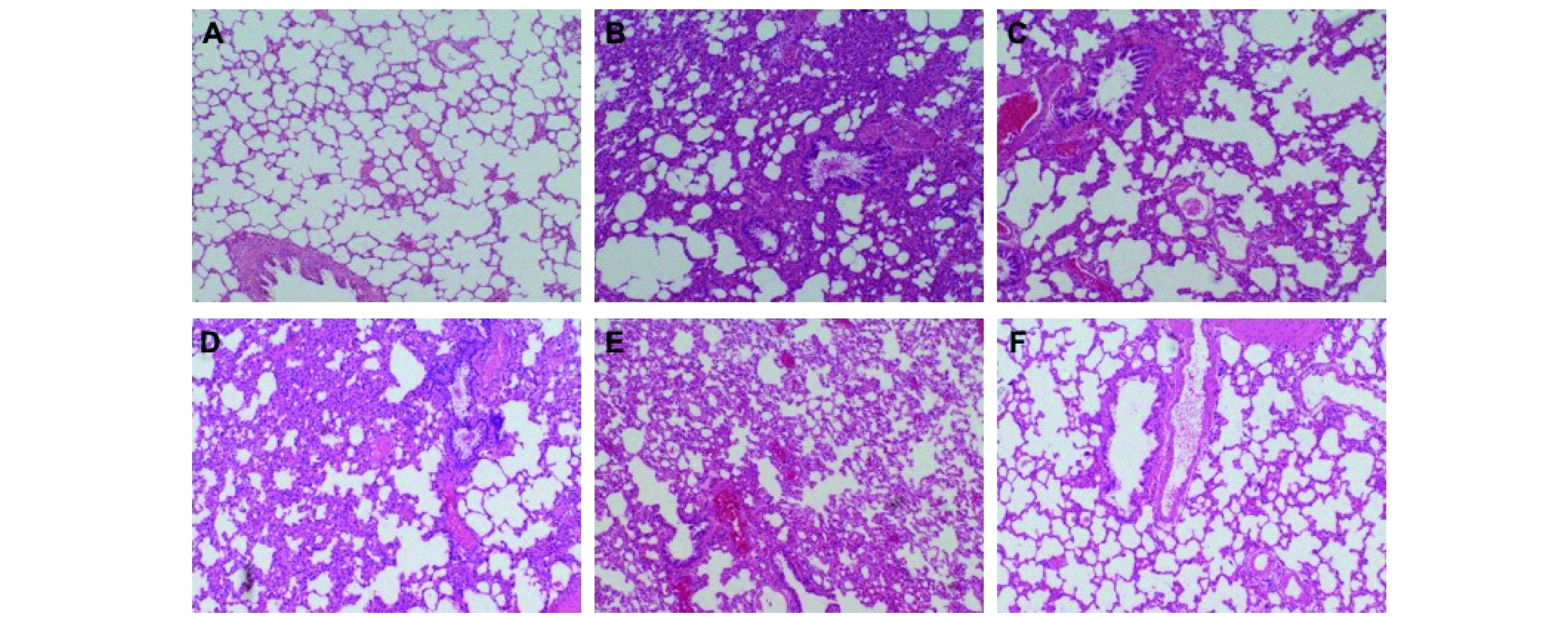
A:Control group;B:Smoking group;C:Smoking and high-doseLianhuagroup;D:Smoking and medium-doseLianhuagroup;E:Smoking and low-doseLianhuagroup;F:Smoking and acetylcysteine group.
图2 大鼠肺组织HE染色(×100)
Fig 2 Lung HE staining in rats (×100)
各组大鼠BALF中IL-4、IL-13、IFN-γ水平的比较 吸烟组大鼠BALF中IL-4、IL-13、IFN- γ水平显著升高,差异有统计学意义(P<0.01或P<0.05);连花中剂量组、连花低剂量组和乙酰半胱氨酸组IL-4、IL-13、IFN-γ水平较吸烟组显著降低,差异有统计学意义(P<0.01);连花高剂量组与吸烟组相比,IL-4、IL-13水平显著降低,差异有统计学意义(P<0.01),IFN-γ水平也稍有下降,但差异无统计学意义(图3)。
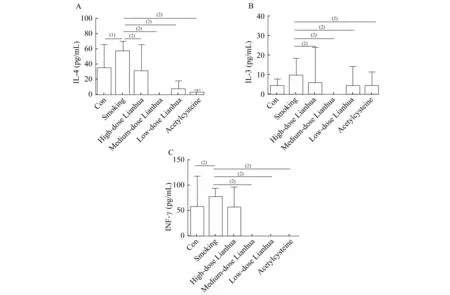
A:Levels of IL-4 in BALF;B:Levels of IL-13 in BALF;C:Levels of IFN-γ in BALF.(1)P<0.05,(2)P<0.01.
图3 大鼠肺泡灌洗液中IL-4、IL-13和IFN-γ的水平
Fig 3 Levels of IL-4,IL-13 and IFN-γ in bronchoalveolar lavage fluid in rats
各组大鼠血清中IL-6、TNF-α水平的比较 与对照组相比,吸烟组血清IL-6、TNF-α水平均有不同程度上升,IL-6升高较显著,差异有统计学意义(P<0.01);连花高、中、低剂量组和乙酰半胱氨酸组IL-6和TNF-α水平均较吸烟组有不同程度降低(图4)。
A:Levels of IL-6 in serum;B:Levels of TNF-α in serum.(1)P<0.01.
图4 大鼠血清中IL-6和TNF-α的水平
Fig 4 Serum levels of IL-6 and TNF-α in rats
讨 论
吸烟是COPD的主要危险因素,慢性支气管炎又与COPD密切相关。本研究使用吸烟法制备大鼠慢性支气管炎模型模拟了人类慢性支气管炎的发生发展。吸烟大鼠出现咳嗽、体重增长缓慢、气道阻塞等症状,肺组织HE染色显示吸烟组病理学改变符合人类慢性支气管炎的表现,说明大鼠慢性支气管炎模型复制是成功的。连花急支片各剂量组和乙酰半胱氨酸组能减轻吸烟大鼠支气管黏膜炎性细胞浸润和黏膜上皮脱落程度,减少支气管腔内黏液分泌,减轻支气管管壁水肿,表明连花急支片和乙酰半胱氨酸可改善慢性支气管炎大鼠支气管和肺组织的病理变化,具有缓解支气管炎症的作用。
慢性支气管炎时,支气管管壁增厚,引起管腔狭窄,支气管杯状细胞增生,黏液分泌增多,黏稠的分泌物滞留于气道内,从而引起气道阻塞;烟雾刺激及炎性介质引起支气管强烈收缩,使气道弹性阻力增加,肺泡壁弹性组织破坏,使肺顺应性降低。给予连花急支片和乙酰半胱氨酸治疗后,肺弹性阻力明显降低,肺顺应性也有了显著好转。
辅助性T细胞亚群与COPD发生具有重要关系,Th1/Th2细胞功能失衡可能是COPD的重要发病机制[3-5]。IL-4主要是由Th2细胞产生的一种促进体液免疫、抑制细胞免疫的特征性细胞因子,相关研究已明确IL-4在COPD发病过程中为促炎因子[6-8]。研究显示IL-13与COPD的发生、发展密切相关,并且与病情严重程度呈正比[7,9-10]。我们的研究结果表明,连花急支片各剂量组和乙酰半胱氨酸组能显著降低吸烟组升高了的IL-4和IL-13水平(P<0.01),抑制Th2细胞功能,使Th2细胞因子分泌下降。而IFN-γ是另一种由Th1细胞产生调节细胞功能的小分子多肽,过去的研究发现COPD患者痰中IFN-γ水平显著上调,说明COPD患者Th1功能亢进,IFN-γ的过度活化打破了Th1/Th2的平衡状态,激活中性粒细胞,促进炎性介质和炎性细胞的大量释放,引起异常的免疫应答和炎性反应[8,11]。另有研究显示IFN-γ能刺激诱导MMP-9的释放,后者可降解细胞外基质,使肺泡无效腔扩大,肺组织弹力逐渐丧失,继而形成肺气肿[12]。本研究结果显示,吸烟组IFN-γ水平明显高于对照组,差异具有统计学意义(P<0.01),与之前的报道结果一致;连花中剂量组、连花低剂量组、乙酰半胱氨酸组IFN-γ水平显著下调(P<0.01),说明连花急支片和乙酰半胱氨酸可以抑制Th1细胞功能,使Th1、Th2细胞相互平衡,以维持正常的免疫功能。
TNF-α是由巨噬细胞和淋巴细胞产生的一种重要的促炎因子,适量的TNF-α具有抗感染、抗病毒和抗肿瘤作用,但是TNF-α过量,则使微血管通透性增加,趋化和激活中性粒细胞,介导过度炎性反应,引起气道损伤,TNF-α还可刺激单核细胞等产生IL-6,后者是一种调节免疫应答的糖蛋白,对中性粒细胞及多种炎性细胞具有趋化和激活作用[13]。本研究结果显示,吸烟组大鼠血清TNF-α和IL-6水平均较对照组增高,给予连花急支片和乙酰半胱氨酸治疗后,TNF-α和IL-6水平均有不同程度的降低,说明TNF-α和IL-6确实在慢性支气管炎的发生发展中起着重要作用,而连花急支片和乙酰半胱氨酸能通过调节免疫功能,降低慢性支气管炎大鼠体内TNF-α和IL-6水平,减少其对气道的进一步损伤,从而控制炎症的发展。
综上所述,连花急支片与乙酰半胱氨酸作用相当,能降低慢性支气管炎大鼠气道弹性阻力,提高肺顺应性,减少支气管及肺组织中中性粒细胞、炎性介质和细胞因子浸润,对控制气道炎症有较好的疗效。该作用机制可能通过减少Th2细胞因子IL-4、IL-13,抑制Th1细胞因子IFN-γ,使Th1/Th2细胞功能达到平衡;同时,也通过降低TNF-α和IL-6水平,抑制中性粒细胞和多种炎性细胞的趋化和激活,达到控制炎症的目的。目前,连花急支片已在临床上急性支气管炎患者中得到广泛应用,在慢性支气管炎中治疗剂量的选择还需随机对照临床研究进一步证实,作为一种中药制剂,该药不良反应少,安全性好,值得推广。
[1] 谷春华,王宏涛,朱慧明,等.连花急支片治疗急性支气管炎药效学研究 [J].亚太传统医药,2015,11(9):9-11.
[2] 彭红星,杨荣时,曾玉兰.细胞间黏附分子-1、巨噬细胞炎性蛋白-2在吸烟诱导的支气管炎大鼠模型中的变化及其意义 [J].实用医学杂志,2009,25(14):2234-2236.
[3] BARCZYK A,PIERZCHALA W,KON OM,etal.Cytokine production by bronchoalveolar lavage T lymphocytes in chronic obstructive pulmonary disease [J].JAllergyClinImmunol,2006,117(6):1484-1492.
[4] HODGE G,NAIRN J,HOLMES M,etal.Increased intracellular T helper 1 proinflammatory cytokine production in peripheral blood,bronchoalveolar lavage and intraepithelial T cells of COPD subjects [J].ClinExpImmunol,2007,150(1):22-29.
[5] WANG HY,PENG WD,WENG YS,etal.Imbalance of Th17/Treg cells in mice with chronic cigarette smoke exposure [J].IntImmunopharmacol,2012,14(4):504-512.
[6] CAO Y,GONG W,ZHANG H,etal.A Comparison of Serum and Sputum Inflammatory Mediator Profiles in Patients with Asthma and COPD [J].JIntMedRes,2012,40(6):2231-2242.
[7] MAY RD,FUNG M.Strategies targeting the IL-4/IL-13 axes in disease [J].Cytokine,2015,75(1):89-116.
[8] EICKMEIER O,HUEBNER M,HERRMANN E,etal.Sputum biomarker profiles in cystic fibrosis (CF) and chronic obstructive pulmonary disease (COPD) and association between pulmonary function [J].Cytokine,2010,50(2):152-157.
[9] LEE JS,ROSENGART MR,KONDRAGUNTA V,etal.Inverse association of plasma IL-13 and inflammatory chemokines with lung function impairment in stable COPD:a cross-sectional cohort study [J].RespRes,2007,8(6):795-800.
[10] MIOTTO D,RUGGIERI MP,BOSCHETTO P,etal.Interleukin-13 and-4 expression in the central airways of smokers with chronic bronchitis [J].EurRespirJ,2003,22(4):602-608.
[11] HENS G,VANAUDENAERDE BM,BULLENS DMA,etal.Original article Sinonasal pathology in nonallergic asthma and COPD:‘united airway disease’ beyond the scope of allergy [J].Allergy,2008,63(3):261-267.
[12] 谈春江,杜娟.慢性阻塞性肺疾病稳定期基质金属蛋白酶-9和γ-干扰素与肺功能的相关性 [J].贵阳医学院学报,2015,40(2):146-148.
[13] 黄勇,黄亚林,苏韫,等.野菊花提取物对慢性支气管炎大鼠血清和支气管肺泡灌洗液中TNF-α、IL-6含量及肺组织病理形态学的影响 [J].中国老年学杂志,2010,30(18):2614-2616.
Effectiveness ofLianhuaJizhiTablets for chronic bronchitis in rats
ZHOU Xia1,2, FENG Na-na1, LI Jing1, CHEN Cui-cui1, SONG Yuan-lin1, BAI Chun-xue1, JIN Xian-qiao2, ZHOU Jian1△
(1DepartmentofRespiratoryMedicine,ZhongshanHospital,FudanUniversity,Shanghai200032,China;2DepartmentofRespiratoryMedicine,HuashanHospital,FudanUniversity,Shanghai200040,China)
Objective To study the effectiveness ofLianhuaJizhiTablets for chronic bronchitis. Methods Seventy-two SD rats were assigned to six groups:control group,smoking group,smoking and high-doseLianhuagroup,smoking and medium-doseLianhuagroup,smoking and low-doseLianhuagroup and smoking and acetylcysteine group.The rat model of chronic bronchitis was established by daily exposure to cigarette smoking and then treated with different treatments.Airway responsiveness was assessed by pulmonary function meter.HE staining of lung tissue was used to analyze the degree of inflammatory response and the pathological changes.ELISA was used to detect the concentration of inflammatory cytokines in serum and bronchoalveolar lavage fluid (BALF). Results AfterLianhuaJizhiTablets and acetylcysteine treatment,the performance status of smoking rat was significantly elevated.LianhuaJizhiTablets and acetylcysteine treatment could significantly improve the airway responsiveness of smoking rats.HE staining showed that infiltration of inflammatory cells in bronchia and edema of bronchial wall were alleviated byLianhuaJizhiTablets and acetylcysteine treatment.LianhuaJizhiTablets and acetylcysteine treatment could significantly reduce the levels of IL-4,IL-13and IFN- γ in BALF of smoking rats.Levels of IL-6 and TNF-α in serum decreased at different degrees byLianhuaJizhiTablets and acetylcysteine treatment. Conclusions Similar to acetylcysteine,LianhuaJizhiTablets alleviated the infiltration of inflammatory cells,pathological changes and improved pulmonary function in rats through regulating the balance of inflammatory cytokines,and consequently achieved a therapeutic effect.
LianhuaJizhiTablets; chronic bronchitis; chronic obstructive pulmonary disease; effectiveness; rat
北京市科委“十病十药专项”(Z121102001112002);国家自然科学基金(81570028,81400018,81500026)
R562.2
A
10.3969/j.issn.1672-8467.2017.01.004
2016-06-30;编辑:王蔚)
△Corresponding author E-mail:zhou.jian@fudan.edu.cn
*This work was supported by“Ten Diseases and Ten Drugs Research Project” of Beijing Science and Technology Commission(Z121102001112002) and the National Natural Sciencec Foundation of China (81570028,81400018,81500026).
