Salubrinal通过抗氧化应激延缓细胞衰老的实验研究
2017-03-01李敏超束婷婷唐伟娄青林顾刘宝
李敏超 束婷婷 唐伟 娄青林 顾刘宝
Salubrinal通过抗氧化应激延缓细胞衰老的实验研究
李敏超 束婷婷 唐伟 娄青林 顾刘宝
目的 观察Salubrinal对Etoposide诱导的大鼠肾小管上皮细胞(NRK-52E)衰老的保护作用,并探讨其可能的作用机制。 方法 将NRK-52E细胞株分为对照组、衰老组(Etoposide 1μg/ml诱导)及治疗组(Etoposide 1μg/ml+Salubrinal 50 μmol/L),药物干预24 h后于倒置显微镜下观察各组NRK-52E细胞形态,β-半乳糖苷酶活性(SA-β-gal)染色方法检测细胞衰老情况,荧光素酶报告基因法检测p16启动子活性,DCFH法检测ROS的水平, Western blot法检测氧化应激标志性蛋白c-fos表达水平。 结果 与对照组相比,Etoposide刺激24 h后NRK-52E细胞衰老明显增加,Salubrinal干预后NRK-52E细胞衰老形态改善;Etoposide刺激后活性氧(ROS)产生增多,p16启动子活性增强,c-fos表达增加,Salubrinal干预后上述现象均被逆转。 结论 Salubrinal可能通过抗氧化应激延缓Etoposide诱导的NRK-52E细胞衰老。
Salubrinal;衰老;氧化应激;保护
细胞衰老最初由Hayflick 在1961 年观察到,指细胞由生长状态转变为不可逆的生长停止状态[1]。细胞衰老是个体衰老在细胞水平的体现,常被用作衰老研究的实验工具[2]。细胞衰老与个体衰老关系密切, 组织器官中衰老细胞的比例随年龄上升而逐渐上升[3],细胞衰老可以通过多种途径促进个体衰老及衰老相关性疾病[4],而清除衰老细胞能有效延缓衰老症状的出现[5]。因此,延缓细胞衰老对于整体抗衰老具有极为重要的意义和作用。
Salubrinal是一种小分子化合物,由Boyce等[6]在2005年首先报道。研究显示,Salubrinal对细胞具有多方面的保护作用,可以对抗多种病理状态诱发的细胞凋亡[7],能改善氧化应激[8],抑制 NF-κB 活性[9]。氧化应激是细胞衰老的促进因素,干细胞的DNA损伤常伴氧化应激,是干细胞衰老的问责因子[10]。同时氧化应激是衰老的主要驱动力之一,在衰老和衰老相关性疾病中可以发现过多的活性氧及其他氧化应激产物[11]。因此,本研究建立Etoposide诱导体外培养细胞衰老模型,予Salubrinal进行干预,探讨Salubrinal通过抗氧化应激延缓细胞衰老的可能机制。
1 材料与方法
1.1 药物与试剂 Etoposide购自日本和光纯药工业株式会社,刺激浓度为1 μg/ml;Salubrinal 购自埃利斯维尔tocris生物科学,刺激浓度为50 μmol/L。DMEM/F12培养基购自美国Hyclone公司;胎牛血清(Fetal bovine serum, FBS)、0.25%胰酶均购自于Gibco公司。活性氧(reactive oxygen species,ROS)检测试剂盒购自碧云天有限公司。p16INK4a-luc质粒由日本昭和大学Kiyoshi Nose教授惠赠。c-fos、β-actin和羊抗兔IgG等抗体均购于美国Cell Signaling Technology公司。ECL(Electro-Chemi-Luminescence)发光液和PVDF(Polyvinylidene fluoride)膜购于Millipore公司。
1.2 仪器 CO2恒温培养箱(日本Sanyo公司);倒置相差显微镜(日本Olympus公司);低速离心机(美国Scilogex公司);PowerPacBasic电泳仪(美国Bio-Rad公司);荧光素酶分析系统(美国Promega公司)。
1.3 大鼠肾小管上皮细胞(NRK-52E)培养及干预 NRK-52E细胞株由日本山梨大学Kitamura教授惠赠。NRK-52E细胞用5%胎牛血清的DMEM/F12培养基,在37 ℃、5% CO2培养箱内培养传代,细胞生长汇合至80%时,弃原培养基,均匀加入0.25%胰酶1 ml,置于培养箱中消化约3 min,待贴壁细胞漂浮后,用5 ml培养基终止消化,吹打混匀制成单细胞悬液并转移至15 ml离心管中,于低速离心机中1000 r/min离心4 min。吸去上清液,向细胞团块中加入适量培养基,1/4~1/3传代,每2~3 d传代1次。取处于对数生长期的NRK-52E细胞,以2×105个/孔的密度铺板至6孔板中,37 ℃、5% CO2培养24 h后,衰老组予浓度为1 μg/ml的Etoposide刺激,治疗组予浓度为1 μg/ml的Etoposide刺激及浓度为50 μmol/L 的Salubrinal干预,干预后24 h观察细胞形态及p16INK4a启动子活性变化。
1.4 倒置显微镜观察形态学变化 取处于对数生长期的NRK-52E细胞接种于6孔板,铺板密度为2×105个/孔,37 ℃、5% CO2培养24 h后,分组给药刺激,24 h后在倒置显微镜下观察细胞衰老的形态学变化,并以倒置相差显微镜(日本Olympus公司CK40-SL)拍摄细胞形态照片(200倍)。
1.5 SA-β-gal染色 实验结束后收板以3% 福尔马林固定细胞4 min,于X-gal溶液在37 ℃下培育6~24 h,倒置显微镜可见衰老细胞可经此法阳染而成为蓝色。X-gal溶液组成:1 mg/ml X-gal,40 mmol/L pH 6.0的citric acid/sodium phosphate,5 mmol/L potassium ferricyanide, 5 mmol/L potassium ferrocyanide, 150 mmol/L氯化钠和2 mmol/L氯化镁。
1.6 ROS检测 将NRK-52E细胞以1×105/孔的密度铺板于12孔板中,37 ℃、5% CO2培养24 h后,给细胞换液,按6 h,1 h时间点给予药物刺激,置于培养箱30 min后,用不含血清的培养液洗3遍,装载探针,25 min后,再用不含血清的培养液洗3遍,置于荧光显微镜下观察荧光。
1.7 细胞转染及荧光素酶检测 将NRK-52E细胞铺于35 mm培养皿中,细胞数约2×105个,当生长融合接近80%时,将6 μl lipofectamine转染试剂及3 μg pGL2-p16INK4a-luc质粒分别加入500 μl不含FBS的培养基中,吹打混匀后静置5 min,然后将加入质粒及转染试剂的液体混匀后静置20 min,最后将上述混合液均匀滴入细胞中进行转染,置于培养箱中6~8 h后换液,即得到转染pGL2-p16INK4a质粒的细胞,于培养箱培养18~24 h后重新铺板于96孔板,密度为2×104/孔,24 h后给予药物刺激,衰老组予浓度为1 μg/mL的Etoposide刺激,治疗组予浓度为1 μg/ml的Etoposide刺激及浓度为50 μmol/L的Salubrinal干预24 h后收板并检测各组luciferase值,荧光素酶的活性通过荧光素酶分析系统根据制造商的方案进行评估,以CCK-8(Cell Counting Kit)结果校正细胞数量。
1.8 Western blot检测蛋白表达 吸去待收板细胞原培养液,PBS缓冲液洗2遍后加入裂解液,于冰上充分震荡裂解,BSA(Bovine Serum Albumin)法测定蛋白浓度。取蛋白样品各60 μg,在电泳槽中进行聚丙烯酰胺凝胶电泳,电转膜至PVDF膜上,TBST(TBS+Tween)封闭1 h,一抗孵育过夜,其中c-fos抗体滴度1∶1000,β-actin 抗体滴度1∶2000。TBST洗膜5 min×3次,二抗孵育1.5 h,TBST再次洗膜5 min×3次,化学发光法成像。蛋白含量用Image J软件进行半定量分析。
1.9 统计学方法 采用SPSS 17.0统计软件处理实验数据,计量资料以均数±标准差表示,组间比较采用非参数Mann-Whitney U检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Salubrinal改善Etoposide诱导的NRK-52E细胞衰老形态学改变 对照组NRK-52E细胞形态正常,无特殊变化;Etoposide刺激NRK-52E细胞24 h后,形态发生改变,细胞体积变大,细胞扁平,胞核体积增加,多核,衰老形态细胞增加;Salubrinal干预后细胞衰老的形态改善,胞核体积减小,多核减少,衰老形态的细胞减少。见图1。
2.2 SA-β-gal染色结果 光学显微镜下观察,衰老形态的细胞SA-β-gal染色呈蓝色。对照组着染阴性,Etoposide处理细胞24 h后SA-β-gal染色阳性细胞显著增加,Salubrinal干预组SA-β-gal染色减弱,计算2组染色阳性率细胞,差异有统计学意义(P<0.05)。见图2。
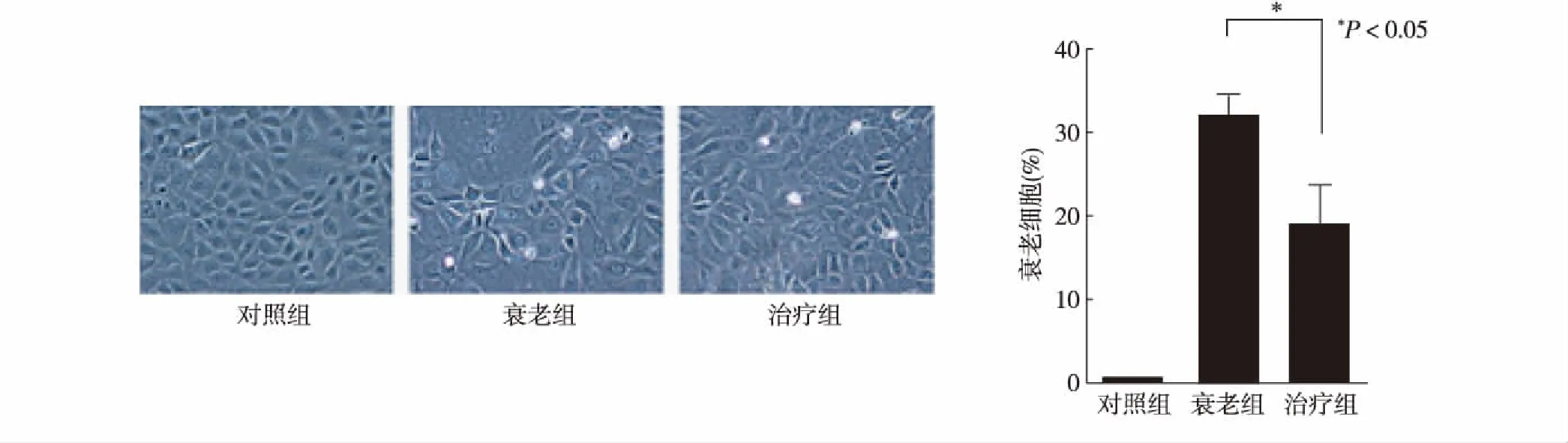
图1 Salubrinal改善Etoposide诱导的NRK-52E细胞衰老形态学改变(×200)
2.3 Salubrinal抑制Etoposide诱导的p16INK4a转录激活 瞬时转染p16INK4a质粒24 h后,用Etoposide及Salubrinal处理细胞,24 h后进行荧光素酶检测以评价p16INK4a启动子活性。结果显示,Etoposide可诱导p16INK4a启动子活性增强,Salubrinal干预后可部分逆转p16INK4a启动子活性的升高。见图3。

图3 Salubrinal抑制Etoposide诱导的p16INK4a活性
2.4 Salubrinal抑制Etoposide刺激后NRK-52E细胞ROS的产生 对照组NRK-52E细胞在装载探针DCFH后仅能观察到细胞本底水平的荧光;Etoposide刺激1 h,6 h后细胞荧光显著增强,呈时间梯度增加;Salubrinal干预后荧光减弱,表明Salubrinal可以逆转Etoposide诱导的NRK-52E 细胞ROS的升高。见图4。

图4 Salubrinal抑制Etoposide刺激后NRK-52E细胞ROS的产生
2.5 Salubrinal抑制Etoposide诱导的c-fos蛋白表达升高 与对照组相比,Etoposide处理后氧化应激蛋白c-fos表达蛋白明显增加;Salubrinal干预后c-fos蛋白下调(1 h)。提示Salubrinal可抑制Etoposide诱导的氧化应激。见图5。

图5 Western blot检测氧化应激标志性蛋白c-fos表达水平的影响
3 讨论
本研究发现Salubrinal可以抑制Etoposide诱导的NRK-52E细胞衰老,缓解Etoposide对细胞造成的氧化应激,从而发挥对抗衰老的作用。目前对Salubrinal的生物学功能研究主要集中在其对抗细胞凋亡的研究,对其在改善细胞衰老方面的研究尚少。
本实验采用Etoposide诱导细胞衰老,该方法是经典的衰老模型,倒置显微镜及SA-β-gal染色均可证实细胞衰老的发生。Salubrinal可明显改善Etoposide诱导细胞衰老形态。除形态学的改善,Salubrinal还可抑制Etoposide诱导的pGL2-p16INK4a转录激活。Salubrinal同时改善Etoposide诱导的细胞氧化应激,包括逆转Etoposide诱导的NRK-52E 细胞ROS的升高,抑制Etoposide诱导的c-fos蛋白表达升高。
研究表明,细胞衰老与氧化应激存在密切联系,氧化应激通过损伤DNA使维持细胞基本生理功能的基因表达失活,从而导致细胞衰老[12],进而导致组织损伤。一方面,随着年龄的增长,线粒体内的ROS 会不断累积增加。过多的ROS会导致生物膜损伤、蛋白质损伤和mtDNA 氧化损伤,从而导致细胞衰老。另一方面,机体氧化与抗氧化水平失衡也是导致衰老的重要因素[13]。ROS和脂质过氧化反应的产物可以同时作用于基因组和线粒体DNA,导致各类DNA损伤:双和单链断裂,DNA加合物形成,DNA碱基和脱氧核糖改变。DNA双链断裂(double-strand breaks,DSBs)是最危险的损害。他们造成严重的基因突变,导致各种疾病和肿瘤进展[14]。如果细胞修复及时的话,单链断裂(single-strand breaks,SSBs)对细胞的有害性不大。如果修复不快,染色体的单键断裂也会造成严重损害并导致许多疾病的发生[15]。
当机体处于氧化应激状态时,体内组织细胞ROS 增加, 当超过机体清除能力时就会导致 ROS 蓄积。研究证实,ROS 能有效地激活 c-fos[16],因此,c-fos是反映氧化应激水平的重要因素。
综上所述,Salubrinal可缓解Etoposide对ROS、c-fos等氧化应激分子的激活,因此其对抗衰老的可能作用机制之一为改善细胞的氧化应激状态。Salubrinal发挥上述作用的更深层次机制包括端粒酶,其他衰老相关蛋白如cyclin A、 cyclin B1等的研究,尚未深入进行,后续工作有待进一步展开。
[1] Hayflick L, Moorhead PS. The serial cultivation of human diploid cell strains[J]. Exp Cell Res,1961, 25: 585-621.
[2] Sikora E, Arendt T, Bennett M, et al. Impact of cellular senescence signature on ageing research[J]. Ageing Res Rev,2011, 10(1): 146-152.
[3] Dimri GP, Lee X, Basile G, et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo[J]. Proc Natl Acad Sci U S A, 1995, 92(20): 9363-9367.
[4] Freund A, Orjalo AV, Desprez PY, et al. Inflammatory networks during cellular senescence: causes and consequences[J]. Trends Mol Med, 2010, 16(5): 238-246.
[5] Baker DJ, Wijshake T, Tchkonia T, et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders[J]. Nature, 2011, 479(7372): 232-236.
[6] Boyce M, Bryant KF, Jousse C, et al. A selective inhibitor of eIF2alpha dephosphorylation protects cells from ER stress[J]. Science, 2005, 307(5711): 935-939.
[7] Liu CL, Li X, Hu GL, et al. Salubrinal protects against tunicamycin and hypoxia induced cardiomyocyte apoptosis via the PERK-eIF2alpha signaling pathway[J]. J Geriatr Cardiol, 2012, 9(3): 258-268.
[8] Wu CT, Sheu ML, Tsai KS, et al. Salubrinal, an eIF2alpha dephosphorylation inhibitor, enhances cisplatin-induced oxidative stress and nephrotoxicity in a mouse model[J]. Free Radic Biol Med, 2011, 51(3): 671-680.
[9] Kadomatsu M, Nakajima S, Kato H, et al. Cordycepin as a sensitizer to tumour necrosis factor (TNF)-alpha-induced apoptosis through eukaryotic translation initiation factor 2alpha(eIF2alpha)-and mammalian target of rapamycin complex 1 (mTORC1)-mediated inhibition of nuclear factor (NF)-kappaB[J]. Clin Exp Immunol, 2012, 168(3): 325-332.
[10]Signer RA, Morrison SJ. Mechanisms that regulate stem cell aging and life span[J]. Cell Stem Cell, 2013, 12(2): 152-165.
[11]Kudryavtseva AV, Krasnov GS, Dmitriev AA,et al. Mitochondrial dysfunction and oxidative stress in aging and cancer[J]. Oncotarget,2016, 7(29): 44879-44905.
[12]Ashok BT, Ali R. The aging paradox: free radical theory of aging[J]. Exp Gerontol, 1999, 34(3): 293-303.
[13]原慧萍,杨泽. 氧化应激与衰老研究进展[J]. 中国老年保健医学,2015, 13(5): 14-16.
[14]Tchurikov NA, Fedoseeva DM, Sosin DV, et al. Hot spots of DNA double-strand breaks and genomic contacts of human rDNA units are involved inepigenetic regulation[J]. J Mol Cell Biol, 2015, 7(4): 366-382.
[15]Caldecott KW. Single-strand break repair and genetic disease[J]. Nat Rev Genet,2008, 9(8): 619-631.
[16]Lee GH, Lee MH, Yoon YD, et al. Protein kinase C stimulates human B cell activating factor gene expression through reactive oxygen species-dependent c-Fos in THP-1 pro-monocytic cells[J]. Cytokine, 2012, 59(1): 115-123.
Intervention of cellular senescence by Salubrinal through inhibition of oxidative stress
LIMin-chao,TANGWei,LOUQing-lin,GULiu-bao.
DiabetesCenter;
SHUTing-ting.
CentralLaboratory,JiangsuGeriatricHospital,Nanjing210024;
LIMin-chao.
NanjingUniversityofTraditionalChineseMedicine,Nanjing210029,China
Objective To investigate the protective effects of Salubrinal on Etoposide-induced cellular senescence in tubular epithelial cells (NRK-52E), and to explore the possible mechanisms. Methods NRK-52E cells were divided into control group (control), senescence group (Etoposide 1 μg/ml) and salubrinal-treated group (Etoposide 1 μg/mL+Salubrinal 50 μM). After 24 h of intervention, cells were observed under an inverted microscope for cellular morphology and β-galactosidase activity (SA-β-gal) staining to detect cell senescence. The cellular senescence was further confirmed by a luciferase reporter system reflecting p16 promoter activity. The levels of ROS were tested using a ROS-DCFH assay. In addition, the expressions of c-fos and the marker of oxidative stress were tested by western blot. Results Treatment with Etoposide for 24 h obviously induced cellular senescence in NRK-52E cells, including morphological changes, positive SA-β-gal staining, and increased p16 promoter activity. The intervention of Salubrinal markedly attenuated NRK-52E cell senescence. Etoposide induced the production of ROS and expression of c-fos, which were suppressed by the treatment with Salubrinal. Conclusions Salubrinal may attenuate Etoposide-induced NRK-52E cellular senescence by inhibiting oxidative stress.
Salubrinal; senescence; oxidative stress; protection
国家自然科学基金青年科学基金项目(81300257)
210024江苏省南京市,江苏省老年医院糖尿病防治研究中心(李敏超,唐伟,娄青林,顾刘宝);中心实验室(束婷婷);210029江苏省南京市,南京中医药大学第一临床医学院(李敏超)
顾刘宝,Email:abobgu@sina.com
R 592
A
10.3969/j.issn.1003-9198.2017.02.008
2016-06-19)
