铝合金化技术在乏燃料干法后处理中的应用研究进展
2017-03-01刘雅兰叶国安柴之芳石伟群
刘雅兰,叶国安,柴之芳,石伟群,*
铝合金化技术在乏燃料干法后处理中的应用研究进展
刘雅兰1,2,叶国安2,柴之芳1,石伟群1,*
干法后处理在未来先进核燃料循环中将发挥关键作用。由美国开发的熔盐电精炼流程是目前最具应用前景的干法后处理流程之一,但是锕系元素(An)与镧系元素(Ln)的高效分离仍然是该流程目前亟待解决的关键科学与技术问题之一。研究表明,An与Ln形成铝合金时沉积电位差较大,采用固态铝电极电解有望实现An与Ln的有效分离,从而更好地服务于分离-嬗变策略。本文针对铝合金化技术在乏燃料干法后处理中的应用研究进展进行综合阐述,重点介绍铝合金化在熔盐电精炼中的应用研究,主要包括Ln和An的铝合金化行为、An和Ln的铝合金化分离等几个方面。
乏燃料后处理;铝合金化;熔盐电精炼
干法后处理,一般是在非水介质中,将锕系元素与其他裂片元素进行分离的过程,熔盐体系是最常用的一种溶剂。熔盐具有理论分解电压高、离子导电性好、蒸气压低以及热稳定性好等特点,使得干法后处理在未来先进核燃料循环中具有显著优势[1]。目前,美国开发的熔盐电精炼流程是最有希望实现工业化的流程之一。20世纪80年代美国提出了一体化快堆(integral fast reactor, IFR)研究计划[2-3],而干法后处理技术是IFR必不可少的部分,因此阿贡国家实验室(ANL)开始了基于高温冶金和电化学技术相结合的干法后处理研究。首先,ANL开发了经典的用于处理金属乏燃料的熔盐电精炼流程,该流程是熔盐电解干法后处理技术的关键步骤。金属乏燃料熔盐电精炼流程示意图示于图1[4]。采用LiCl-KCl熔盐为电解质,将切割后的金属乏燃料置于阳极吊篮中进行溶解,同时在固态不锈钢阴极上析出纯的铀金属,在液态镉阴极(LCC)上共同析出超铀元素、铀和少量稀土元素。至2007年,爱达荷国家实验室(INL)采用该流程已经成功处理了3.4 t的EBR-II乏燃料[5]。在此基础上,ANL随后提出了处理轻水堆(LWR)氧化物乏燃料的流程[6]。
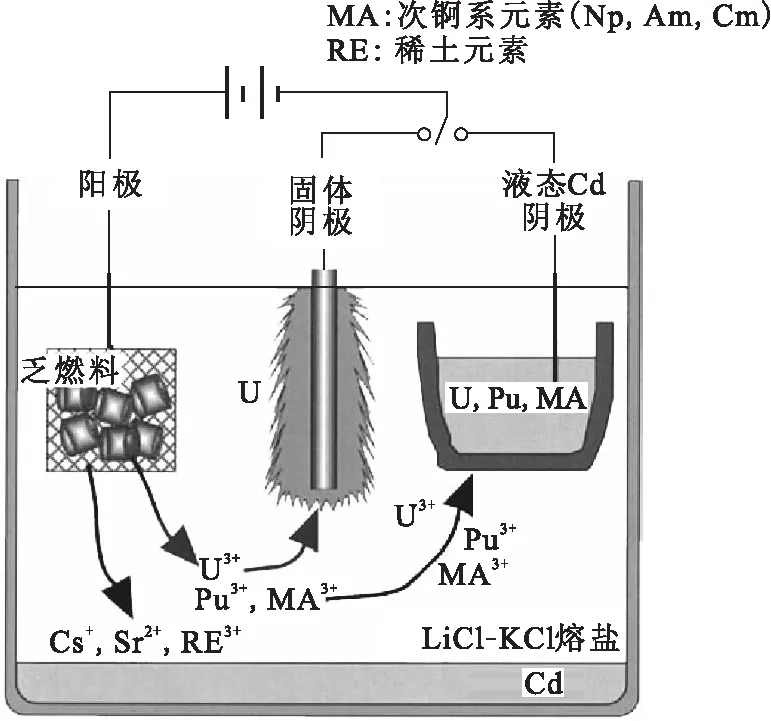
图1 金属乏燃料熔盐电精炼流程示意图[4]Fig.1 Schematic of the electrorefining process for metal fuel reprocessing[4]
熔盐电精炼流程可以实现金属乏燃料和氧化物乏燃料的干法后处理。采用不锈钢阴极成功实现了U的回收利用,而采用液态镉阴极则可以实现Pu及其他次锕系元素(MA)的回收。但是Pu及MA和稀土元素(RE)在LCC上的标准还原电位非常接近,使得Pu及MA与RE元素在LCC上的分离因子不高[7]。因此,在目前干法后处理技术中,An元素与Ln元素的分离,尤其是超铀元素(TRU)与Ln的分离仍是一个亟待解决的关键科学问题。为了提高An元素与Ln元素的分离系数,科学家们在改变电极材料方面进行了一系列研究[8-13]。其中,Lemort[8]和Conocar 等[14]发现在氟盐体系中采用液态Al金属对An元素进行还原萃取时,Al对An元素具有很强的亲和力且能够形成Al-An合金,从而可达到较好的An-Ln分离效果。德国的超铀元素研究中心(ITU)希望将Al的这一性质应用于An与Ln的电解分离,并进行了一系列尝试性工作,提出了基于采用固态Al阴极电解的概念流程。近几年来国内一些单位也相继开展了干法后处理研究工作,包括中国原子能科学研究院、中国工程物理研究院、中国科学院上海应用物理研究所、中国科学院高能物理研究所(简称中科院高能所)、清华大学、哈尔滨工程大学等。其中,中科院高能所和哈尔滨工程大学在An和Ln的铝合金化行为方面进行了一系列研究,开展了通过共还原形成铝合金的方式分离An元素和Ln元素的研究,希望将该方法应用于加速器驱动次临界系统(ADS)乏燃料的干法后处理。本文中,将这种在阴极以形成铝合金的方式使An或Ln元素沉积析出的过程称为铝合金化,并对该技术在乏燃料干法后处理中的应用研究进展进行综合阐述,重点介绍铝合金化在熔盐电精炼中的应用研究。
1 铝合金化在液态金属还原萃取中的应用
液态金属还原萃取是指在熔盐体系中采用含有还原剂的液态金属将熔盐中的金属阳离子还原的过程,熔盐中的金属阳离子被还原后溶解在液态金属相中。以氟化物熔盐体系为例, 其中R代表还原剂,M代表熔盐中的金属阳离子,则液态金属还原萃取过程可用式(1)所示。

y/xRFx+M(液态金属)
(1)
对于M元素的萃取效率可以用M在液态金属和熔盐中的分配比(D(M))来表示,如式(2)。
D(M)=X(M)(液态金属)/x(MFy)(熔盐中)
(2)
其中:X为摩尔分数;x、y为原子个数。对于两种元素M1和M2的分离效率可以用分离因子(SF)来表示(式(3))。
SF(M1/M2)=D(M1)/D(M2)
(3)
SF(M1/M2)与M1和M2在液态金属中的活度系数(γ)相关,γ(M1)/γ(M2)越小,M1越容易与M2分离[12]。根据元素An和Ln在不同液态金属中的活度系数,在氟化物熔盐体系中采用液态Al金属最有可能实现An与Ln的有效分离[12,15]。
Conocar等[12]详细研究了Pu、Am、Ce 和Sm在LiF-AlF3/Al-Cu体系中的分离。测得在830 ℃时不同AlF3浓度的熔盐体系中Pu、Am、Ce 和Sm在LiF-AlF3/Al-Cu体系中的分配比。发现Pu和Am相对于Ce的分离因子均可以达到250,相对于Sm的分离因子可以达到500。但是对于Pu、Am等An元素在液态金属中的存在形式,Conocar等并未进行深入研究。
2 铝合金化在熔盐电精炼中的应用
2.1 电精炼过程中铝合金化An-Ln分离的基本原理
电精炼过程中,An元素和Ln元素在熔盐中以金属阳离子Ann+、Ln3+的形式存在,通过电沉积在阴极上被还原为金属[16-17]。由于各元素在电极上的沉积电位不同,通过控制电位可以实现不同元素之间的分离。An与Ln元素均可以在铝电极上沉积,并形成相应的An-Al或Ln-Al合金,其理论分离效果与二者的沉积电位差(ΔE)相关,具有式(4)的关系。
ΔE=E*,0(Ann+/AnxAly)-E*,0(Ln3+/
(4)
式中:R为气体常数;T为绝对温度;F为法拉第常数;n为电子数;E*,0(Ann+/AnxAly)与E*,0(Ln3+/LnxAly)分别为An和Ln形成铝合金的条件标准电势;c0(Ann+)和c0(Ln3+)分别为Ann+和 Ln3+在熔盐中的初始摩尔浓度;η(An)与η(Ln)分别为An与Ln的提取率,定义为式(5)。
(5)
式中:c0(Mn+)和c(Mn+)分别为分离前、后该金属离子在熔盐中的浓度。根据公式(4),ΔE由转移电子数、各金属离子的初始浓度以及提取率决定。在773 K时,如η(An)≥99.999%,同时η(Ln)≤0.001%,对于四价和三价的An阳离子,E*,0(Ann+/AnxAly)与E*,0(Ln3+/LnxAly)之间的电位差ΔE应分别大于0.19 V和0.25 V,如表1所示。
目前,在熔盐中实现An或Ln元素的铝合金化电沉积有两种方法。一种是采用固体Al电极,使An或Ln元素发生欠电位沉积在固态Al阴极表面形成合金,电化学过程如式(6)。
(6)
另一种是采用An或Ln元素的离子和Al离子直接共还原得到铝合金,电化学过程如式(7)。
xMn++yAl3++(nx+3y)e-=MxAly
(7)
德国的ITU、西班牙的Castrillejo等,我国的中科院高能所、哈尔滨工程大学等单位在这方面已进行了一系列研究。这些研究主要包括:Ln元素的铝合金化行为;An元素的铝合金化行为;An和Ln元素的铝合金化分离以及An-Al合金中An元素和Al的分离等几个方面。
2.2 Ln元素在熔盐体系中的铝合金化电化学行为
在氯化物熔盐体系中,Ln3+在惰性电极上的还原过程分为两种情形:一种为直接由三价阳离子还原至金属;另一种则首先由三价阳离子还原到低价态的离子,然后再还原至金属。对于这两种Ln元素的铝合金化行为,目前均已有报道。

表1 T=773 K,三价或四价An元素与Ln元素分离所需的条件标准电位差Table 1 Necessary potential difference(ΔE) for different separation conditions at 773 K
(1) 一步还原的Ln3+铝合金化电化学行为
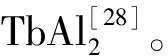
(2) 两步还原的Ln3+铝合金化电化学行为
Nd3+、Sm3+、Eu3+、Tm3+和Yb3+在氯化物熔盐体系中均为两步还原过程:即Ln3+/Ln2+、Ln2+/Ln。其中Sm2+/Sm、Eu2+/Eu和Yb2+/Yb电对的还原电位比Li+/Li电对的还原电位更负,在LiCl-KCl熔盐体系中只能观察到Ln3+/Ln2+的电化学信号,在惰性电极上不能得到纯的Sm、Eu和Yb金属。通过在固态铝电极上沉积,或采用与Al3+共还原,这些两步还原的Ln3+也可形成铝合金,尤其是Sm、Eu和Yb也可以铝合金的形式沉积出来[32-38]。Nd3+、Tm3+在Al电极上可以实现一步还原直接得到相应的金属间化合物[39-43]。
Ln元素在熔盐中均可以实现铝合金化电沉积,并使其沉积电位正移。因此,在采用铝合金化分离An和Ln元素的过程中应避免Ln元素的铝合金化沉积,当An元素与Ln元素分离完成后,可以采用形成铝合金的形式实现Ln元素的提取。
2.3 An元素在熔盐体系中的铝合金化电化学行为
为了将Al电极应用于干法后处理过程中An元素和Ln元素的分离,国内外一些机构详细研究了An元素在LiCl-KCl熔盐体系中的铝合金化行为。

Soucek等[50]比较了An元素和Ln元素在惰性W电极和固态铝电极上的析出电位, 发现An、Ln元素在Al电极上的析出电位明显比在惰性钨电极上的析出电位更正。而且An、Ln等元素离子在Al电极上的析出电位差要大于液态Bi电极和液态Cd电极。根据Soucek等[50]的结果,形成铝合金时Am与Nd的沉积电位差ΔE≈0.15 V,Am与La的ΔE≈0.20 V。而在传统液态Bi电极和Cd电极上Am与La的ΔE仅分别为0.06 V和0.04 V。该结果表明:锕系元素(尤其是Am)与镧系元素的电解分离在Al电极上应该比在传统液态Cd阴极和Bi阴极上更容易实现。
对中科院高能所Shi等[18-19,29,31,34,48,51-53]已发表的结果进行综合整理,如图2所示(由于各个实验参比电极的状态会不可避免的稍有不同,导致测量的结果会有一定偏差,因此本图所示的电位是以在773 K 时 Li+/Li 电对平衡电位等于-2.40 V为基准校准后的结果)。结果表明,Th和Ln均可以和Al共还原形成金属间化合物。Th-Al可以形成五种金属间化合物,沉积电位分布在-1.51~-1.05 V,最容易生成的Al3Th其沉积电位为-1.18 V。La、Ce、Nd与Al可以形成Al11Ln3型金属间化合物,沉积电位较正,其中Al11La3和Al11Nd3与Al3Th的沉积电位最接近。变价稀土元素Sm和Eu与Al形成的金属间化合物沉积电位较负,与Al3Th的沉积电位相差较大,因此这几种元素与Th的分离理论上很容易进行。其余Gd、Tb、Dy、Ho和Er等稀土元素与Al都容易形成稳定的Al3Ln型金属间化合物,且沉积电位在-1.40~1.45 V,与Al3Th的沉积电位差均大于0.2 V。根据沉积电位差分析,在LiCl-KCl熔盐体系中实现Th与Ln的分离理论上是可行的。

图2 Th4+、Ln3+与Al3+共还原得到的金属间化合物种类及沉积电位(相对于Ag/AgCl参比)Fig.2 Intermetallic compounds by the co-reduction of Th4+, Ln3+and Al3+, and their deposition potential(vs. Ag/AgCl)
2.4 An和Ln元素在熔盐体系中的铝合金化电化学分离
在研究了An和Ln元素铝合金化行为的基础上,德国的ITU开展了An和Ln元素的分离工作。Soucek等[50]首先对模拟乏燃料U60Pu20Zr10Am2Nd3.5Y0.5Ce0.5Gd0.5进行了在固态Al电极上的电精炼。实验过程示于图3[50],电解过程中An-Ln合金在阳极溶解,生成可溶的Ln3+、An3+阳离子,同时An3+在铝电极上选择性析出形成An-Al合金,而Ln3+则留在熔盐中。在此过程中如将沉积电位控制在-1.25 V或-1.30 V以内,在Al电极上得到的析出产物中U/Nd、Pu/Nd和Am/Nd质量比值分别大于2 000、990、55,而且在熔盐中Am/Nd的质量浓度比为0.41。采用该方法能够实现An元素与Ln元素的有效分离,尤其对次锕系元素Am来讲,其分离系数相对传统的液态Bi和Cd电极大大提高[54]。为了研究UZr和UPuZr合金在Al电极上的电精炼过程,文献[55]在LiCl-KCl熔盐体系中引入U3+、Pu3+、Np3+、Zr2+或Zr4+、Am3+、Nd3+、Y3+、Ce3+和Gd3+进行模拟研究,采用恒电流法控制电位在-1.25 V以内可以选择性地沉积An元素;同时还发现提高温度使Al电极熔化有利于提高An在阴极中的含量。随后该实验室以U-Pu-Zr(U、Pu和Zr的质量分数分别为71%、19%和10%)合金做阳极,进行了Al电极上的电解精炼实验,发现Al对An的沉积量很大,通过恒电流和恒电位法沉积,阴极上Al与An的质量比可分别达到1∶1.58和1∶2.25,沉积产物主要为(U,Pu)Al3[56]。在此基础上该实验室还继续开展了辐照后的An-Zr合金在Al电极上的电精炼过程,结果发现采用Al阴极也可以有效地实现An与其它元素的分离,与未辐照的锕系合金在铝电极上电精炼研究结果相一致[57]。并发现,在电解过程中施加低电流密度比高电流密度容易得到较厚的合金层,且合金厚度的平方和沉积时间为正比关系,这说明合金的扩散是合金形成的决速步骤[57]。
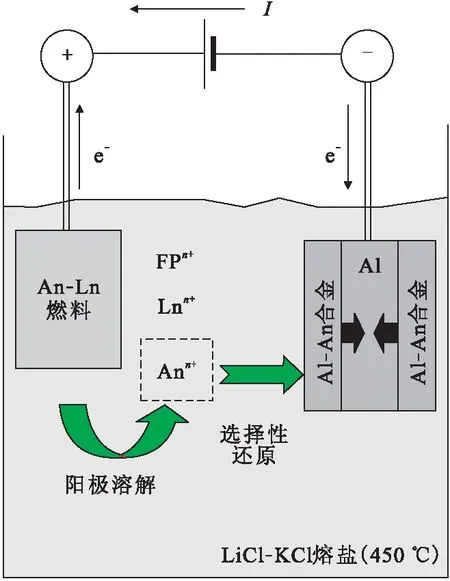
图3 An-Ln合金在固态铝电极上电精炼示意图[50]Fig.3 Principle of the electrorefining process of metallic An-Ln fuel[50]
但是,在上述电解过程中,随着An在Al电极上不断地析出,熔盐中Ln的含量越来越高,因为浓差极化导致An与Ln的析出电位逐渐接近,使得分离系数下降,为了解决这一问题ITU随后提出了“彻底电解”方案[58],对经上述电解流程处理过的熔盐体系进行进一步的彻底电解,提取熔盐中累积的Ln元素。在彻底电解过程中,阳极析出Cl2,采用导气管将Cl2导出,此时熔盐中的Ln浓度基本保持不变,通过电位控制可以实现An完全在Al电极上选择性地析出。采用该方法在LiCl-KCl-UCl3-NdCl3熔盐体系中分离U和Nd,达到了很好的分离效果,且电流效率高达90%。
成功实现An和Ln组分离之后,ITU进一步开展了An与Al的分离研究。采用Cl2将An-Al合金氯化生成AnCl3和AlCl3,生成的AlCl3在惰性气氛下升华与AnCl3分离,最后AnCl3经过还原得到纯的An金属[59-60]。在经过一系列研究的基础上,ITU提出了采用固态Al电极处理乏燃料的概念流程,其流程示意图示于图4[50]。
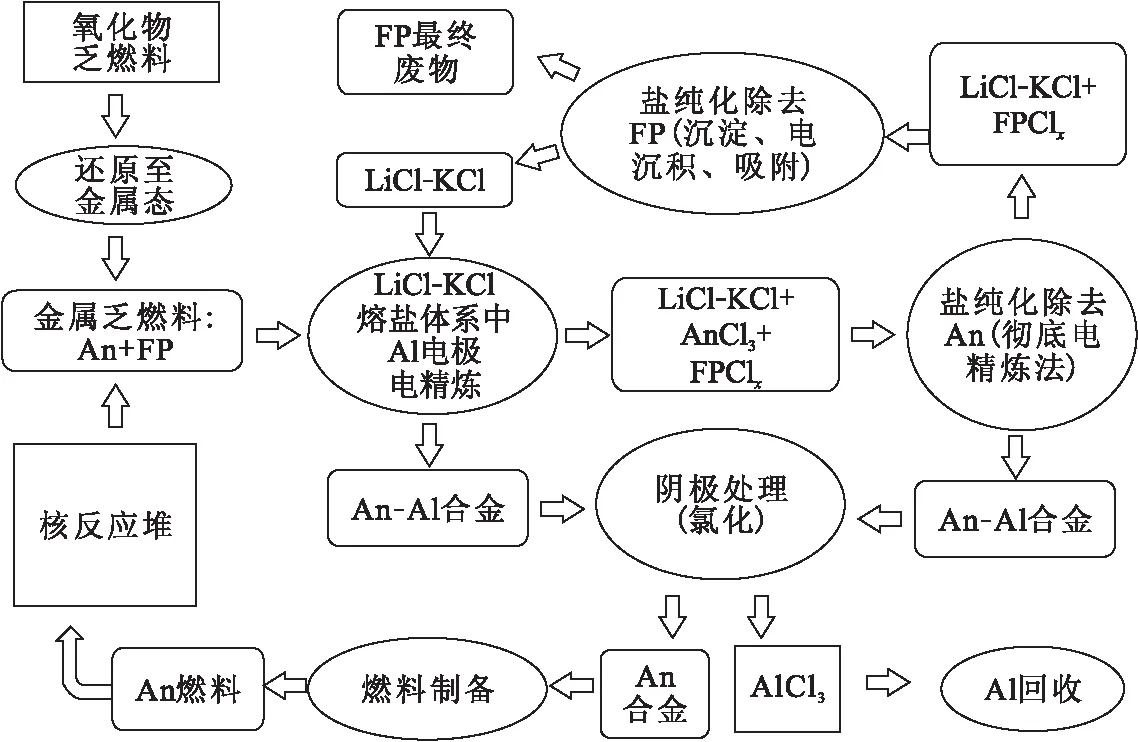
图4 ITU 基于固态Al电极电解精炼的乏燃料干法后处理流程示意图[50]Fig.4 Flowsheet proposed in ITU for pyrochemical reprocessing of spent nuclear fuel based on electrorefining of actinides onto solid aluminum cathodes[50]
该流程设想首先将氧化物乏燃料转化为金属,得到的金属中含有少量FP,FP主要为RE元素。然后将得到的金属作为阳极,Al做阴极,在LiCl-KCl熔盐中进行电解精炼,使An元素在Al电极上沉积得到An-Al,而RE元素仍然以离子的形式留在熔盐中。当熔盐中RE元素的浓度累积到一定程度时,将金属阳极取出,以惰性电极做阳极进行下一步“彻底电解”过程,该过程将熔盐中的An元素全部沉积到Al阴极上。然后再将含有RE的熔盐通过沉淀、电沉积、吸附等方式进行纯化除去RE。最后将纯化后的LiCl-KCl继续重复使用,而RE以最终废物的形式进行处置。得到的An-Al合金,通过氯化的方式实现An与Al的分离,最终得到金属An用于燃料制备。目前,该流程仍处于实验室开发阶段,仍有许多关键的科学与技术问题有待解决。
需要指出的是,将固态活性Al电极应用于乏燃料后处理也会受到一些客观条件的限制。例如,An在固态Al电极上沉积时首先在电极表面形成合金,并向电极内部扩散。但是,在固态电极上的合金化电沉积由于受金属间扩散速率的限制,反应速率较低,而且在反应过程中会不断地消耗Al阴极,An金属的最大沉积量受限。Soucek等[58]在研究U-Pu-Zr 合金(U、Pu和Zr的质量分数分别为71%、19%和10%)的电精炼时指出,如果以形成AnAl3型金属间化合物计算,1 g 铝电极理论上最多只能沉积2.94 g An金属,而实际电解中1 g 铝电极上最多沉积了2.33 g An。
采用共还原法电沉积有望避免上述问题,Liu等[61]在ITU的研究基础上提出了采用共还原形成An-Al合金的方式实现An元素和Ln元素组分离的新设想。以AnO2和Ln2O3为前体,首先通过AlCl3辅助溶解实现AnO2和Ln2O3的完全氯化,在熔盐中直接得到AnCl4和LnCl3;然后使An和Al在阴极共沉积形成An-Al合金实现与Ln的分离,整个过程示于图5[61]。
Liu等[61]采用这一方法首先成功实现了ThO2和Eu2O3混合物中Th与Eu的分离。随后进一步研究了Th与La的分离,发现增加AlCl3的含量有利于Th与Al的共还原,可以提高分离速率和分离效率;通过控制电位实现了Th与La的有效分离[52]。目前该实验室仍在进一步研究以AnO2为前体An与Ln元素铝合金化分离,有可能为氧化物乏燃料的后处理提供新的思路。但是,采用共还原法在电极上得到合金较疏松,容易从电极上脱落,可能会造成回收率降低的情形发生。另外,共还原过程中除了还原An元素还需要还原Al元素,会造成对An提取的电流效率降低。
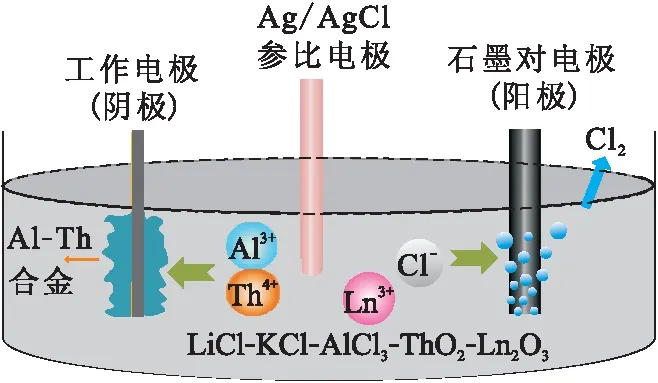
图5 共还原法分离Th与Ln示意图[61]Fig.5 Separation of Th from Ln[61]
3 总结与展望
通过An元素的铝合金化电沉积可以有效实现在熔盐体系中An元素与Ln元素的组分离,尤其是可以大大提高超铀元素与镧系元素的分离效率,这对于乏燃料干法后处理技术的发展具有重要意义。国内外在An元素与Ln元素的组分离方面已经进行了一系列研究,且提出了基于固态铝阴极电解精炼的乏燃料干法后处理概念流程。但是,目前的研究结果表明,该流程的工业化实施仍有很长的路要走,诸多关键的科学与技术问题亟待解决。首先,An在固态Al电极的沉积速率和沉积量比较有限,会导致采用固态Al电极进行连续电解时需要不断地更换新的Al阴极。如果采用An与Al共还原的方式进行电解,则在电解过程中需要不断补充加入AlCl3。其次,以An-Al合金的方式回收An元素,需要对 An-Al合金进一步氯化挥发处理才能得到纯的An元素金属,过程比较复杂。因此,目前该方法还不成熟需要进一步研究,需要进一步改进电解过程的连续性,提高电流效率,探索电沉积产物中An与Al分离更简单有效的方法。根据目前的研究结果,采用这种方法处理燃耗较低的乏燃料在经济上会受到制约,因为铀直接在不锈钢电极上沉积得到纯的铀金属在经济上更具优势。但是,对于高燃耗、含Pu及次锕系元素量较高的乏燃料,如ADS乏燃料等,铝合金化分离应该更有优势。
[1] 欧阳应根.干法后处理技术典型流程综述[J].中国核科技报告,2001(00):378-392.
[2] Chang Y I. The integral fast-reactor[J]. Nuclear Technology, 1989, 88(2): 129-138.
[3] Till C E, Chang Y I, Hannum W H. The integral fast reactor: an overview[J]. Progress in Nuclear Energy, 1997, 31(1-2): 3-11.
[4] Sakamura Y, Inoue T, Iwai T, et al. Chlorination of UO2, PuO2and rare earth oxides using ZrCl4in LiCl-KCl eutectic melt[J]. J Nucl Mater, 2005, 340(1): 39-51.
[5] Simpson M F. Developments of spent nuclear fuel pyroprocessing technology at idaho national laboratory, INL/EXT-12-25124TRN: US1203451[R]. United States: DOE-NA, 2012.
[6] 刘学刚.乏燃料干法后处理技术研究进展[J].核化学与放射化学,2009,31(增刊):35-44.
[7] Li S X, Herrmann S D, Simpson M F. Electrochemical analysis of actinides and rare earth constituents in liquid cadmium cathode product from spent fuel electrorefining[J]. Nucl Technol, 2010, 171(3): 292-299.
[8] Lemort F, Boen R, Allibert M, et al. Kinetics of the actinides-lanthanides separation: mass transfer between molten fluorides and liquid metal at high temperatures[J]. J Nucl Mater, 2005, 336(2-3): 163-172.
[9] Kato T, Inoue T, Iwai T, et al. Separation behaviors of actinides from rare-earths in molten salt electrorefining using saturated liquid cadmium cathode[J]. J Nucl Mater, 2006, 357(1-3): 105-114.
[10]Sakamura Y, Hijikata T, Kinoshita K, et al. Measurement of standard potentials of actinides(U, Np, Pu, Am) in LiCl-KCl eutectic salt and separation of actinides from rare earths by electrorefining[J]. J Alloys Compd, 1998, 271: 592-596.
[11]de Cordoba G, Laplace A, Conocar O, et al. Determination of the activity coefficient of neodymium in liquid aluminium by potentiometric methods[J]. Electrochim Acta, 2008, 54(2): 280-288.
[12]Conocar O, Douyere N, Lacquement J. Extraction behavior of actinides and lanthanides in a molten fluoride/liquid aluminum system[J]. J Nucl Mater, 2005, 344(1-3): 136-141.
[13]Moriyama H, Yamana H, Nishikawa S, et al. Equilibrium distributions of actinides and lanthanides in molten chloride salt and liquid zinc binary phase system[J]. J Nucl Mater, 1997, 247: 197-202.
[14]Conocar O, Douyere N, Lacquement J. Distribution of actinides and lanthanides in a molten fluoride/liquid aluminum alloy system[J]. J Alloys Compd, 2005, 389(1-2): 29-33.
[15]Moriyama H, Yajima K, Nunogane N, et al. Reductive extraction of lanthanide and actinide elements from molten Lif-Bef2salt into liquid bismuth[J]. J Nucl Sci Technol, 1984, 21(12): 949-958.
[16]Cassayre L, Serp J, Soucek P, et al. Electrochemistry of thorium in LiCl-KCl eutectic melts[J]. Electrochim Acta, 2007, 52(26): 7432-7437.
[17]Vandarkuzhali S, Gogoi N, Ghosh S, et al. Electrochemical behaviour of LaCl3at tungsten and aluminium cathodes in LiCl-KCl eutectic melt[J]. Electrochim Acta, 2012, 59: 245-255.
[18]Liu Y L, Yuan L Y, Ye G A, et al. Co-reduction behaviors of lanthanum and aluminium ions in LiCl-KCl eutectic[J]. Electrochim Acta, 2014, 147: 104-113.
[19]Wang L, Liu Y L, Liu K, et al. Electrochemical extraction of cerium from CeO2assisted by AlCl3in molten LiCl-KCl[J]. Electrochim Acta, 2014, 147: 385-391.
[20]Zhang M, Wang H Y, Han W, et al. Electrochemical extraction of cerium and formation of Al-Ce alloy from CeO2assisted by AlCl3in LiCl-KCl melts[J]. Sci China-Chem, 2014, 57(11): 1477-1482.
[21]Castrillejo Y, Bermejo M R, Arocas P D, et al. Electrochemical behaviour of praseodymium(Ⅲ) in molten chlorides[J]. J Electroanal Chem, 2005, 575(1): 61-74.
[22]Tang H, Yan Y D, Zhang M L, et al. AlCl3-aided extraction of praseodymium from Pr6O11in LiCl-KCl eutectic melts[J]. Electrochim Acta, 2013, 88: 457-462.
[23]Bermejo M R, Gomez J, Medina J, et al. The electrochemistry of gadolinium in the eutectic LiCl-KCl on W and Al electrodes[J]. J Electroanal Chem, 2006, 588(2): 253-266.
[24]Castrillejo Y, Bermejo M R, Barrado A I, et al. Electrochemical behaviour of dysprosium in the eutectic LiCl-KCl at W and Al electrodes[J]. Electrochim Acta, 2005, 50(10): 2047-2057.
[25]Castrillejo Y, Bermejo M R, Barrado E, et al. Electrochemical behaviour of erbium in the eutectic LiCl-KCl at W and Al electrodes[J]. Electrochim Acta, 2006, 51(10): 1941-1951.
[26]Castrillejo Y, Bermejo M R, Barrado E, et al. Electrodeposition of Ho and electrochemical formation of Ho-Al alloys from the eutectic LiCl-KCl[J]. J Electrochem Soc, 2006, 153(10): C713-C721.
[27]Bermejo M R, Barrado E, Martinez A M, et al. Electrodeposition of Lu on W and Al electrodes: electrochemical formation of Lu-Al alloys and oxoacidity reactions of Lu(Ⅲ) in the eutectic LiCl-KCl[J]. J Electroanal Chem, 2008, 617(1): 85-100.
[28]Li M, Gu Q Q, Han W, et al. Electrodeposition of Tb on Mo and Al electrodes: thermodynamic properties of TbCl3and TbAl2in the LiCl-KCl eutectic melts[J]. Electrochim Acta, 2015, 167: 139-146.
[29]Su L L, Liu K, Liu Y L, et al. Electrochemical behaviors of Dy(Ⅲ) and its co-reduction with Al(Ⅲ) in molten LiCl-KCl salts[J]. Electrochim Acta, 2014, 147: 87-95.
[30]Liu K, Liu Y L, Yuan L Y, et al. Electrochemical formation of erbium-aluminum alloys from erbia in the chloride melts[J]. Electrochim Acta, 2014, 116: 434-441.
[31]Liu K, Liu Y L, Yuan L Y, et al. Electroextraction of gadolinium from Gd2O3in LiCl-KCl-AlCl3molten salts[J]. Electrochim Acta, 2013, 109: 732-740.
[32]Castrillejo Y, Fernandez P, Medina J, et al. Electrochemical extraction of samarium from molten chlorides in pyrochemical processes[J]. Electrochim Acta, 2011, 56(24): 8638-8644.
[33]Ji D B, Yan Y D, Zhang M L, et al. Electrochemical preparation of Al-Sm intermetallic compound whisker in LiCl-KCl eutectic melts[J]. Electrochim Acta, 2015, 165: 211-220.
[34]Liu K, Liu Y L, Yuan L Y, et al. Electroextraction of samarium from Sm2O3in chloride melts[J]. Electrochim Acta, 2014, 129: 401-409.
[35]Bermejo M R, de la Rosa F, Barrado E, et al. Cathodic behaviour of europium(Ⅲ) on glassy carbon, electrochemical formation of Al4Eu, and oxoacidity reactions in the eutectic LiCl-KCl[J]. J Electroanal Chem, 2007, 603(1): 81-95.
[36]Gibilaro M, Massot L, Chamelot P, et al. Electrochemical extraction of europium from molten fluoride media[J]. Electrochim Acta, 2009, 55(1): 281-287.
[37]Yan Y D, Tang H, Zhang M L, et al. Extraction of europium and electrodeposition of Al-Li-Eu alloy from Eu2O3assisted by AlCl3in LiCl-KCl melt[J]. Electrochim Acta, 2012, 59: 531-537.
[38]Yan Y D, Li X, Zhang M L, et al. Electrochemical extraction of ytterbium and formation of Al-Yb alloy from Yb2O3assisted by AlCl3in LiCl-KCl melt[J]. J Electrochem Soc, 2012, 159(11): D649-D655.
[39]Yan Y D, Xu Y L, Zhang M L, et al. Electrochemical extraction of neodymium by co-reduction with aluminum in LiCl-KCl molten salt[J]. J Nucl Mater, 2013, 433(1-3): 152-159.
[40]Castrillejo Y, Fernandez R, Bermejo M R, et al. Electrochemistry of thulium on inert electrodes and electrochemical formation of a Tm-Al alloy from molten chlorides[J]. Electrochim Acta, 2009, 54(26): 6212-6222.
[41]Smolenski V, Novoselova A. Electrochemistry of redox potential of the couple Tm3+/Tm2+and the formation of a Tm-Al alloy in fused NaCl-2CsCl eutectic[J]. Electrochim Acta, 2012, 63: 179-184.
[42]Li X, Yan Y D, Zhang M L, et al. Electrochemical formation of Al-Tm intermetallics in eutectic LiCl-KCl melt containing Tm and Al ions[J]. J Nucl Mater, 2014, 452(1-3): 197-204.
[43]Smolenski V, Novoselova A, Osipenko A, et al. The influence of electrode material nature on the mechanism of cathodic reduction of ytterbium(Ⅲ) ions in fused NaCl-KCl-CsCl eutectic[J]. J Electroanal Chem, 2009, 633(2): 291-296.
[44]Sedmidubsky D, Konings R J M, Soucek P. Ab-initio calculations and phase diagram assessments of An-Al systems(An=U, Np, Pu)[J]. J Nucl Mater, 2010, 397(1-3): 1-7.
[45]Cassayre L, Caravaca C, Jardin R, et al. On the formation of U-Al alloys in the molten LiCl-KCl eutectic[J]. J Nucl Mater, 2008, 378(1): 79-85.
[46]Soucek P, Malmbeck R, Mendes E, et al. Study of thermodynamic properties of Np-Al alloys in molten LiCl-KCl eutectic[J]. J Nucl Mater, 2009, 394(1): 26-33.
[47]Mendes E, Malmbeck R, Nourry C, et al. On the electrochemical formation of Pu-Al alloys in molten LiCl-KCl[J]. J Nucl Mater, 2012, 420(1-3): 424-429.
[48]Liu Y L, Yan Y D, Han W, et al. Extraction of thorium from LiCl-KCl molten salts by forming Al-Th alloys: a new pyrochemical method for the reprocessing of thorium-based spent fuels[J]. Rsc Advances, 2013, 45(3): 23539-23547.
[49]Liu K, Yuan L Y, Liu Y L, et al. Electrochemical reactions of the Th4+/Th couple on the tungsten, aluminum and bismuth electrodes in chloride molten salt[J]. Electrochim Acta, 2014, 130: 650-659.
[50]Soucek P, Malmbeck R, Nourry C, et al. Pyrochemical reprocessing of spent fuel by electrochemical techniques using solid aluminium cathodes[J]. Energy Procedia, 2011, 7: 396-404.
[51]Luo L X, Liu Y L, Liu N, et al. Electroreduction-based Tb extraction from Tb4O7on different substrates: understanding Al-Tb alloy formation mechanism in LiCl-KCl melt[J]. Rsc Advances, 2015, 5(85): 69134-69142.
[52]Liu Y L, Ye G A, Yuan L Y, et al. Electroseparation of thorium from ThO2and La2O3by forming Th-Al alloys in LiCl-KCl eutectic[J]. Electrochim Acta, 2015, 158: 277-286.
[53]Liu K, Liu Y L, Yuan L Y, et al. Thermodynamic and electrochemical properties of holmium and HoxAly intermetallic compounds in the LiCl-KCl eutectic[J]. Electrochim Acta, 2015, 174: 15-25.
[54]Serp J, Allibert M, LeTerrier A, et al. Electroseparation of actinides from lanthanides on solid aluminum electrode in LiCl-KCl eutectic melts[J]. J Electrochem Soc, 2005, 152(3): C167-C172.
[55]Cassayre L, Malmbeck R, Masset P, et al. Investigation of electrorefining of metallic alloy fuel onto solid Al cathodes[J]. J Nucl Mater, 2007, 360(1): 49-57.
[56]Soucek P, Cassayre L, Malmbeck R, et al. Electrorefining of U-Pu-Zr-alloy fuel onto solid aluminium cathodes in molten LiCl-KCl[J]. Radiochim Acta, 2008, 96(4-5): 315-322.
[57]Soucek P, Murakami T, Claux B, et al. Separation of actinides from irradiated An-Zr based fuel by electrorefining on solid aluminium cathodes in molten LiCl-KCl[J]. J Nucl Mater, 2015, 459: 114-121.
[58]Soucek P, Malmbeck R, Mendes E, et al. Exhaustive electrolysis for recovery of actinides from molten LiCl-KCl using solid aluminium cathodes[J]. J Radioanal Nucl Chem, 2010, 286(3): 823-828.
[59]Cassayre L, Soucek P, Mendes E, et al. Recovery of actinides from actinide-aluminium alloys by chlorination: part Ⅰ[J]. J Nucl Mater, 2011, 414(1): 12-18.
[60]Soucek P, Cassayre L, Eloirdi R, et al. Recovery of actinides from actinide-aluminium alloys by chlorination: part Ⅱ[J]. J Nucl Mater, 2014, 447(1-3): 38-45.
[61]Liu Y L, Yan Y D, Han W, et al. Electrochemical separation of Th from ThO2and Eu2O3assisted by AlCl3in molten LiCl-KCl[J]. Electrochim Acta, 2013, 114: 180-188.
1.中国科学院 高能物理研究所 核能放射化学实验室,北京 100049;2.中国原子能科学研究院 放射化学研究所,北京 102413
Research Progress on Molten Salt Electrorefining Process by Forming Aluminum Alloys
LIU Ya-lan1,2, YE Gao-an2, CHAI Zhi-fang1, SHI Wei-qun1,*
1.Laboratory of Nuclear Radiation and Nuclear Energy Technology, Institute of High Energy Physics, Chinese Academy of Sciences, Beijing 100049, China;2.China Institute of Atomic Energy, P. O. Box 275(26), Beijing 102413, China
Pyrometallurgical process is one of the most promising options for the advanced nuclear fuels cycle. Up to now, the molten salt electrorefining process, which was developed by Argonne National Laboratory(ANL), is the most practical pyrometallurgical process. However, the complete separation of actinides(An) from lanthanides(Ln) is still a challenge for the typical electrorefining process. The current investigations show that the deposition potential gaps of actinides and lanthanides on the solid Al cathode are bigger than those on other active cathodes, and therefore the separation of actinides from lanthanides by forming Al-An alloys are more promising for the partitioning and transmutation. This review is focused on the research progress concerning the separation of An from Ln by forming An-Al alloys for the pyrometallurgical process, and is involved in the following main parts: electrochemical behaviour of Ln on the formation of Ln-Al alloys; electrochemical behaviour of An on the formation of An-Al alloys; and the separation of An from Ln by forming An-Al alloys.
spent fuel reprocessing; aluminum alloying; molten salt electrorefining
2016-01-12;
2016-10-07
国家自然科学基金资助项目(91226201,91426302,11275219);中国科学院核能先导专项(XDA030104)
刘雅兰(1982—),女,河北保定人,助理研究员,核燃料循环与材料专业,E-mail: liuyalan@ihep.ac.cn
*通信联系人:石伟群(1976—),男,湖北黄梅人,研究员,放射化学专业,E-mail: shiwq@ihep.ac.cn
TL24
A
0253-9950(2017)01-0013-09
10.7538/hhx.2017.39.01.0013
