金银花尺蠖幼虫肠道细菌分离与鉴定
2017-03-01向玉勇徐中秋柴新义
向玉勇, 徐中秋, 柴新义
(滁州学院生物与食品工程学院,安徽滁州 239000)
金银花尺蠖幼虫肠道细菌分离与鉴定
向玉勇, 徐中秋, 柴新义
(滁州学院生物与食品工程学院,安徽滁州 239000)
金银花尺蠖是近年来新发现的金银花主要食叶害虫之一,在河南、山东、安徽等地均有分布。为了解金银花尺蠖幼虫肠道环境中的细菌种类,对金银花尺蠖幼虫肠道中的细菌进行分离、纯化和培养,获得3个细菌菌株,对菌株的培养性状、染色反应、菌体形态、生理生化反应进行系统研究。结果表明,它们分别属于葡萄球菌属(Staphylococcus)、巨大芽孢杆菌(Bacillusmegaterium)和枯草芽孢杆菌(Bacillussubtilis)。这3种菌株在金银花尺蠖幼虫肠道中存在的数量差别很大,其中葡萄球菌属的数量最大,为6.59×1011个/mL。
金银花尺蠖;肠道细菌;分离;鉴定
动物的肠道系统内寄居着数量巨大的微生物群,动物的生长发育除受温度、湿度、光照等环境因素影响外,还受其肠道系统内的微生物群影响[1-2]。这些微生物群是在与宿主动物协同进化过程中形成的,含有多种酶系统,能参与寄主动物能量和物质代谢,以及遗传信息运转等一系列生理过程[3],因此,对寄主动物的健康生长是有益的。昆虫是动物界中数量最大的类群,在昆虫肠道系统中寄居的正常微生物群,是昆虫机体的生理组成部分,与昆虫营养生理活动有着密切关系[4]。如有些昆虫不能直接利用食物中的某些营养成分,必须依靠肠道内微生物的作用才能消化食物,从而促进营养物质的代谢和转化。肠道微环境发生改变,可引起微生物群发生变化,从而影响昆虫的生命活动。因此,对昆虫肠道微生物菌群进行研究,可以通过人为调控打破其肠道微生态平衡,影响昆虫的营养生理活动,使其不能正常发育,从而控制害虫的发生危害,对害虫防治具有十分重要的理论和实践意义。目前,国内对昆虫肠道微生物的研究只涉及少数昆虫[4-7],昆虫是动物界中种类最大的类群,不同种类昆虫甚至同种昆虫不同虫态肠道微生物的种类会存在差异。因此,还必须选择更多的昆虫种类加以系统研究,以明确不同种类昆虫肠道微生物的类群。
金银花尺蠖(Heterolochajinyinhuaphaga)属鳞翅目尺蛾科昆虫,别称拱腰虫,是近年新发现的金银花主要食叶害虫之一,在河南、山东、安徽等地已有报道[8-11]。该虫常将金银花叶片咬成缺刻或孔洞,甚至将叶片全部吃光,造成金银花大面积减产,给金银花生产带来严重损失。目前,国内对金银花尺蠖的研究主要是关于其生物学特性及防治方面[8-12],而对其肠道微生物的研究尚未见报道。本试验对金银花尺蠖幼虫的肠道细菌进行分离及鉴定,以了解其幼虫肠道细菌的种类,为进一步探讨肠道细菌对其生命活动的影响奠定基础,从而为更好地利用微生态调控技术防治该虫提供科学依据。
1 材料与方法
1.1 供试虫源与培养基
金银花尺蠖幼虫采集于安徽省明光市三界镇,在室内人工气候箱[光—暗周期为14 h—10 h、温度为(25±1)℃、相对湿度为(70±7)%]中用新鲜的金银花叶片饲养,选取大小一致的健康老熟幼虫作为试验材料。培养基:NA培养基、NB培养基、金氏B培养基、PDA培养基等[13]。
1.2 试验方法
1.2.1 肠道细菌的分离与纯化 取10头金银花尺蠖5龄老熟幼虫,浸泡在75%的乙醇中将其杀死,15 s后取出虫体放在0.1%氯化汞液中消毒2 min,再用灭菌水清洗,然后在无菌条件下取出消化道称其质量后用灭菌研钵研磨成匀浆,研磨液用灭菌水稀释至10-1~10-10。取10-8、10-9、10-10等3个稀释度用平板稀释法和涂抹法进行分离,各稀释度重复3次,分别置于生化培养箱中,在30 ℃下培养72 h。挑取表征各异菌落在NA培养基平板上划线、纯化,然后分别移植斜面培养,并按出现数量依次编号。
1.2.2 肠道细菌的鉴定 将分离纯化得到的各细菌菌株进行形态染色,观察其培养性状,并进行生理生化测定,根据文献[14-15]进行鉴定。
1.2.3 肠道细菌的数量测定 将肠道细菌悬浮液定量稀释后,取一定量不同稀释度的细菌悬浮液,在琼脂平板上培养72 h,选取菌落生长稀疏、适当稀释度计算菌落数,求出3个重复的平均值。按照以下公式计算出肠道中的细菌数[4]:肠道中的细菌数(个/mL)=平板上菌落数(个)×稀释倍数/平板上加菌液的量(mL)。
2 结果与分析
通过对金银花尺蠖幼虫肠道细菌进行分离纯化,获得3个细菌菌株,对3个菌株进行鉴定试验。
2.1 菌体形态和培养性状
在NA培养基上将供试菌株培养24 h,经革兰氏染色法和3% KOH简易法鉴别,均呈阳性。油镜下观察发现,1个菌株呈球状,2个菌株呈杆状。用NA、NB培养基将分离纯化的供试菌株经28 ℃培养48 h后观察,3个菌株在2种培养基各呈不同的表现(表1)。

表1 金银花尺蠖幼虫肠道细菌形态特征及培养性状
2.2 供试菌株生理性状
从表2可知,经不同温度、pH值、NaCl浓度下培养,所有供试菌株均在15~42 ℃、pH值5~9、NaCl浓度2%~7%条件下生长良好。在10 ℃低温下只有3号菌株能够正常生长;在55 ℃高温下,只有1号菌株能够正常生长;pH值=11条件下只有1、2号菌能正常生长;在10% NaCl浓度条件下只有1号菌株可以正常生长。

表2 金银花尺蠖幼虫肠道细菌生理性状
注:“+”表示该条件下菌株扩繁;“-”表示该条件下菌株死亡。
2.3 供试菌株生化性状
3种菌株均产生氧化酶和过氧化氢酶,能进行淀粉水解和硝酸盐还原,均能分解利用葡萄糖、麦芽糖、乳糖、半乳糖、阿拉伯糖、海藻糖、果糖、甘露糖、甘露醇、山梨醇、肌醇,甲基红试验均呈阴性,都不产生吲哚,其他生化项目各异(表3)。
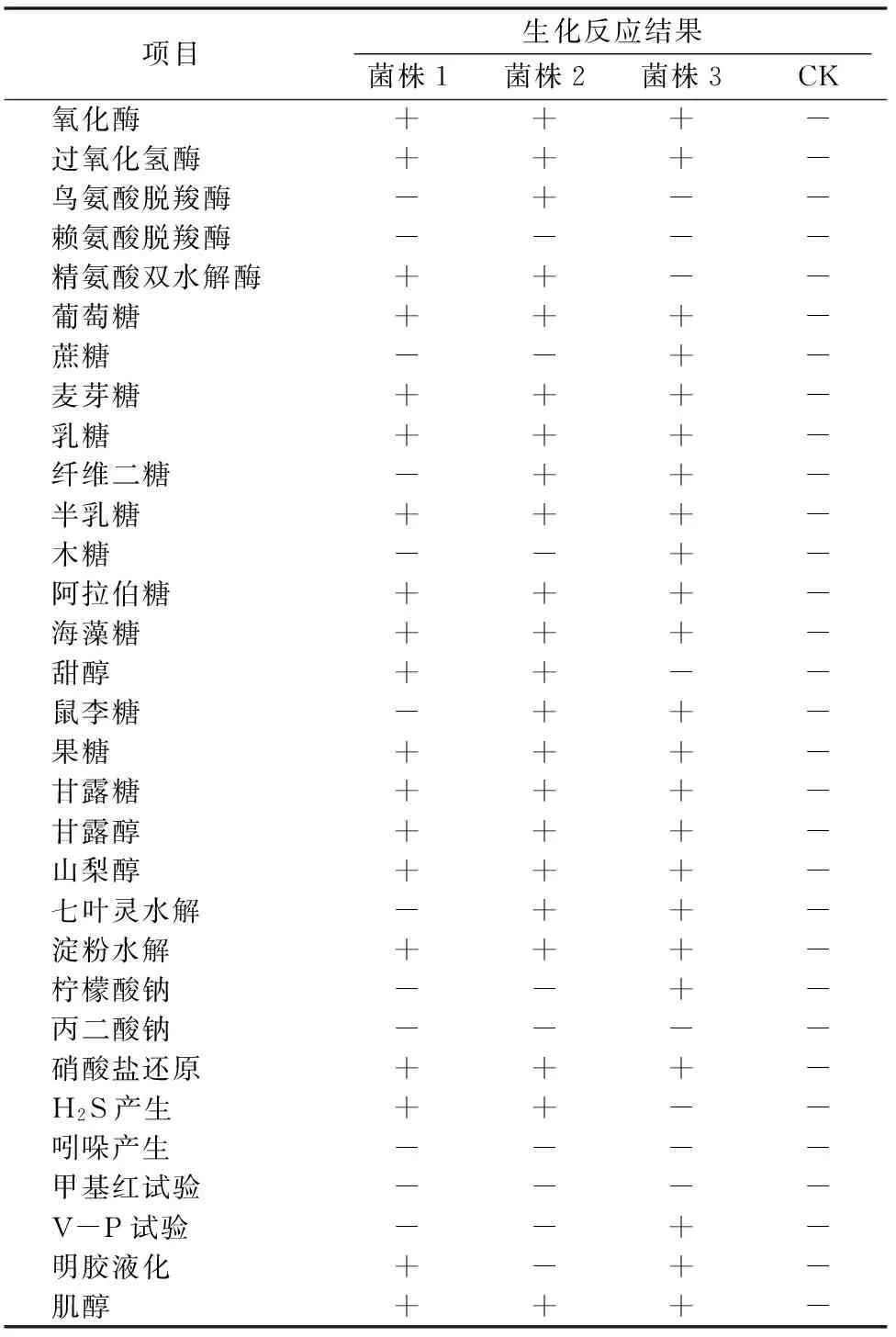
表3 金银花尺蠖幼虫肠道细菌生化反应
注:“+”表示阳性;“-”表示阴性。
2.4 菌株鉴定
通过对3个细菌菌株的培养性状、菌体形态、染色反应、生理生化性状等进行试验,结果表明它们分别属于葡萄球菌属(Staphylococcus)、巨大芽孢杆菌(Bacillusmegaterium)和枯草芽孢杆菌(Bacillussubtilis)。由表4可见,金银花尺蠖幼虫肠道中各菌株存在的数量差别很大,其中葡萄球菌属的数量最大,为6.59×1011个/mL。

表4 金银花尺蠖幼虫肠道细菌鉴定结果及存在数量
3 讨论
与其他动物一样,昆虫与共生的肠道微生物之间建立了复杂的协同进化关系,其肠道系统为各种微生物提供适宜的生活环境,肠道微生物一方面帮助宿主昆虫消化食物,为昆虫提供各种营养物质,另一方面可以起着益生素的作用,调控肠道微生物区系本身之间的平衡,保证昆虫健康。肠道微生物的类群和数量与昆虫所取食的食物性质存在密切的关系,不同食性昆虫肠道环境中的微生物菌株的种类和数量存在差别。如刺吸植物汁液的斑衣蜡蝉(Lycormadelicatula)成虫消化道内存在有多黏芽孢杆菌(Bacilluspolymyxa)、地衣芽孢杆菌(Bacilluslicheniformis)、巨大芽孢杆菌(Bacillusmegaterium)和枯草芽孢杆菌(Bacillussubtilis)4种细菌,其中多黏芽孢杆菌数量最多[4];取食动物性物品和食品的白腹皮蠹(Dermestesmaculatus)成虫消化道内分布有坚强芽孢杆菌(Bacillusfirmus)、气微菌属(Aeromicrobium)、浸麻芽孢杆菌(Bacillusmacerans)、葡萄球菌属(Staphylococcus)、巨大芽孢杆菌和短芽孢杆菌(Bacillusbrevis)6种细菌,以巨大芽孢杆菌数量最多[7]; 取食植物叶片或茎秆的沙漠蝗肠道中优势菌群为肠杆菌属和链球菌属[16]。本试验从金银花尺蠖幼虫肠道中分离鉴定出3种细菌,分别为葡萄球菌属(Staphylococcus)、巨大芽孢杆菌(Bacillusmegaterium)和枯草芽孢杆菌(Bacillussubtilis),其中葡萄球菌属的数量最大。金银花尺蠖的食性单一,只取食危害金银花等少数忍冬科植物,消化道对食物消化也比较单一,可能导致肠道中的细菌种类比较少。另外,金银花是中药材,含有抑菌作用的活性成分,其活性成分对金银花尺蠖肠道细菌的影响还有待进一步研究。
为适应中药材无公害生产的要求,今后还需进一步分析金银花尺蠖幼虫肠道主要细菌菌株的功能,并与食物的营养成分进行关联分析,探讨细菌菌群与金银花尺蠖幼虫的共生机制,从而通过人工方法改善和调节肠道微生物的微生态条件,调控金银花尺蠖的生长发育,实现该虫的生态控制。
[1]何明清. 动物微生态学[M]. 北京:中国农业出版社,1994.
[2]施曼玲,邱清波,计 翔. 两种有磷类爬行动物消化道微生物的研究[J]. 动物学杂志,2000,35(6):12-15.
[3]陈 群,鲍大鹏. 人及动物胃肠道正常微生物群的研究[J]. 安徽农业技术师范学院学报,1999,13(4):39-42.
[4]刘玉升,陈艳霞,吕 飞,等. 斑衣蜡蝉成虫肠道细菌的鉴定研究[J]. 山东农业大学学报(自然科学版),2006,37(4):495-498.
[5]贝绍国,刘玉升,崔俊霞. 日本龟蜡蚧肠道细菌分离及鉴定研究[J]. 山东农业大学学报(自然科学版),2005,36(2):209-212.
[6]孟祥杰,刘玉升,崔 俊,等. 六斑异瓢虫成虫肠道细菌分离及鉴定研究[J]. 中国微生态学杂志,2008,20(2):120-121,125.
[7]秦 浩,李志鹏,李林懋,等. 白腹皮蠹幼虫肠道细菌分离及鉴定[J]. 安徽农业大学学报,2013,40(3):482-486.
[8]张文冉,高殿滑,刘爱华. 金银花尺蠖的发生与气象条件的关系[J]. 气象与环境科学,2007,30(4):60-62.
[9]王广军,张国彦,王江蓉. 金银花尺蠖的发生规律与防治技术[J]. 中国植保导刊,2005,25(3):22-23.
[10]姜 敏,邵明果,赵伯林. 金银花尺蠖的生物学特性及防治技术[J]. 山东林业科技,2005(1):62-63.
[11]向玉勇,刘克忠,殷培峰,等. 安徽金银花尺蠖的生物学特性[J]. 滁州学院学报,2010,12(5):35-37.
[12]倪云霞,刘新涛,刘玉霞,等. 金银花尺蠖的药剂防治[J]. 河南农业科学,2006,35(12):78-79.
[13]陈天寿. 微生物培养基的制造与应用[M]. 北京:中国农业出版社,1995:179-671.
[14]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 2版. 北京:科学出版社,2001.
[15]布坎南R E,吉本斯N E. 伯杰细菌鉴定手册[M]. 中国科学院微生物研究所,译. 8版. 北京:科学出版社,1984.
[16]Hunt J,Charnly A K. Abundance and distribution of the gut flora of the desert locust,Schistocercagregaria[J]. Journal of Invertebrate Pathology,1981,38(3):378-385.
10.15889/j.issn.1002-1302.2017.02.029
2015-11-21
安徽省高校省级自然科学研究项目(编号:KJ2012B123);安徽省高等学校优秀青年人才基金(编号:2009SQRZ147);国家级大学生创新创业训练计划(编号:201310377018)。
向玉勇(1974—),男,湖南麻阳人,博士,副教授,主要从事资源昆虫学及害虫防治研究。E-mail:xyy10657@sohu.com。
S433.4
A
1002-1302(2017)02-0106-02
向玉勇,徐中秋,柴新义. 金银花尺蠖幼虫肠道细菌分离与鉴定[J]. 江苏农业科学,2017,45(2):106-108.
