麻风树脂肪酸去饱和酶7基因的克隆及生物信息学分析
2017-03-01王海波郭俊云
王海波, 郭俊云, 刘 潮, 高 永
(1.曲靖师范学院云南高原生物资源保护与利用研究中心,云南曲靖 655011; 2.曲靖师范学院生物资源与食品工程学院,云南曲靖 655011;3.云南省高校云贵高原动植物多样性及生态适应性进化重点实验室,云南曲靖 655011)
麻风树脂肪酸去饱和酶7基因的克隆及生物信息学分析
王海波1,2,3, 郭俊云2, 刘 潮1,2,3, 高 永1,2,3
(1.曲靖师范学院云南高原生物资源保护与利用研究中心,云南曲靖 655011; 2.曲靖师范学院生物资源与食品工程学院,云南曲靖 655011;3.云南省高校云贵高原动植物多样性及生态适应性进化重点实验室,云南曲靖 655011)
质体型ω-3(Δ15)脂肪酸去饱和酶(FAD7)是多不饱和脂肪酸合成途径中催化亚油酸(Δ9,12-C18 ∶2)形成α-亚麻酸(Δ9,12,15-C18 ∶3,ALA)的关键酶。基于麻风树低温锻炼转录组数据,通过逆转录PCR(RT-PCR)技术克隆到麻风树FAD7基因的全长cDNA,命名为JcFAD7。结果表明,该cDNA序列全长1 796 bp,完整开放阅读框1 341 bp,编码446个氨基酸,理论分子量为51.1 ku,等电点为8.92。序列分析表明,JcFAD7编码蛋白包含膜结合FAD蛋白的4个跨膜区、2个膜嵌合区、1个亚铁血红素结合基序及3个组氨酸簇等特征区域。构建系统进化树显示,麻风树 JcFAD7 蛋白与芍药(Paeonialactiflora)的亲缘关系最近。
麻风树;脂肪酸去饱和酶7(FAD7);基因克隆;生物信息学分析
麻风树(JatrophacurcasL.)为喜温植物,原产于热带及亚热带地区[1-2],可形成优势种群落,现广布于25°N~25°S之间,在我国云南、广西、四川、广东、海南等省(区)多有野生种分布[2-3]。因其种子具有含油量高、油质好、可生产生物柴油等优点,成为具有巨大开发潜力的能源树种。温度是影响麻风树地域分布的主要限制因素,10 ℃以下低温对麻风树有致命的伤害[4-5],可严重影响麻风树的产量、分布及其产业的发展。因此,弄清麻风树低温冷害与抗冷性机制,进而培育抗冷新品种,对于麻风树的基础与应用研究都有重要意义。
细胞膜的流动性和稳定性是细胞乃至整个植物体赖以生存的基础[6],细胞膜不仅是植物低温伤害的原初部位,也是植物细胞感受低温的首要结构元件。大量研究证实,膜系中脂肪酸的不饱和度或膜流动性与植物抗冷性密切相关。膜脂的不饱和脂肪酸比例越大,膜流动性越强,植物的相变温度越低,抗冷性越强[7-8]。高等植物不饱和脂肪酸生物合成始于质体基质中的棕榈酰-ACP(palmitoyl-ACP,C16 ∶0)和硬脂酰-ACP(stearic-ACP,C18 ∶0),硬脂酰-ACP被质体中可溶性硬脂酰-ACP去饱和酶(stearic-ACP desaturase,简称SAD或FAD1)催化形成油酰-ACP(oleic-ACP,Δ9-C18 ∶1)[9]。棕榈酰-ACP与油酰-ACP随后继续在质体内或被运往内质网形成甘油酯,而棕榈酰-ACP被定位于质体膜上的棕榈酰-ACP去饱和酶(palmitoyl-ACP desaturase,简称FAD4或FAD5,属ω-6系列的膜整合蛋白)催化形成棕榈油酰-ACP(palmitoleoyl-ACP,Δ9-C16 ∶1)。单不饱和脂肪酸(monounsaturated fatty acid,简称MUFA)分别由与内质网或质体膜结合的ω-6(Δ12)、ω-3(Δ15)脂肪酸去饱和酶(fatty acid desaturase,简称FAD)作用进一步去饱和,生成多不饱和脂肪酸(polyunsaturated fatty acid,简称PUFA)的甘油酯[10]。催化多不饱和脂肪酸生成的脂肪酸去饱和酶主要有5种:FAD2、FAD3、FAD6、FAD7和FAD8,它们都属于膜整合蛋白(FAD2、FAD3定位于内质网膜,FAD6、FAD7和FAD8定位于质体膜),可分为ω-6型(也称为Δ12型)(包括FAD2、FAD6)、ω-3 型(也称为Δ15型)(包括FAD3、FAD7、FAD8)两大类[11-12]。FAD7以NADPH-铁氧还蛋白为电子供体,催化亚油酸(Δ9,12-C18 ∶2)形成α-亚麻酸(Δ9,12,15-C18 ∶3,简称ALA)[13]。本研究利用GenBank中麻风树低温锻炼转录组数据[14-15],筛选并克隆到麻风树FAD7基因(JcFAD7),并对其进行生物信息学分析,为进一步研究JcFAD7基因的结构与功能及该基因在麻风树三烯脂肪酸形成中的作用奠定基础。
1 材料与方法
1.1 材料与处理
供试麻风树种子采自云南省楚雄州元谋县。选取饱满的麻风树种子,先用1.5% CuSO4消毒20 min,再用无菌水漂洗5次,于26 ℃恒温培养箱中吸涨24 h[16]。将吸涨的种子在无菌水中漂洗3次,播于垫有5层用无菌水湿润的滤纸的白瓷盘(24 cm×16 cm)中,于相对湿度75%、昼—夜温度26 ℃—20 ℃、光—暗周期16 h—8 h的恒温培养箱中萌发5 d。之后将发芽的种子播于消毒的培养土中并于同样恒温培养箱中培养15 d至第2张真叶展开。取第2张真叶材料,液氮速冻后置于-80 ℃冰箱中用于RNA的提取。
1.2 菌株与主要试剂
大肠杆菌Trans1-T1(DH5α)菌株,由笔者所在实验室保存;TransZol Up、DNase I、TransStartTaqDNA聚合酶、氨苄青霉素(Amp)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)、异丙基硫代半乳糖苷(IPTG)、2×EasyTaqPCR SuperMix(+dye,即已加6×loading buffer,PCR产物可直接上样电泳)、TransScript Two-Step RT-PCR SuperMix、EasyPure Quick Gel Extraction Kit、EasyPure Plasmid MiniPrep Kit、pEASY-T1 Cloning Kit、Trans 2K Plus II DNA Marker,购自北京全式金生物技术有限公司;引物合成和测序由深圳华大基因有限公司完成。
1.3 试验方法
1.3.1 总RNA的提取及第1链cDNA的合成 取0.2 g麻风树叶片材料,按照王海波等的方法[13],利用TransZol Up试剂提取并纯化总RNA。以Anchored Oligo(dT)18为逆转录引物,利用TransScript Two-Step RT-PCR SuperMix合成第1链cDNA。
1.3.2 麻风树JcFAD7基因全长cDNA的克隆 以与麻风树同科的植物蓖麻(Ricinuscommunis)FAD7全长mRNA序列(L25897.1)为种子序列,对GenBank中麻风树低温锻炼转录组数据(GenBank登录号:GAHK00000000.1)的45 171条Unigenes序列进行本地BLAST,得到麻风树JcFAD7基因的序列CL1490.Contig2_JC-CK_1A(GAHK01004476.1,2 035 bp)。分析表明,该序列包含全长开放阅读框(ORF)(1 341 bp)。以此序列为基础设计全长cDNA克隆引物,并送深圳华大基因有限公司合成。引物序列:上游F,5′-CTACAGACGATAGAGAAC-3′;下游R,5′-GAACAAATGATAGGATAC-3′。以“1.3.1”节中的反转录cDNA为模板,使用TransStartTaqDNA 聚合酶进行PCR扩增,扩增条件:94 ℃ 5 min→(94 ℃ 30 s,48.8 ℃ 30 s,72 ℃ 1.5 min,35个循环)→72 ℃ 20 min。扩增完成后用1%琼脂糖凝胶电泳检测PCR产物,利用EasyPure Quick Gel Extraction Kit从琼脂糖凝胶中回收目的基因片段(1 796 bp),并与克隆载体pEASY-T1连接,转化大肠杆菌Trans1-T1感受态细胞,涂LB抗性平板(LB-Amp++IPTG+X-gal),过夜生长,挑取白斑菌落进行菌落PCR鉴定。阳性克隆取名为pEASY-T1-JcFAD7,并送深圳华大基因有限公司,利用pEASY-T1质粒上的M13F、M13R通用引物进行双向测序。
1.3.3 麻风树JcFAD7基因的生物信息学分析 利用 BioEdit 软件将JcFAD7 cDNA序列翻译成氨基酸序列,利用在线工具ProtParam计算蛋白质的理论分子量、等电点等基本参数。利用在线工具TMHMM与Proscale检测其跨膜结构与亲/疏水特性。从GenBank下载其他物种FAD7氨基酸序列,利用ClustalX进行序列相似性比对,然后用MEGA软件通过邻接法(neighbour-joining,简称NJ)构建系统进化树,并采用自展法(Bootstrap method)进行检验。
2 结果与分析
2.1 麻风树JcFAD7基因全长cDNA的克隆
以麻风树叶片cDNA为模板,扩增JcFAD7基因cDNA的全长序列,结果表明,扩增得到的产物长度约 1.8 kbp(图1-A)。将目的条带切胶回收后与T/A克隆载体pEASY-T1连接,转化大肠杆菌,通过菌落PCR验证阳性克隆(图1-B)。挑取阳性克隆过夜摇菌,并用M13通用引物进行测序。

2.2 麻风树JcFAD7基因的生物信息学分析
经测序分析,本研究克隆的麻风树JcFAD7基因的cDNA序列全长1 796 bp,包含1个完整的开放阅读框(1 341 bp),编码446个氨基酸(图2)。将JcFAD7编码框与其基因组序列进行比对,发现JcFAD7基因包含8个外显子、7个内含子。ProtParam分析结果显示,JcFAD7编码的蛋白质分子量为 51.1 ku,理论等电点为8.92。TMHMM与Proscale分析表明,JcFAD7蛋白存在6段明显的疏水区域,与4段跨膜α-螺旋区、2段膜嵌合α-螺旋区相对应(图3)。另外研究表明,该蛋白质在N端、C端都不含信号肽,但N端存在1个亚铁血红素结合基序。
将克隆的麻风树JcFAD7基因翻译的氨基酸序列与 GenBank 下载的其他高等植物的FAD7进行序列相似性比对,用邻接法构建系统进化树(图4)。FAD7蛋白的物种名称及GenBank登录号:拟南芥(Arabidopsisthaliana),NM_111953.2;垂枝桦(Betulapendula),AY135565.1;二穗短柄草(Brachypodiumdistachyon),XM_003558109.2;欧洲油菜(Brassicanapus),FJ985690.1;亚麻荠(Camelinasativa),XM_010466516.1;茶(Camelliasinensis),KC847167.1;黄瓜(Cucumissativus),NM_001287475.1;播娘蒿(Descurainiasophia),EF105163.1;油棕(Elaeisguineensis),XM_010939556.1;美洲油棕(Elaeisoleifera),EU057620.1;猴面花(Erythrantheguttata),XM_012994633.1;巨尾桉(Eucalyptusgrandis),XM_010032901.1;大豆(Glycinemax),GQ144962.1;野大豆(Glycinesoja),L22965.1;草棉(Gossypiumherbaceum),KF460118.1;陆地棉(Gossypiumhirsutum),KF460144.1;雷蒙德氏棉(Gossypiumraimondii),NM_001309351.1;向日葵(Helianthus annuus),AY254858.1;苹果(Malus domestica),NM_001293987.1;蒺藜苜蓿(Medicago truncatula),XM_003604610.1;川桑(Morus notabilis),XM_010103126.1;莲(Nelumbo nucifera),XM_010266313.1;美花烟草(Nicotiana sylvestris),XM_009799172.1;烟草(Nicotiana tabacum),D79979.1;茸毛烟草(Nicotiana tomentosiformis),XM_009596074.1;橄榄(Olea europaea),DQ788674.1;芍药(Paeonia lactiflora),KP271031.1;胡杨(Populus euphratica),XM_011006458.1;马齿苋(Portulaca oleracea),DQ991249.1;蓖麻(Ricinus communis),L25897.1;芝麻(Sesamum indicum),U25817.1;油桐(Vernicia fordii),AF200717.1;豇豆(Vigna unguiculata),EU180596.1;葡萄(Vitis vinifera),XM_002273738.2;玉米(Zea mays),NM_001279611.1;麻风树(Jatropha curcas,登录号暂缺)。结果显示,单子叶植物如二穗短柄草与双子叶植物明显聚类为2支,说明两者的FAD7基因在进化上亲缘关系较远。在双子叶植物中,不同科的植物分别聚类为单独1支,如豆科(Leguminosae)的大豆、蒺藜苜蓿等,茄科(Solanaceae)的烟草、美花烟草等,大戟科(Euphorbiaceae)的油桐、蓖麻等,十字花科(Brassicaceae)的拟南芥、油菜、播娘蒿等。大戟科的麻风树未与近科物种蓖麻聚类在一起,而与芍药的亲缘关系更近,序列相似性为 74.6%。

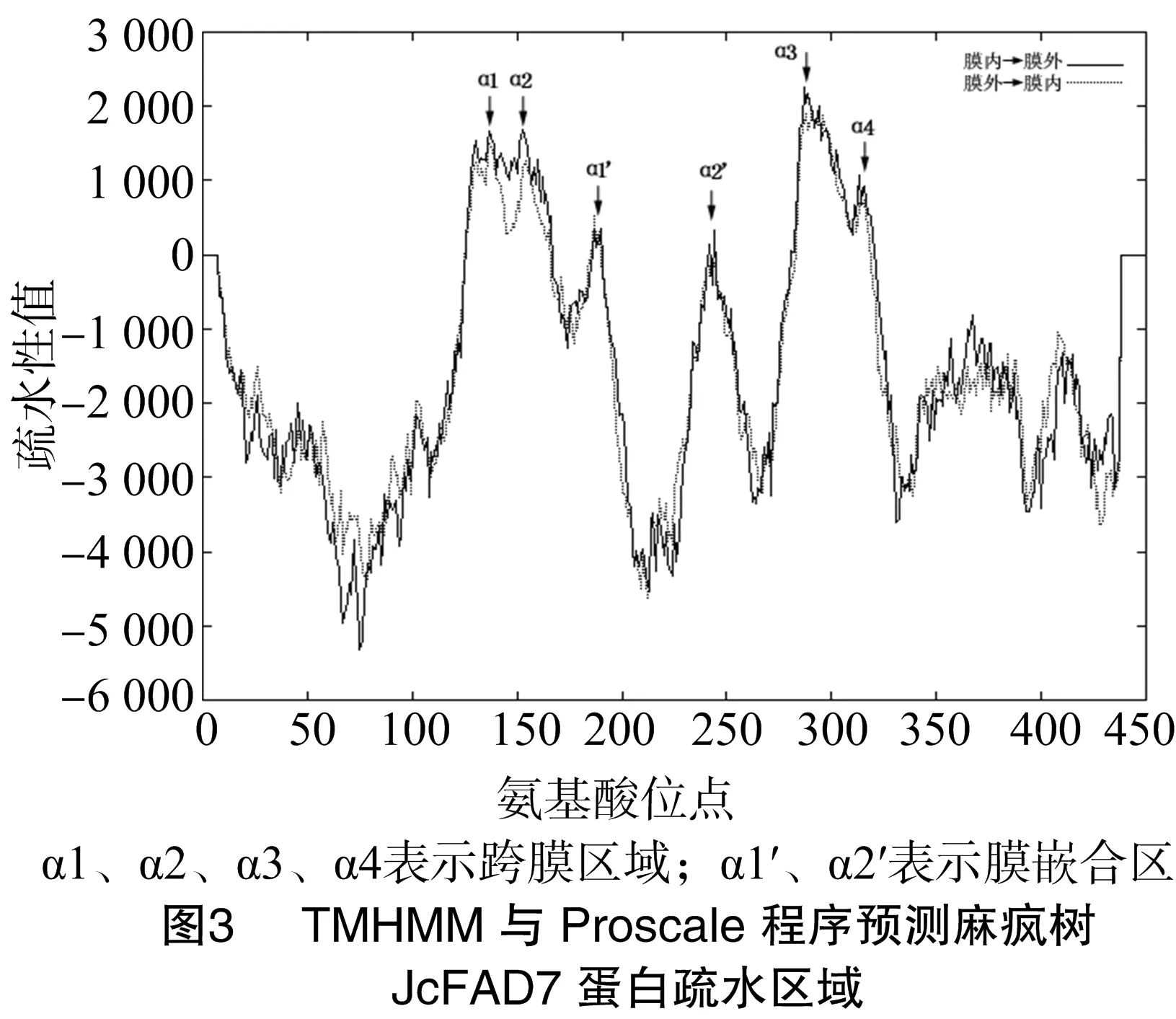
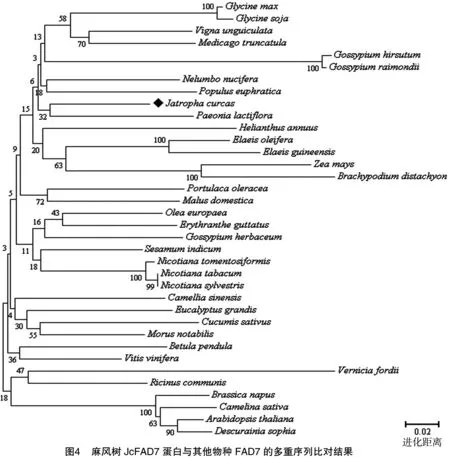
3 讨论
决定高等植物抗冷性强弱的主要是三烯脂肪酸(简称TA,即C18 ∶3、C16 ∶3)的含量。目前,催化三烯脂肪酸合成的关键ω-3去饱和酶FAD3、FAD7、FAD8的研究也在逐渐深入。根据电子供体不同可将ω-3脂肪酸去饱和酶分为2类:一类为FAD3,定位于植物细胞的内质网,以细胞色素b为电子供体,作用于磷脂酰甘油(PG)或其他磷脂;另一类为FAD7、FAD8,定位于植物细胞的质体,以铁氧还蛋白为电子供体,作用于磷脂酰甘油、硫脂和半乳糖脂。FAD3、FAD7、FAD8都具有相似的蛋白序列结构特征,氨基端与羧基端位于膜的外侧,保守性低,中间部位相对保守,包含4个跨膜区域及2段膜嵌合区,在细胞质一侧存在3个极度保守的组氨酸簇(HX3/4HH、HX2/3HH、HX2/3HH)与Fe2+形成酶的催化活性中心[17](图5)。
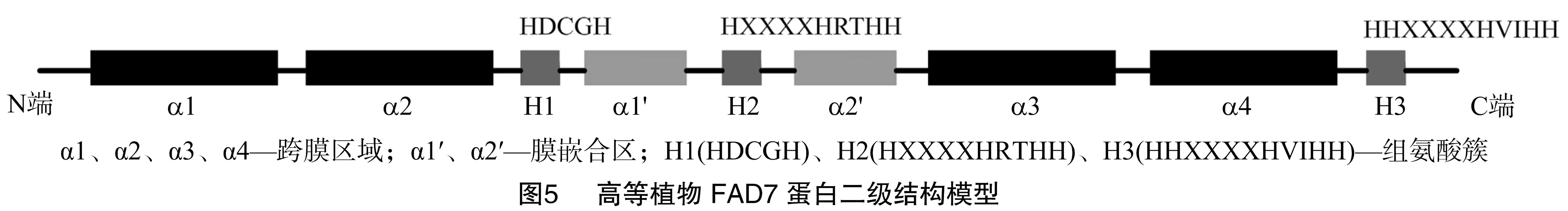
FAD3基因编码内质网型ω-3脂肪酸去饱和酶,负责质体内膜膜脂之外所有不饱和甘油酯的合成。目前已经从拟南芥、油菜、大豆、红花菜豆(PhaseoluseoccineusL.)、芝麻、甘蓝(Brassicaoleracea)、亚麻(Linumusitatissimum)、菠菜(Spinaciaoleracea)、番茄(Lycopersiconesculentum)、欧洲白桦(BetulapendulaRot)、白苏[Perillafrutescens(L.) Britt]、紫苏[Perillafrutescens(L.) Britton.]、云杉(PiceaasperataMast)、油桐[Verniciafordii(Hemsl.) Airy Shaw]、野毛豆(GlycinesojaSieb. Et Zucc.)、挪威云杉[Piceaabies(L.) Karst.]、麻风树(JatrophacurcasL.)、油橄榄等植物中分离到FAD3基因。Kodama等研究表明,随着温度的降低,植物体内FAD3 mRNA含量增加,进而亚麻酸的比例提高,而且FAD3基因的响应可能依赖于翻译后水平的调控,涉及蛋白质的磷酸化共价修饰调节作用[18]。Yu等在番茄中过表达FAD3基因,经过4 ℃低温处理后,转基因番茄叶片中亚麻酸含量增加,植株地上部分生物量高于对照植株,叶片中叶绿体膜系统超微结构和所有亚细胞器的完整性均高于对照植株[19]。FAD7、FAD8为FAD3的质体型同工酶。FAD7基因的表达不受温度的调控,而FAD8基因则属于温度敏感型表达,在转录、转录后水平都受到调控,而酶活性的调控区域主要在FAD8的羧基末端。目前已从拟南芥、油菜、甘蓝、向日葵、玉米、欧芹(Petroselinumcrispum)、蓖麻、白桦(BetulaplatyphyllaSuk.)、新疆野苹果[Malussieversii(Ledeb.) Roem.]、大豆、芥菜、莱茵衣藻(ChlamydomonasreinhardtiiD.)、播娘蒿、黄瓜、洋桔梗(EustomagrandiflorumShinn.)、芝麻、仙客来(CyclamenpersicumMill.)等植物中分离到FAD7基因。Kodama等将从拟南芥中克隆的叶绿体ω-3脂肪酸去饱和酶基因(FAD7基因)导入烟草中进行表达,发现转基因烟草中十六碳三烯酸、十八碳三烯酸含量提高,其前体物质含量相应减少,在1 ℃低温下表现出明显的抗寒性。表明FAD7基因在叶绿体中主要负责叶组织中三烯脂肪酸的形成,同时也有力地证明了三烯脂肪酸水平的提高对植物耐寒性有非常重要的作用[20],这与Dominguez等研究发现转FAD7基因番茄植株的抗寒性提高的结果一致[21]。1994年,Gibson等首次分离到FAD8基因,并进一步分析了FAD8、FAD7基因的结构和功能特点,结果表明,与其他已知去饱和酶基因及FAD7相比,在正常条件下,FAD8 mRNA表达水平较稳定,但在低温条件下,其表达水平会显著升高,证明FAD8基因属于低温诱导基因,与植物的抗冷性直接相关[22]。目前,已经从拟南芥、玉米、籼稻(OryzasativaL. ssp.indicaKato)、白桦、豇豆、油菜、马齿苋、播娘蒿等植物中分离到FAD8基因。Wang等将FAD8基因在水稻中过表达,发现转基因品系中十六碳三烯脂肪酸和亚麻酸含量均增加,2 ℃处理7 d后,转基因植株受损伤程度明显低于对照植株[23]。
研究发现,植物组织中不饱和脂肪酸含量一般占脂肪酸总量的75%以上,而植物组织的不饱和脂肪酸组成在很大程度上受脂肪酸去饱和酶种类和数量的调控,深入了解脂肪酸去饱和酶的种类、数量及其编码基因的各种性质对于定向改变植物的脂肪酸组成具有重要的理论和实际意义。本研究首次克隆到能源植物麻风树的FAD7基因,该基因为控制α-亚麻酸系列多不饱和脂肪酸合成的关键酶基因,深入研究该基因的结构特征、表达方式对于阐明麻风树不饱和脂肪酸与抗冷性的关系具有较好的指导作用。
[1]林 娟,周选围,唐克轩,等. 麻疯树植物资源研究概况[J]. 热带亚热带植物学报,2004,12(3):285-290.
[2]何 璐,虞 泓,范源洪,等. 麻疯树(JatrophacurcasL.)植物学研究进展[J]. 长江流域资源与环境,2010,19(增刊1):120-127.
[3]王海燕,文明富,刘石生,等. 麻疯树生物学研究进展及其开发利用[J]. 热带作物学报,2010,31(4):670-675.
[4]Johnson T S,Eswaran N,Sujatha M. Molecular approaches to improvement ofJatrophacurcasLinn. as a sustainable energy crop[J]. Plant Cell Reports,2011,30(9):1573-1591.
[5]Carels N.Jatrophacurcas:a review[J]. Advances in Botanical Research,2009,50:39-86.
[6]Lee D H,Lee C B. Chilling stress-induced changes of antioxidant enzymes in the leaves of cucumber:in gel enzyme activity assays[J]. Plant Science,2000,159(1):75-85.
[7]孙中海,章文才,区胜祥,等. 柑橘抗寒性与膜脂肪酸组分的关系研究[J]. 武汉植物学研究,1990,8(1):79-85.
[8]沈 漫,王明庥,黄敏仁. 植物抗寒机理研究进展[J]. 植物学通报,1997,14(2):1-8.
[9]Heilmann I,Mekhedov S,King B,et al. Identification of theArabidopsispalmitoyl-monogalactosyldiacylglycerol Δ7-desaturase geneFAD5,and effects of plastidial retargeting ofArabidopsisdesaturases on thefad5 mutant phenotype[J]. Plant Physiology,2004,136(4):4327-4345.
[10]Mekhedov S,de Ilárduya O M,Ohlrogge J. Toward a functional catalog of the plant genome. A survey of genes for lipid biosynthesis[J]. Plant Physiology,2000,122(2):389-402.
[11]Ohlrogge J B,Browse J A. Lipid biosynthesis[J]. Plant Cell,1995,7(7):957-970.
[12]Zhuang H,Hamilton-Kemp T R,Andersen R A,et al. The impact of alteration of polyunsaturated fatty acid levels on C6-aldehyde formation ofArabidopsisthalianaleaves[J]. Plant Physiology,1996,111(3):805-812.
[13]王海波,邹竹荣,龚 明. 基于RNA-Seq数据筛选的小桐子抗冷相关基因的表达模式及其聚类分析[J]. 基因组学与应用生物学,2014,33(6):1196-1205.
[14]Wang H B,Zou Z R,Wang S S,et al. Global analysis of transcriptome responses and gene expression profiles to cold stress ofJatrophacurcasL.[J]. PLoS One,2013,8(12):e82817.
[15]Wang H B,Zou Z R,Wang S S,et al. Deep sequencing-based transcriptome analysis of the oil-bearing plant Physic Nut(JatrophacurcasL.)under cold stress[J]. Plant Omics,2014,7(3):178-187.
[16]李忠光,龚 明. 不同化学消毒剂对小桐子种子萌发和幼苗生长的影响[J]. 种子,2011,30(2):4-7,12.
[17]朱 敏,余龙江. 脂酰脱饱和酶[J]. 生命的化学,2001,21(6):478-480.
[18]Kodama H,Nishiuchi T,Seo S,et al. Possible involvement of protein phosphorylation in the wound-responsive expression ofArabidopsisplastid omega-3 fatty acid desaturase gene[J]. Plant Science,2000,155(2):153-160.
[19]Yu C,Wang H S,Yang S,et al. Overexpression of endoplasmic reticulum omega-3 fatty acid desaturase gene improves chilling tolerance in tomato[J]. Plant Physiology and Biochemistry,2009,47(11/12):1102-1112.
[20]Kodama H,Hamada T,Horiguehi G,et al. Genetic enhance-merit of cold tolerance by expression of a gene for chloroplastω-3 fatty acid desaturase in transgenic tobacco[J]. Plant Physiology and Biochemistry,1994,105(2):601-605.
[21]Dominguez T,Luisa Hernandez M,Pennycooke J C,et al. Increasing omega-3 desaturase expression in tomato results in altered aroma profile and enhanced resistance to cold stress[J]. Plant Physiology,2010,153(2):655-665.
[22]Gibson S,Arondel V,Iba K,et al. Cloning of a temperature-regulated gene encoding a chloroplast omega-3 desaturase fromArabidopsisthaliana[J]. Plant Physiology,1994,106(4):1615-1621.
[23]Wang J,Ming F,Pittman J,et al. Characterization of a rice (OryzasativaL.) gene encoding a temperature-dependent chloroplastω-3 fatty acid desaturase[J]. Biochemical and Biophysical Research Communications,2006,340(4):1209-1216.
10.15889/j.issn.1002-1302.2017.02.008
2015-11-23
国家自然科学基金(编号:31460179)。
王海波(1980—),男,山西长治人,博士,副教授,硕士生导师,主要从事植物逆境分子生物学研究。Tel:(0874)8987890;E-mail:bocai0406@163.com。
Q785
A
1002-1302(2017)02-0031-05
王海波,郭俊云,刘 潮,等. 麻风树脂肪酸去饱和酶7基因的克隆及生物信息学分析[J]. 江苏农业科学,2017,45(2):31-35.
