小麦抗叶锈病中间材料的 Lr24、Lr38分子标记辅助选择
2017-03-01范学锋张徐明张立荣张英姿杨文香刘大群
王 志,安 哲,范学锋,张徐明,张立荣,张英姿,杨文香,刘大群
(1.河北农业大学植物病理学系/河北省农作物病虫害生物防治工程技术研究中心, 河北保定 071001;2.河北省沙河市农业局,河北沙河 054100)
小麦抗叶锈病中间材料的 Lr24、Lr38分子标记辅助选择
王 志1,安 哲1,范学锋1,张徐明2,张立荣1,张英姿1,杨文香1,刘大群1
(1.河北农业大学植物病理学系/河北省农作物病虫害生物防治工程技术研究中心, 河北保定 071001;2.河北省沙河市农业局,河北沙河 054100)
为加速小麦抗叶锈优质品种的培育,利用 Lr24、 Lr38的分子标记对优质品种豫麦34、中优9507和高抗叶锈品系1R17的杂交F3:4代的优质材料进行了目的基因的鉴定。结果从150份杂交后代F3:4中筛选出了70份聚合 Lr24和 Lr38的高抗优质材料,其余80份材料表型为抗叶锈病,但不含 Lr24和 Lr38或仅含二者之一。本研究避免了小麦抗叶锈病育种的盲目性,提高了抗叶锈基因选择的准确度。
小麦叶锈病; Lr24和 Lr38;基因聚合;分子标记辅助育种
由专性寄生真菌Pucciniatriticina引起的小麦叶锈病是影响我国小麦产量的重要病害之一[1]。抗病小麦品种的应用是防治该病害最经济、有效、环保的措施。由于定向选择压力增大,造成小麦叶锈菌生理小种变异加快,加速了抗病品种抗性的丧失。聚合多个抗病基因是增加品种抗病谱、延长品种使用期的有效途径。传统育种依赖于抗性鉴定和个体表型的选择,受环境条件、发育状况和鉴定方法等因素影响较大,容易使抗性基因在选择过程中丢失。对同一病原的不同抗性基因进行选择时,仅通过抗性表型很难判断所选材料携带的抗病基因。分子标记辅助育种是利用与特定性状紧密连锁或共分离的分子标记对DNA目标区域进行直接筛选的育种方法,具有快速、准确、不受环境条件影响等优点,可以及早、准确发现含目的基因的材料,提高育种效率[2]。董 娜等[3]利用与抗白粉病基因 Pm21和 Pm13共分离或紧密连锁的分子标记,对分别含 Pm21和 Pm13的小麦品系杂交F2代进行检测,获得 Pm21+ Pm13聚合单株。
目前,已发现100余个小麦抗叶锈病基因,已正式命名到 Lr73[4],其中有60余个已定位在小麦特定的染色体上[5]。 Lr24抗叶锈病基因来源于长穗偃麦草[6],携带此基因的小麦全生育期抗叶锈病。 Lr38来源于中间偃麦草[7],携带此基因的小麦全生育期抗叶锈病,我国尚未发现对 Lr38有毒性的菌株。
Lr24和 Lr38的RFLP、RAPD和AFLP标记已经转化为稳定简便的STS和SCAR标记。Schachermayr[8]和Gupta等[9]开发了 Lr24的分子标记,该标记稳定性强,与抗叶锈基因 Lr24共分离,其中,Gupta等[9]开发的分子标记的使用范围更广。张 娜等[10]分别采用小麦3D染色体上已知的EST-SSR标记和偃麦草E组染色体的一对SCAR标记,开发并验证了 Lr24和 Lr38的共显性引物。张翠茹[11]利用RAPD技术开发了 Lr38 的RAPD标记。闫红飞等[12]利用尤明山等[13]开发的偃麦草E组染色体的一对SCAR标记,建立了与 Lr38紧密连锁的分子标记。胡亚亚等[14]利用21个与Lr基因紧密连锁或共分离的分子标记,确定了14个小麦品种(系)中所含的抗叶锈基因。姚宏鹏等[15]利用已知的抗叶锈病基因 Lr10、 Lr24、 Lr34和 Lr38的分子标记,对生产上高产优质的小麦品种和含有多个高抗叶锈病基因的抗病小麦F2:3代材料进行目的基因的选择,筛选出具有聚合抗性基因的中间材料共47份。
本试验以多个农艺性状优良的小麦品种与含有高抗叶锈病基因( Lr24, Lr38)的1R17杂交后代F3:4为材料,对其植株进行 Lr24和 Lr38的分子检测,旨在筛选出兼具优良农艺性状和抗病基因 Lr24和 Lr38的后代,确保抗叶锈病育种目标的准确实施,加速育种进程。
1 材料与方法
1.1 试验材料
杂交亲本为5个优质栽培品种YM34、09P200、21924、21898、ZY9507及携带 Lr24和 Lr38基因的高抗品系1R17,杂交组合为1R17/YM34、1R17/ZY9507、1R17/09P200、1R17/21898、1R17/21924、ZY9507/1R17、ZY9507/1R17//1R17。接种用菌株为10种等量混合的强优势小麦叶锈菌,致病类型分别为FHRT、THTS、THQS、PHTP、THTT、FHGQ、FHQT、PHQT、THKT和FHHT。接种用菌株、感病品种郑州5389、感病对照Thatcher和近等基因系TcLr24、TcLr38、杂交后代F3:4材料均由河北农业大学小麦叶锈病研究中心提供。
1.2 试验方法
1.2.1 F3:4杂交后代抗病性鉴定
将F3:4杂交后代材料种于行长1.5 m,行距20 cm的小区,小区之间播种感病品种郑州5389。将10种强优势菌株等量混合放入水中并加入适量(0.1%)吐温20搅拌至叶锈菌团完全散开,于2015年4月18日傍晚用喷壶喷雾接种于郑州5389后,用地膜覆盖并黑暗保湿12~16 h。2015年5月18日和5月28日(郑州5389发病严重度达100%)进行测试材料的抗病性鉴定。按照Roelfs等[16]的小麦叶锈菌鉴定标准鉴定反应型。
1.2.2 样品选择
根据抗性评价标准,选择侵染型为“0”、“;”的单株进行挂牌标记并采集叶片,待小麦完全成熟后筛选株高合适、有一定抗倒伏能力、结实率高、穗形大、更接近于高产、优质亲本的单株。5月18日第一次选择,5月28日第二次印证选择,以第二次鉴定的结果为依据。
1.2.3 叶片总DNA的提取与质量检测
使用CTAB法[17]提取供试材料叶片的DNA,利用分光光度计和0.8%的琼脂糖凝胶电泳对DNA进行质量检测。
1.2.4 抗叶锈病基因聚合材料的分子检测
用于检测的分子标记见表1,引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为20 μL,包括10×buffer(含Mg2+)2 μL、dNTP 0.4 μL(10 mmol·L-1)、每条引物25 ng、模板DNA 50 ng、1 UTaq聚合酶。S1302-609标记的扩增程序为:95 ℃预变性2 min;94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃延伸7 min。Y38SCAR982标记的PCR反应程序为:94 ℃预变性5 min;94 ℃变性1.5 min,68 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃延伸8 min。扩增产物用1%的琼脂糖凝胶电泳检测。
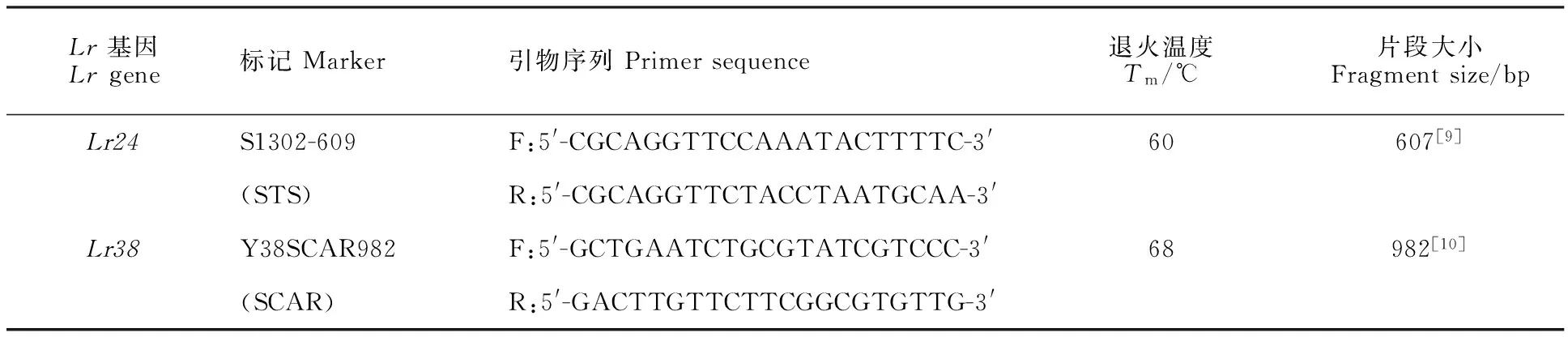
表1 Lr24与 Lr38的标记信息Table 1 Informations of marker linked with Lr24 and Lr38
2 结果与分析
2.1 田间材料的选择结果
从7种不同组合的F3:4代材料中选择对小麦叶锈病抗性为免疫或近免疫(0或;)、农艺性状良好的小麦品系150份,具体组合和抗性见表2。
2.2 小麦抗叶锈病材料的分子检测结果
2.2.1 目的基因 Lr24的检测结果
用与 Lr24紧密连锁的STS标记对供试材料检测,有105个F3:4杂交后代扩增出与 TcLr24相同的607 bp的DNA片段(图1),占被测F3:4杂交后代的70.0%。而感病对照Thatcher未出现该片段,认为这105份材料含有抗性基因 Lr24。
2.2.2 目的基因 Lr38的检测结果
用与 Lr38紧密连锁的SCAR标记对供试材料检测,有94个F3:4杂交后代出现了与TcLr38相同的982 bp的DNA片段(图2),占被测F3:4杂交后代的62.7%,而感病对照Thatcher未出现该片段,认为这94份F3:4杂交后代材料含有抗性基因 Lr38。

M:DNA marker;W:水; N:Tc Lr24;S:Thatcher;G:中优9507;1~20:1R17/中优9507的F3:4材料。下图同。
M:DNA marker; W:Water; N: Tc Lr24; S:Thatcher; G:ZY9507; 1-20:1R17/ZY9507 F3:4material.The same in Fig.2.
图1 部分材料 Lr24基因的扩增结果
Fig.1 PCR fragments of Lr24 gene in part tested materials

图2 部分材料 Lr38基因的扩增结果
2.3 Lr24和 Lr38的聚合结果
在被检测的150个杂交F3:4代材料中,有70(46.7%)个材料同时聚合了 Lr24和 Lr38,33个材料仅携带 Lr24基因,22个材料仅携带 Lr38基因,25份材料没有扩增出 Lr24和 Lr38中的任何一个基因(表2)。

表2 1R17抗叶锈基因导入聚合材料的结果Table 2 Genotyping results of resistance genes in pyramiding materials derived from 1R17
(续表2 Continued table 2)

编号Number组合Combination基因GeneLr24Lr38反应型Type编号Number组合Combination基因GeneLr24Lr38反应型Type481R17/ZY9507--0127ZY9507/1R171//1R17++0491R17/ZY9507++0128ZY9507/1R171//1R17-+0501R17/ZY9507++0129ZY9507/1R171//1R17-+0511R17/ZY9507+-0130ZY9507/1R171//1R17+-0521R17/ZY9507++0131ZY9507/1R171//1R17++0531R17/ZY9507++0132ZY9507/1R171//1R17+-0541R17/ZY9507++01331R17/YM34+-;551R17/ZY9507+-01341R17/YM34+-;561R17/ZY9507++01351R17/YM34-+;571R17/ZY9507++01361R17/YM34++;581R17/ZY9507++01371R17/YM34++;591R17/ZY9507++01381R17/YM34++;601R17/ZY9507+-01391R17/21924+-;611R17/ZY9507++01401R17/21924-+;621R17/ZY9507++01411R17/21924++;631R17/ZY9507++01421R17/21924++;641R17/ZY9507++01431R17/21924+-;651R17/ZY9507+-01441R17/21924++;661R17/ZY9507--01451R17/21898++;671R17/ZY9507++01461R17/21898-+;681R17/ZY9507++01471R17/21898++0691R17/ZY9507--01481R17/21898+-;70ZY9507/1R17++01491R17/21898++071ZY9507/1R17-+01501R17/21898+-;72ZY9507/1R17--0TcLr24+-0;73ZY9507/1R17--0TcLr38-+0;74ZY9507/1R17+-0ZY9507--375ZY9507/1R17--009P200--;1376ZY9507/1R17++0YM34--477ZY9507/1R17-+021924--;3178ZY9507/1R17--021898--;3179ZY9507/1R17--0Thatcher--4
3 讨 论
传统育种依靠表型选择杂交后代,容易受到自然环境、发育时期、鉴定方法等因素的影响,且改良周期长,在育种过程中,由于种群进化经常导致改良后的品种缺乏竞争优势。利用与目的基因紧密连锁或共分离的分子标记进行目的基因筛选,可以准确筛选优良目的基因,缩短育种年限。
抗叶锈基因 Lr24和 Lr38在中国均为强抗叶锈基因,按照常规育种方法很难确定所选材料是否携带这两种基因。利用分子标记辅助育种则可以有效克服这些困难。分子标记辅助选择的效率取决于被检测的分子标记与目标基因的连锁程度,连锁越紧密,则二者的重组率越低,选择效率越高。本试验所选用的分子标记(S1302-609、Y38SCAR982)与目的基因 Lr24、 Lr38紧密连锁,特异性强,能有效检测 Lr24和 Lr38基因[10-14]。
本研究田间对叶锈病高抗的150份材料中,有33份材料仅携带 Lr24基因,22份材料仅携带 Lr38基因。这主要由于 Lr24和 Lr38基因单独存在对叶锈菌均具有极强的抗性,田间表型差异很小,再次说明仅靠抗性鉴定很难确定材料所携带抗性基因类型。25份材料未携带 Lr24或 Lr38基因,这25份材料分别来自1R17与ZY9507、YM34、09P200和21898的杂交, 这可能是杂交后代聚合了ZY9507、YM34、09P200、21898与1R17的其他抗叶锈基因。试验再次体现了分子标记辅助鉴定的快速性、准确性。
研究发现,1R17/ZY9507的聚合效率最高,被测两个目的基因聚合率为63.7%;ZY9507/1R17的聚合效率最低,目的基因聚合率仅为10.5%;1R17为母本时,平均聚合率为39.8%,聚合效率较高;当1R17作为父本时,聚合率为仅为10.5%,聚合率低。回交材料ZY9507/1R17//1R17的目的基因聚合率达到40%,说明母本基因对后代的贡献较大,F2代与含有目的基因的亲本回交可以有效提高聚合效率。
由于本试验仅开展了 Lr24、 Lr38的分子标记检测,筛选结果中高产优质基因可能存在杂合现象,仍需对高产优质性状进行进一步跟踪,以期更高效获得高产、高抗叶锈病的优质小麦品种。
[1]KOMER J A.Genetics of resistance to wheat leaf rust [J].AnnualReviewofPhytopathology,1996,34(34):435.
[2] LANDE R,THOMPSON R.Efficiency of marker-assisted selection in the improvement of quantitative traits [J].Genetics,124(3):743.
[3] 董 娜,张亚娟,张军刚,等.分子标记辅助小麦抗白粉病基因 Pm21和 Pm13聚合育种[J].麦类作物学报,2014,34(12):1639.
DONG N,ZHANG Y J,ZHANG J G,etal.Molecular marker assisted pyramid breeding of powdery mildew resistance gene Pm21 and Pm13 [J].JournalofTriticeaeCrops,2014,34(12):1639.
[4] PARK R,MOHLER V,NAZARI K,etal.Characterisation and mapping of gene Lr73 conferring seedling resistance toPucciniatriticinain common wheat [J].Theoretical&AppliedGenetics,2014,127(9):2041.
[5] HERRERA S A,LAGUDAH E S,JULIO H E,etal.New slow-rusting leaf rust and stripe rust resistance genes Lr67 and Yr46 in wheat are pleiotropic or closely linked [J].Theoretical&AppliedGenetics,2011,122(1):239.
[6] LI H J,CHEN Q,CONNER R L,etal.Molecular characterization of a wheat-Thinopyrumponticumpartial amphiploid and its derivatives for resistance to leaf rust [J].Genome,2003,46(5):906.
[7] FRIEBE B,ZELLER F J,MUKAI Y,etal.Characterization of rust-resistant wheat-Agropyronintermediumderivatives by C-banding,insituhybridization and isozyme analysis [J].Theoretical&AppliedGenetics,1992,83(6-7):775.
[8] SCHACHERMAYR G M,MESSMER M M,FEUILLET C,etal.Identification of molecular markers linked to theAgropyronelongatumderived leaf rust resistance gene Lr24 in wheat [J].Theoretical&AppliedGenetics,1995,90(7-8):982.
[9] GUPTA S K,CHARPE A,KOUL S,etal.Development and validation of SCAR markers co-segregating with anAgropyronelongatumderived leaf rust resistance gene Lr24 in wheat [J].Euphytica,2006,150(1-2):233.
[10] 张 娜,陈玉婷,李亚宁,等.小麦抗叶锈病基因 Lr24的一个新STS标记[J].作物学报,2008,34(2):212.
ZHANG N,CHEN Y T,LI Y N,etal.A novel STS marker for leaf rust resistance gene Lr24 in wheat [J].ActaAgronomicaSinica,2008,34(2):212.
[11] 张翠茹.小麦抗叶锈基因 Lr38的RAPD分子标记[D].保定:河北农业大学,2001:24.
ZHANG C R.Development of a RAPD molecular marker for the leaf rust resistance gene Lr38 in wheat [D].Baoding:Agricultural University of Hebei,2001:24.
[12] 闫红飞,杨文香,褚 栋,等.小麦抗叶锈基因 Lr38的一个新标记[J].中国农业科学,2008,41(11):3604.
YAN H F,YANG W X,CHU D,etal.A new marker tagged to the leaf rust resistance gene Lr38 [J].ScientiaAgriculturaSinica,2008,41(11):3604.
[13] 尤明山,李保云,唐朝晖,等.偃麦草E染色体组特异RAPD和SCAR标记的建立[J].中国农业大学学报,2002,7(5):1.
YOU M S,LI B Y,TANG Z H,etal.Establishment of E-genome-specific RAPD and SCAR markers forThinopyrumspp [J].JournalofChinaAgriculturalUniversity,2002,7(5):1.
[14] 胡亚亚,张 娜,李林懋,等.14个小麦品种(系)抗叶锈性分析[J].作物学报,2011,37(12):2158.
HU Y Y,ZHANG N,LI L M.Analysis of wheat leaf rust resistance genes in 14 wheat cultivars or lines [J].ActaAgronomicaSinica,2011,37(12):2158.
[15] 姚宏鹏,安 哲,张毓妹,等.小麦抗叶锈病聚合品种中间材料的分子标记辅助选择[J].分子植物育种,2015,11(13):2421.
YAO H P,AN Z,ZHANG Y M,etal.Marker-assisted selection of wheat leaf rust resistance genes in the pyramiding middle materials of wheat [J].MolecularPlantBreeding,2015,11(13):2421.
[16] ROELFS A P,SINGH R P,SAARI E E.Rust Diseases of Wheat:Concepts and Methods of Disease Management [M].Mexico,D.F.,CIMMYT,1992:7.
[17] GILL K S,LUBBERS E L,GILL B S,etal.A genetic linkage map ofTriticumtauschii(DD) and its relationship to the D genome of bread wheat(AABBDD) [J].Genome,1991,34(3):362.
Marker-Assisted Selection of Wheat Leaf Rust Resistant Genes Lr24 and Lr38 in the Pyramiding Materials of Wheat
WANG Zhi1,AN Zhe1,FAN Xuefeng1,ZHANG Xuming2,ZHANG Lirong1,ZHANG Yingzi1,YANG Wenxiang1,LIU Daqun1
(1.Department of Plant Pathology,Agricultural University of Hebei/Biological Con1trol Center of Plant Diseases and Plant Pests of Hebei Province,Baoding,Hebei 071001,China; 2.Agricultural Bureau of Shahe City,Shahe,Hebei 054100,China)
In order to screen the leaf rust resistance and high quality pyramiding wheat progeny,the molecular markers of leaf rust resistance genes Lr24 and Lr38 were used to identify the wheat leaf rust resistance gene Lr24 and Lr38 in 150 F3:4offsprings derived from the high-yield and high-quality varieties. The results showed that 70 of 150 lines co-contained both Lr24 and Lr38.Eighty lines which showed resistance contained no Lr24 or Lr38. This study reduced the cost of wheat breeding improvement and improved the accuracy of gene selection for leaf rust resistance.
Wheat leaf rust; Lr24 and Lr28; Resistance genes pyramiding; Molecular maker-assisted breeding
时间:2017-01-03
2016-04-07
2016-06-14
国家重点基础研究发展计划项目(2013CB127700);河北省现代农业产业体系小麦产业创新团队建设项目(HBCT2013010204);河北省高等学校科学技术研究项目(Z2014065)
E-mail:w2707905@163.com
杨文香(E-mail:wenxiangyang2003@163.com); 刘大群(E-mail:ldq@hebau.edu.cn)
S512.1;S332
A
1009-1041(2017)01-0016-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20170103.1625.006.html
