心肌缝隙连接蛋白43在运动预处理不同保护时相表达变化的比较研究
2017-03-01齐光辉王凯
齐光辉 王凯
曲阜师范大学体育科学学院(山东曲阜 273165)
心肌缝隙连接蛋白43在运动预处理不同保护时相表达变化的比较研究
齐光辉 王凯
曲阜师范大学体育科学学院(山东曲阜 273165)
目的:比较大鼠心肌缝隙连接蛋白43(Cx43)mRNA和蛋白在运动预处理(EP)早、晚期保护时相的表达变化。方法:SD大鼠32只随分为对照组(C组)、力竭运动组(EE组)、早期运动预处理+力竭运动组(EEP+EE组)和晚期运动预处理+力竭运动组(LEP+EE组)。在建立EP和EE动物模型基础上,用原位杂交和实时荧光定量PCR方法观察和检测心肌Cx43 mRNA表达,用免疫组织化学和Western免疫印迹方法观察和检测心肌Cx43蛋白表达。结果:与EE组相比,EEP+EE和LEP+EE组心肌Cx43 mRNA和蛋白水平显著升高。与EEP+EE组相比,LEP+EE组心肌Cx43原位杂交信号没有显著变化,Cx43 mRNA表达也没有显著性差异。与EEP+EE组相比,LEP+EE组心肌Cx43免疫阳性反应无明显变化,Cx43蛋白表达也没有显著性差异。结论:运动预处理早、晚期保护时相分别促进了心肌Cx43 mRNA和蛋白的表达,但在这两个保护时相之间,Cx43 mRNA和蛋白的表达没有明显差异,表明心肌Cx43在介导运动预处理早、晚期心肌保护效应中的表达变化规律和运动预处理早、晚期保护时相的变化具有同步性。
运动预处理;缝隙连接蛋白43;心肌;大鼠;保护时相
运动预处理(exercise preconditioning,EP)作为运动干预手段,一方面能够诱导减轻心肌缺血再灌注(ischemic-reperfusion,I/R)损伤的保护效应[1,2],另一方面能诱导减轻力竭运动致运动性心肌损伤的心肌保护效应[3-5],并且EP心肌保护效应分为早期保护效应(ear⁃ly exercise preconditioning,EEP)和晚期保护效应(late exercise preconditioning,LEP)两个时相,前者在预处理随后就发生,时间约为1~3 h。后者在预处理后12 h发生,24~48 h达到高峰,并能够持续24~72 h[6]。
EP心肌保护效应的内在机制可能涉及到信号转导通路的中介物质或效应物质的表达分布及活化。心肌缝隙连接蛋白43(connexin43,Cx43)是心肌保护效应中的一种重要的效应物质。心肌缝隙连接(gap junc⁃tion,GJ)是将相邻心肌细胞进行连接的细胞内通道,主要由效应物质心肌Cx43构成,并且该物质在心肌保护效应信号转导通路中发挥重要作用。有研究发现运动引起心肌Cx43表达明显升高[7,8]。我们前期的研究发现,EP引起了心肌Cx43蛋白水平明显升高[9]。但是,关于心肌Cx43在EP早、晚期不同心肌保护时相中表达变化的比较研究未见相关报道。本研究旨在通过比较心肌Cx43 mRNA和蛋白在EP早、晚期保护时相中的表达变化,为深入探讨EP早、晚期心肌保护效应机制提供新的理论和实验依据。
1 材料与方法
1.1 动物模型的建立
选用体重约256±13 g的健康雄性SD大鼠32只作为实验对象,采购于山东中医药大学实验中心,许可证号:0013594,实验动物合格证号:Scxk(鲁)2013001。常规分笼饲养,5只/笼,均以标准啮齿类动物饲料饲养,自由饮食饮水。室温20~22℃,相对湿度45%~50%,光照时间12 h/d。大鼠在0°跑台连续进行5 d适应性训练,速度15 m/min,时间 10~20 min。在适应性训练后休息1 d,将32只大鼠随机分为对照组(control group,C组)、力竭运动组(exhaustive exer⁃cise group,EE组)、早期运动预处理+力竭运动组(ear⁃ly exercise preconditioning + exhaustive exercise group,EEP+EE组)和晚期运动预处理+力竭运动组(late exercise preconditioning+ exhaustive exercise group,LEP+EE组)。参照Shen等[3,4]的文献报道及我们前期的研究成果[5],建立EP和EE模型。
C组不进行跑台运动,EE组以35 m/min的速度运动至力竭,致大鼠运动性心肌损伤。EEP和LEP组进行一次速度为28~30 m/min、运动10 min、休息10 min、重复4次的间歇跑台运动,建立EP模型。EEP+EE和LEP+EE组在上述EP基础上,分别在30 min和24 h后再以35m/min的速度运动至力竭。
1.2 取材与处理
在建模结束30 min后,分别对C组、EE组、EEP+ EE组和LEP+EE组取材。实验程序如下:腹腔麻醉大鼠并取出大鼠心脏。一部分心脏经预先冷却的灭菌生理盐水清洗,置于液氮中速冻后,放置于-80℃冰箱保存,用于心肌Cx43 mRNA和蛋白表达的检测。另一部分心脏进行原位灌注后,用于观察心肌Cx43 mRNA和蛋白表达分布情况。
1.3 心肌CCxx4433 mmRRNNAA原位杂交实验
切片经常规脱蜡至水、漂洗、胃蛋白酶消化后,加原位杂交预杂交液进行预杂交孵育,滴加含有地高辛标记的寡核苷酸探针的杂交液进行杂交孵育,用SSC进行漂洗,滴加血清封闭液进行封闭并于恒温箱内孵育,滴加SABC进行孵育后,再滴加生物素化过氧化酶进行孵育并DAB显色、苏木素复染及盐酸酒精分化。然后进行脱水透明、封片、观察及摄片。合成的心肌Cx43 mRNA探针序列如下所示:5’-TCTCT CACGT GCGCT TCTGG GTCCT TCAGA TCATA-3’;5’-CT⁃CA TCCAG TGGTA CATCT ATGGG TTCAG CTT⁃GA G-3’;5’-AACAA TTCCT CGTGC CGCAA TTA⁃CA ACAAG CAAGC-3’。Cx43原位杂交试剂盒和DAB显色试剂购买于武汉博士德生物工程有限公司。
1.4 心肌CCxx4433 mmRRNNAA表达测定
采用实时荧光定量PCR方法检测Cx43 mRNA表达。心肌组织加入Trizol试剂匀浆,进行总RNA的提取,用样品RNA进行cDNA合成,合成的cDNA用于实时定量PCR扩增反应。反应体系由10×PCR缓冲液、Taq聚合酶、PCR特异引物F和R、2×ROX Reference Dye及cDNA组成。反应程序为:(95℃,3 min),1个循环;(95℃,15 sec;59℃,20 sec;72℃,20 sec;82.5℃,20 sec),40个PCR循环。在ABI 7900 Realtime PCR仪上进行定量PCR的检测。采用TANON凝胶图像分析系统进行图像处理,并以目的基因/GAPDH mRNA电泳条带吸光度来表示Cx43 mRNA结果。Cx43和内参GAPDH的序列位置见表1。
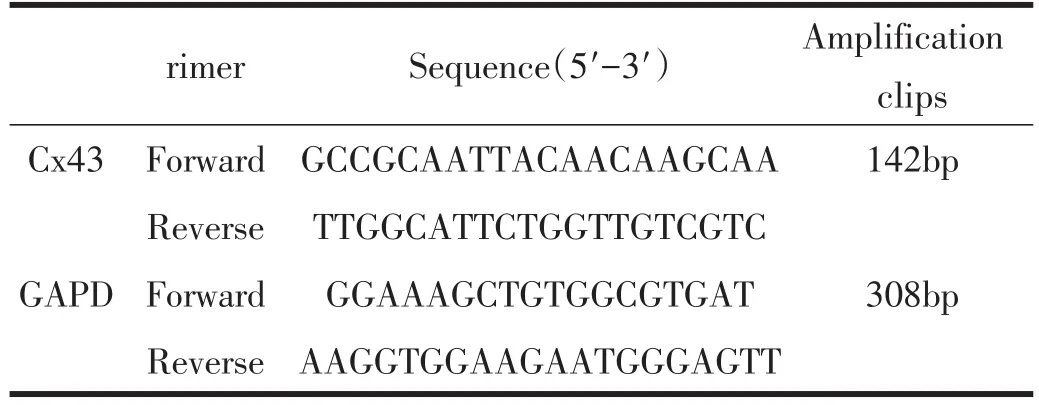
表1 心肌Cx43与GAPDH序列和扩增片段
1.5 心肌CCxx4433的定位表达
柑橘产量与气温、降水量呈显著正相关;与日照时数呈极显著负相关。需要加强研究柑橘各发育期气象因子与柑橘产量的关系,掌握柑橘生长发育期对气温、降水、日照的需求,有效利用气象条件,防范气象灾害,结合生产实际,加强果园管理,提高柑橘产量与品质。
采用免疫组织化学SABC法,切片经常规脱蜡、漂洗、孵育、山羊血清封闭及孵育后,滴加一抗(1∶200,兔抗鼠Cx43),孵育,置于室温并经PBS漂洗,滴加生物素化二抗(1∶200,羊抗兔IgG),于37℃温箱内孵育,滴加SABC,孵育、显色、脱水、透明及封片。
1.6 心肌CCxx4433蛋白表达检测
采用western blot方法,取心肌组织低速匀浆并进行15 min离心后,取上清待用,加入电泳缓冲液煮沸、上样、电泳,进行蛋白质转移并将转移后的膜置于室温封闭,再进行免疫反应,分别加入Cx43和GAPDH一抗(1∶5000和1∶10000,兔抗鼠。Cx43,购于武汉博士德生物工程有限公司。GAPDH,购于上海康成生物工程公司)。洗膜后加入二抗(1∶5000,羊抗兔),室温震荡孵育,充分洗膜并进行显色。心肌Cx43的蛋白水平用Cx43蛋白灰度值/GAPDH灰度值的相对比值表示。
1.7 统计学分析
采用SPSS 12.0统计软件处理实验数据,所有数据以均数±标准差(±s)表示。组间比较采用One-way ANOVA检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 心肌CCxx4433原位杂交实验观察
心肌Cx43原位杂交结果如图1所示,C组原位杂交信号呈棕褐色分布于心肌细胞胞浆之中。与EE组相比,EEP+EE和LEP+EE组原位杂交信号增强,而EEP+ EE和LEP+EE组相比,原位杂交信号没有明显差异。

图1 各组大鼠心肌Cx43原位杂交结果(×400)
2.2 心肌CCxx4433实时荧光定量PPCCRR检测
心肌Cx43实时荧光定量PCR结果如图2所示。与EE组相比,EEP+EE和LEP+EE组水平升高,且具有统计学意义(2.12±0.18 vs.1.51±0.15;2.19±0.29 vs.1.51±0.15,P<0.05),而EEP+EE和LEP+EE组相比没有显著性差异(2.12±0.18 vs.2.19±0.29,P>0.05)。
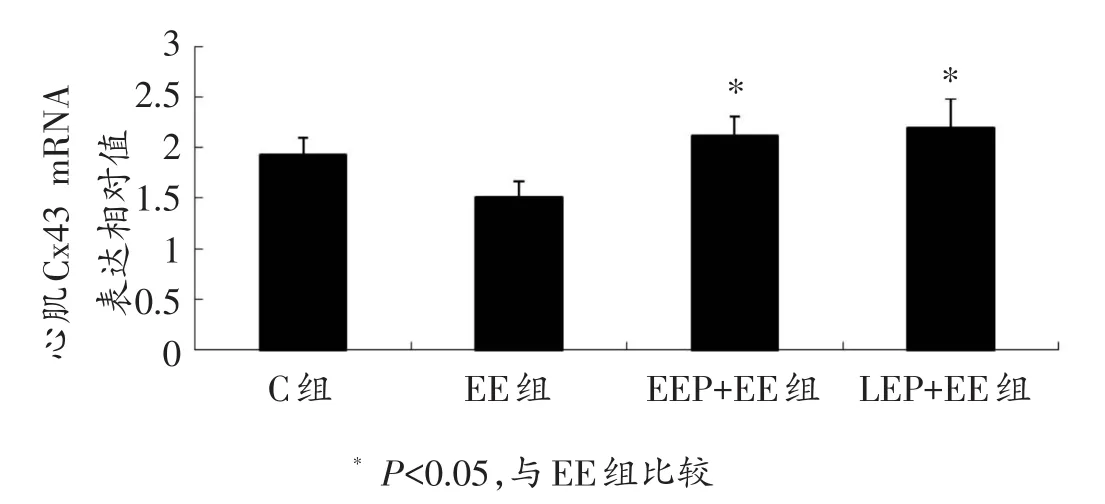
图2 各组大鼠心肌Cx43 mRNA表达水平比较
心肌Cx43免疫组织化学实验结果如图3所示。C组免疫阳性反应呈棕褐色杆状或小斑点状分布于心肌细胞闰盘处和心肌细胞侧-侧处,以闰盘处较多;与EE组相比,EEP+EE和LEP+EE组免疫阳性反应增强。而EEP+EE和LEP+EE组相比,免疫阳性反应无显著差异。
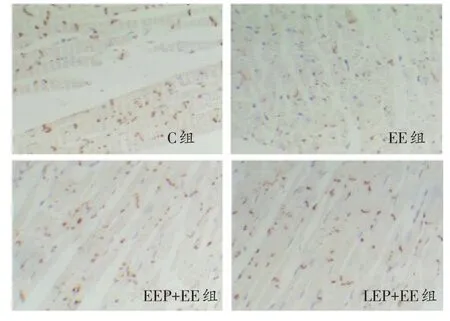
图3 各组大鼠心肌Cx43免疫组织化学结果(×400)
2.4 心肌CCxx4433免疫印迹检测
心肌Cx43免疫印迹结果如图4所示。与EE组相比,EEP+EE和LEP+EE组水平升高,且具有统计学意义(0.51 ± 0.08 vs.0.30 ± 0.10;0.51 ± 0.27 vs.0.30±0.10,P<0.05)。而LEP+EE组和EEP+EE组相比没有显著性差异(0.51±0.08 vs.0.51±0.27,P>0.05)。
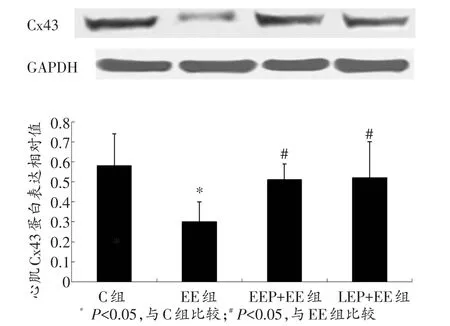
图4 各组大鼠心肌Cx43蛋白水平比较
3 讨论
3.1 运动预处理心肌保护效应
Murry等[10]研究发现,缺血预处理(ischemic pre⁃conditioning,IP)能够诱导减轻缺血性心肌损伤的保护效应,并且,IP心肌保护效应分为第一保护时相(first window of protection,FWOP)和第二保护时相(second window of protection SWOP)。FWOP作为早期发生的保护效应,通常在IP后即刻发生,并能持续约2~3 h,而SWOP是在IP后12~24 h发生,并能持续约72~90 h的晚期保护效应[11,12]。
EP作为一种预处理的手段,也能够诱导减轻心肌损伤的保护效应。与IP心肌保护效应分为FWOP和SWOP两个保护时相相类似,EP心肌保护效应分为EEP和LEP两个保护时相。Domenech等[6]研究发现,EP诱导产生了减轻心肌I/R损伤心肌梗塞面积的早、晚期两个时相的保护效应。Babai等[13]研究发现,EP可以诱导产生减轻心肌I/R损伤引发的室性心律失常的早、晚期两个时相的保护效应。Shen等[4]研究发现,EP可以诱导产生减轻异丙肾上腺素(isoproterenol,ISO)导致的心肌损伤,对ISO所致心肌损伤产生早、晚期保护效应。以上研究表明,EP能够诱导产生减轻心肌I/R损伤心肌梗塞面积、心律失常等早、晚期两个时相心肌保护效应。本课题组参照Domenech等[6]和Shen等[3,14]文献报道的运动方案建立运动预处理和力竭运动模型,研究发现,EP诱导了减轻力竭运动导致的急性心肌损伤的早、晚期保护效应[5]。
以上研究表明,EP一方面能够诱导产生减轻缺血性心肌损伤的早、晚期保护效应,另一方面能够诱导减轻运动性心肌损伤的早、晚期保护效应。在EP诱导减轻心肌损伤的保护效应中,涉及到的信号转导通路主要包括触发物质-中介物质-效应物质,其中中介物质主要包括蛋白激酶C(protein kinase C,PKC)和蛋白激酶A等;效应物质主要包括ATP敏感钾通道、热休克蛋白和缝隙连接蛋白等离子通道和效应蛋白[15]。
根据以上分析可知,EP减轻心肌损伤保护效应的机制可能是运动作为一种预处理的刺激引起中介物质的活化,进一步调控了效应物质的活化或增强了其表达水平,从而诱导了减轻运动性心肌损伤的早、晚期保护效应[16,8]。但是,在EP心肌保护效应中,具体是哪一种或哪些物质介导了早、晚期保护效应,尚需进一步探讨。
3.2 缝隙连接蛋白4433在运动预处理早、晚期保护时相的表达变化
心肌Cx43是形成缝隙连接通道的主要蛋白成分,在心肌保护效应信号转导通路中发挥重要作用。IP保护效应影响了心肌缺血损伤时心肌Cx43的表达和分布,可能是因为IP改变了缺血时心肌Cx43的磷酸化状态而达到保护缺血心肌的作用,而心肌Cx43磷酸化状态维持的机制可能是通过IP引起心肌线粒体ATP敏感钾通道开放或激活PKC激酶的活性来实现的。EP心肌保护效应也能够促进心肌Cx43的表达,心肌Cx43在EP诱导的心肌保护效应中发挥了重要的作用[9]。但是对心肌Cx43在EP早、晚期两个保护时相中的表达变化比较的研究尚未涉及。本实验进一步比较了心肌Cx43 mRNA和蛋白在EP早、晚期保护时相中的表达变化,结果显示,运动性心肌损伤后Cx43 mRNA明显下降,在EP诱导的早期和晚期保护效应中,Cx43 mRNA表达明显上升,而EP的两个保护效应相比较,Cx43 mRNA的表达未见明显变化。心肌Cx43蛋白的表达和Cx43 mRNA的表达相类似,在EP诱导的早期和晚期保护效应中,Cx43蛋白的表达明显上升,而早、晚期不同保护时相相比较,Cx43蛋白的表达未见明显变化。
心肌Cx43是心室肌细胞之间电流的主要导体[17],对心肌缝隙连接通道正常电偶联功能、心脏正常电活动和协调心脏舒缩功能有重要影响[18]。研究表明,心肌缺血时,氧自由基增加、钙超载及酸中毒等因素可导致心肌Cx43和心肌缝隙连接通道结构和功能发生改变,从而引起电脱偶联,这是诱发缺血性心律失常的重要因素[19]。李玉光等[20]研究发现,急性心肌缺血时,引起心肌Cx43降解,并且心肌端-端连接处的降解比侧-侧连接处的降解更为明显,端-端连接处心肌Cx43的明显减少会导致心脏纵向传导速度明显下降,使心肌传导速度的各向异性发生改变,这些改变是导致心肌传导阻滞和折返传导,诱发心律失常发生的根本原因。Beardslee等[21]研究发现,心肌组织随缺血情况的加重可能发生心肌Cx43磷酸化水平下降而去磷酸化水平升高,认为心肌Cx43的去磷酸化和细胞内的ATP水解互为因果,因此影响了细胞间电偶联,导致传导异常和形成折返性心律失常。
除了心肌缺血能够影响心肌Cx43的表达外,有研究发现,过度训练能够影响心肌Cx43的表达变化,引起心肌侧-侧连接处电偶联增多,端-端连接处电偶联减少,并且发生分布紊乱现象[7]。在心脏中,心脏脉冲的传导速度存在着各向异性,当各向异性低时,正常情况下有序化的心脏收缩和舒张功能会被破坏,发生折返性的几率增大,较容易发生心房颤动和心律失常。过度训练引起心肌损伤的机制可能是连接蛋白构型变化增加了横向传导,降低了各向异性传导的能力,使传导速度减慢,增加了传导折返环形成的几率,诱使心律失常的发生。因为连接蛋白正常构型是心脏传导的解剖学基础,有研究结果表明,在病理条件下,伴随着心衰程度的加重,连接蛋白发生端-端连接减少,侧-侧连接增加的构型改变。心肌脉冲传导速度减慢,形成折返传导的几率加大,随着心衰程度的进一步加重,连接蛋白发生降解和蛋白量减少,引起心肌传导阻滞加重,进而诱发心律失常[22]。
以上因心肌缺血和过度训练对心肌Cx43的影响及所诱发的心律失常的机制可能相一致,并且因心肌缺血和过度训练所引起的心肌Cx43的表达变化与我们前期的研究结果相吻合[23]。同时也有研究发现,规律性的运动训练也能够影响心肌Cx43的表达变化,田振军等[7]研究发现,有氧运动引起心肌Cx43表达的升高及其分布构型的变化。Bellafiore等[8]研究发现,耐力运动在引起心肌Cx43表达增加的同时,导致了心肌毛细血管面积明显增加,表明心肌Cx43的表达变化参与了心肌微脉管的重塑过程。同时我们前期的研究发现,运动性心肌损伤引起了心肌Cx43蛋白水平明显降低,而EP在一定程度上维持了心肌Cx43蛋白的表达水平[9]。以上研究表明,过度训练和力竭运动能够引起心肌Cx43的表达下降,而EP及其规律性运动可以维持该蛋白的表达及分布。
本研究发现心肌Cx43 mRNA和蛋白在EP早、晚期不同保护时相中的表达明显上升,且该蛋白的表达变化时间和EP早、晚期保护时相相一致。心肌Cx43蛋白表达的增加及表达的重新分布通过改变心肌缝隙连接通道的构型,进一步影响了心肌细胞电偶联及电生理特性,从而减轻了运动性心肌损伤。以上心肌Cx43蛋白不但在EP早期保护时相中发挥了心肌保护效应,也在EP晚期保护时相中发挥了心肌保护效应,表明EP早期保护时相和晚期保护时相都能够通过促进心肌Cx43的表达而诱导心肌保护效应。这提示在EP诱导的减轻力竭运动所致运动性心肌损伤的早、晚期保护效应中,心肌Cx43作为一种效应物质介导了此心肌保护效应。而心肌Cx43在EP的早期保护效应和晚期保护效应相比较未见明显差异,表明心肌Cx43在介导运动预处理早、晚期心肌保护效应中的表达变化规律和运动预处理早、晚期保护时相的变化具有同步性。
心肌Cx43作为EP心肌保护通路的效应物质,是公知的磷酸化蛋白,其C-末端丝氨酸残基有许多磷酸化位点,受多种蛋白激酶和/或蛋白磷酸酶调节。心肌Cx43介导EP早、晚期保护效应的机制可能受到PKC的调控。Yu等[24]研究发现,PKC的活化一方面引起了心肌Cx43蛋白表达增加,同时还引起了该蛋白表达分布及构型的变化。Miura等[25]研究发现,可以通过激活PKC激酶以维持心肌Cx43磷酸化水平,关闭缝隙连接通道,从而减少死亡因子的扩散来发挥缩小心肌梗塞面积的作用。进一步研究发现,PKC能够引起心肌Cx43具体位点的变化从而导致该蛋白构象变化。Bao等[26]研究发现,PKC引起了心肌Cx43在S368位点的磷酸化,从而导致该蛋白构型发生变化,并进一步影响到缝隙连接通道,引起该通道通透性降低。Ek-Vitorin等[27]研究发现,PKC引起的心肌Cx43在S368位点的磷酸化参与了心肌缝隙连接通道对选择渗透性的调控。以上研究提示,可能是PKC直接磷酸化心肌Cx43羧基末端区域的S368位点,导致单通道电导功能发生变化,进而降低细胞间通讯联系并影响心肌细胞保护效应。
根据我们的研究,EP能维持心肌Cx43蛋白的表达,在运动性心肌损伤过程中维持心肌Cx43的含量,减少其脱磷酸化,从而保持其构成的心肌缝隙连接通道的基本结构,减少横向传导,增加了各向异性传导的能力,使传导速度加快,减少传导折返环形成的几率,在一定程度上减少运动性心肌损伤的发生。以上研究只对PKC能够调控心肌Cx43的表达进行了探讨,而进一步的研究发现,不管是在EP早期心肌保护效应还是晚期保护效应中,PKC都影响了心肌Cx43的表达及分布[28]。并且,也有研究发现,在EP早期和晚期心肌保护效应中,δPKC的蛋白表达升高[14],表明δPKC的蛋白表达变化和EP早期和晚期保护时相的变化相一致。同时δPKC的蛋白表达升高与我们研究中心肌Cx43在EP早、晚期保护时相中的表达升高以及PKC调控了EP早、晚期保护时相中的心肌Cx43的表达结果相吻合。这提示PKC作为一种重要的中介物质,对EP早、晚不同心肌保护时相中效应物质心肌Cx43的表达具有调控作用。从而也证实了PKC调控心肌Cx43的表达和运动预处理早、晚期保护时相的变化相一致。
正是PKC的调控,引起心肌Cx43表达升高和分布构型发生变化,从而介导了减轻运动性心肌损伤保护效应。PKC的亚型较多,到底是哪一种亚型参与了对心肌Cx43在S368位点的磷酸化尚需作进一步探讨。除了PKC能够调控心肌Cx43的表达外,影响该蛋白表达分布的因素很多,该蛋白可能还受到其他中介物质的调控,或者也可能是因为心肌Cx43和其他效应物质之间的相互作用引起了该蛋白的表达变化,从而介导了减轻运动性心肌损伤的保护效应。心肌Cx43在EP不同保护时相表达变化的机制尚需深入探讨。
4 结论
运动预处理早、晚期保护时相分别促进了心肌Cx43 mRNA和蛋白的表达,但在这两个保护时相之间,Cx43 mRNA和蛋白的表达没有显著性差异,表明心肌Cx43在介导运动预处理早、晚期心肌保护效应中的表达变化规律和运动预处理早、晚期保护时相的变化具有同步性。
[1]Parra VM,Macho P,Domenech RJ.Late cardiac precondi⁃tioning by exercise in dogs is mediated by mitochondrial potassium channels[J].J Cardiovasc Pharmacol,2010,56(3):268-274.
[2]Powers SK,Quindry JC,Kavazis AN.Exercise-induced cardioprotection againstmyocardialischemia-reperfusion injury[J].Free Radic Biol Med,2008,44(2):193-201.
[3]Shen YJ,Pan SS,Ge J,et al.Exercise preconditioning providesearly cardioprotection againstexhaustive exer⁃cise in rats:potential involvement of protein kinase C del⁃ta translocation[J].Mol Cell Biochem,2012,368(1-2):89-102.
[4]Shen YJ,Pan SS,Zhuang T,et al.Exercise precondition⁃ing initiates late cardioprotection against isoproterenol-in⁃duced myocardial injury in rats independent of protein kinase C[J].J Physiol Sci,2011,61(1):13-21.
[5]王凯.心肌ATP敏感钾通道在运动预适应诱导减轻运动性心肌损伤保护效应中变化的研究[D].上海体育学院博士学位论文,2012.
[6]Domenech R,Macho P,Schwarze H,et al.Exercise induc⁃es early and late myocardial preconditioning in dogs[J].Cardiovasc Res,2002,55(3):561-566.
[7]王友华,田振军.不同强度动训练对大鼠心室肌胶原纤维和Cx43和Cx45影响的实验研究[J].北京体育大学学报,2009,32(6):47-50.
[8]BellafioreM,SivveriniG,Palunbo D,etal.Increased cx43 and angiogenesis in exercised mouse hearts[J].Int J Sports Med,2007,28(9):749-755.
[9]王凯,刘洪珍.心肌缝隙连接蛋白43mRNA和蛋白在运动预处理心肌保护效应中表达变化[J].中国运动医学杂志,2014,33(7):676-681.
[10]Murry CE,Jennings RB,Reimer KA.Preconditioning with ischemia:a delay of lethal cell injury in ischemic myocar⁃ dium[J].Circulation,1986,74(5):1124-1136.
[11]Kuzuya T,Hoshida S,Yamashita N,et al.Delayed effects of sublethal ischemia on the acquisition of tolerance to ischemia[J].Circ Res,1993,72(6):1293-1299.
[12]MarberMS,LatchmanDS,WalkerJM,etal.Cardiac stress protein elevation 24 hours after brief ischemia or heat stress is associated with resistance to myocardial in⁃farction[J].Circulation,1993,88(3):1264-1272.
[13]Babai L,Szigeti Z,Parratt JR,et al.Delayed cardioprotec⁃tive effects of exercise in dogs are amino guanidine sen⁃sitive:possible involvementofnitricoxide[J].Clin Sci(Lond),2002,102(4):435-445.
[14]申毓军.运动预适应对力竭运动大鼠心肌损伤保护效应中蛋白激酶C的作用及其机制[D].上海体育学院博士学位论文,2011.
[15]申毓军,潘珊珊.运动预适应心肌保护效应与细胞信号转导研究现状和展望[J].上海体育学院学报,2010,34(6):55-58.
[16]Calvert JW.Cardioprotective effects of nitrite during exer⁃cise.Cardiovasc Res,2011,89(3):499-506.
[17]Saffitz JE.Regulation of intercellular coupling in acute and chronic heart disease[J].Braz J Med Res,2000,33(4):407-413.
[18]Kirchhof S,Kin JS,Hngendorf A,et al.Abnormal cardiac conduction and morphogenesis in connexin40 and connex⁃in43 double-deficient mice[J].Cire Res,2000.87(5):346-348.
[19]王广强.步长稳心颗粒通过调节Cx43稳定性抗缺血性心律失常作用研究[D].吉林大学硕士学位论文,2013.
[20]李玉光,林吉进,王东明,等.急性心肌缺血时连接蛋白43迅速降解的非均一性研究[J].中华心血管病杂志,2002,30(9):50-53.
[21]Beardslee MA,Lerner DL,Tadros PN,et al.Dephosphory⁃lation and intracellular redistribution of ventricular con⁃nexin43 during electrical uncoupling induced by ischemia [J].Circ Res,2000,87(8):656-662.
[22]Jonsma HJ,Wilder R.Gap junctions in cardiovascular disease.Cir Res,2000,86(12):1193-1197.
[23]王凯.心肌缝隙连接蛋白43基因和蛋白在运动性心肌损伤中表达变化的研究.北京体育大学学报[J],2013,36(10):59-64.
[24]Yu L,Zhao Y,Xu S,et al.Advanced Glycation End Prod⁃uct(AGE)-AGE Receptor(RAGE)System Upregulated Connexin43 Expression in Rat Cardiomyocytes via PKC and Erk MAPK Pathways[J].Int J Mol Sci,2013,14(2):2242-2257.
[25]Miura T,OhnumaY,Kuno A,et al.Protective role of gap junctions in preconditioning against myocardial infarction [J].Am JPhysiolHeartCircPhysiol,2004,55(1):H214-H2211.
[26]Bao X,Reuss L,Altenberg GA.Regulation of purified and reconstituted connexin43 hemichannels by protein ki⁃nase C mediated phosphorylation of Serine 368.J Biol Chem,2004,279(19):20058-20066.
[27]Ek-Vitorin JF,King TJ,Heyman NS,et al.Selectivity of connexin 43 channels is regulated through protein kinase C-dependent phosphorylation[J].Circ Res,2006,98(12):1498-1505.
[28]王凯.蛋白激酶C对晚期运动预处理心肌保护效应中缝隙连接蛋白43表达的影响[J].中国运动医学杂志,2015,34(11):1081-1087.
Comparative Study on the Expression of Myocardial Connexin 43 in Different Cardioprotection Stages of Exercise Preconditioning
Qi Guanghui,Wang Kai
College of Sports Science,Qufu Normal University,Qufu 273165,China
Wang Kai,Email:wangkai-liaoda@163.com
ObjectiveTo compare the expression of myocardial connexin 43(Cx43)mRNA and its pro⁃tein during early and late cardioprotection stages of exercise preconditioning.MethodsThirty-two Sprague-Dawley rats were randomly divided into a control group,an exhaustive exercise(EE)group,an early exercise preconditioning+exhaustive exercise(EEP+EE)group and a late exercise preconditioning +exhaustive exercise(LEP+EE)group,each of 8.All groups were given intervention as their group name indicated.Then in situ hybridization and real-time fluorescent quantitative PCR methods were used to detect the changes of myocardial Cx43mRNA and immunohistochemical method and Western blotting were used to detect the changes of Cx43 protein.ResultsCompared with EE group,there was significant increase in Cx43 mRNA and its protein expression in group EEP+EE and LEP+EE.Com⁃pared with EEP+EE group,no significant changes was found in situ hybridization and Cx43 Immunoreac⁃tivity in LEP+EE group,neither did significant differences in the expression of Cx43 mRNA and its pro⁃tein.ConclusionEEP and LEP can significantly promote the expression of myocardial Cx43 mRNA and its protein respectively.However there is no significant changes of myocardial Cx43 mRNA and protein expression between the 2 time phases.It demonstrates that the expression of Cx43 in the early and late stage of myocardial protective effect was consistent with the changes of the early and latephase of the protective effect of EP.
exercise preconditioning,connexin43,myocardial,rats,protection phase
2016.01.25
中国博士后科学基金资助(编号:2014M560538)
王凯,Email:wangkai-liaoda@163.com
