黄芪生脉速溶片的制备和评价
2017-03-01沈悦敏徐友江单伟光
杨 燕,沈悦敏,徐友江,单伟光
(1.浙江工业大学 药学院,浙江 杭州 310014;2.浙江新光药业,浙江 嵊州 312400)
黄芪生脉速溶片的制备和评价
杨 燕1,沈悦敏1,徐友江2,单伟光1
(1.浙江工业大学 药学院,浙江 杭州 310014;2.浙江新光药业,浙江 嵊州 312400)
采用减压干燥法制备黄芪生脉(HQSM)速溶片并进行质量评价.以膨胀率和溶解时间为指标,优化处方工艺;以内皮细胞损伤模型评价HQSM速溶片的内皮细胞保护作用;以HPLC法研究HQSM速溶片的主要成份.结果表明:稀释剂种类和质量分数、预制片压缩程度和真空度等因素显著影响膨胀率和溶解时间;HQSM速溶片的水溶液具有抗内皮细胞损伤作用,质量浓度越大,作用越明显;HQSM速溶片含党参炔苷、五味子醇甲和原儿茶酸等成份.HQSM速溶片工艺简单,溶解迅速,有明显活性,含多种有效成份,具有良好的开发前景.
黄芪生脉;速溶片;减压干燥;内皮细胞保护
中药速溶片能在少量水中迅速溶解得到澄明溶液,具有贮存稳定,使用方便等优点,应用前景广阔.但中药复方存在剂量大,成份复杂,吸湿严重等问题,制备速溶片困难重重[1].现有研究主要集中在筛选高效崩解体系和避免生产过程引湿等方面.胡容峰等[2]以微晶纤维素、羧甲基淀粉钠和糊精为辅料,干法压片制备复方丹参口腔速溶片,优化处方的崩解时间为53 s,主要有效成分丹参酮的溶出速度参数T50=3.5 min.陈三宝[3]以西洋参提取物为原料,以羧甲基淀粉钠、微晶纤维素和低取代羟丙基纤维素为联合崩解剂,以甘露醇为稀释剂,制备西洋参口腔速溶片,崩解时间小于60 s,口感良好.林茵等[4]以黄芪有效部位提取物为原料,以明胶作为主要掩味材料,以甘露醇和甜蜜素为辅助矫味剂,以交联羧甲纤维素钠为崩解剂,直接压片制备黄芪有效部位口腔速崩片.所得片剂30 s内完全崩解,3 min释药85%以上.上述中药速溶片的主要释药机理都是崩解,但因为崩解剂难溶于水,不可避免有沙砾感,并影响溶液的澄明度.
黄芪生脉(HQSM)是以黄芪、党参、麦冬、五味子和南五味子为原料,提取浓缩得到的中药复方提取物.HQSM口服液,具有益气滋阴,养心补肺的功效,用于治疗气阴两虚,心悸气短的冠心病,具有良好的临床疗效[5-6].本课题拟以HQSM为原料,选择水溶性辅料,采用新型减压膨胀法制备HQSM速溶片,旨在研究处方工艺因素对高孔隙率速溶片的影响,并考察其用于制备中药复方速释制剂的可行性.
1 材料和仪器
HQSM浓浸膏(浙江新光药业,No.20151117);党参炔苷对照品(上海金穗生物,No.20150909);五味子醇甲对照品(上海金穗生物,No.20150730);甘露醇(杭州普修生物);乳糖(德国美剂乐);糊精(杭州普修生物);水溶性淀粉(安徽山河药用辅料);PEG 8000(陶氏化学);醋酸(分析纯,上海凌峰化学试剂);乙腈(色谱纯,美国sigma);人脐静脉内皮细胞(HUVECs,中国科学院上海细胞库);HCY试剂(美国sigma);RPMI-1640培养液(吉诺生物医药);胎牛血清(赛默飞世尔);噻唑蓝(MTT,美国sigma).
高效液相色谱(1200,美国安捷伦);真空干燥箱(DZF-6020,上海精宏);低温高速台式离心机(17R,赛默飞世尔);酶标仪(VersaMax,美国Molecular Devices);CO2细胞培养箱(180-250,赛默飞世尔).
2 方 法
2.1 HQSM速溶片的制备
取处方量的HQSM浓浸膏(水份质量分数为30%)和稀释剂,混合均匀制备湿料.将湿料切成等体积小块(约200 mg),装入自制模具的圆形模孔(直径7.0 mm),压制成一定高度圆柱状预制片.将预制片置于减压干燥器中,于45 ℃,不同真空度条件下干燥30 min,得到HQSM速溶片.
2.2 膨胀率和溶解时间的测定
游标卡尺测定预制片干燥前后的直径和高,膨胀率P计算式为

(1)
式中:R0和R为预制片干燥前后的直径;H0和H为预制片干燥前后的高.
学校是儿童学习的场所,学校教育是儿童接受教育必不可少的要素。关于乡村小学应肩负的重要使命,林春生在《抗战期中的乡村小学》中提出了“乡村小学要与地方领袖合作,竭力协助完成军事计划;组织与训练青年;对乡村民众灌输爱国爱民的民族思想和战时常识;设法提高农村的战时生产。”[10]
将HQSM速溶片置于200 mL去离子水(37 ℃)中,完全分散的时间计为溶解时间.
2.3 内皮细胞保护效果评价
HUVEC细胞用10%胎牛血清的RPML-1640培养液培养,以每孔150 μL(8 000个细胞)悬液接种于96孔板中,培养24 h.加入50 μL的HCY水溶液(16 mmol/L),培养5 d,MTT法检测细胞活力(D)[7],以加相应溶剂的细胞为空白组,细胞存活率计算式为

(2)
阴性对照:HCY模型组,HCY的最终浓度为4 mmol/L.实验组:HCY(4 mmol/L)+ HQSM速溶片低中高质量浓度的水溶液(1,10,100 μg/mL).培养5 d,MTT法测定细胞活力,以加相应溶剂的细胞为空白组,按式(2)计算细胞存活率.统计学分析,评价实验组结果与阴性对照组之间是否存在显著性差异.
2.4 成份研究
精密称取1.16 mg原儿茶酸对照品,1.05 mg党参炔苷对照品和1.24 mg五味子醇甲对照品,分别置于5 mL容量瓶中,加甲醇超声定容,得到相应储备液.精密移取200 μL原儿茶酸储备液,800 μL党参炔苷储备液和300 μL五味子醇甲储备液,于容量瓶中混合摇匀,即得混合对照品溶液.
取三片HQSM速溶片粉碎,精密称取300 mg细粉于10 mL容量瓶中,加甲醇溶解,过滤,滤液挥干,用200 μL流动相复溶,离心,即得供试品溶液.
HPLC色谱条件[8]:依利特C18柱(4.6 mm×250 mm,5 μm);流动相A乙腈-B 0.1%醋酸水溶液.梯度洗脱:0~25 min,8%~12%A;25~40 min,12%~30%A;40~55 min, 30%~100%A;55~60 min,100%A;检测波长254 nm;流速1.0 mL/min,柱温30 ℃;进样量10 μL.
3 结果和分析
3.1 稀释剂种类对膨胀率和溶解时间的影响
固定预制片中稀释剂质量分数为75%,研究稀释剂种类的影响(图1).结果表明:甘露醇为稀释剂时膨胀率最高,溶解最迅速.乳糖、糊精、水溶性淀粉和PEG 8000为稀释剂时,预制片均有一定的膨胀性,溶解时间略延长,但都小于60 s.膨胀性和溶解性的差异可能与稀释剂本身的密度、成型性和水溶性等有关.甘露醇是冷冻干燥[9]和喷雾干燥[10]常用的赋形剂,也同样适用于本实验.

A—甘露醇;B—乳糖;C—糊精;D—水溶性淀粉;E—PEG 800图1 稀释剂种类对膨胀率和溶解时间的影响Fig.1 The effect of diluents on expansivity and dissolution time
3.2 稀释剂质量分数对膨胀率和溶解时间的影响
以甘露醇为稀释剂,研究稀释剂质量分数的影响(图2).结果表明:稀释剂为67.5%时,湿料过湿,预制片成型困难,无法得到片型产品.稀释剂为70%~77.5%时,预制片在减压干燥过程中可产生不同程度的膨胀;稀释剂为75%时,膨胀率最大,溶解速度最快;稀释剂为80%时,几乎无膨胀,溶解时间也很长.这种现象的可能原因是稀释剂质量分数的变化导致预制片中水份和粘性成份的质量分数随之发生变化;只有水份质量分数和体系粘度适宜时,快速减压引起的水份瞬间蒸发才能形成高孔隙率且不会坍塌的骨架.
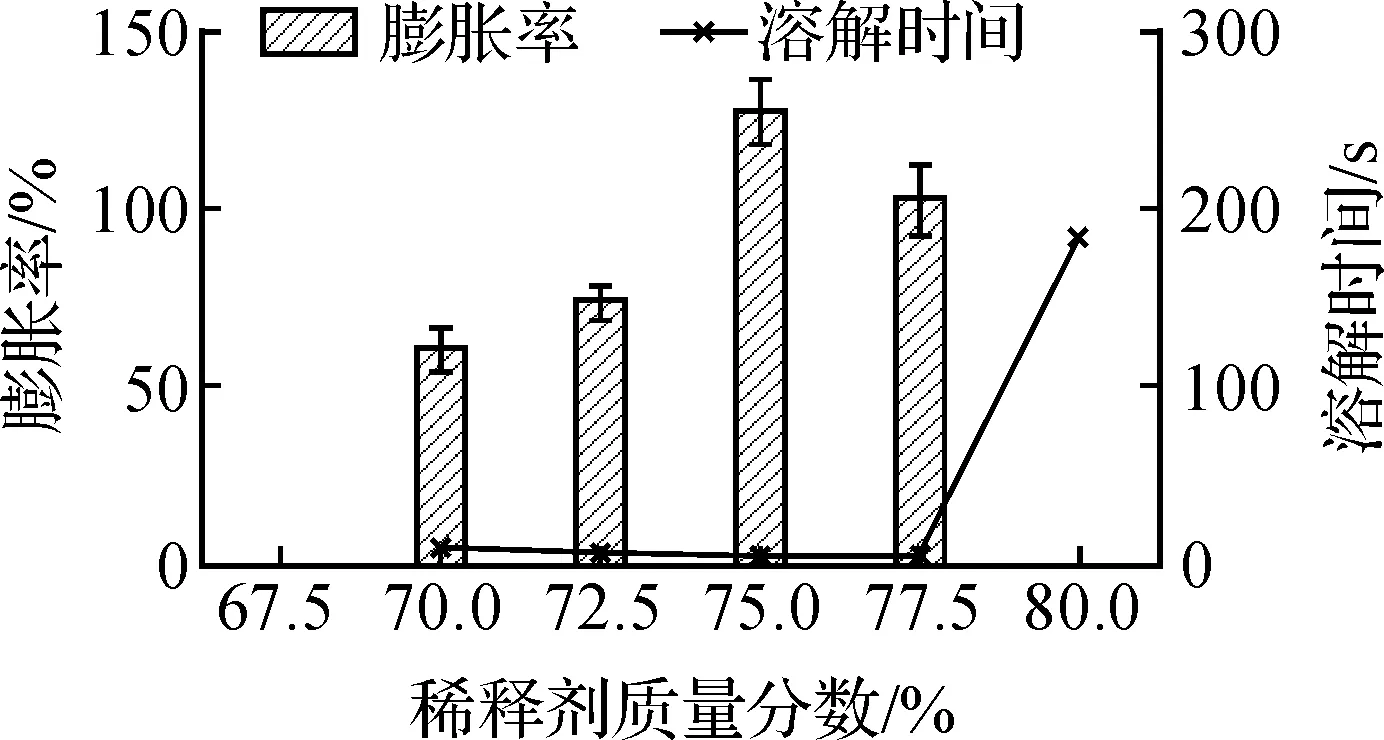
图2 稀释剂质量分数对膨胀率和溶解时间的影响Fig.2 The effect of diluents content on expansivity and dissolution time
3.3 压缩程度对膨胀率和溶解时间的影响
固定预制片的模具直径为7 mm,调节预制片的压缩高度,研究压缩程度的影响(图3).结果表明:压缩过紧(片高4.75 mm)时,物料粘模,难以得到完整的预制片;压缩程度在一定的范围内(片高4.75~5.75 mm),预制片均有良好的膨胀率和速溶性;当片高为5.25 mm时体系的膨胀率最高,相应的体系密度为0.99 g/cm3.

图3 压缩程度对膨胀率和溶解时间的影响Fig.3 The effect of compression degree on expansivity and dissolution time
3.4 真空度对膨胀率和溶解时间的影响
固定干燥温度为45 ℃,研究真空度的影响(图4).结果表明:真空度越小膨胀率越大,溶解时间越快.当真空度为0.01 atm时,预制片的膨胀最为明显,溶解时间也最快.这可能与减压干燥时真空度下降速度快,而热能传导速度慢有关.当真空度为0.01 atm时,水的沸点仅为7 ℃,预制片在抽真空过程中就会因水气瞬间蒸发而快速膨胀;当真空度提高至0.1 atm时,水的沸点上升至为45 ℃,水份完全蒸发需要依赖体系温度缓慢上升;随着真空度继续提高,水份瞬间蒸发的能量下降,预制片的膨胀率也随之下降,相应的溶解时间延长.

图4 真空度对膨胀率和溶解时间的影响Fig.4 The effect of vacuum degree on expansivity and dissolution time
3.5 优化处方工艺
m(HQSM浓浸膏)∶m(甘露醇)=1∶3混合制湿料,切成200 mg小块,压制成预制片(直径7 mm,高5.25 mm).置于0.01 atm,45 ℃的条件下进行减压干燥30 min.优化速溶片膨胀率为(128.6±13.8)%,溶解时间为(4.0±1.0) s,n=6.
3.6 内皮细胞保护作用
HCY是血管疾病的独立危险因子,高HCY血症与动脉粥样硬化形成之间存在病理学关联[11].现有研究发现丹皮酚[7]、盐酸川芎嗪[12]和通心络胶囊[13]均能对抗HCY诱导的血管内皮细胞损伤,其机制可能与氧化应激作用有关.
由图5可知:阴性对照的细胞存活率为68.1%,HCY诱导内皮细胞损伤模型建立成功.经统计学分析,HQSM速溶片低中高剂量组(1,10,100 μg/mL)的细胞存活率与阴性对照组相比,均有显著性差异(分别为P<0.05,P<0.01和P<0.001).说明HQSM速溶片溶液低中高质量浓度的水溶液均有抗HCY诱导的内皮细胞损伤作用,质量浓度越大作用越明显.内皮细胞保护作用的研究,从细胞水平揭示了HQSM速溶片具有治疗动脉粥样硬化的潜力.
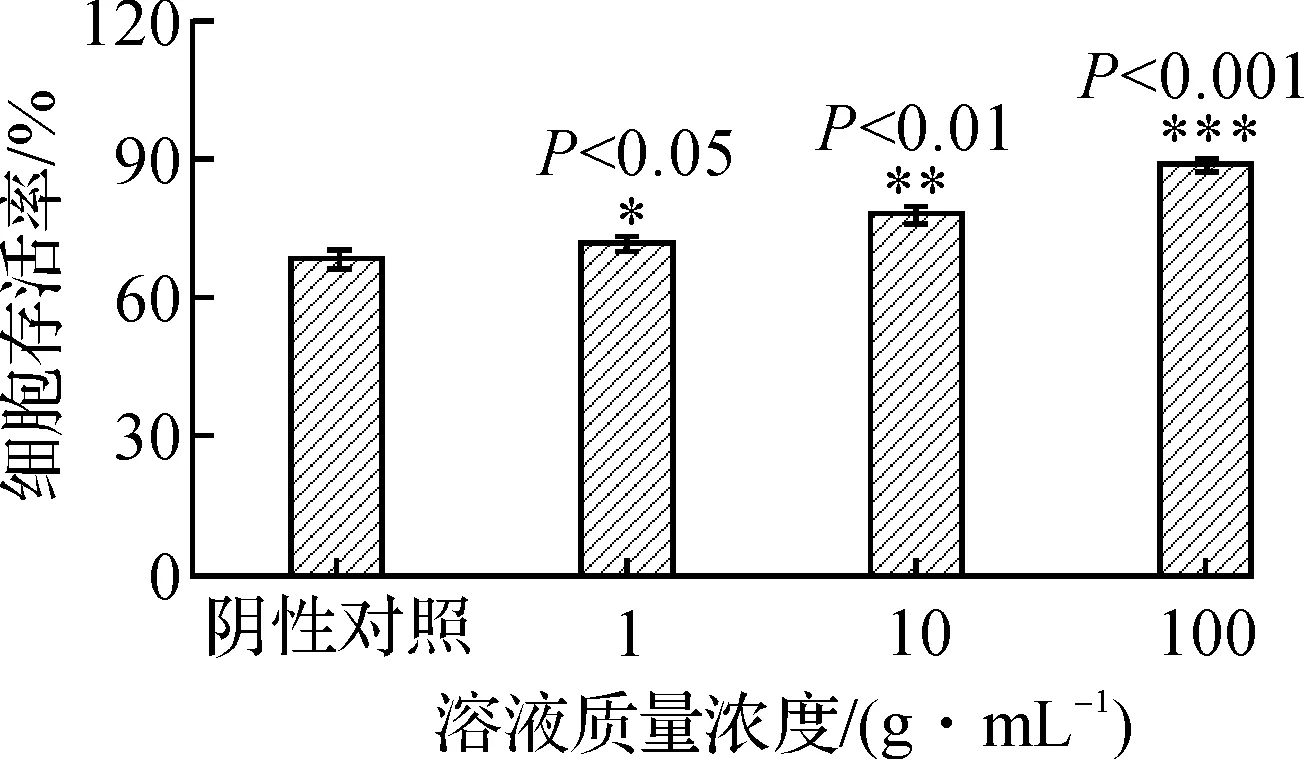
图5 HQSM速溶片的内皮细胞保护作用Fig.5 The endothelial cytoprotection activity of HQSM fast dissolving tablets
3.7 成份研究
由图6可知:HQSM速溶片采用HPLC梯度洗脱可同时检测到原儿茶酸、党参炔苷和五味子醇甲等多种成份,此结果与生脉饮(党参方)[8]和相关药材[14]的检测结果基本吻合,有助于后期的质量标准建立.现代药理学研究表明:原儿茶酸对大鼠心肌缺血/再灌注损伤具有保护作用[15];党参皂苷的调血脂和抗氧化作用可能是治疗动脉粥样硬化的重要药理学基本[16].五味子能改善心功能,增强心脏血管舒收力[17].进一步考察原儿茶酸、党参炔苷和五味子醇甲的内皮细胞保护活性,将有助于研究HQSM速溶片的作用机理,并为筛选科学的质量控制指标提供实验基础.另外,考虑到HQSM复方中成份复杂,后期拟结合多种检测方法和来源探究[18-19],开展系统的成份分析.例如:陈建真等[20]采用HPLC-DAD法从自制HQSM胶囊中分得16个特征峰,陆铖等[21]采用HPLC法从市售HQSM口服液中测出五味子乙素、五味子酯甲、党参炔苷和鲁斯可皂苷元四种成份.

图6 HPLC色谱图及其成份Fig.6 HPLC chromatogram and the active ingredients
4 结 论
本课题利用HQSM浸膏高粘度的特性,调节处方工艺制备预制片,使其在减压干燥条件下自行膨胀,形成高孔隙率的速溶片.本方法无需将中药浸膏喷雾干燥制备浸膏粉,可节省大量能耗和辅料,并防止出现浸膏粉吸湿等问题,具有工艺简便高效等优点,为新型中药复方速释制剂的开发提供了有益的启示.初步细胞药效学和成份研究进一步证明了HQSM速溶片有内皮细胞保护作用,含多种活性成份,具有良好的开发前景.
[1] 刘华刚.中药片剂有效成分溶出速率存在的问题分析及对策思路[J].中成药,2000,22(6):443-445.
[2] 胡容峰,朱家壁,彭代银,等.综合评分法优化复方丹参口腔速溶片制剂处方[J].中国中药杂志,2006,31(5):381-382.
[3] 陈三宝.西洋参口腔速溶片的研制[J].食品和机械,2015,31(6):212-214.
[4] 林茵,刘超平,李国成,等.黄芪有效部位口腔速崩片的研制及其质量评价[J].中药材,2007,30(7):870-872.
[5] 杨桂洪.黄芪生脉饮辅助治疗病毒性心肌炎的临床疗效观察[J].2010,16(20):152-153.
[6] 吕圭源,李立文,陈素红.黄芪生脉多糖两种给药途径对小鼠免疫功能的影响[J].2006,17(6):402-404.
[7] 徐倩,曹凯,周晓慧.丹皮酚对同型半胱氨酸损伤内皮细胞eNOS表达及NO水平的影响[J].中成药,2012,34(12):2286-2289.
[8] 楚楚,徐绍静,吴琼琼,等.HPLC同时测定生脉饮(党参方)中多组分的含量[J].中药材,2013,36(5):820-823.
[9] 张晓博,谷艳玲,张丽男,等.黄芩素注射用冻干粉针剂的制备[J].中国医药工业杂志,2015,46(11):1202-1207.
[10] VANHOORNE V, VAN BOCKSTAL P J, VAN SNICK B, et al. Continuous manufacturing of delta mannitol by cospray drying with PVP[J]. International journal of pharmaceutics,2016,501(1/2):139-247.
[11] 王雪茵,胡永华.同型半胱氨酸代谢与脑卒中关系的研究进展[J].中华疾病控制杂志,2013,17(11):988-992.
[12] 许栋明,吴丹.盐酸川芎嗪对同型半胱氨酸致ECV304细胞损伤的保护作用[J].中药中药杂志,2012,37(12):1937-1839.
[13] 吴琳,刘勇,熊肇军,等.通心络胶囊对同型半胱氨酸诱导的血管内皮细胞损伤的保护作用[J].中国动脉硬化杂志,2011,19(5):385-389.
[14] 应国清,郭涛,易喻,等.RP-HPLC法检测华中五味子药材中的五味子醇甲的含量[J].浙江工业大学学报,2009,37(1):6-9.
[15] 覃华,张琰,杜小燕,等.原儿茶酸对大鼠心肌缺血/再灌注损伤的保护作用[J].西北药学杂志,2015,30(6):709-712.
[16] 聂松柳,徐先祥,夏伦祝.党参总皂苷对实验性高脂血症大鼠血脂和No含量的影响[J].安徽中医学院学报,2002,21(4):40-42.
[17] 向辉,邱云波.五味子药效与临床应用研究[J].医药导报,2011,30:89-90.
[18] 颜继忠,陈岑,楚楚,等.生脉饮(党参方)中5-羟甲基糠醛的分离及其来源探究[J].浙江工业大学学报,2015,43(4):379-382.
[19] 李行诺,马旭,楚楚,等.泽泻指纹图谱研究[J].浙江工业大学学报,2013,41(2):143-146.
[20] 陈建真,吕圭源,陈素红,等.黄芪生脉胶囊与组方药材指纹图谱色谱峰相关性研究[J].中国中药杂志,2008,33(23):2769-2771.
[21] 陆铖,周盛会,李炜,等.HPLC-DAD同时测定黄芪生脉饮中4种成分含量[J].中国中医药信息杂志,2015,22(7):96-99.
Preparation and evaluation of Huang Qi Sheng Mai fast dissolving tablets
YANG Yan1, SHEN Yuemin1, XU Youjiang2, SHAN Weiguang1
(1.College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China; 2.Zhejiang Xinguang Pharmaceutical Co., Ltd., Shengzhou 312400, China)
To prepare Huang Qi Sheng Mai (HQSM) fast dissolving tablets by vacuum drying method, and evaluate their properties. The expansivity and dissolution time were used as index to optimize the formulation and technology. The endothelial cytoprotection activity of tablets was evaluated using endothelial cells injured model. Active ingredients in tablets were investigated by HPLC. The results illustrated that diluents type, diluents content, compression extent and vacuum degree had a significant influence on the expansivity and dissolution time. Tablets solutions had endothelial cytoprotection activity, which was increased with the solution concentration. Lobetyolin, schisandrin and protocatechuic acid were found in tablets. HQSM fast dissolving tablets could be easily prepared and had significant advantages, such as fast dissolving, obvious activity and various active ingredients. It had a potential to be used in practice.
Huang Qi Sheng Mai; fast dissolving tablets; vacuum drying; endothelial cytoprotection
(责任编辑:刘 岩)
2016-04-27
浙江省博士后科研项目(BSH1502032)
杨 燕(1982—),女,浙江湖州人,讲师,博士,研究方向为药剂学,E-mail:yangyan10@zjut.edu.cn.
R283.6
A
1006-4303(2017)01-0056-04
