采用EF-1α序列分析法对苜蓿根腐病病原菌
——锐顶镰刀菌的鉴定
2017-02-28易铭梁嘉俊史建李洪建程积民焦锋
易铭,梁嘉俊,史建,李洪建,程积民,焦锋*
(1.西北农林科技大学动物科技学院,陕西 杨凌 712100;2.彬县西坡乡动物卫生监督所,陕西 彬县 713500)
采用EF-1α序列分析法对苜蓿根腐病病原菌
——锐顶镰刀菌的鉴定
易铭1,梁嘉俊1,史建2,李洪建1,程积民1,焦锋1*
(1.西北农林科技大学动物科技学院,陕西 杨凌 712100;2.彬县西坡乡动物卫生监督所,陕西 彬县 713500)
苜蓿根腐病对苜蓿生长和产量造成严重影响,为了解引起根腐病病原真菌的种类,本文对从陕西省定边县牧草草场紫花苜蓿根部分离得到的根腐病病原菌进行形态学观察、EF-1α序列分析鉴定及接种试验。结果表明:通过对病原菌在PDA培养基中的分离、纯化得到的单菌落形态学观察及显微镜下菌丝、孢子的观察,该病原菌属于引起苜蓿根腐病的镰刀菌属(Fusarium);用CTAB法提取病原菌基因组DNA,并对EF-1α序列进行PCR扩增、回收纯化、克隆测序,将测序结果进行Blast比对,构建系统发育树,分析与Genbank已知近缘种属亲缘关系,结果显示与锐顶镰刀菌(F.acuminatum)亲缘关系最近,可信度达99%;最后通过根部接种试验,接种苜蓿根部发病症状与田间根腐病发病症状一致,鉴定结果显示本试验研究的引起紫花苜蓿根腐病的病原菌为镰刀菌属锐顶镰刀菌(F.acuminatum)。
紫花苜蓿;根腐病;EF-1α;锐顶镰刀菌
紫花苜蓿(Medicagosativa)属蔷薇目,豆科,苜蓿属草本植物,是世界上栽培最早、种植面积最广的豆科牧草。紫花苜蓿不仅能够改良土壤结构,且蛋白含量高、氨基酸组成比例合理、维生素含量丰富,有"牧草之王"的美称[1]。紫花苜蓿种植面积大,产量高,经济效益显著,是我国重要的牧草资源,而苜蓿病害是制约苜蓿生产和影响苜蓿产品质量的最主要因素。导致病害的病原微生物包括真菌、细菌、病毒、线虫等,据统计全球每年由牧草病虫害造成的牧草生产损失达35%以上[2]。苜蓿病害使苜蓿营养成分下降,进而降低了饲用价值和经济价值。随着我国苜蓿生产的快速发展,种植面积的扩大和集约化程度的不断提高,苜蓿病害所造成的损失也愈发严重。一些原来不重要的病害、危害不大的病害,可能会成为爆发性的、广泛流行的病害。因此,苜蓿病害研究工作对提高苜蓿产量及产品质量有着重要的作用。
苜蓿根腐病是世界性病害,普遍发生在各苜蓿种植地区。因苜蓿利用年限较长,苜蓿根腐病已成为苜蓿产量下降和植株衰败的一个极其重要的原因[3]。苜蓿根腐病多由镰刀菌侵染导致,该病对苜蓿生长的各个时期均可造成严重危害,导致根中柱腐烂,根茎和根中部变空,分支减少,侧根大量腐烂死亡,固氮能力降低,苜蓿寿命和利用年限缩短[4],王雪薇等[5]的研究表明根腐病是限制新疆苜蓿生产的主要因素,死亡率可达60.08%~70.45%;孟嫣等[6]报道甘肃定西地区苜蓿发病植株比健康植株发芽延迟20 d左右,且分蘖数明显减少,植株稀疏,生长缓慢;陈雅君等[7]对黑龙江各地区紫花苜蓿根腐病的调查发现,根腐病在各地区均有发生,严重地区发病率高达92%。苜蓿镰刀菌根腐病主要病原菌为尖孢镰刀菌(Fusariumoxysporium)、腐皮镰刀菌(F.solani)、燕麦镰刀菌(F.avenaceum)等。
真菌的分类与鉴定在过去一般采用形态学的方法,即根据真菌的形态、生长特点、孢子结构等特征来加以区分。但是真菌种类众多,往往不同种属的真菌表现出相似的特征,仅依靠形态学进行鉴定准确性比较低,同时也难以在种的层次上判断真菌的分类。而准确的诊断是制定经济有效的防治病害的基础,因此能够准确鉴定真菌病原菌的种类是十分必要的。随着分子生物学技术的发展,越来越多的植物病理学研究者用分子标记技术应用于苜蓿病害的分子鉴定中。相比传统的形态学方法,分子技术手段更能够反映出不同种病原真菌的本质区别,能够客观、准确而又快速地鉴定植物病原菌。通过将得到的病原菌信息在生物信息学数据库中比对,研究人员能够更好地研究真菌的表型、遗传、地域分布之间的关系。目前常用于真菌分类鉴定的DNA片段主要有5.8S rDNA基因,18S rDNA基因,28S rDNA基因,ITS(intra transcription spacer)序列,IGS(intragenic spacer)序列,线粒体细胞色素b(mitochondrial cytochrome b)基因,翻译延伸因子(translationelongation factor,TEF)基因等[8]。其中EF-1α序列常用来鉴定镰刀菌属真菌[9],且EF-1α在物种鉴定方面有高分辨能力,较以往的ITS序列有较多的种间变异,适于作为系统进化研究的遗传标记[10]。
本试验将田间发病苜蓿根部病原菌分离纯化培养,结合形态学和序列分析法对其进行鉴定。由于利用ITS序列分析法未能对此病原菌进行种级分类,采用EF-1α序列分析法进行鉴定,并将测序结果进行Blast比对,构建系统发育树,同时对比其与ITS序列进化树的不同,进而鉴定病原菌的种属关系。本试验是国内首次利用EF-1α序列分析法对苜蓿根腐病病原菌进行鉴定的报道,以期为苜蓿根腐病的诊断和防治提供理论依据。
1 材料与方法
1.1 试验材料
本试验所用的紫花苜蓿植株及病根于2015年8月采自陕西省榆林市定边县牧草种植基地(N 37°42′6.45″;E 107°37′28.75″)。选取病害症状典型的发病植株根部进行拍照,并用木质标本夹制作标本。
1.2 病原真菌分离
根据《植病研究方法》[11]真菌的分离培养步骤,在无菌操作环境下,从病斑边缘处切取3 mm×3 mm小块病组织,先用1%次氯酸钠溶液消毒5~7 min,再置于75%乙醇3~5 s,之后以无菌水冲洗3次,接种在PDA培养基上,置于25 ℃培养箱活化培养。采用划线培养法对菌落进行纯化,共培养10个培养皿的单菌落作为重复对照,并用斜面PDA培养基保种。
1.3 病原菌形态学特征和病原物的鉴定
依据真菌学分类的常规方法,在PDA平板培养基上观察并记录菌落形状、色泽与生长速度等特征;显微镜下观测分生孢子的形态、大小、隔膜数,顶端细胞喙的有无、形态、大小。
1.4 CTAB法提取苜蓿真菌病原菌基因组DNA
参照Guo等[12]的方法,部分操作稍有改进:在培养基表面刮取菌丝,取250 mg左右液氮研磨、粉碎,加入600 μL的CTAB提取液、10 μL β-巯基乙醇,65 ℃水浴30 min;4 ℃ 12000 r/min离心10 min;取上清,加入1 μL的RNA 酶,37 ℃水浴1 h;加入24 μL无水乙醇及24 μL乙酸钾KAC(5 mol/L),冰上放置1 h;加等体积600 μL氯仿-异戊醇(24∶1),充分混匀,4 ℃ 12000 r/min离心10 min;取上清,加入等体积酚/氯仿/异戊醇(25∶24∶1),4 ℃ 12000 r/min离心10 min;取上清,加等体积的氯仿/异戊醇(24∶1)再次抽提;取上清,加600 μL异丙醇,混匀后-20 ℃静置沉淀30~60 min;4 ℃ 12000 r/min离心10 min,弃上清,沉淀加入75%乙醇300 μL洗涤,7000 r/min离心5 min,重复2次;沉淀在超净台吹风干燥;100 μL ddH2O溶解DNA,-20 ℃保存备用。
1.5 病原菌EF-1α序列的PCR扩增和检测
PCR扩增引物为:EF-1H(5′-ATGGGTAAGGAAGACAAGAC-3′)和EF-2T(5′-GGAAGTACCAGTGATCATGTT-3′)[13]。扩增体系为20 μL,其中模板DNA 1 μL,上下引物各1 μL,ddH2O 7 μL,Taq Mix 10 μL。扩增程序为94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s ,72 ℃延伸1 min,34个循环;72 ℃延伸5 min。扩增产物进行琼脂糖凝胶电泳,90 V下电泳30 min,经 EB染色后在紫外凝胶成像系统下观测照相。
1.6 PCR产物的克隆、测序
PCR产物使用TianGen试剂盒纯化回收后,连接入PMD-19T载体,16 ℃水浴1 h;将10 μL连接产物加入到融化的感受态中,冰浴30 min,再42 ℃热激45~90 s,立即冰浴2 min;将连接产物与感受态加入到500 μL预热37 ℃的LB液体培养基中,摇床震荡培养60 min;取70~100 μL涂布在含有Amp(50 mg/mL)、IPTG(200 mg/mL)、X-gal(200 mg/mL)的LB固体培养基平板上,37 ℃倒置过夜培养;蓝白斑筛选后放入含Amp(50 mg/mL)的LB液体培养基中,37 ℃震荡过夜培养;经菌液PCR鉴定和Tiangen kit质粒小提试剂盒提取质粒DNA后送测序,测序结果在NCBI上进行核酸BLAST比对分析,并利用Mega软件的UPGMA法和NJ法构建系统发育树,分析其与GenBank公布的近缘种的亲缘关系,确定病原菌种类。
1.7 病原菌根部接种试验
采用根部接种法。用无菌的铁匙刮取PDA平板上的菌落到10 mL离心管中,加入5 mL无菌水,用漩涡振荡器使悬浮液混合均匀,7000 r/min离心5 min,离心后取上清液即为孢子悬浮液,用血球计数板观察计数孢子悬液浓度,并稀释使浓度约为5×105个/mL。试验组接种对象选用在温室内培养一月后的无病紫花苜蓿,3组重复,每组3株;接种前先用清水洗净根部,用灭菌过的刀片对根部造成轻微割伤;采用浸根接种法,将根部浸入孢子悬浮液数分钟,接菌后的苜蓿置于温室内正常管理。对照组苜蓿根部同样造成割伤,并用清水做同样处理。定期记录发病情况并选取病症典型植株拍照。
2 结果与分析
2.1 苜蓿根腐病症状及病原真菌形态特征
植株感病后枝条萎蔫下垂,生长缓慢,叶片变黄枯萎。根部出现黄褐色病斑,病斑逐渐扩大呈黄褐色水渍状。主根或侧根表皮呈黄褐色,病部表皮腐烂,有根毛脱落。根中部变空,分枝减少,侧根大量腐烂死亡。病原菌在PDA培养基上,25 ℃条件下,生长2 d后菌落平均直径为1.3 cm,4 d后为3.13 cm,7 d后生长速度较快,近铺满全皿,并出现3层颜色,最外层为浅黄色,中间层为色素枣红色,最内层为黄色孢子团堆,菌落平均直径8.5 cm(图1)。气生菌丝繁茂,呈白色绒状,色素枣红色;无小型分生孢子,大型分生孢子形态较为一致,镰刀型,弯曲,中部细胞膨大,顶孢呈长锥形,多为2~5横隔膜。根据植株发病症状,病原菌形态特征等,依据植物病原真菌学[14],初步认定病原菌属于半知菌亚门丝孢纲瘤座孢目镰刀菌属(Fusarium)。
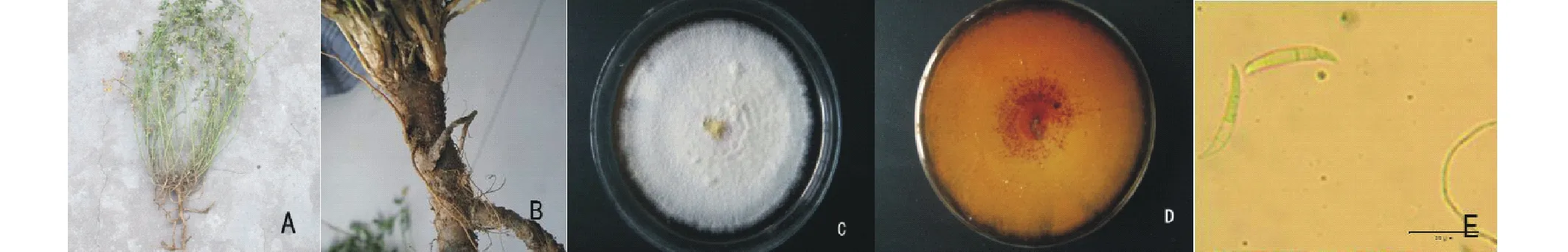
图1 苜蓿根腐病发病症状及病原形态特征Fig.1 The symptoms of alfalfa Fusarium root rot and morphology of isolated pathogen A、B:发病植株症状;C、D:PDA培养基上菌落正面与背面;E:光学显微镜下大型分生孢子。A,B:Symptoms of Fusarium root rot;C,D:Front and back surface of the colony on PDA;E:Macroconidium under light microscopy.
2.2 PCR扩增及测序
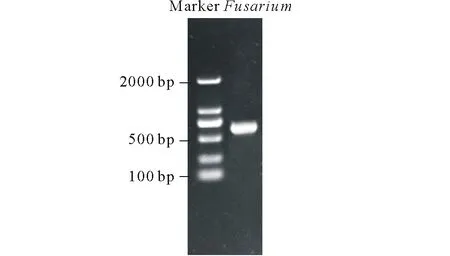
图2 PCR扩增产物电泳图Fig.2 The agarose gel electrophoresis of DNA products amplified by PCR
以CTAB法提取出的病原菌DNA为模板,用EF-1H/EF-2T作为引物做PCR扩增,5 μL点样电泳,在紫外凝胶成像系统下拍照如图2,条带单一较亮,且无非特异性扩增条带,分子量在500~750 bp之间。
蓝白斑筛选后,通过菌液PCR检测,挑选阳性克隆的菌样,送测序,测序结果如图3。用Bioxm软件对测序结果碱基成分及GC含量进行分析,得到根腐病病原菌EF-1α序列总长度为674 bp,其中G+C含量为51.19%。

图3 苜蓿镰刀菌根腐病病原菌EF-1α序列Fig.3 The EF-1α sequence of alfalfa Fusarium root rot pathogen
2.3 EF-1α序列系统发育树的构建
在本试验的前期研究中,使用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对此病原菌的rDNA-ITS序列进行扩增和测序,得到长度为524 bp的核苷酸序列,用NJ法构建ITS序列的系统发育树(图4)。可以看到病原菌ITS序列seq2与锐顶镰刀菌(Fusariumacuminatum)、 燕麦镰刀菌(Fusariumavenaceum)、三线镰刀菌(Fusariumtricinctum)在一个分支,且可信度(bootstrap)

图4 病原菌rDNA-ITS序列的NJ树Fig.4 The NJ tree of rDNA-ITS sequence
为68%,说明此病原菌和镰刀菌属锐顶镰刀菌、燕麦镰刀菌、三线镰刀菌的真菌亲缘关系比较近,但由于病原菌与镰刀菌属的这几个近缘种在系统进化树上同在一个分支且无法再分,单独根据ITS序列系统发育树尚无法准确判断病原菌的种级分类水平。
因此采用EF-1α序列分析法继续进行鉴定,将EF-1α序列测序得到的序列与GenBank中已有序列进行核酸BLAST比对分析,得到与GenBank中已有序列同源性较高的菌种信息(表1),参比菌种均来自于被镰刀菌侵染的不同植株[15-18],本试验病原菌序列与Fusariumacuminatum序列同源性最高,Ident值为99%。
用Mega 6.0软件将相似序列进行比对,采用K2模型,分别用NJ法(图5)和UPGMA(图6)法构建EF-1α序列的系统进化树。
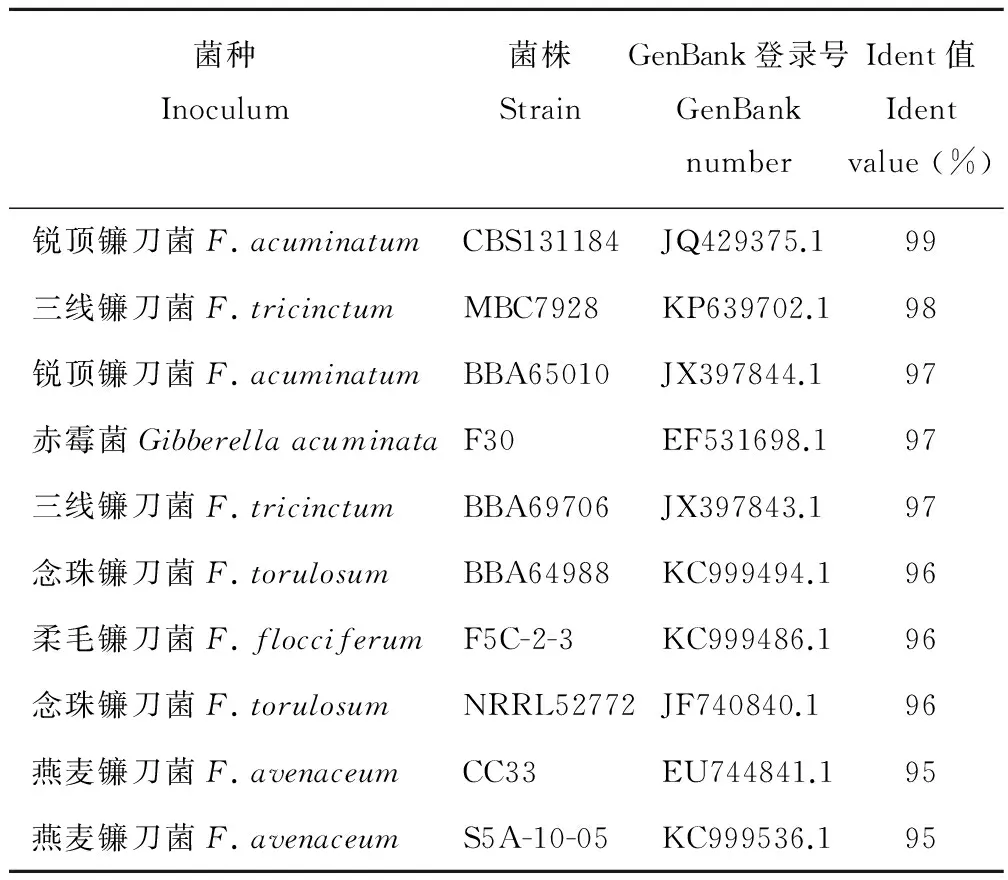
表1 Blast比对得到相似序列的菌种信息Table 1 Strains of similar sequence
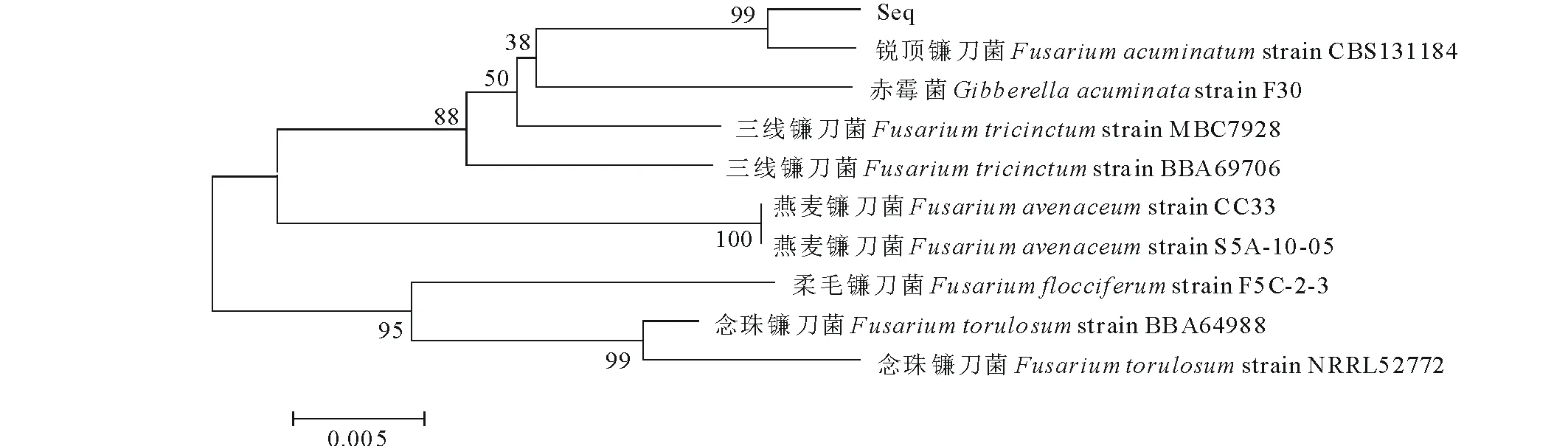
图5 病原菌EF-1α序列的NJ树Fig.5 The NJ tree of EF-1α sequence

图6 病原菌EF-1α序列的UPGMA树Fig.6 The UPGMA tree of EF-1α sequence
分支上侧数字为大于50%的Bootstrap检验值(1000次重复),通过对NJ树的分析结果表明:在遗传距离为0.005,bootstrap为1000次检验时,病原菌EF-1α序列与Fusariumacuminatum在同一分支,且可信度达99%,可以初步认定本试验研究的苜蓿根腐病病原菌属于Fusariumacuminatum(锐顶镰刀菌)种;UPGMA树的结果与NJ树结果一致。结合两种建树结果可以说明,引起本试验中苜蓿根腐病的病原菌为锐顶镰刀菌。
2.4 病原菌根部接种验证
接种的9株健康苜蓿有5株接种一周后出现明显发病症状,接种两周后可观察到:试验组苜蓿根部出现明显腐烂症状,主根呈黄褐色,表皮腐烂,根毛脱落,发病症状与田间症状相似,而对照组则没有发病现象(图7)。将试验组发病苜蓿根部病原菌再分离,纯化培养,得到与原接种所用相同病原菌,根据科赫法则,可说明本试验研究的病原菌是引起紫花苜蓿根腐病的病原菌,即锐顶镰刀菌(Fusariumacuminatum)。

图7 孢子悬浮液浸根法接种结果Fig.7 The results of inoculated with conidial suspension by root dipping
3 结论与讨论
苜蓿根部病害是由土传真菌所致,是影响苜蓿产量和产品质量的重要因素。据统计,在已研究证实的侵入苜蓿根部的真菌中,镰刀菌属(Fusarium)占比重最大,是引起苜蓿根部病害的主要致病菌[19]。苜蓿根腐病是苜蓿主要的根部病害,先后报道的病原菌种类达28种,其中镰刀菌13种[20]。在本研究中,从陕西省定边县牧草种植基地采集发病苜蓿,病株生长缓慢,叶片枯萎变黄,病部表皮腐烂,根毛脱落,符合苜蓿根腐病发病症状;将病部病原菌分离、纯化培养,得到病原菌单菌落,菌落气生菌丝繁茂,色素枣红色;在光学显微镜下观察,大型分生孢子形态较为一致,镰刀型,顶孢延长成锥形,2~5横隔,大小在3.5~5.9 μm×27.4~69.8 μm之间,符合镰刀菌的形态特征,可初步判定分离得到的病原菌属镰刀菌属。
由于同属真菌形态差异不明显,通过形态特征观察难以进行种级分类鉴定,使用分子鉴定可以快速准确地鉴定植物病原菌。在目前的植物病原菌鉴定报道中,使用rDNA-ITS序列进行分子鉴定是最为普遍的,但rDNA的ITS序列进化快速,被认为缺乏保守性,在真菌分类鉴定方面使用单一基因作为分子标记具有一定的不可靠性。在本试验中,使用rDNA-ITS序列分析法构建镰刀菌系统进化树,苜蓿根腐病ITS序列与锐顶镰刀菌(Fusariumacuminatum)、 燕麦镰刀菌(Fusariumavenaceum)、三线镰刀菌(Fusariumtricinctum)在一个分支,且可信度(bootstrap)为68%,试验病原菌与镰刀菌属的这几个近缘种在系统进化树上同在一个分支且无法再分,因此认为单独的根据ITS序列尚无法准确判断本研究中病原菌的种级分类水平,需要用其他序列再次进行分析。
翻译延伸因子(translationelongation factor,TEF)基因常作为分子标记对真菌进行鉴定分类和系统进化分析。其中EF-1α序列常用来鉴定镰刀菌属真菌,如Zhao等[21]采用EF-1α序列进行进化分析对九州镰刀菌、拟枝孢镰刀菌、厚垣镰刀菌等进行鉴定。且EF-1α在物种鉴定方面有高分辨能力,较以往的ITS序列有较多的种间变异,适于作为系统进化研究的遗传标记。因此本试验采用EF-1α序列分析法对苜蓿根腐病病原菌进行鉴定,并构建系统进化树。结果表明病原菌EF-1α序列与Fusariumacuminatum在同一分支,且可信度达99%,可认定本试验研究的苜蓿根腐病病原菌属于Fusariumacuminatum(锐顶镰刀菌)种。同时接种试验表明分离得到的病原菌是本研究中苜蓿根腐病致病病原菌,且与已报道的关于锐顶镰刀菌致病性试验结果相符[22]。
综上,通过对紫花苜蓿根腐病病原菌的形态特征观察、EF-1α序列分子鉴定、致病性试验,可以表明本试验所研究苜蓿根腐病病原菌为锐顶镰刀菌(Fusariumacuminatum)。对比rDNA-ITS与EF-1α序列鉴定结果的不同,可以认为不同的序列分析法对不同菌种有着不同的适用性,这可能与不同菌种序列进化速度不同有关。因此在对某种病原菌进行鉴定时,有必要用不同种序列构建发育树,才能得到相对可靠的结论。本文是首次关于陕西省苜蓿根部病害的报道,并且通过分子序列鉴定确定了病原真菌种类,以期为生产中苜蓿根腐病的诊断及进一步的防治提供理论依据。
References:
[1] Geng H Z, Wu Y F, Cao Z Z. Chinese Alfalfa[M]. Beijing: Chinese Agriculture Press, 1995: 114-130. 耿华珠, 吴永敷, 曹致中. 中国苜蓿[M]. 北京: 中国农业出版社, 1995: 114-130.
[2] Nan Z B. Establishing sustainable management system for disease of pasture crops in China. Acta Prataculturae Sinica, 2000, 9(2): 1-9. 南志标. 建立中国的牧草病害可持续管理体系. 草业学报, 2000, 9(2): 1-9.
[3] Cao L X, Zhao C H, Kong Q Q,etal. Advances in Alfalfa root rot pathogen and control research. Inner Mongolia Agriculture Science and Technology, 2006, (3): 36-37. 曹丽霞, 赵存虎, 孔庆全, 等. 紫花苜蓿根腐病病原及防治研究进展. 内蒙古农业科技, 2006, 3: 36-37.
[4] Xue F X. Grassland Protection[M]. Beijing: Chinese Agriculture Press, 2009. 薛福祥. 草地保护学——牧草病理学分册[M]. 北京: 中国农业出版社, 2009.
[5] Wang X W, Wang C L, Zhou G,etal. Investigation and analysis on Lucerne diseases from Altay newly-established areas in northern Xinjiang. Journal of Xinjiang Agriculture University, 1996, 19(3): 40-44. 王雪薇, 王纯利, 周刚, 等. 新疆阿勒泰新垦区苜蓿病害调查与分析. 新疆农业大学学报, 1996, 19(3): 40-44.
[6] Meng Y, Li M Q. Research progress on alfalfa crown and root rot pathogen and their control. Pratacultural Science, 2005, 22(5): 89-92. 孟嫣, 李敏权. 苜蓿根和根茎腐烂病病原及防治研究进展. 草业科学, 2005, 22(5): 89-92.
[7] Chen Y J, Cui G W. Survey and separation of alfalfa root rot pathogen in Heilongjiang Province. Grassland of China, 2001, 23(3): 78-79. 陈雅君, 崔国文. 黑龙江省紫花苜蓿根腐病调查及病原分离. 中国草地, 2001, 23(3): 78-79.
[8] Zhang B. Identification, Classification, and Phylogenetic Relationships of Pathogenic Fungi Based on Mitochondrial Cytochrome b Gene and Translation Elongation Factor Gene Analysis[D]. Jilin: Basic Medical College of Jilin University, 2007. 张波. 线粒体细胞色素b和翻译延伸因子基因分析用于病原真菌的分离、鉴定和系统发生[D]. 吉林: 吉林大学基础医学院, 2007.
[9] Kristensen R, Gauthier G, Berdal K G. DNA microarray to detect and identify trichothecene and moniliformin-producingFusariumspecies. Journal of Applied Microbiology, 2007, 102(4): 1060-1070.
[10] Yergeau E, Filion M, Vujanovic V. A PCR-denaturing gradient gel electrophoresis approach to assessFusariumdiversity in asparagus. Journal of Microbiological Methods, 2005, 60(12): 143-154.
[11] Fang Z D. The Method on Studies of Plant Pathology[M]. Beijing: Chinese Agriculture Press, 1998: 122-125. 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 122-125.
[12] Guo L D, Hyde K D, Liew E C Y. Identification of endophytic fungi fromLivistonachinensisbased on morphology and rDNA sequences. New Phytologist, 2000, 147: 617-630.
[13] O’Donnell K, Kistler H C, Cigelnik E,etal. Multiple evolutionary origins of the fungus causing Panama disease of banana: Concordant evidence from nuclear and mitochondrial gene genealogies. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(5): 2044-2049.
[14] Zhang Z Y, Leng H Q, Zhang Z M,etal. Plant Pathogenic Mycology[M]. Chengdu: Sichuan Science and Technology Press, 1988: 384-386. 张中义, 冷怀琼, 张志铭, 等. 植物病原真菌学[M]. 成都: 四川科学技术出版社, 1988: 384-386
[15] Mahdi Dacari, Anne Dvan Diepeningen, Assadollah Babai-Ahari,etal. Rapid identification ofFusariumgramminespecies complex using Rolling Circle Amplification(RCA). Journal of Microbiological Methods, 2012, 89(1): 63-70.
[16] O’Donnell K, Humber R A, Geiser D M,etal. Phylogenetic diversity of insecticolous fusaria inferred from multilocus DNA sequence data and their molecular identification via FUSARIUM-ID andFusariumMLST. Mylologia, 2012, 104(2): 427-445.
[17] Stenglein S A, Rodriguero M S, Chandler E,etal. Phylogenetic relationships ofFusariumpoae based on EF-1 alpha and mtSSU sequences. Fungal Biology, 2010, 114(1):96-106.
[18] Grafenhan T, Patrick S K, Roscoe M,etal. Fusarium damage in cereal grains from Western Canada. Journal of Agricultural and Food Chemistry, 2013, 61(23):5425-5437.
[19] Guo Y X, Nan Z B, Wang C Z,etal. Progress in research on root invading fungi ofMedicagosativa. Acta Prataculturae Sinica, 2009, 18(5): 243-249. 郭玉霞, 南志标, 王成章, 等. 苜蓿根部入侵真菌研究进展. 草业学报, 2009, 18(5): 243-249.
[20] Chen Y J, Liu X M, Cui G W,etal. Research progress in root rot of alfalfa. Grassland of China, 2000, (1): 51-56. 陈雅君, 刘学敏, 崔国文, 等. 紫花苜蓿根腐病的研究进展. 中国草地, 2000, (1): 51-56.
[21] Zhao Z H, Lu G Z, Jiang Z D,etal. Identification ofFusariumkyushuense,F.sporotrichioidesandF.chlamydosporumusing EF-1α sequence data and morphological characteristics of conidia in aerial mycelium. Mycosystema, 2011, 30(5): 713-720.
[22] Li M Q. Comparative pathogenicity of isolates ofFusariumspp and cultivars resistance in alfalfa. Grassland of China, 2003, 25(1): 39-43. 李敏权. 苜蓿根和根颈腐烂病病原致病性及品种抗病性研究. 中国草地, 2003, 25(1): 39-43.
Identification ofFusaruimacuminatumisolated fromMedicagosativaroot using the EF-1α sequence analysis method
YI Ming1, LIANG Jia-Jun1, SHI Jian2, LI Hong-Jian2, CHENG Ji-Min1, JIAO Feng1*
1.CollegeofAnimalScienceandTechnology,NorthWestAgricultureandForestryUniversity,Yangling712100,China; 2.AnimalHealthInspectionofXipoCountry,Binxian713500,China
Alfalfa root rot causes serious reductions in alfalfa growth and yield. To identify the species of pathogenic fungus causing root rot disease, the root rot pathogen ofMedicagosativa(alfalfa) collected from pasture in Dingbian County, Shaanxi Province, was analyzed by morphological observations, EF-1α sequence analysis, and inoculation tests. The mycelium and spores of a single colony of the pathogen growing on culture medium were observed under a microscope. Based on its morphology, the pathogen was identified as aFusariumfungus. The genomic DNA was extracted from the pathogen using the cetyl-trimethylammonium bromide method, and the translation elongation factor gene was selected for PCR amplification, gel recycling, purification, cloning, sequencing, and phylogenetic analyses. A phylogenetic tree constructed using MEGA and sequences available in Genbank showed that the pathogen had the closest relationship withFusariumacuminatum(99%). In the root inoculation test, the disease symptoms of roots inoculated with the isolated pathogen were the same as those characteristic of root rot disease ofM.sativain the field. Together, these results verified that the pathogen causing root rot disease ofM.sativain Shaanxi Province isF.acuminatum.
Medicagosativa; root rot; EF-1α;Fusariumacuminatum
10.11686/cyxb2016100
http://cyxb.lzu.edu.cn
2016-03-09;改回日期:2016-05-11
国家公益性行业(农业)科研专项经费项目(201303157)和国家现代农业牧草产业技术体系(CRAS-35)资助。
易铭(1990-),男,黑龙江牡丹江人,在读硕士。E-mail: yiminggodlike@163.com
*通信作者Corresponding author. E-mail: fjiao@nwsuaf.edu.cn
易铭, 梁嘉俊, 史建, 李洪建, 程积民, 焦锋. 采用EF-1α序列分析法对苜蓿根腐病病原菌——锐顶镰刀菌的鉴定. 草业学报, 2017, 26(2): 61-68.
YI Ming, LIANG Jia-Jun, SHI Jian, LI Hong-Jian, CHENG Ji-Min, JIAO Feng. Identification ofFusaruimacuminatumisolated fromMedicagosativaroot using the EF-1α sequence analysis method. Acta Prataculturae Sinica, 2017, 26(2): 61-68.
