骨钙素通过抑制脂肪组织炎症改善肥胖小鼠胰岛素敏感性
2017-02-28李小成任卫东朱晓波
李小成, 史 丽, 任卫东, 朱晓波
(1河北北方学院附属第一医院内分泌科,河北 张家口 075061; 2张北县医院内科,河北 张家口 076450; 3河北北方学院生物化学教研室,河北 张家口 075000)
骨钙素通过抑制脂肪组织炎症改善肥胖小鼠胰岛素敏感性
李小成1,2, 史 丽1, 任卫东1, 朱晓波3△
(1河北北方学院附属第一医院内分泌科,河北 张家口 075061;2张北县医院内科,河北 张家口 076450;3河北北方学院生物化学教研室,河北 张家口 075000)
目的: 为探讨骨钙素改善肥胖相关胰岛素抵抗的机制,我们观察了骨钙素对饮食诱导的肥胖小鼠脂肪组织中炎症的影响。方法: C57BL/6小鼠以高脂饮食喂养12周后,对肥胖小鼠每日腹腔注射骨钙素(30 ng/kg或3 ng/kg),对照组以等体积的生理盐水处理。测定各组小鼠体重、体脂、血清甘油三酯和血清游离脂肪酸的变化;进行葡萄糖耐量试验和胰岛素耐量试验;免疫组化染色观察巨噬细胞向脂肪组织的浸润程度及巨噬细胞标志物CD68的蛋白表达量;实时荧光定量PCR检测单核细胞趋化蛋白1(MCP-1)及CD68的mRNA表达。结果: 骨钙素(30 ng/kg或者3 ng/kg)处理4周,能降低HFD小鼠的体重、体脂量、空腹胰岛素水平,改善其糖耐量异常和胰岛素抵抗。此外,在骨钙素(30 ng/kg)治疗肥胖小鼠脂肪组织巨噬细胞的浸润减少,脂肪组织中MCP-1与CD68 mRNA表达明显降低。 结论: 骨钙素(30 ng/kg)通过下调CD68和MCP-1表达,抑制肥胖小鼠脂肪组织巨噬细胞聚集及MCP-1分泌,降低小鼠体重和体内脂肪含量,改善了肥胖小鼠的胰岛素敏感性。
骨钙素; 肥胖; 胰岛素抵抗; 巨噬细胞
肥胖被认为是一个慢性炎症性疾病,高脂饮食后数天内许多炎性因子开始增加[1]。在这些炎性因子中,单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)被认为是十分重要的因子,它能促进巨噬细胞向脂肪组织的浸润[2],是引起脂肪组织炎症的重要因素[3-4]。脂肪细胞与巨噬细胞间的相互作用最终引起脂肪组织的炎性反应,导致胰岛素抵抗及Ⅱ型糖尿病的发生[5-6]。此外,近期的研究表明,肥胖状态下MCP-1还能降低肝脏及肌肉组织丝/苏氨酸蛋白激酶(Akt)的磷酸化,直接影响胰岛素的信号传导,被认为是 2 型糖尿病发生的独立危险因素[7]。因此,减少脂肪组织中巨噬细胞的数量及MCP-1的表达水平,将有望成为肥胖相关疾病的一个新的治疗靶点。
骨钙素(osteocalcin)是由成骨细胞特异性合成的蛋白,早期的研究发现其促进骨合成及骨转化,近年的研究表明骨钙素在调节糖代谢及能量代谢方面也发挥了重要的作用[8-10]。骨钙素基因敲除小鼠表现为胰岛β细胞的减少,糖耐量的异常及胰岛素抵抗[11],而间断或者持续给予骨钙素治疗后,不仅促进了胰岛素的分泌,改善了胰岛素的敏感性,而且降低了体内甘油三酯的水平,减轻了体重[12-13]。临床研究中也表明,骨钙素能使非酒精性脂肪肝患者肝脏组织Akt的磷酸化作用加强,改善内质网应激,减轻肝脏组织炎症反应[14]。骨钙素能否减少脂肪组织中巨噬细胞趋化因子的表达,如MCP-1等,从而减轻肥胖相关的慢性炎症反应及胰岛素抵抗,国内外尚未见相关的研究报道,为此,本文探讨了骨钙素对肥胖小鼠脂肪组织MCP-1及巨噬细胞标志物CD68的影响。
材 料 和 方 法
1 动物
雄性C57BL/6小鼠60只,体重20~22 g,由北京维通利华实验动物有限公司提供,在室温(22±2)℃、湿度50%~55%、12 h/12h光照变化条件下自由进水、进食饲养。
2 主要药品和试剂
骨钙素购自上海沪震实业有限公司;TRIzol试剂购自TaKaRa; RNA反转录试剂盒购自北京天根生化科技有限公司;甘油三酯(triglyceride,TG)、游离脂肪酸(free fatty acids,FFA)、TNF-α、IL-6及胰岛素ELISA试剂盒购自南京建成生物工程研究所;抗 MCP-1 及抗 CD68 抗体购自武汉博士德生物工程有限公司;DAB显色剂购自北京中衫金桥。
3 方法
3.1 动物造模及分组 健康雄性C57BL/6小鼠60只,适应性喂养 1周后,随机数字表选取 10只作为标准饮食(normal diet, ND)组,用普通饲料喂养;其余小鼠用45%高脂饲料(购自北京华阜康生物科技有限公司)喂养12周,筛选体重指数超过正常小鼠20%的小鼠作为肥胖模型小鼠(参照Kanda等[15]和Kamei等[16]的方法)。
将肥胖小鼠随机分为高脂饮食(high-fat diet, HFD)组、高剂量(high dose, H)骨钙素(30 ng/kg)处理的HFD组(HFD+ H组)和低剂量(low dose, L)骨钙素(3 ng/kg)处理的HFD组(HFD+L组)。骨钙素处理组每日腹腔注射骨钙素,HFD组注射生理盐水,共4 周,每周检测小鼠的体重及空腹血糖。处理过程中ND组继续普食喂养,肥胖小鼠继续以高脂饮食喂养。实验结束,断头取血,静置 30 min,离心(1 088×g、5 min)制备血清,迅速分离小鼠附睾及肾周围脂肪组织并称取其重量,样品储存于-80 ℃备用。
3.2 血清甘油三酯、胰岛素和炎性因子的检测 甘油三酯以甘油磷酸氧化酶-过氧化物酶法试剂盒测定;血清胰岛素的含量以 ELISA 检测试剂盒进行检测,按说明书操作,将标准品及各组血清加至包被孔37 ℃孵育2 h;各孔加入酶标抗体37 ℃孵育1 h ;加入生物素抗体37 ℃孵育1 h ;加底物显色液37 ℃孵育20 min;终止液终止反应,采用酶标仪在450 nm 处测定各孔吸光度值。
3.3 胰岛素耐受试验(insulin tolerance test,ITT) 实验结束时(共16周),小鼠禁食过夜,以1.5 IU/kg 剂量的胰岛素腹腔注射,鼠尾获得小鼠血样,血糖仪(Roche)分别测量注射前及注射后 15、30、45、60、90和120 min 小鼠血糖浓度。
3.4 腹腔葡萄糖耐量试验 (intraperitoneal glucose tolerance test, IGTT) 实验小鼠空腹8 h后,分别以50%葡萄糖按2.0 g/kg 剂量给小鼠腹腔注射,鼠尾获得血样, 以血糖仪(Roche)分别测定注射前及注射后15、30、60和120 min时点血糖浓度。
3.5 免疫组织化学法染色脂肪组织中的巨噬细胞 将附睾脂肪组织取出后置于4% 多聚甲醛固定 24 h,乙醇梯度脱水,常规石蜡包埋,将标本切成 4 mm 厚切片,切片二甲苯脱蜡,梯度乙醇至水化,0.3% H2O2处理后进行脂肪细胞免疫组织化学法双染色。加入 1∶100 稀释的生物素化CD68抗体,37 ℃孵育 30 min,加入 1∶100 稀释链霉亲和素-生物素复合物(SABC),37 ℃孵育 30 min,加入 1∶200 稀释的兔抗CD68抗体4 ℃过夜,滴加辣根过氧化物酶标记的Ⅱ抗,PBS清洗3 min×3 次,DAB 显色,水溶性封片胶封片,用Nikon Eclipse Ti 显微镜系统拍照。
3.6 Real-time PCR 检测脂肪组织CD68及MCP-1的mRNA 表达 将超低温冻结的小鼠睾丸周围脂肪组织称量后用液氮预冷的研钵研磨,采用TRIzol法提取细胞总RNA,紫外分光光度计测量RNA的浓度及A260/A280值。按逆转录试剂盒说明书将10 μL 逆转录反应体系于37 ℃ 45 min,85 ℃ 5 s 终止反应,制备cDNA。用real-time PCR法检测CD68及MCP-1的mRNA 表达水平。用Primer -Express 3.0软件设计引物,MCP-1的上游引物序列为5’-CTTCCTCCACCACCATGCA-3’,下游引物序列为5’-AGCCGGCAACTGTGAACAG-3’;CD68的上游引物序列为5’-TCCTTCACGGAGACACCT-3’,下游引物序列为5-GGCTGGGAACCATTAGTC-3’; 内参照基因β-actin的上游引物序列为5’-GGGAAATCGTGCGTGAC-3’,下游引物序列为5’-CTGGAAGGTGGACAGTGAG-3’;引物由上海宝生物公司合成。Real-time PCR 反应条件为95 ℃ 3 min; 95 ℃ 10 s, 60 ℃ 30 s, 95 ℃ 10 s, 扩增39个循环; 65 ℃~95 ℃,每 0.5 ℃ 5 s梯度递增。采用荧光定量PCR分析软件Bio-Rad CFX Manager分析结果。按照公式2-ΔΔCt计算mRNA相对表达量。
4 统计学处理
数据采用SPSS 16.0统计软件进行分析。实验数据以均数±标准差(mean±SD)表示,组间多重比较在方差齐性检验后进行单因素方差分析,并用Bonferroni校正的t检验进行各组均数间的两两比较,以P<0.05 为差异有统计学意义。
结 果
1 骨钙素降低肥胖小鼠脂肪含量及体重
骨钙素4周治疗,显著降低了肥胖小鼠体重,且大剂量骨钙素治疗(30 ng/kg) 体重下降更明显,但2个剂量组间肥胖小鼠体重无显著差异。骨钙素治疗的2组小鼠内脏脂肪百分比以及血清TG、FFA水平也显著降低(P<0.05), 30 ng/kg与3 ng/kg剂量的骨钙素对以上各参数的影响差异无统计学显著性,见图1。
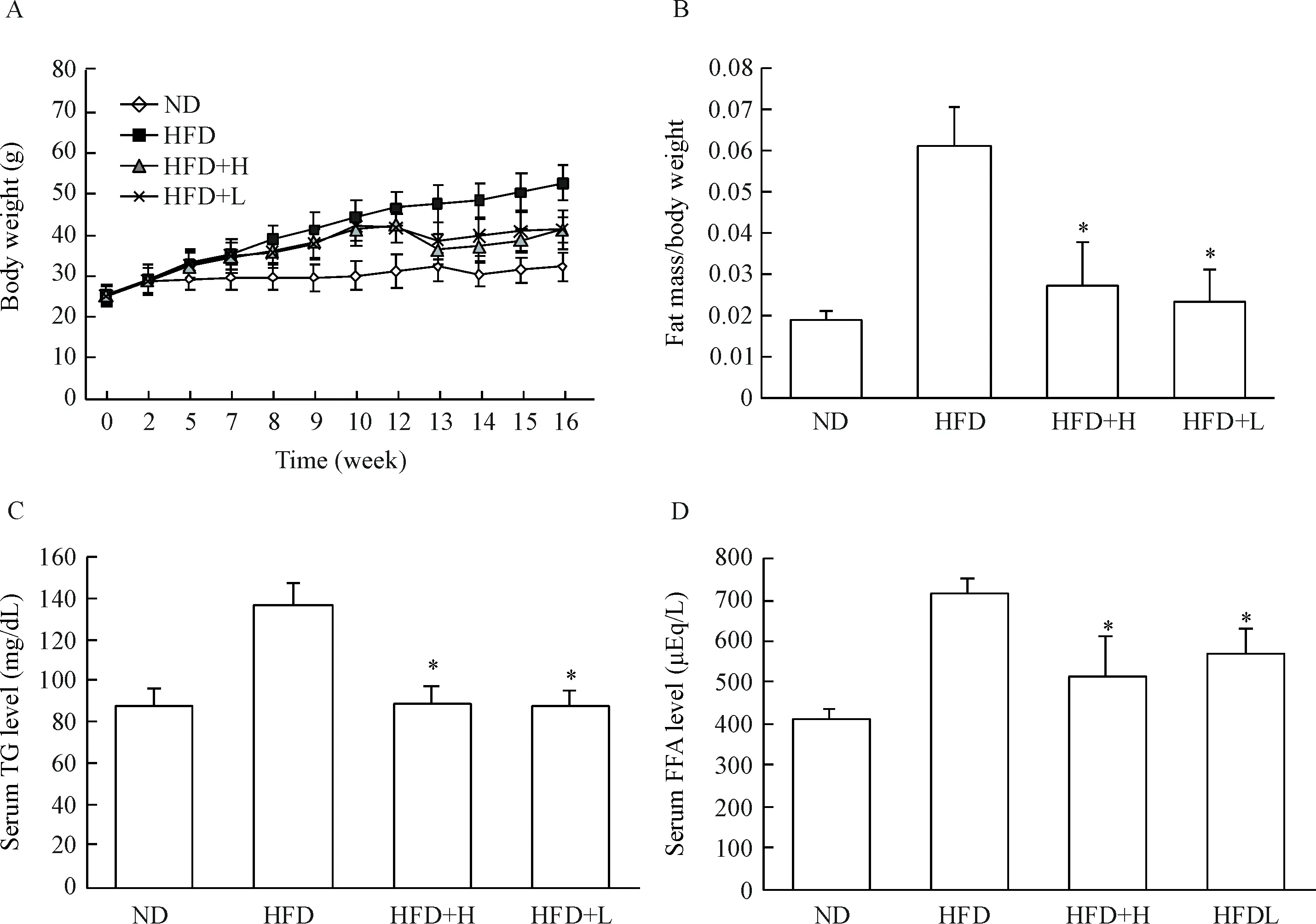
Figure 1.The effects of osteocalcin on body weight (A), body fat mass (B), serum triglycerides (C) and serum free fatty acid (D) in various groups. Mean±SD.n=10.*P<0.05vsHFD group.
图1 骨钙素对各组小鼠体重、体脂及血清甘油三酯和游离脂肪酸的影响
2 骨钙素对肥胖小鼠葡萄糖耐量的影响
腹腔葡萄糖耐量试验结果显示,HFD肥胖小鼠IGTT曲线下面积与ND组小鼠相比显著增加,差异有统计学显著性(P<0.05),提示明显的糖耐量异常。2个浓度的骨钙素治疗后肥胖小鼠IGTT曲线下面积相比于HFD小鼠显著降低,差异有统计学显著性(P<0.05)。但2个剂量骨钙素治疗组小鼠IGTT曲线下面积相比差异无统计学显著性,见图2。

Figure 2.The effect of osteocalcin on intraperitoneal glucose to-lerance test in various groups. Mean±SD.n=10.
图2 骨钙素对各组肥胖小鼠葡萄糖耐量的影响
3 骨钙素能改善肥胖小鼠胰岛素抵抗
胰岛素耐量试验显示,HFD肥胖小鼠的ITT曲线下面积及空腹胰岛素水平升高,提示显著的胰岛素抵抗。经过4周骨钙素治疗后的小鼠ITT曲线下面积及空腹胰岛素水平显著下降(P<0.05),胰岛素敏感性增加。2个剂量骨钙素作用的差异无统计学显著性,见图3。
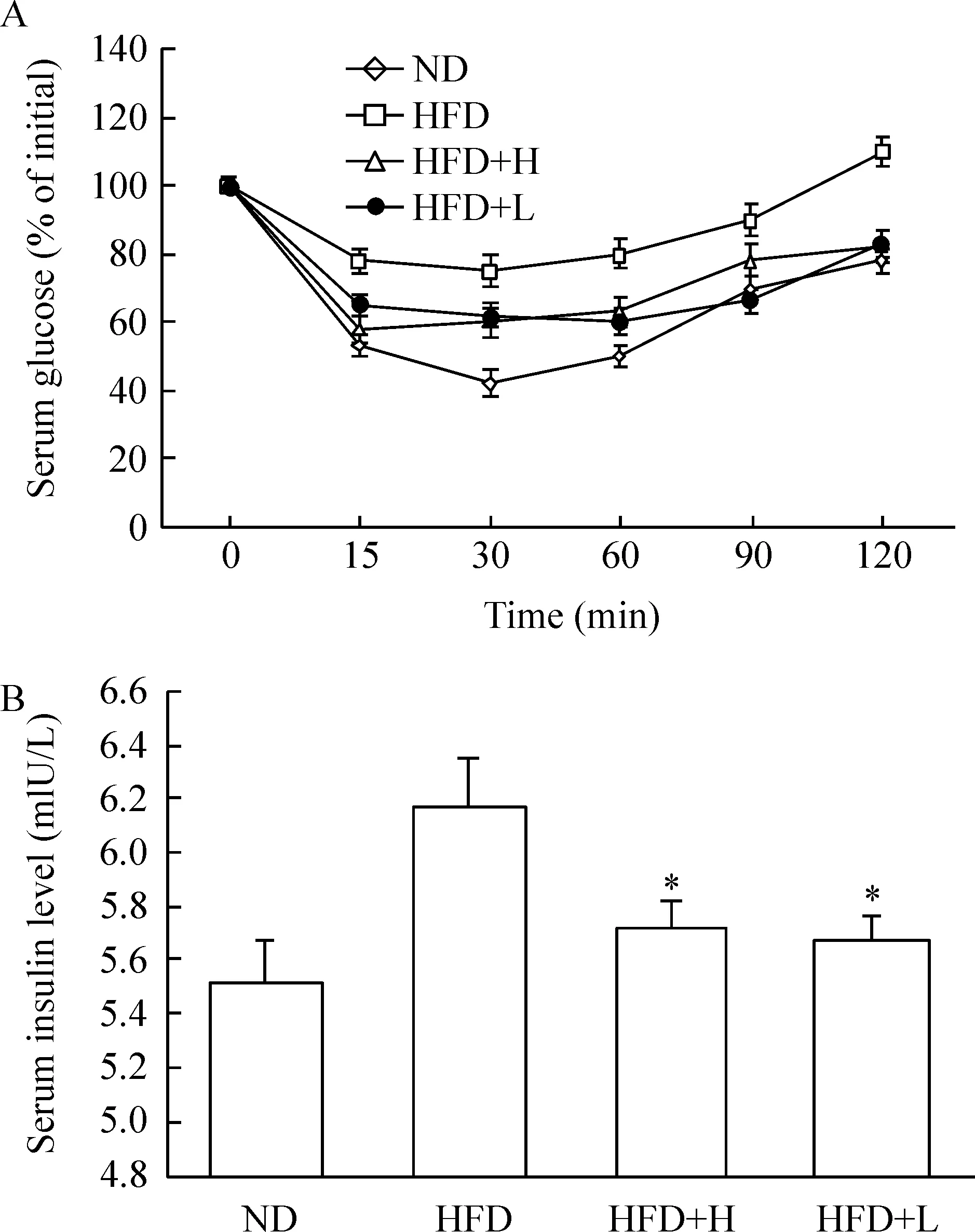
Figure 3.The effect of osteocalcin on insulin resistance in va-rious groups. A: insulin tolerance test; B: serum insulin levels. Mean±SD.n=10.*P<0.05vsHFD group.
图3 骨钙素对各组小鼠胰岛素抵抗的影响
4 骨钙素降低了HFD肥胖小鼠脂肪组织中炎性细胞的集聚
利用小鼠单克隆抗体CD68免疫组织化学染色分析小鼠脂肪组织中巨噬细胞的分布情况。相对于HFD组小鼠,HFD+H和ND组小鼠脂肪组织中巨噬细胞冠状区域显著减少。同时,巨噬细胞阳性面积统计结果也显示,HFD+H组和ND组小鼠的巨噬细胞阳性面积比HFD组显著降低(P<0.01),但是HFD+L组巨噬细胞阳性面积较HFD组没有明显变化,见图4。
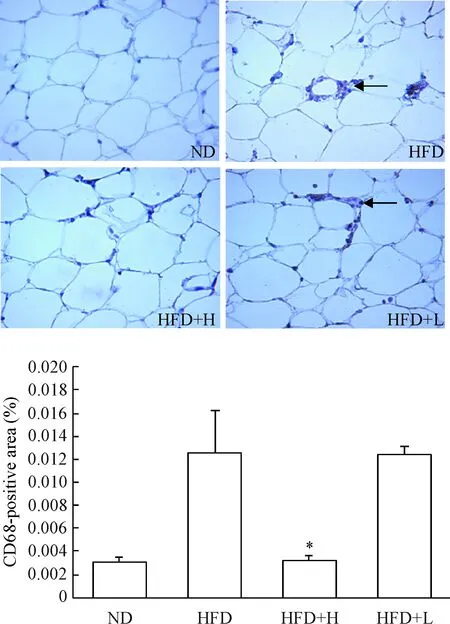
Figure 4.The effect of osteocalcin on macrophage infiltration in the adipose tissue of mice in various groups (×400). Arrows indicate coronary area of CD68-positive macrophages. Mean±SD.n=10.*P<0.05vsHFD group.
图4 骨钙素对各组小鼠脂肪组织中巨噬细胞聚集的影响
5 骨钙素对脂肪组织中MCP-1及CD68 mRNA水平的影响
对脂肪组织中MCP-1及CD68的mRNA表达情况进行real-time PCR分析,结果显示,HFD组CD68及MCP-1的mRNA表达较ND组显著增加,其相对表达量分别是ND组的4.1及2.8倍(P<0.05);HFD+H组较HFD组CD68及MCP-1的mRNA相对表达量分别减少了52%及36% (P<0.05),HFD+L组与HFD组比较差异无统计学显著性,见图5。
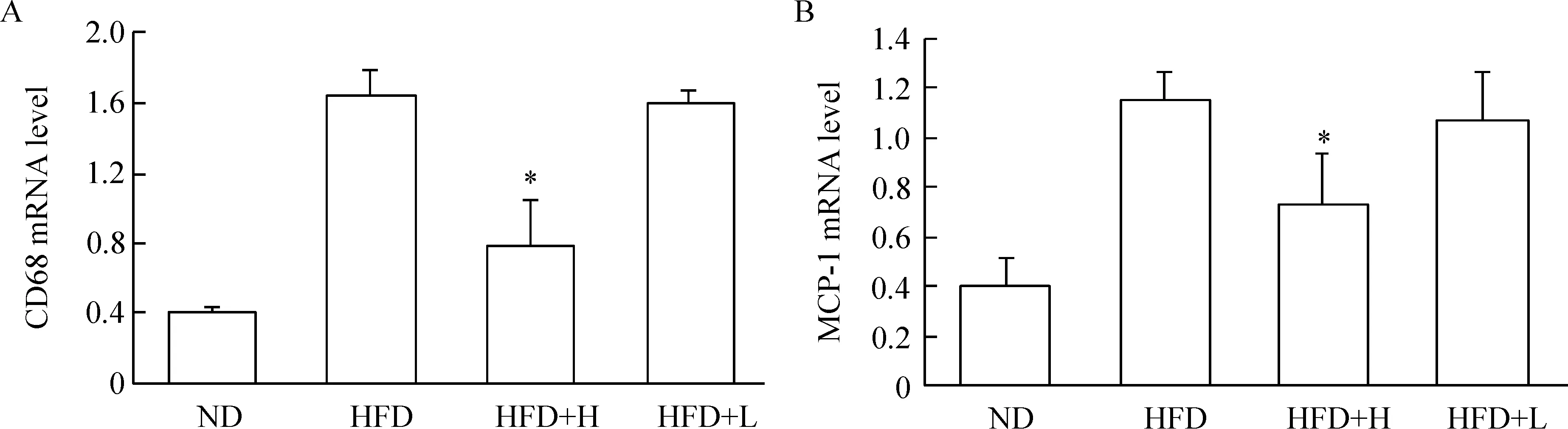
Figure 5.The effect of osteocalcin on the mRNA expression of MCP-1 (A) and CD68 (B) in the adipose tissue of mice in various groups. Mean±SD.n=10.*P<0.05vsHFD group.
图5 骨钙素对各组小鼠脂肪组织中MCP-1及CD68 mRNA表达的影响
讨 论
近年,许多研究表明了肥胖与骨代谢相关指标的关系。骨钙素作为骨代谢的一个重要调节成分,不仅参与骨合成和转化,也在糖、脂代谢发挥重要作用,与肥胖及肥胖相关疾病密切相关。骨钙素敲除基因小鼠出现葡萄糖耐受、高血糖及肥胖。骨钙素治疗的高脂饮食小鼠体重、脂肪含量及胰岛素抵抗均得到了显著改善[17]。本研究中,我们应用骨钙素治疗(4 周)高脂喂养的C57小鼠也得到了同样的结果。2个剂量的骨钙素(30 ng/kg和3 ng/kg)均显著降低了HFD小鼠体重、内脏脂肪含量及血清中FFA、TG水平,也改善了HFD肥胖小鼠的葡萄糖耐量异常和胰岛素抵抗。
体内外实验表明,骨钙素的不同作用存在着浓度依赖性, pmol 剂量的骨钙素可有效调节胰腺β-细胞中胰岛素和细胞增殖相关基因的表达,而nmol级才能增加脂肪细胞中脂联素的表达[18]。在本研究中,虽然2个剂量的骨钙素相差9倍,但所观察的作用没有显著差异。
诸多研究已经肯定肥胖及脂肪组织的胰岛素抵抗均与机体的慢性炎症反应有关[19-21]。最早发现的肥胖个体脂肪组织中高水平表达的炎性因子是TNF-α[22-23],同时也证实了它与肥胖及胰岛素抵抗的密切联系[21]。随后,越来越多的肥胖相关的炎性因子被发现,如IL-6、IL-8、MCP-1等。在高脂饮食诱导的肥胖过程中,脂肪组织存在一系列的炎性因子,如IL-6、TNF-α、MCP-1等,其中MCP-1作用最为重要[15]。MCP-1是趋化因子家族成员之一,能吸引巨噬细胞及T细胞向炎症部位的聚集,巨噬细胞是炎性因子的重要来源[6]。以小鼠为模型的动物实验发现,骨髓来源的单核细胞通过血液的传送而定居在脂肪组织中,而这些巨噬细胞导致了脂肪组织中TNF-α及IL-6等炎性因子的增多[5]。研究发现高表达MCP-1的转基因小鼠,脂肪组织中出现了巨噬细胞集聚的增多 同时伴有胰岛素抵抗。
我们通过对巨噬细胞标志物CD68的分析也观察到了肥胖状态下巨噬细胞在脂肪组织的聚集,MCP-1 mRNA表达水平增加,不同于以往研究的是,我们的研究观察到了骨钙素(30 ng/kg)治疗可以导致脂肪组织中CD68及MCP-1的mRNA表达水平下降,浸润到脂肪组织的巨噬细胞明显减少。但是,低剂量骨钙素(3 ng/kg)虽然降低了HFD小鼠体重、改善了HFD小鼠葡萄糖耐量异常和胰岛素抵抗, 但是,却没有显著减少巨噬细胞在脂肪组织的聚集及CD68和MCP-1的表达。导致这种差异的机制不清,或许低剂量骨钙素的作用涉及另外的作用机制。
骨钙素影响CD68及MCP-1表达的机制仍不清楚。尚未有骨钙素直接作用于巨噬细胞的报道。相关的研究显示骨钙素可以促进脂联素分泌[24]、提高胰高血糖素样肽1表达[25],脂联素可以刺激抗炎细胞因子的释放,下调人巨噬细胞中前炎性因子干扰素γ的产生[26];胰高血糖素样肽-1可以阻止炎性因子对肝细胞的毒性作用[27]。本研究中,骨钙素是否通过脂联素和/或高血糖素样肽-1影响巨噬细胞在脂肪组织的聚集有待进一步研究。
骨钙素与胰岛素抵抗关系密切,对骨钙素与脂肪组织炎性因子的研究将有助于改善胰岛素抵抗的严重程度,为胰岛素抵抗综合征的治疗研究提供实验依据和理论基础。
综上所述,骨钙素通过抑制肥胖小鼠脂肪组织相关的炎症反应,主要是巨噬细胞的聚集及其分泌的炎性因子如MCP-1,减轻了肥胖相关的体重增加,体内脂肪含量,明显改善了肥胖小鼠的胰岛素敏感性。
[1] Suganami T, Ogawa Y. Adipose tissue macrophages: their role in adipose tissue remodeling[J]. J Leukocyte Biol, 2010, 88(1):33-39.
[2] Suganami T, Nishida J, Ogawa Y. A paracrine loop between adipocytes and macrophages aggravates inflammatory changes role of free fatty acids and tumor necrosis factor α[J]. Arterioscler Thromb Vasc Biol, 2005, 25(10): 2062-2068.
[3] Surmi BK, Hasty AH. The role of chemokines in recruitment of immune cells to the artery wall and adipose tissue[J]. Vasc Pharmacol, 2010, 52(1):27-36.
[4] Jiao P, Chen Q, Shah S, et al. Obesity-related upregulation of monocyte chemotactic factors in adipocytes: involvement of NF-κB and JNK pathways[J]. Diabetes, 2009, 58(1):104-115.
[5] Weisberg SP, McCann D, Desai M, et al. Obesity is associated with macrophage accumulation in adipose tissue[J]. J Clin Invest, 2003, 112(12):1796-1808.
[6] Xu H, Barnes GT, Yang Q, et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance[J]. J Clin Invest, 2003, 112(12):1821-1830.
[7] Weisberg SP, Hunter D, Huber R, et al. CCR2 modulates inflammatory and metabolic effects of high-fat feeding[J]. J Clin Invest, 2006, 116(1):115-124.
[8] Fukumoto S, Martin TJ. Bone as an endocrine organ[J]. Trends Endocrinol Metab, 2009, 20(5):230-236.
[9] de Paula FJ, Horowitz MC, Rosen CJ. Novel insights into the relationship between diabetes and osteoporosis[J]. Diabetes Metab Res Rev, 2010, 26(8):622-630.
[10]Razzaque MS. Osteocalcin: a pivotal mediator or an innocent bystander in energy metabolism?[J]. Nephrol Dial Transplant, 2011, 26(1):42-45.
[11]Lee NK, Sowa H, Hinoi E, et al. Endocrine regulation of energy metabolism by the skeleton[J]. Cell, 2007, 130(3):456-469.
[12]Ferron M, Hinoi E, Karsenty G, et al. Osteocalcin diffe-rentially regulates β cell and adipocyte gene expression and affects the development of metabolic diseases in wild-type mice[J]. Proc Natl Acad Sci U S A, 2008, 105(13): 5266-5270.
[13]Ferron M, McKee MD, Levine RL, et al. Intermittent injections of osteocalcin improve glucose metabolism and prevent type 2 diabetes in mice[J]. Bone, 2012, 50(2):568-575.
[14]Zhou B, Li H, Xu L, et al. Osteocalcin reverses endoplasmic reticulum stress and improves impaired insulin sensitivity secondary to diet-induced obesity through nu-clear factor-κB signaling pathway[J]. Endocrinology, 2013, 154(3):1055-1068.
[15]Kanda H, Tateya S, Tamori Y, et al. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity[J]. J Clin Invest, 2006, 116(6):1494-1505.
[16]Kamei N, Tobe K, Suzuki R, et al. Overexpression of monocyte chemoattractant protein-1 in adipose tissues causes macrophage recruitment and insulin resistance[J]. J Biol Chem, 2006, 281(36):26602-26614.
[17]Lee NK, Sowa H, Hinoi E, et al. Endocrine regulation of energy metabolism by the skeleton[J]. Cell, 2007, 130(3):456-469.
[18]郭晓强. 骨钙素:一种重要的能量代谢调节激素[J]. 生命科学, 2011, 23(1): 102-105.
[19]Hotamisligil GS, Shargill NS, Spiegelman BM. Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance[J]. Science, 1993, 259(5091):87-91.
[20]Hotamisligil GS, Arner P, Caro JF, et al. Increased adipose tissue expression of tumor necrosis factor-alpha in human obesity and insulin resistance[J]. J Clin Invest, 1995, 95(5):2409-2415.
[21]李 欣, 袁 莉.长期高脂喂养大鼠胰岛功能改变与胰岛炎症反应有关[J]. 中国病理生理杂志, 2009, 25(5):949-953.
[22]Kern PA, Ranganathan S, Li C, et al. Adipose tissue tumor necrosis factor and interleukin-6 expression in human obesity and insulin resistance[J]. Am J Physiol Endocrinol Metab, 2001, 280(5): E745-E751.
[23]Holness CL, da Silva RP, Fawcett J, et al. Macrosialin, a mouse macrophage-restricted glycoprotein, is a member of the lamp/lgp family[J]. J Biol Chem, 1993, 268(13):9661-9666.
[24]戴小宇, 腾华建. 骨钙素调节糖代谢的研究进展[J]. 中国病理生理杂志, 2013, 29(5):952-956, 960.
[25]刘冬梅, 刘建民. 骨钙素对糖代谢的调节作用[J]. 中华骨质疏松和骨矿盐疾病杂志, 2015, 6(2):97-102.
[26]崔丽娟, 都 健. 脂联素与炎症及胰岛素抵抗关系的研究进展[J]. 国际内分泌代谢杂志, 2006, 26(Suppl):44-46.
[27]Fontana J, ,,ervinková Z, Anděl M. Effects of GLP-1 (glucagon-like peptide 1) on liver[J]. Vnitr Lek, 2013, 59(7):551-558.
(责任编辑: 陈妙玲, 罗 森)
Improvement of insulin sensitivity by osteocalcin inhibits inflammation in the adipose tissue of obese mice
LI Xiao-cheng1,2, SHI Li1, REN Wei-dong1, ZHU Xiao-bo3
(1DepartmentofEndocrinology,TheFirstAffiliatedHospitalofHebeiNorthUniversity,Zhangjiakou075061,China;2DepartmentofInternalMedicine,ZhangbeiHospital,Zhangjiakou076450,China;3DepartmentofBiochemistry,HebeiNorthUniversity,Zhangjiakou075000,China.E-mail:zjkzxb@163.com)
AIM: To explore the improving effect of osteocalcin on obesity-related insulin resistance and inflammation in the adipose tissue of obese mice. METHODS: The C57BL/6 mice were fed with high-fat diet for 12 weeks to obtain obese mice. Osteocalcin (30 ng/kg or 3 ng/kg) and saline solution (control) were intraperitoneally injected for other 4 weeks. The fat mass, body weight, serum triglycerides and serum free fatty acid were analyzed. Intraperitoneal glucose tolerance test and insulin tolerance test were carried out. Macrophage infiltration degree in the adipose tissue was observed by immunohistochemical staining. The mRNA expression of monocyte chemotactic protein-1 (MCP-1) and CD68 was detected by real-time fluorescence quantitative PCR. RESULTS: Osteocalcin (30 ng/kg or 3 ng/kg) treatment for 4 weeks significantly reduced the body weight, fat mass and insulin level, and improved abnormal glucose tolerance and insulin resistance in the obese mice. Moreover, the macrophage infiltration decreased, and the mRNA expression of MCP-1 and CD68 was down-regulated in the adipose tissue of obese mice treated with osteocalcin at 30 ng/kg. CONCLUSION: Osteocalcin at 30 ng/kg significantly reduces body weight and fat mass, and attenuates the severity of insulin resistance through down-regulating the mRNA expression of MCP-1 and CD68 and inbihiting macrophage infiltration in the adipose tissue of obese mice induced by high-fat diet.
Osteocalcin; Obesity; Insulin resistance; Macrophages
1000- 4718(2017)02- 0302- 06
2016- 08- 01
2016- 11- 14
R587.1; R363.2
A
10.3969/j.issn.1000- 4718.2017.02.018
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0313-4029270; E-mail: zjkzxb@163.com
