CEA迷你基因串联体疫苗免疫小鼠脾细胞对CEA阳性肿瘤细胞的杀伤作用及疫苗的安全性评价①
2017-02-27方艳秋魏海峰米旭光芦小单李首庆
方艳秋 魏海峰 李 丹 米旭光 芦小单 李首庆 刘 磊 谭 岩
(吉林省人民医院医学诊治实验中心,长春 130021)
·生物治疗·
CEA迷你基因串联体疫苗免疫小鼠脾细胞对CEA阳性肿瘤细胞的杀伤作用及疫苗的安全性评价①
方艳秋 魏海峰 李 丹②米旭光 芦小单 李首庆 刘 磊 谭 岩
(吉林省人民医院医学诊治实验中心,长春 130021)
目的:观察CEA迷你基因串联体疫苗pcDNA-triCEA625-667免疫小鼠脾细胞对肿瘤细胞特异性杀伤作用并对疫苗免疫小鼠后的安全性进行评估。方法:BALB/c小鼠随机分为空白载体组(pcDNA3.0)、单倍体疫苗实验组(pcDNA-CEA625-667)、串联体疫苗实验组(pcDNA-triCEA625-667),肌肉注射法免疫动物,每隔10 d免疫1次,共免疫4次,记录免疫小鼠的体重变化、存活情况以及检测血清ALT、肌酐水平。以疫苗免疫小鼠的脾细胞为效应细胞,以 LDH 释放法检测其对CEA阳性的小鼠肝癌细胞株(H22-CEA+)、胃癌细胞株(MFC-CEA+)、结肠癌细胞株(CT26-CEA+)以及CEA阴性小鼠肝癌细胞株(H22-CEA-)的特异性CTL的杀伤活性。结果:两种疫苗对CEA阳性的肝癌、胃癌及结肠癌细胞均具有较强的杀伤活性,与 PcDNA3.0空载体组相比,差异有统计学意义(P<0.01)。而对CEA阴性肿瘤细胞(H22-CEA-)则几乎无影响。迷你串联体基因疫苗pcDNA-triCEA625-667对肝癌细胞H22-CEA+及胃癌细胞MFC-CEA+的杀伤活性强于单倍体基因疫苗pcDNA-CEA625-667(P<0.05)。疫苗免疫对小鼠的存活状态、体重变化及肝肾功能指标均无影响。结论:CEA迷你基因疫苗安全有效,能够诱导肿瘤特异性CTL产生,且三倍体串联体疫苗免疫效果优于单倍体疫苗。
癌胚抗原;迷你基因;基因疫苗;体外实验;抗肿瘤
目前,高居恶性肿瘤发病率和死亡率之首的CEA阳性肿瘤的治疗效果不能令人满意。为了探索一种安全有效的免疫治疗新方法,本研究前期利用PCR技术从人基因组中得到CEA625-667DNA片段并将其顺次定向亚克隆到真核表达载体 pcDNA3.0中,成功地构建了含有CEA625-667基因三串联体的DNA疫苗pcDNA-triCEA625-667[1]。本次实验拟应用该疫苗免疫的小鼠脾细胞为效应细胞,以肝癌、胃癌、结肠癌为靶细胞,观察疫苗免疫的小鼠脾细胞对CEA阳性肿瘤细胞的杀伤作用,探讨CEA迷你基因串联体疫苗应用于CEA阳性肿瘤治疗的可能性,并对疫苗免疫小鼠后的安全性进行评估,为进一步的临床研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料 CEA阳性的小鼠肝癌细胞株(H22-CEA+)、胃癌细胞株(MFC-CEA+)、结肠癌细胞株(CT26-CEA+)、CEA阴性小鼠肝癌细胞株(H22-CEA-)(本室制备并保存);重组真核表达质粒pcDNA-CEA625-667及pcDNA-triCEA625-667(本室制备并保存);IMDM培养基(美国Sigma公司);胎牛血清(Gibcobrl公司)。
1.1.2 实验动物 BALB/c小鼠购自吉林大学基础医学院动物室,雄性,6~8周,体重18~22 g。
1.2 方法
1.2.1 动物免疫 小鼠随机分成3组,每组6只。分别为空白载体组(pcDNA3.0)、单倍体疫苗实验组(pcDNA-CEA625-667)、串联体疫苗实验组(pcDNA-triCEA625-667)。肌肉注射法免疫动物。浓度为0.95 μg/μl的质粒与终浓度3%氢氧化铝胶悬液1∶1(V∶V)混合,每只小鼠每次接种100 μg质粒。分两侧注射与小鼠大腿内侧肌群,每隔10 d免疫1次,共免疫4次。记录免疫小鼠的体重变化情况及存活情况。
1.2.2 免疫小鼠脾细胞的收集 最后一次免疫后10 d,断颈处死小鼠,眼球取血,分离血清检测ALT水平和肌酐水平。无菌取脾,将脾浸入含10%小牛血清的IMDM细胞培养液中,轻轻研磨,纱布过滤后用玻璃试管收集脾细胞。离心、破红、重悬、洗涤,1%台盼蓝染色测定细胞存活率,计数后调整细胞浓度为1×107ml-1。
1.2.3 免疫小鼠脾细胞对CEA阳性肿瘤细胞的杀伤作用 以LDH 释放法检测特异性CTL的杀伤活性。用含5%小牛血清的IMDM培养液调整各肿瘤细胞株至1×105ml-1作为靶细胞,每孔加入100 μl。以疫苗免疫小鼠的脾细胞为效应细胞,按照不同的效靶比(E∶T) 100∶1、50∶1、25∶1、12.5∶1 加入效应细胞,每孔加入100 μl,并分别设置靶细胞和效应细胞对照孔,设置3个复孔。37℃,5%CO2环境下共同孵育4 h,转移上清至新的96 孔板,加入LDH 底物,室温避光静置30 min 后,加入终止反应液,测定490nm 的各孔OD值,计算杀伤率。杀伤率(%)=(实验孔OD值-效应细胞自然释放孔OD值-靶细胞自然释放OD值)/(靶细胞最大释放孔OD值-靶细胞自然释放孔OD值)×100%。
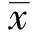
2 结果
2.1 免疫小鼠的体重变化情况 图1为疫苗免疫小鼠3个月内的体重变化曲线。可以看出,实验组小鼠与正常对照组比较有相同的体重增长曲线。表明疫苗没有诱发实验小鼠局部或全身的炎症反应,导致小鼠体重下降。实验组小鼠及对照组小鼠均无死亡。
2.2 疫苗接种后小鼠肝肾功能检测 血清中ALT水平和肌酐水平检测结果显示各组无明显差异(P>0.05),表明pcDNA-CEA625-667及pcDNA-triCEA625-667肌肉注射免疫均对小鼠肝功能和肾功能没有明显的影响,见表1。
2.3 免疫小鼠脾细胞对CEA阳性肿瘤细胞的杀伤作用 两种疫苗免疫组小鼠脾细胞的 CTL 特异性杀伤活性均明显增强,两种疫苗对CEA阳性的肝癌、胃癌及结肠癌细胞均具有较强的杀伤活性,与PcDNA3.0空载体组相比,差异有统计学意义(P<0.01)。而对CEA阴性肿瘤细胞(H22-CEA-)几乎无影响。且串联体基因疫苗pcDNA-triCEA625-667组对肝癌细胞H22-CEA+及胃癌细胞MFC-CEA+的杀伤活性强于单倍体基因疫苗pcDNA-CEA625-667组(P<0.05)。结果见图2。
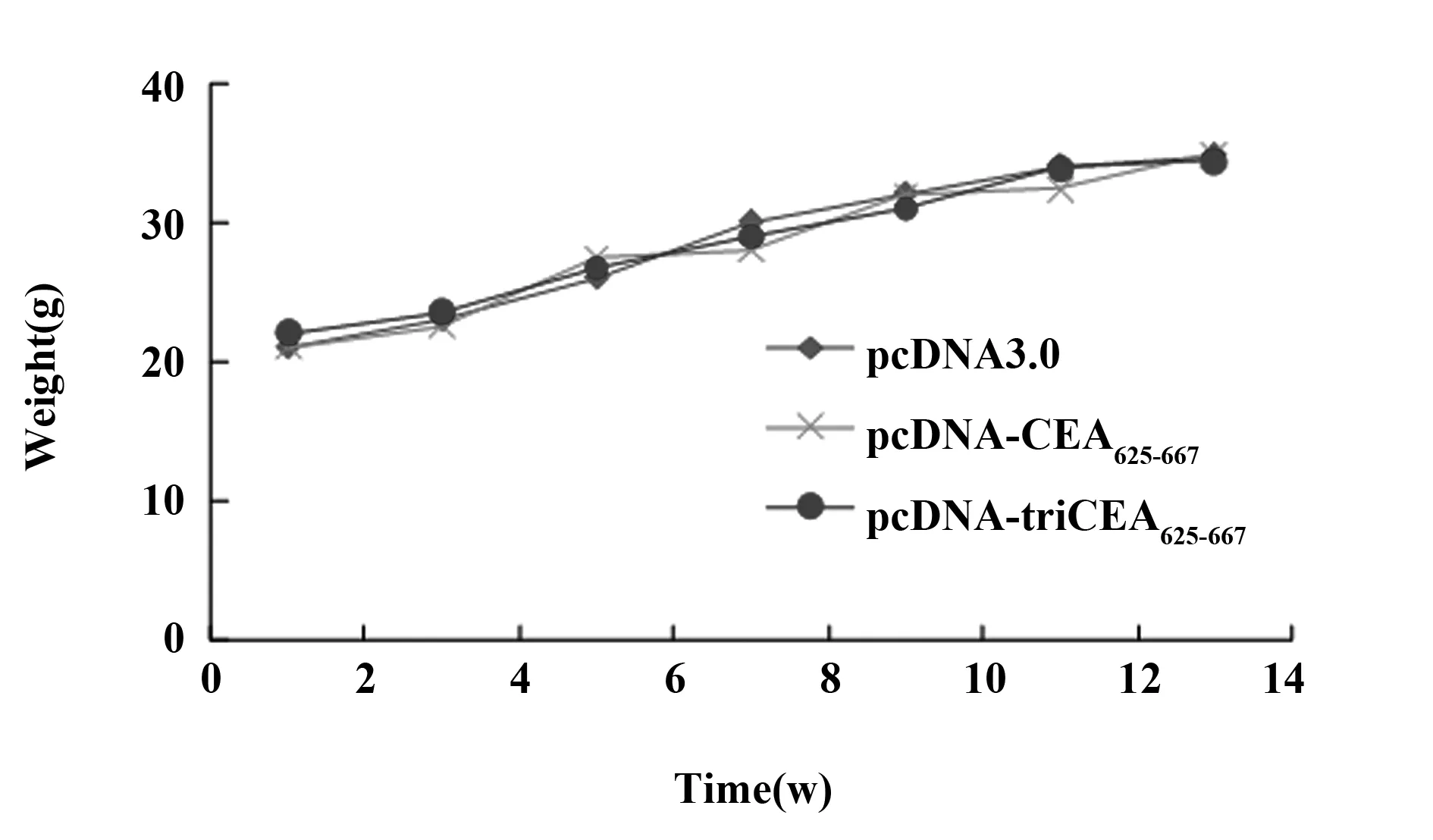
图1 疫苗免疫后小鼠的体重变化曲线Fig.1 Curve of changes of mice weight after transplantion

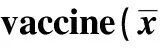

GroupsnALT(U/ml)Creatinine(μmol/L)pcDNA306526±231246±71pcDNA⁃CEA625⁃6676537±211219±68pcDNA⁃triCEA625⁃6676516±191234±74
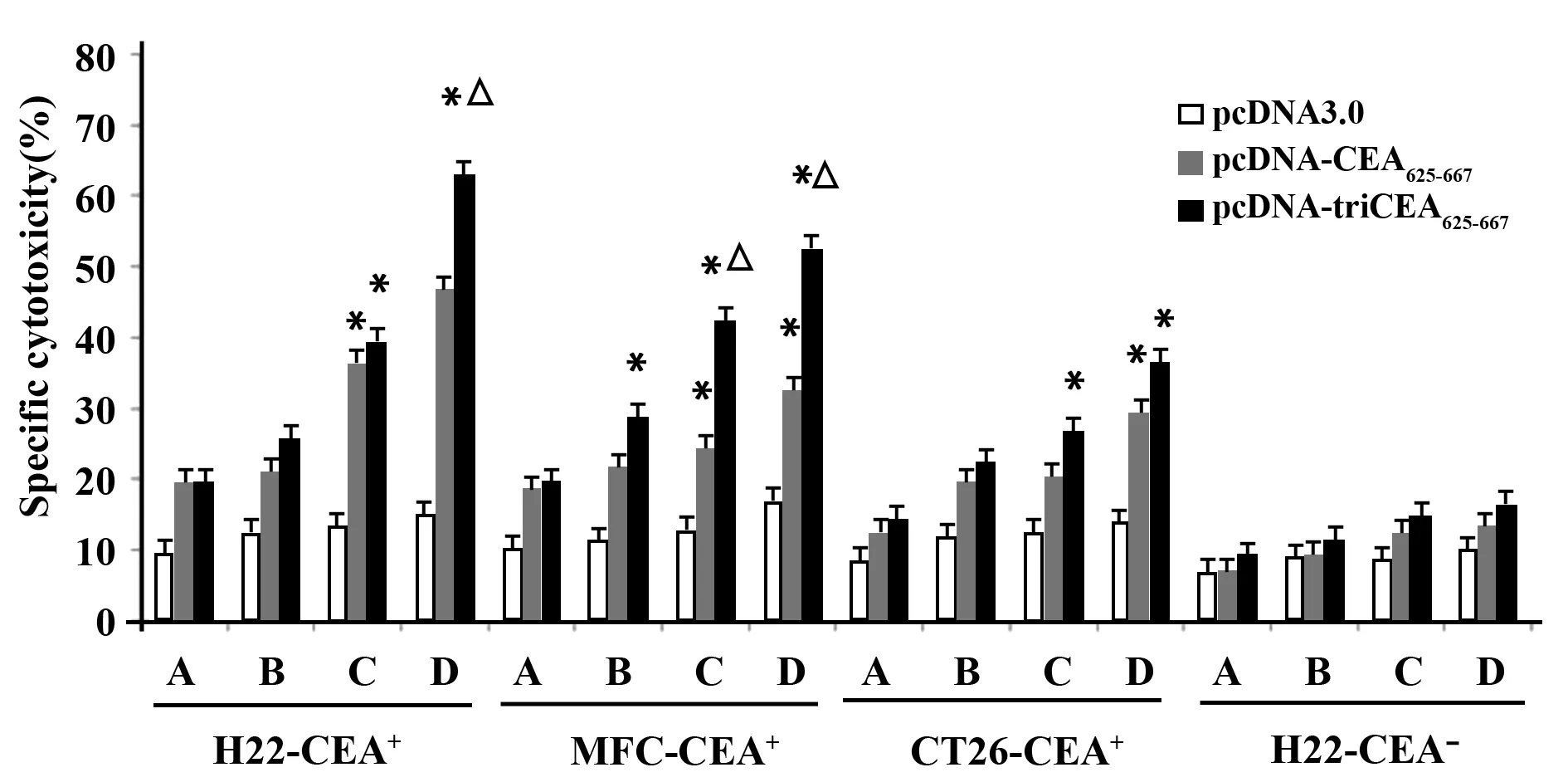
图2 免疫小鼠脾细胞诱导的CTL 特异性杀伤活性Fig.2 CTL specific cytotoxicity induced by spleen cells in miceNote: *.P<0.01 vs pcDNA-3.0 group;△.P<0.05 vs pcDNA-CEA625-667 group.Effect target ratio 12.5∶1,25∶1,50∶1 and 100∶1 were denoted respectively by A,B,C and D.
3 讨论
应用CEA疫苗进行免疫治疗,能产生较广谱的抗肿瘤作用,可以克服一种疫苗仅对一种肿瘤起作用的局限性。但由于CEA的免疫原性很弱或提呈障碍,不能诱发机体产生有效的免疫应答(这可能也是CEA阳性肿瘤逃避机体免疫监控的原因之一)[2]。因此,增强CTL识别抗原的敏感性,避免出现免疫抑制,诱导产生高效特异的抗肿瘤免疫反应是CEA疫苗治疗的主要目的。本研究前期实验选择了包含两个CEA HTL表位(CEA625-669和CEA625-667)的迷你基因CEA625-667来制作串联体基因疫苗,结果表明该疫苗增强免疫效应的作用[3]。
DNA疫苗是近几年来研究的热点之一,它的主要特点在于它们能引起保护性细胞毒T细胞反应[4]。Wolff等[5]不借助病毒载体,将含有编码luciferase基因cDNA的真核表达质粒DNA直接注射入小鼠肌纤维细胞中,可在该肌细胞中检测到luciferase的表达,从而产生了不依赖病毒载体导入的核酸疫苗。Conry等[6]先后对CEA核酸疫苗进行了系列研究,用含有CEA cDNA全序列的真核表达质粒肌注免疫C57小鼠,共免疫3次,取C57小鼠的血液及脾,获得了CEA特异性的体液和细胞免疫,在小鼠体内检测到抗CEA抗体及CEA特异性T细胞增殖;含CEA cDNA全序列的真核表达质粒可诱导产生抗肿瘤免疫应答,在首次免疫3周后,可防止肿瘤的植入再生,而且发现只有肌注才有效;目前该核酸疫苗的Ⅰ期临床应用研究正在进行当中,将编码CEA和HbsAg的cDNA插入真核表达载体pcDNA3中,采用肌注的方法对结肠癌患者进行免疫,通过对抗CEA及HbsAg抗体、T细胞的增生及活性测定,对毒副反应的观察,来评价该核酸疫苗的临床效果。国内李道坤等[7]也证实了重组CEA和IL-2抗肿瘤基因疫苗具有抗肿瘤活性。Xiang等[8]给CEA转基因鼠口服DNA疫苗,发现其具有明显的诱导肿瘤保护性免疫作用,这种作用主要是通过MHCⅠ类限制性CD8+T细胞介导的。Song等[9]的研究发现,若用携带人CEA-DNA及IFN-γ或IL-12基因的质粒给小鼠肌肉注射,能产生IgG2a抗CEA抗体及CEA特异性CTL,符合Th1型反应,能抑制CEA阳性肿瘤细胞株p815的生长;若用携带人CEA-DNA与IL-4基因的质粒给小鼠肌肉注射,则产生的是IgG1抗体,符合Th2型反应,CTL活性及抗肿瘤细胞活性均减低。
本研究观察了疫苗免疫后小鼠的状态、体重变化、肝肾功能以及存活情况,未观察到肌肉注射疫苗给实验小鼠带来任何负面作用。与其他疫苗相比,基因疫苗无疑是安全、有效的。虽然基因疫苗可能会给某些疾病的防治带来一场根本性的变革,但仍可能存在一些潜在的危险因素,例如质粒DNA可能诱导自身免疫反应;持续表达外源抗原可能产生一些不良后果;少量疫苗质粒肌注后逸入血流;接种DNA疫苗后,DNA分子在肌肉细胞中可能整合到宿主基因组等。虽然很多研究结果证明了上述可能性微乎其微,甚至动物实验和临床Ⅰ期安全性试验的结果都证明基因疫苗是安全的[10-12]。然而DNA疫苗进入临床应用还需要一段时间。
[1] 李 丹,谭 岩,刘力华,等.CEA迷你基因串联体肿瘤疫苗的构建[J].吉林大学学报(医学版),2007,33(2):377-380.
[2] Turriziani M,Fantini M,Benvenuto M,etal.Carcinoembryonic antigen (CEA)-based cancer vaccines:recent patents and antitumor effects from experimental models to clinical trials[J].Recent Pat Anticancer Drug Discov,2012,7(3):265-296.
[3] Li D,Hua S,Fan Y,etal.DNA vaccine expressing repeated carcinoembryonic antigen (CEA)(625-667) induces strong immunity in mice[J].Immunol Lett,2011,135(1-2):124-128.
[4] Chu D,Moroda M,Piao L,etal.CTL induction by DNA vaccine with Toxoplasma gondii-HSP70 gene[J].Parasitol Int,2014,62(2):408-416.
[5] Wolff JA,Malone RW,Williams P,etal.Direct gene transfer into mouse muscle in vivo[J].Science,1990,247(4949 Pt1):1465-1468.
[6] Conry RM,Lobuglio AF,Curiel DT.Phase a trial of a po lynucle otide antitumor immunization to human carcinoembryonic antigen in patients with metastatic colorectal cancer[J].Hum Gene Ther,1996,7:755-764.
[7] 李道坤,张 帆,孙维权,等.重组CEA和IL-2抗肿瘤基因疫苗的构建及其抗肿瘤作用研究[J].中国医药指南,2013,11(35):50-52.
[8] Xiang R,Silletti S,Lode HN.etal.Protective immunity against human carcinoembr-yonic antigen (CEA) induced by an oral DNA vaccine in CEA-transgenic mice[J].Clin Cancer Res,2001,7(3):856-864.
[9] Song K,Chang Y,Prud′homme GJ.Regulation of T-helper-1 versus T-helper-2 activity and enhancement of tumor immunity by combined DNA-based vaccination and nonviral cytokine gene transfer[J].Gene Ther,2000,7(6):481-492.
[10] Balint JP,Gabitzsch ES,Rice A,etal.Extended evaluation of a phase 1/2 trial on dosing,safety,immunogenicity,and overall survival after immunizations with an advanced-generation Ad5 [E1-,E2b-]-CEA(6D) vaccine in late-stage colorectal cancer[J].Cancer Immunol Immunother,2015,64(8):977-987.
[11] Bilusic M,Heery CR,Arlen PM,etal.Phase I trial of a recombinant yeast-CEA vaccine (GI-6207) in adults with metastatic CEA-expressing carcinoma[J].Cancer Immunol Immunother,2014,63(3):225-234.
[12] Diaz-Montero CM,Chiappori A,Aurisicchio L,etal.Phase 1 studies of the safety and immunogenicity of electroporated HER2/CEA DNA vaccine followed by adenoviral boost immunization in patients with solid tumors[J].J Transl Med,2013,11:62.
[收稿2016-12-09]
(编辑 许四平)
Tumor specific immune response induced by three tandem repeats of CEA mini gene DNA vaccine and safety evaluation
FANGYan-Qiu,WEIHai-Feng,LIDan,MIXu-Guang,LUXiao-Dan,LIShou-Qing,LIULei,TANYan.
CenterforMedicalTreatmentandDiagnosis,JilinProvincePeople′sHospital,Changchun130021,China
Objective:To observe the specific killing effect on tumor cells of the spleen cells in mice immunized with three tandem repeats of CEA minigene DNA vaccine pcDNA-triCEA625-667and to evaluate the safety of the vaccine.Methods: The BALB/c mice were randomly divided into blank vector group (pcDNA3.0),haploid vaccine group (pcDNA-CEA625-667) and tandem repeats vaccine group (pcDNA-triCEA625-667).The mice received a total of 4 intramuscular immunization every 10 days once.The changes of body weight,survival state were recorded and the levels of serum ALT and serum creatinine were detected.The specific CTL killing activity of spleen cells in accinated mice on mouse hepatoma cells(H22-CEA+),gastric cancer cells(MFC-CEA+),colorectal cancer cells(CT26-CEA+) with high expression of CEA and mouse hepatoma cells(H22-CEA-) without expression of CEA was detected.Results: The two vaccines had strong killing activity on CEA positive liver cancer,gastric cancer and colon cancer cells,and the difference was statistically significant (P<0.01) compared with the PcDNA3.0 group.And they had almost no effect on CEA negative tumor cells (H22-CEA-).The killing activity on liver cancer cell(H22-CEA+) and gastric cancer cell(MFC-CEA+) induced by pcDNA-triCEA625-667was stronger than that induced by pcDNA-triCEA625-667(P<0.05).The survival status,change of body weight and function of liver and kidney of the mice were not affected by the vaccine.Conclusion: There was no adverse reaction in the course of vaccine immunization.The minigene DNA vaccine derived from CEA can induce tumor specific CTL effect and the immune response level elicited by three tandem repeats of minigene DNA vaccine was superior to that elicited by haploid vaccine.
Carcinoembryonic antigen;Minigene;DNA vaccine;Vitro experiment;Anti tumor
10.3969/j.issn.1000-484X.2017.02.011
①本文受吉林省科技厅国际合作项目(20140414043GH)、吉林省科技厅中青年科技创新领军人才及团队项目(20140519018JH)、吉林省人社厅省人才开发资金(2016年度)和吉林省科技厅重点实验室项目(20122113)资助。
及指导教师:谭 岩(1956年-),男,博士,教授,博士生导师,主要从事肿瘤生物治疗及疫苗研发方面的研究,E-mail:tanyan49@hotmail.com。
R392 R730.5
A
1000-484X(2017)02-0217-04
②吉林大学第一医院呼吸内科,长春130021。作者简介:方艳秋(1968年-),女,博士,教授,主任医师,硕士生导师,主要从事肿瘤生物治疗基础与临床方面的研究,E-mail:yq.fang@163.com。
