LL-37抑制结核分枝杆菌感染巨噬细胞炎性因子分泌的研究①
2017-02-27杜先智
邓 燕 杜先智
(重庆医科大学第二附属医院呼吸内科,重庆400010)
LL-37抑制结核分枝杆菌感染巨噬细胞炎性因子分泌的研究①
邓 燕 杜先智
(重庆医科大学第二附属医院呼吸内科,重庆400010)
目的:探讨LL-37在感染结核分枝杆菌(Mycobacterium tuberculosis,Mtb)的巨噬细胞(Macrophage,Mφ)中对炎性因子分泌的影响及其抗炎作用。方法:(1)使用豆蔻酰佛波醇乙酯(PMA)将THP-1细胞诱导分化为具有吞噬作用的巨噬细胞(Mφ),用Mtb感染Mφ,构建细胞模型,用不同浓度的LL-37处理感染Mtb的巨噬细胞,并设置对照组。(2)实验分组:①正常对照组:THP-1+生理盐水;②Mtb组:THP-1+Mtb;③Mtb+LL-37 5 μg/ml组:THP-1+Mtb+5 μg/ml LL-37;④ Mtb+ LL-37 10 μg/ml组:THP-1+ Mtb+10 μg/ml LL-37;⑤ Mtb+ LL-37 20 μg/ml组:THP-1+Mtb+20 μg/ml LL-37。(3)各组培养6、12、24、48 h后用RT-PCR检测促炎因子IL-12p40、TNF-α及抗炎因子IL-4、IL-10 mRNA的表达;ELISA测定上清中细胞因子IL-12p40、TNF-α、IL-4、IL-10的分泌量。结果:与正常对照组相比较,Mtb感染组各时间段IL-12p40、TNF-α、IL-4及IL-10 的mRNA表达上调,并且其分泌量显著增加(P<0.05);LL-37刺激组与Mtb组相比较,各时间段外源性LL-37降低促炎因子IL-12p40、TNF-α mRNA的表达,IL-12p40、TNF-α分泌下降(P<0.05);而IL-4、IL-10 mRNA的表达升高,抗炎因子IL-4、IL-10分泌增加(P<0.05)。结论:外源性LL-37可抑制Mtb感染的巨噬细胞炎性细胞因子分泌,其效应与LL-37的浓度、感染Mtb的时间相关。本研究为结核病的治疗提供了新的见解。
LL-37;结核分枝杆菌;细胞因子
结核病(Tuberculosis)是一种由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起的慢性传染性疾病,也是单一感染导致死亡率仅次于艾滋病的世界性传染病。2013年WHO数据显示,有 900万新发病例,有 150万死于结核[1]。我国是仅次于印度的第二大高结核病负担国,据估计仅肺结核就使国民生产总值每年直接损失90亿元以上,结核病仍然是影响国民健康、制约经济发展的重大传染病。近年来由于多重耐药结核(MDR)和广泛耐药结核(XDB)[2]、艾滋病患者的增多,结核病的治疗面临着巨大挑战。
人抗菌肽(The human cathelicidin microbial peptide,CAMP)在人的细胞核糖体合成,为12~60个氨基酸组成的小分子碱性多肽,具有较强的阳离子特征和两亲性结构。唯一明确的人类抗菌肽被称为人类阳离子抗微生物蛋白(hCAP-18),LL-37是作为有活性的C-末端肽从hCAP-18裂解所得的[3],具有广泛的免疫活性,发挥既促炎又抗炎的效应[4]。研究证明,在生理水平1,25(OH)2D3的情况下,感染Mtb的Mφ内产生人抗菌肽显著增多,并诱发巨噬细胞自噬[5]。内源性人抗菌肽调节Mφ内IL-12p40、TNF-α等细胞因子的产生[6]。目前,国内外对于外源性LL-37在结核分枝杆菌感染的巨噬细胞中抗炎作用研究较少,因此本实验探究外源性LL-37在结核分枝杆菌感染的巨噬细胞中细胞因子分泌的影响。
1 材料与方法
1.1 材料
1.1.1 细胞系和菌株 人单核巨噬细胞系THP-1细胞系购自第三军医大学中心实验室。Mtb标准人型毒力株H37Rv(ATCC93009)由重庆市肺科医院惠赠。
1.1.2 主要试剂 LL-37购自上海吉尔生化公司;豆蔻酰佛波醇酯(PMA)购自Santa Cruz 公司;Trizol RNA提取试剂、RNA逆转录试剂盒、SYBR等PCR试剂购自TaKaRa公司;PCR引物由Invitrogen公司合成;ELISA试剂盒购自北京四正柏公司;RPMI1640、胎牛血清购自Gibco BRL公司。
1.2 方法
1.2.1 细菌的培养 在生物安全柜中,按照法国梅里埃公司米氏M7H9液体培养基说明,将H37Rv(ATCC93009)菌株接种于M7H9液体培养基中,接种后的培养瓶置于法国梅里埃公司BacT/ALERT MP处理系统进行快速液体培养,取21 d培养物以吐温80/PBS液稀释成菌液,用生物梅里埃细菌浓度比浊仪测定其浊度,配制成2×108ml-1的菌悬液,备用。
1.2.2 细胞的培养、诱导及分化 人单核巨噬细胞系 THP-1细胞在含10%胎牛血清、100 U/ml链霉素、100 U/ml青霉素的RPMI1640培养基中培养,将细胞置于37℃、5%CO2培养箱内培养。收集对数生长期的THP-1接种于6孔板中,用不含抗生素的10%RPMI1640培养基培养,细胞生长至浓度为2×106ml-1时,分别加入100 ng/ml PMA孵育24 h,诱导THP-1细胞分化使之具有吞噬能力。
1.2.3 细胞的分组、感染 在生物安全柜中,将上述6孔板中已分化的THP-1细胞随机分为5组,向各组加入浓度为2×107ml-1的Mtb悬液,感染2 h后,未被吞噬的Mtb用PBS洗涤3次除去,添加不含抗生素的10%RPMI1640培养基继续培养,以此时间点计时感染6、12、24、48 h后收集上清液和细胞,实验重复3次,每个样本设置3个复孔。
1.2.4 RT-PCR检测的IL-12p40、TNF-α、IL-4、IL-10 mRNA表达 提取RNA,将1×107ml-1细胞加入Trizol 裂解细胞,移液枪反复吹打,室温静置5 min,然后加入200 μl氯仿,混匀,快速震荡30 s,4℃12 000 r/min 离心15 min;将上清液移至 1.5 ml离心管中,加入500 μl预冷的异丙醇,颠倒混匀,室温静置 15 min后 12 000 r/min 4℃ 离心 10 min,弃去上清,在离心管中加入预冷的75%的乙醇 1 ml,震荡片刻,12 000 r/min 4℃离心5 min,弃上清,室温静置干燥2~5 min,去RNase水溶解沉淀。用紫外光分光光度计测总RNA含量和纯度,以1 μg总RNA为模板,用Oligo为引物,按照说明书介绍的方法逆转录合成cDNA。IL-12p40、TNF-α、IL-4、IL-10、β-Actin 引物由Invitrogen合成(表1)。将制取的cDNA照条件扩增:SYBR 12.5 μl、Forward Primer (10 μmol/L) 1 μl、Reverse Primer (10 μmol/L) 1 μl、模板DNA 2 μl、无核酸酶水调整总量至25 μl。然后设置96℃预变性3 min、96℃变性30 s、58℃退火30 s、72℃延伸30 s、35个循环。RT-PCR实验数据用2-ΔΔCt法(Ct为荧光达到阈值时所需要PCR的循环数)分析样本IL-12p40、TNF-α、IL-4、IL-10 mRNA的相对表达量。
表1 PCR引物
Tab.1 Primer sequences of assayed genes

GeneSequencesLengthIL⁃12p40Forward5′⁃GACATTCTGCGTTCAGGTCCAG⁃3′98bpReverse5′⁃CATTTTTGCGGCAGATGACCGTG⁃3TNF⁃αForward5′⁃CTCTTCTGCCTGCTGCACTTTG⁃3′135bpReverse5′⁃ATGGGCTACAGGCTTGTCACTC⁃3′IL⁃4Forward5′⁃AGGTGTCGATTTGCAGTGAC⁃3′145bpReverse5′⁃ACTAGGCCTCACCTGATACG⁃3′IL⁃10Forward5′⁃TGCCTTCAGCAGAGTGAAGA⁃3′169bpReverse5′⁃GTCTTGGTTCTCAGCTTGGG⁃3′β⁃ActinForward5′⁃CACCATTGGCAATGAGCGGTTC⁃3′135bpReverse5′⁃AGGTCTTTGCGGATGTCCACGT⁃3′
1.2.5 ELISA检测IL-12p40、TNF-α、IL-4、IL-10 按照试剂盒说明加样,置于37℃温育60 min,加入稀释30倍的洗涤液洗板5次,加显色剂,37℃避光显色5~15 min 后加入终止液,终止反应。450 nm 波长检测吸光度(OD)值并测各细胞因子浓度。

2 结果
2.1 RT-PCR检测IL-12p40、TNF-α、IL-4、IL-10 mRNA水平
2.1.1 各组不同时段IL-12p40 mRNA水平 各时间段Mtb感染组与正常对照组相比较,Mtb感染组IL-12p40 mRNA表达增加。在相同作用时间下,LL-37刺激组与未刺激比较,IL-12p40 mRNA的表达与LL-37的浓度和LL-37作用于巨噬细胞的时间有关。在相同作用时间下,浓度越大,抑制作用越明显(P<0.05)。见图1。
2.1.2 各组不同时段TNF-α mRNA水平 各时间段Mtb感染组与正常对照组相比较,Mtb感染组TNF-α mRNA表达增加。在相同作用时间下,LL-37刺激组与未刺激组比较,TNF-α mRNA的表达与LL-37的浓度和LL-37作用于巨噬细胞的时间有关。在相同作用时间下,浓度越大,抑制作用越明显(P<0.05)。见图2。
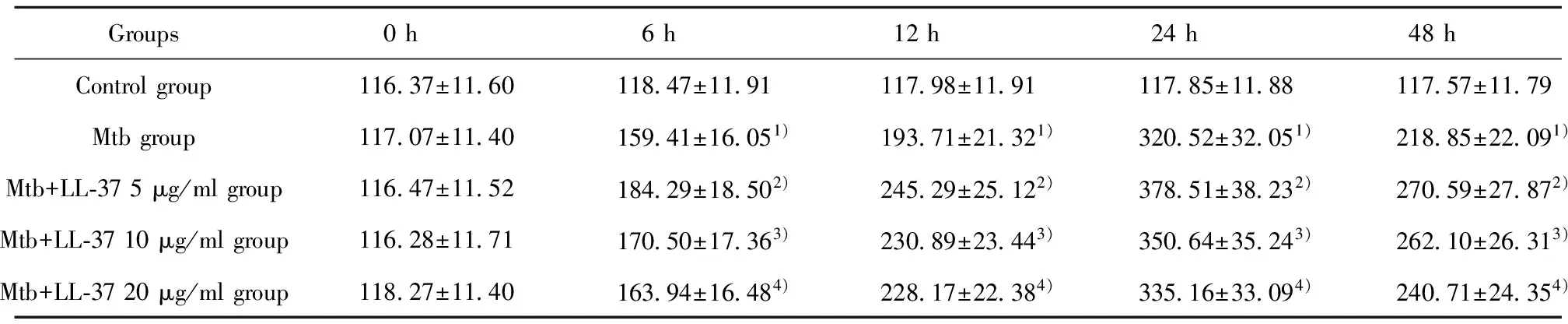
2.1.3 各组不同时段 IL-4 mRNA水平 各时间段Mtb感染组与正常对照组相比较,Mtb感染组 IL-4 mRNA表达增加。在相同作用时间下,LL-37刺激组与未刺激组比较,IL-4 mRNA的表达与LL-37的浓度和LL-37作用于巨噬细胞的时间有关。在相同作用时间下,浓度越小,IL-4 mRNA表达水平越高(P<0.05)。见图3。
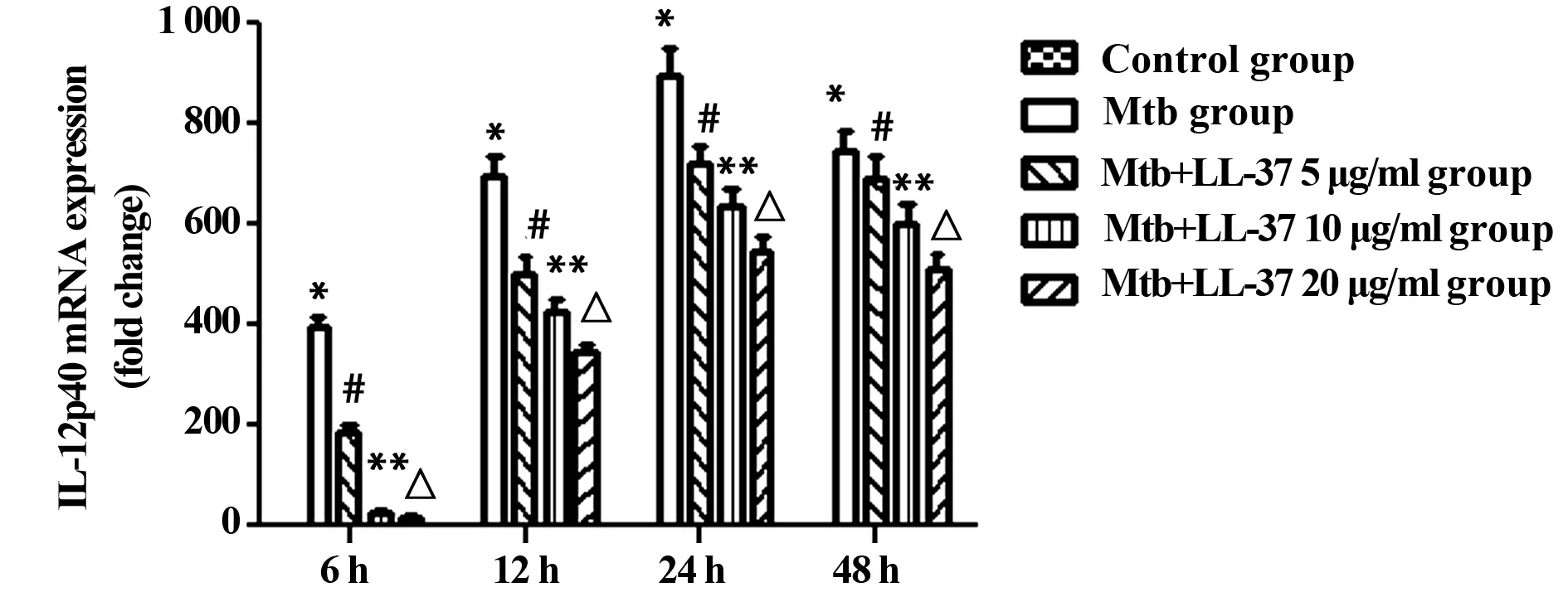
图1 各组不同时段IL-12p40 mRNA水平Fig.1 mRNA of IL-12p40 in various groups at 6 h,12 h,24 h and 48 hNote: *.P<0.05 Mtb group vs control group;# .P<0.05 Mtb group vs Mtb+LL-37 5 μg/ml group;**.P<0.05 Mtb group vs Mtb+LL-37 10 μg/ml group;△.P<0.05 Mtb group vs Mtb+LL-37 20 μg/ml group .n=3 .
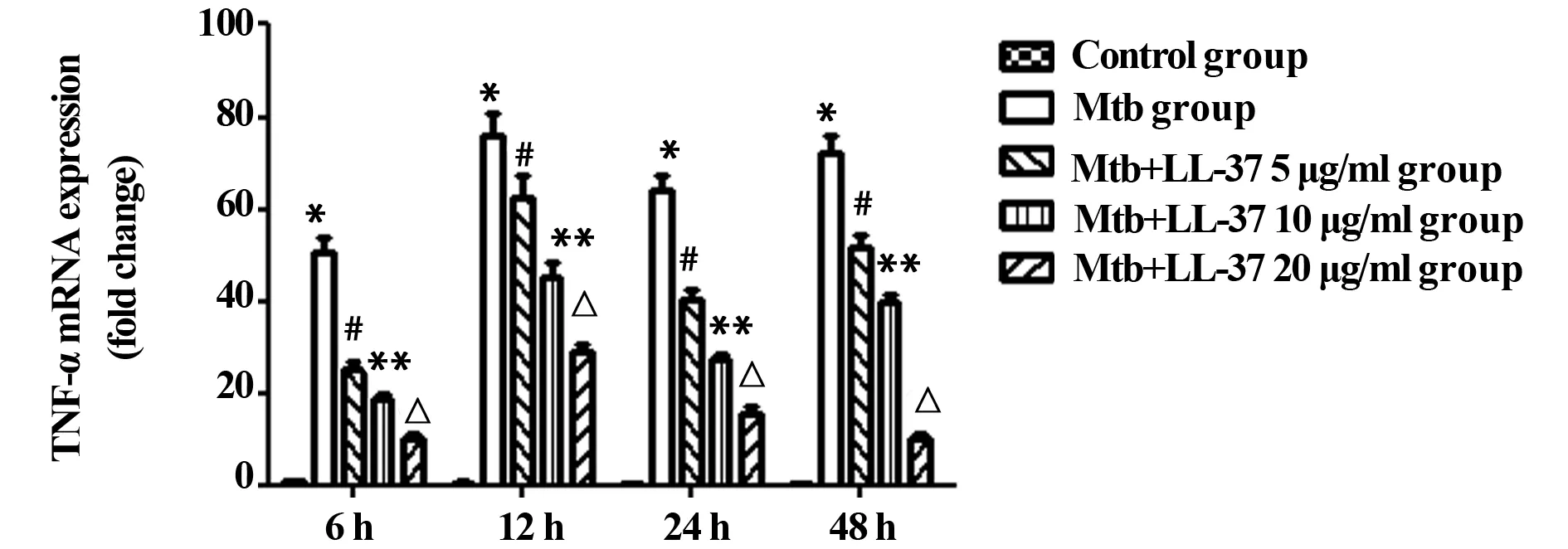
图2 各组不同时段TNF-α mRNA水平Fig.2 mRNA of TNF-α in various groups at 6 h,12 h,24 h and 48 hNote: * .P<0.05 Mtb group vs control group;# .P<0.05 Mtb group vs Mtb+LL-37 5 μg/ml group;**.P<0.05 Mtb group vs Mtb+LL-37 10 μg/ml group;△.P<0.05 Mtb group vs Mtb+LL-37 20 μg/ml group .n=3 .
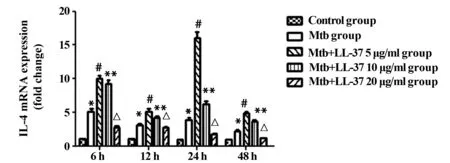
图3 各组不同时间段IL-4 mRNA水平Fig.3 mRNA of IL-4 in various groups at 6 h,12 h,24 h and 48 hNote: * .P<0.05 Mtb group vs control group;# .P<0.05 Mtb group vs Mtb+LL-37 5 μg/ml group;**.P<0.05 Mtb group vs Mtb+LL-37 10 μg/ml group;△.P<0.05 Mtb group vs Mtb+LL-37 20 μg/ml group.n=3 .
2.1.4 各组不同时段IL-10 mRNA水平 各时间段Mtb感染组与正常对照组相比较,Mtb感染组IL-10 mRNA表达增加。在相同作用时间下,LL-37刺激组与未刺激组比较,IL-10 mRNA的表达与LL-37的浓度和LL-37作用于巨噬细胞的时间有关。在相同作用时间下,浓度越小,IL-10 mRNA表达水平越高(P<0.05)。见图4。
2.2 ELISA检测IL-12p40、TNF-α、IL-4、IL-10的分泌
2.2.1 各组不同时段IL-12p40分泌 各时间段Mtb感染组与正常对照组相比较,Mtb感染组IL-12p40分泌增加。在相同作用时间下,LL-37刺激组与未刺激组比较,IL-12p40分泌与LL-37的浓度和LL-37作用于巨噬细胞的时间有关。在相同作用时间下,浓度越大,IL-12p40分泌越少(P<0.05)。见表2。
2.2.2 各组不同时段TNF-α分泌 各时间段Mtb感染组与正常对照组相比较,Mtb感染组TNF-α分泌增加。在相同作用时间下,LL-37刺激组与未刺激组比较,TNF-α分泌与LL-37的浓度和LL-37作用于巨噬细胞的时间有关。在相同作用时间下,浓度越大,TNF-α分泌越少(P<0.05)。见表3。
2.2.3 各组不同时段IL-4分泌 各时间段Mtb感染组与正常对照组相比较,Mtb感染组IL-4分泌增加。在相同作用时间下,LL-37刺激组与未刺激组比较,IL-4分泌与LL-37的浓度和LL-37作用于巨噬细胞的时间有关。在相同作用时间下,浓度越小,IL-4分泌越多(P<0.05)。见表4。
2.2.4 各组不同时段IL-10分泌 各时间段Mtb感染组与正常对照组相比较,Mtb感染组IL-10分泌增加。在相同作用时间下,LL-37刺激组与未刺激组比较,IL-10分泌与LL-37的浓度和LL-37作用于巨噬细胞的时间有关。在相同作用时间下,浓度越小,IL-10分泌越多(P<0.05)。见表5。
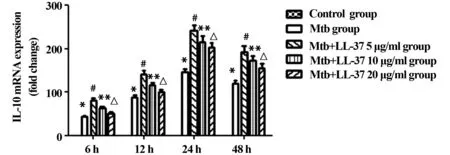
图4 各组不同时段IL-10 mRNA水平Fig.4 mRNA of IL-10 in various groups at 6 h,12 h,24 h and 48 hNote: *.P<0.05 Mtb group vs control group;# .P<0.05 Mtb group vs Mtb+5 μg/ml LL-37 group;**.P<0.05 Mtb group vs Mtb+10 μg/ml LL-37 group;△.P<0.05 Mtb group vs Mtb+20 μg/ml LL-37 group.n=3.
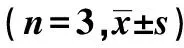
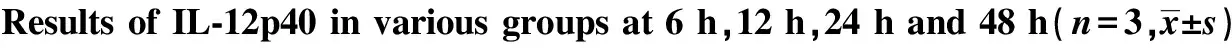
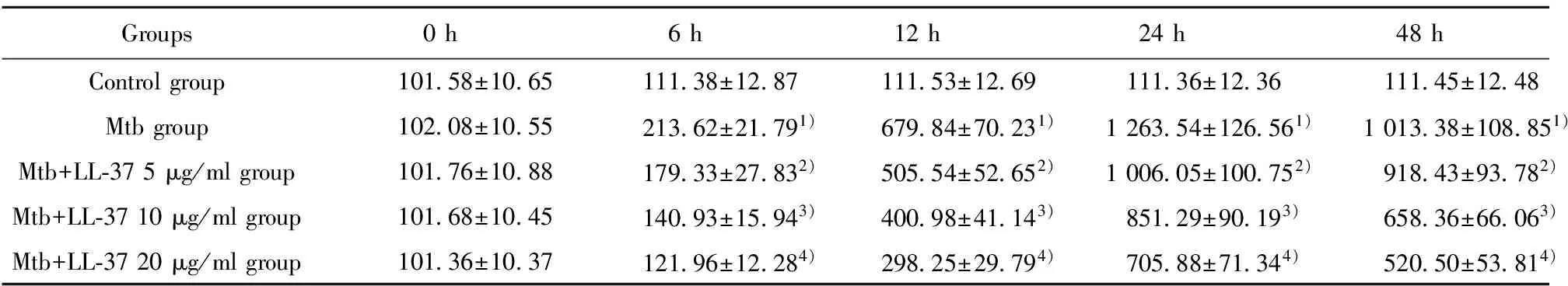
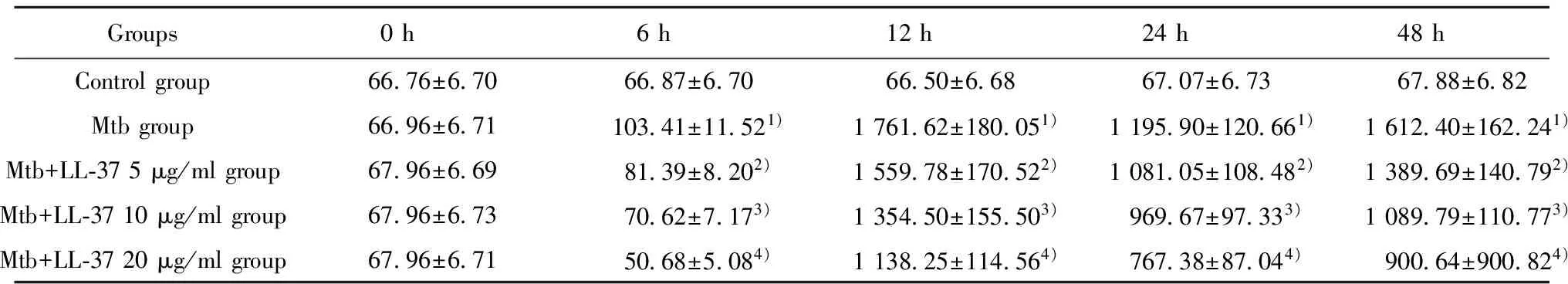
Groups0h6h12h24h48hControlgroup10158±106511138±128711153±126911136±123611145±1248Mtbgroup10208±105521362±21791)67984±70231)126354±126561)101338±108851)Mtb+LL⁃375μg/mlgroup10176±108817933±27832)50554±52652)100605±100752)91843±93782)Mtb+LL⁃3710μg/mlgroup10168±104514093±15943)40098±41143)85129±90193)65836±66063)Mtb+LL⁃3720μg/mlgroup10136±103712196±12284)29825±29794)70588±71344)52050±53814)
Note:1)P<0.05 Mtb group vs control group;2)P<0.05 Mtb group vs Mtb+LL-37 5 μg/ml group;3)P<0.05 Mtb group vs Mtb+LL-37 10 μg/ml group;4)P<0.05 Mtb group vs Mtb+LL-37 20 μg/ml group.n=3 .
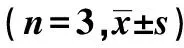
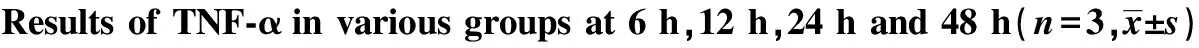
Groups0h6h12h24h48hControlgroup6676±6706687±6706650±6686707±6736788±682Mtbgroup6696±67110341±11521)176162±180051)119590±120661)161240±162241)Mtb+LL⁃375μg/mlgroup6796±6698139±8202)155978±170522)108105±108482)138969±140792)Mtb+LL⁃3710μg/mlgroup6796±6737062±7173)135450±155503)96967±97333)108979±110773)Mtb+LL⁃3720μg/mlgroup6796±6715068±5084)113825±114564)76738±87044)90064±900824)
Note:1)P<0.05 Mtb group vs control group;2)P<0.05 Mtb group vs Mtb+LL-37 5 μg/ml group;3)P<0.05 Mtb group vs Mtb+LL-37 10 μg/ml group;4)P<0.05 Mtb group vs Mtb+LL-37 20 μg/ml group.n=3 .
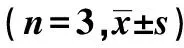
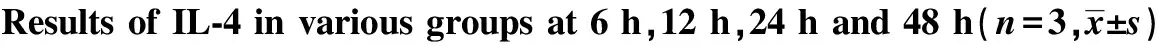
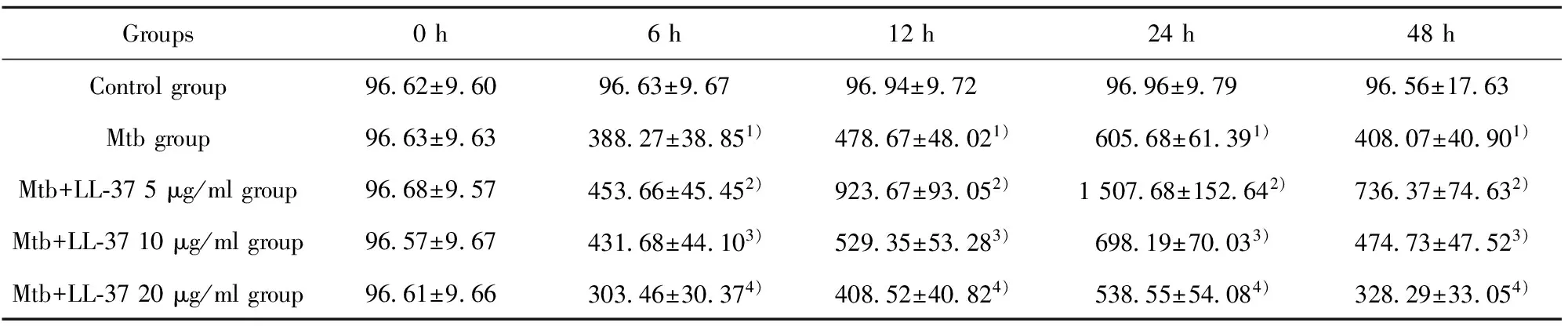
Groups0h6h12h24h48hControlgroup9662±9609663±9679694±9729696±9799656±1763Mtbgroup9663±963 38827±38851) 47867±48021) 60568±61391) 40807±40901)Mtb+LL⁃375μg/mlgroup9668±957 45366±45452) 92367±93052) 150768±152642) 73637±74632)Mtb+LL⁃3710μg/mlgroup9657±967 43168±44103) 52935±53283) 69819±70033) 47473±47523)Mtb+LL⁃3720μg/mlgroup9661±966 30346±30374) 40852±40824) 53855±54084) 32829±33054)
Note:1)P<0.05 Mtb group vs control group;2)P<0.05 Mtb group vs Mtb+LL-37 5 μg/ml group;3)P<0.05 Mtb group vs Mtb+LL-37 10 μg/ml group;4)P<0.05 Mtb group vs Mtb+LL-37 20 μg/ml group.n=3 .
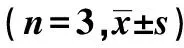
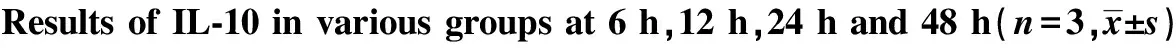
Groups0h6h12h24h48hControlgroup11637±116011847±119111798±119111785±118811757±1179Mtbgroup11707±114015941±16051)19371±21321)32052±32051)21885±22091)Mtb+LL⁃375μg/mlgroup11647±115218429±18502)24529±25122)37851±38232)27059±27872)Mtb+LL⁃3710μg/mlgroup11628±117117050±17363)23089±23443)35064±35243)26210±26313)Mtb+LL⁃3720μg/mlgroup11827±114016394±16484)22817±22384)33516±33094)24071±24354)
Note:1)P<0.05 Mtb group vs control group;2)P<0.05 Mtb group vs Mtb+LL-37 5 μg/ml group;3)P<0.05 Mtb group vs Mtb+LL-37 10 μg/ml group;4)P<0.05 Mtb group vs Mtb+LL-37 20 μg/ml group.n=3 .
3 讨论
我国是世界三大结核病高负担国家之一,结核病是影响我国国民健康和制约我国经济发展的重大传染病。机体抗结核主要通过细胞免疫,巨噬细胞是人体抗结核的第一道防线,主要通过产生和分泌细胞因子参与机体抗结核反应。LL-37是从人类阳离子抗微生物蛋白裂解所得、有活性的C-末端肽,由37个氨基酸组成,呈螺旋状的,包含亲水和疏水部分;LL-37表达于胃肠道、呼吸道上皮细胞、单核细胞、中性粒细胞、T细胞、NK细胞及B细胞。LL-37主要是中性粒细胞和上皮细胞分泌产生,生理情况下,机体可分泌2~5 μg的LL-37,当机体发生炎症和病原体入侵时,LL-37的分泌量增加[7]。现已发现,LL-37是具有多种活性作用且唯一存在于人体内的防御素,其活性包括调节炎症反应,趋化免疫细胞至损伤或感染部位,结合并中和LPS,促进再上皮化及损伤修复等。
人抗菌肽主要通过细胞膜形成通道而破坏细胞膜,从而杀伤病原微生物。抗菌肽主要通过其直接的抗菌活性参与清除机体的结核分枝杆菌。研究表明,肺泡巨噬细胞和单核-巨噬细胞在结核感染时通过产生抗菌肽而清除结核分枝杆菌[8-10]。IL-12p40是活化的单核/巨噬细胞合成的细胞因子,其功能是促进T细胞分化,增加Th1应答,调节细胞免疫。Emi等[6]的研究结果表明,内源性的LL-37抑制IL-12p40的生成。TNF-α是巨噬细胞产生的具有多种生物学活性的细胞因子,对白细胞、血管内皮细胞及结缔组织中的细胞因子具有免疫调节作用。TNF-α 不仅能够刺激细胞产生前列腺素和蛋白酶,还可增强血管通透性,具有促炎作用[11]。有研究表明,内源性的LL-37可以减少LPS和LTA刺激的单核巨噬细胞产生TNF-α[12,13],我们在实验中使用外源性LL-37同样可抑制IL-12p40及TNF-α的生成。
为探讨抗菌肽在结核分枝杆菌感染的巨噬细胞中免疫抑制功能,我们检测了抗炎因子IL-4和IL-10 mRNA的水平和分泌。IL-4和IL-10是Th2细胞分泌的抗炎因子,参与机体的抗结核反应。研究表明,正常人可以分泌一定量的LL-37,当机体分泌抗菌肽不足时,结核的易感性增加[10,12],在活动性结核患者体内IL-4和IL-10均升高[14]。我们的实验表明,5 μg/ml和10 μg/ml的LL-37增加IL-4 mRNA水平,IL-4的分泌量增加,而20 μg/ml的LL-37抑制了IL-4 mRNA水平,IL-4的分泌量减少,这提示外源性LL-37对IL-4的生物学作用与LL-37的浓度相关;同时另一抗炎因子IL-10 mRNA水平, IL-10的分泌量在外源性LL-37的作用下,其表达和分泌是升高的。LL-37对抗炎因子IL-4和IL-10 mRNA水平和分泌的影响,提示LL-37增加抗炎因子的生成。综上,LL-37具有免疫调节功能,既可以通过抑制促炎因子的生成避免过度的炎症反应,又可以增加抗炎因子的生成避免过度的炎症反应,从而使机体在结核分枝杆菌感染时维持动态平衡。
既往研究表明内源性LL-37具有抗细菌、真菌、病毒、寄生虫的作用[15-19]。本研究是首次致力于外源性LL-37在结核分枝杆菌感染的巨噬细胞的免疫调节作用。LL-37对结核分枝杆菌感染的巨噬细胞的细胞因子分泌影响为我们临床治疗结核提供了新的视野和见解,然而,LL-37在结核分枝杆菌感染的巨噬细胞中炎症因子分泌的机制不清,有待进一步研究。
[1] Emami SG.Global tuberculosis report 2014[M].Geneva:WHO Press,2014:12-13.
[2] Sethi S,Mewara A,Dhatwalia SK,etal.Prevalence of multidrug resistance in Mycobacterium tuberculosis isolates from HIV seropositive and seronegative patients with pulmonary tuberculosis in north India[J].BMC Infect Dis,2013,13(1):137.
[3] 李方舟,胡海峰.人cathelicidin抗菌肽LL-37在宿主防御系统中的作用[J].世界临床药物,2011,32(4):243-246.
[4] Sun W,Zheng Y,Lu Z,etal.LL-37 attenuates inflammatory impairment via mTOR signaling-dependent mitochondrial protection[J].Int J Biochem Cell Biol,2014,54(9):26-35.
[5] Yuk JM,Shin DM,Lee HM,etal.Vitamin D3 induces autophagy in human monocytes/macrophages via cathelicidin[J].Cell Host Microbe,2009,6(3):231-243.
[6] Emi S,Shinichi I,Kazunari I,etal.Vitamin D-dependent cathelicidin inhibits Mycobacterium marinum infection in human monocytic cells[J].Dermatol Sci,2013,70(3):166-172.
[7] Nijinik A,Pistolic J,Wyatt A,etal.Human cathelicidin peptide LL-37 modulates the effects of IFN-gamma on APCs[J].J Immunol,2009,183(9):5788-5798.
[8] Rivas-Santiago B,Hernandez-Pando R,Carranza C,etal.Expression of cathelicidin LL-37 during Mycobacterium tuberculosis infection in human alveolar macrophages,monocytes,neutrophils,and epithelial cells[J].Infect Immun,2008,76(3):935-941.
[9] Liu PT,Stenger S,Tang DH,etal.Cutting edge:vitamin D-mediated human antimicrobial activity against Mycobacterium tuberculosis is dependent on the induction of cathelicidin[J].J Immunol,2007,179(4):2060-2063.
[10] Liu PT,Stenger S,Li H,etal.Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response[J].Science,2006,311(5768):1770-1773.
[11] Nemeth J,Winkler HM,Boeck L,etal.Specific cytokine patterns of pulmonary tuberculosis in Central Africa[J].Clin Immunol,2011,138(1):50-59.
[12] Mookherjee N,Brown KL,Bowdish DME,etal.Modulation of the TLR-mediated inflammatory response by the endogenous human host defense peptide LL-37[J].Immunology,2006,176(4):2455-2464.
[13] Scott MG,Vreugdenhil ACE,Buurman WA,etal.Cationic antimicrobial peptides block the binding of lipopolysaccharide (LPS) to LPS binding protein[J].Immunology,2000,164(2):549-553.
[14] 张锦萍.初治肺结核患者外周血T淋巴细胞IL-4、IL-10、IL-18、IL-23及IFN-γ表达的研究[J].哈尔滨医药,2013,33(4):271-273.
[15] Bals R,Wang X,Zasloff M,etal.The peptide antibiotic LL-37/hCAP-18 is expressed in epithelia of the human lung where it has broad antimicrobial activity at the airway surface[J].Proc Natl Acad Sci U S A,1998,95(16):9541-9546.
[16] Barlow PG,Svoboda P,Mackellar A,etal.Antiviral activity and increased host defense against influenza infection elicited by the human cathelicidin LL-37[J].PLoS One,2011,6(10):e25333.
[17] Bartek J,Lukas J.Pathways governing G1/S transition and their response to DNA damage[J].FEBS Lett,2011,490(3):117-122.
[18] Bucki R,Janmey PA.Interaction of the gelsolin-derived antibacterial PBP 10 peptide with lipid bilayers and cell membranes[J].Antimicrobial Agents Chemother,2006,50(9):2932-2940.
[19] Bucki R,Pastore JJ,Randhawa P,etal.Antibacterial activities of rhoda mine B-conjugated gelsolin-derived peptides compared to those of the antimicrobial peptides cathelicidin LL37,Agen magainin II,and melittin[J].Antimicrobial Agents Chemother,2004,48(5):1526-1533.
[收稿2016-06-03 修回2016-09-05]
(编辑 张晓舟)
LL-37 inhibited secretion of inflammatory cytokines in mycobacterium tuber-culosis infected macrophages
DENGYan,DUXian-Zhi.
DepartmentofRespiratoryMedicine,theSecondAffiliatedHospitalChongqingMedicalUniversity,Chongqing400010,China
Objective:To research the anti-inflammatory effect of LL-37 in mycobacterium tuberculosis (Mtb) infected-macrophages,as well as its influence on the secretion of inflammatory cytokines.Methods:(1) THP-1 cells were cultured and incubated with phorbol 12-myristate 13-acetate (PMA) to transform into an adherent macrophage-like state (macrophage,Mφ).Then the THP-1 cell derived macrophages were infected with mycobacterium tuberculosis,and then stimulated with different concentrations of LL-37.(2)The experiment was divided into following groups: ① Control group:THP-1+normal saline (NS);② Mtb group:THP-1+Mtb;③Mtb+LL-37 5 μg/ml group:THP-1+Mtb+5 μg/ml LL-37;④Mtb+LL-37 10 μg/ml group:THP-1+Mtb+10 μg/ml LL-37;⑤Mtb+LL-37 20 μg/ml group:THP-1+Mtb+20 μg/ml LL-37.(3)The mRNA expression levels of IL-12p40,TNF-α,IL-4,and IL-10 will be determined by Real-time PCR respectively at 6,12,24 and 48 hours.The secreted levels of IL-12p40,TNF-α,IL-4,and IL-10 will be determined by ELISA analysis respectively at 6,12,24 and 48 hours.Results:The mRNA expression levels and secreted levels of IL-12p40,TNF-α,IL-4 and IL-10 were increased in Mtb group than those in control group.The mRNA expression levels and secreted levels of pro-inflammatory cytokines IL-12p40 and TNF-α were decreased in the LL-37 groups than those in Mtb group.However,anti-inflammatory cytokines IL-4 and IL-10 mRNA expression levels and secreted levels were increased in the LL-37 groups than those in Mtb group.Conclusion: Exogenous LL-37 inhibited the secretion of inflammatory cytokines in macrophages during mycobacterium tuberculosis infection.The effect is related to the concentrations of LL-37 and the stimulated time of macrophages which were infected with mycobacterium tuberculosis.The results will provide new insights into the treatment of Mtb infection.
LL-37;Mycobacterium tuberculosis(Mtb);Cytokines
10.3969/j.issn.1000-484X.2017.02.006
邓 燕(1989年-),女,硕士,主要从事肺部感染性疾病与免疫的研究。
及指导教师:杜先智(1964年-)男,教授,硕士生导师,主要从事肺部感染性疾病与免疫的研究,E-mail:dxzdjy868@sina.com。
R392.12
A
1000-484X(2017)02-0190-06
①本文为重庆市卫计委重点项目(No.2015ZDXM013)。
