微生物代谢工程的研究进展和展望
2017-02-24顾洋李江华堵国成陈坚刘龙
顾洋,李江华,堵国成,2,陈坚,2,刘龙,2
1.江南大学工业生物技术教育部重点实验室,无锡 214122
2.江南大学糖化学与生物技术教育部重点实验室,无锡 214122
微生物代谢工程的研究进展和展望
顾洋1,李江华1,堵国成1,2,陈坚1,2,刘龙1,2
1.江南大学工业生物技术教育部重点实验室,无锡 214122
2.江南大学糖化学与生物技术教育部重点实验室,无锡 214122

刘龙,江南大学生物工程学院教授,博士生导师,国家优秀青年科学基金获得者。主要从事利用系统与合成生物技术构建微生物细胞工厂高效合成功能营养品的应用基础研究。主持国家“863”项目、“973”子课题、国家自然科学基金等国家和省部级课题10项;以第一作者或通讯作者在《Nature Communications》、《Biotechnology Advances》、《Metabolic Engineering》、《Biotechnology and Bioengineering》等工业生物技术领域权威期刊发表SCI论文60余篇;出版著作和教材3部;获25项中国授权发明专利和2项美国授权发明专利。获聘任英文期刊《Scientific Reports》和《Frontiers in Bioengineering and Biotechnology》的编委。2014年获评江苏省“青蓝工程”优秀青年骨干教师,2015年入选江苏省“六大人才高峰”高层次人才支持计划,2016年被评为江苏省教育工作先进个人。获国家技术发明二等奖(2015)、霍英东教育基金会青年教师奖三等奖(2016)、中国轻工业联合会技术发明一等奖(2013)以及国际学术奖励1项(IFIBiop优秀青年科学家奖)。E-mail: longliu@jiangnan.edu.cn
代谢工程技术是构建微生物细胞工厂的重要方法,其主要目标是通过基因工程等手段将目标代谢产物产量最大化。然而基因工程等操作往往会影响细胞生长速率,导致其生产强度降低。随着合成生物学及相关技术的发展,多种调控策略被应用于代谢工程领域以解决上述问题。通过这些调控可以有效地解决细胞生长与产物合成之间的竞争关系,平衡代谢途径,避免中间代谢产物的过量积累。对这些策略的研究及应用进行了概述和展望。
代谢工程;动态调控;合成生物学;发酵
微生物发酵生产具有可持续、绿色环保等特点,随着传统石油资源的日益枯竭,微生物发酵生产将是替代传统石油化工的重要技术手段[1-3]。作为细胞工厂,微生物已被用于多种同源及异源代谢产物的生产,包括发酵型产物、氨基酸以及众多次级代谢产物的生产[4-5]。从经济角度考虑,微生物发酵生产大宗化学品和生物燃料应具有高转化率、高生产强度、高得率的特点[6]。
代谢工程技术作为构建微生物细胞工厂的重要方法,已经被成功应用于多种生物基产品的工业化生产,如青蒿素、N-乙酰氨基葡萄糖、黄铜类化合物等。传统代谢工程优化细胞生产性能时,通常是经过一轮工程改造后,验证并鉴定限速步骤,然后进行下一轮代谢改造,消除新的限速步骤,提高细胞生产能力,之后再鉴定限速步骤,再进行代谢改造[7-8]。通常情况下,研究者会对关键代谢节点的基因进行过量表达,以期获得较高的转化率和产量。然而实际上,并不是所有的代谢改造都能达到提高目的产物的效果,因为过表达的合成途径会与宿主自身的代谢途径竞争共同的资源和能量,严重时会导致细胞进入应急状态,使得胞内代谢流量产生不平衡,造成中间代谢产物的大量积累,最终抑制胞内代谢活动,降低菌体的生理活性和发酵性能。代谢工程操作常常会影响细胞生长,降低其生长速率,甚至还会形成生长速率极慢的“病态”菌株[9]。此外,蛋白质、维生素、能源化合物及药物的微生物发酵合成,常常需要在宿主细胞中表达多个异源代谢途径,增加菌体的代谢负担。所以工程菌株,通常会存在下列问题:①代谢途径不平衡造成中间代谢积累,降低产物得率;②细胞生长与产物合成途径竞争共同底物,影响产物得率和生产强度;③产物合成途径影响细胞正常代谢,导致限速步骤产生,抑制生物合成;④有毒代谢物的产生,抑制菌体生长。
为了解决上述问题,多种新的策略与工具被应用于代谢工程领域,如代谢进化(metabolic evolution)、支架结构平衡代谢工程、模块途径工程、系统代谢工程以及代谢工程的动态调控策略。随着合成生物学的发展,通过合成生物学理念设计新的生物元件和装置,可以有效地、简便地实现对大规模生物途径的构建。
1 代谢进化
代谢进化是通过对微生物进行驯化培养,以获得提高生长速率、产量、转化率和生产强度的菌体[10]。该策略的具体方法是:首先通过代谢改造,阻断副产物的合成,提高生产菌株的目的代谢产物的产量和转化率,使目的代谢产物合成途径成为消耗还原力(NADH)的主要途径,然后在反应器中进行连续传代培养,筛选出生长速率较快的突变株。因为细胞在利用底物生长的过程中会产生能量(ATP)和还原力,由于副产物合成途径已经被阻断,细胞只能通过合成目的代谢产物才能平衡胞内还原力(NADH)的水平,所以此类细胞会将能量代谢和还原力代谢偶联,在提高菌体生长性能的同时也能提高发酵性能。Ingram等[11]在代谢改造发酵生产D-乳酸的研究中,就是利用该策略成功筛选出生长较好的高性能突变株。该菌在含有10%葡萄糖的LB培养基中能更高效地合成乳酸,其产量比代谢进化之前提高13%,生产强度提高73%。同时,该课题组也利用该策略改善了L-乳酸、L-丙氨酸、乙醇代谢工程菌的发酵性能[11-13]。
2 基于支架结构的合成代谢途径
基于支架结构的合成代谢途径是通过将合成途径中的酶固定于特定支架结构上,使得途径酶可以在空间距离上靠近,从而提高途径酶间的催化效率[14-16]。同时,可以通过调整酶之间的距离和比例进一步调控合成途径的相对活性,达到平衡胞内代谢的目的,避免中间代谢产物的过量积累[13,17]。目前已经建立的支架结构有蛋白支架、RNA支架以及DNA支架[18]。Keasling等[14]设计出一种特殊的蛋白支架用于固定甲羟戊酸合成途径中3个关键酶,并优化了催化效率。该策略成功地将甲羟戊酸的产量提高了77倍,避免了胞内中间代谢物的过量积累,有效缓解了细胞代谢负担。该团队还将同样的蛋白支架应用到葡萄糖二酸的生产中,改造后的工程菌葡萄糖二酸的产量提高了3倍,有效证明了支架结构工具的有效性。Delebecque等[15]研究表明通过RNA支架可以更高效地实现途径酶之间的调控。支架结构可以有效降低途径酶之间的空间位阻,提升酶的催化效率,被证明是一种调控代谢途径及提高菌体生产性能的十分有效的方法。Conrado等[16]使用质粒构建DNA支架,并将这一方法应用于不同代谢产物的生产,如甲羟戊酸、白藜芦醇、1,2-丙二醇。其研究结果表明使用DNA支架也能有效增加代谢产物产量,提高细胞生产性能。
3 模块途径工程
传统代谢工程通常是进行代谢改造,然后鉴定限速步骤,再进行代谢改造[7-8]。但往往一个限制性因素刚被解决,新的代谢瓶颈又会出现。在这样的背景下,模块工程策略被提出用于代谢网络的全局优化。研究者将胞内的代谢途径络分成不同模块,然后利用调控元件构建不同活性模块,再将不同活性模块组装进代谢网络[18-20]。最后通过调整模块间的活性,得到代谢模块相对活性平衡的最优重组菌[21-22]。具体方法是通过对模块中关键基因的拷贝数和启动子进行优化,达到对整个模块的调整。Liu等[23]利用该技术优化了枯草芽孢杆菌生产N-乙酰氨基葡萄糖(GlcNAc),他们将枯草芽孢杆菌胞内代谢途径分为3个模块,分别为GlcNAc合成模块、糖酵解模块和肽聚糖合成模块。该研究小组首先优化了GlcNAc合成途径中关键酶GlmS和Gna1的启动子,敲除了乙酸和乳酸合成相关的基因ldh、pta,阻断了副产物的产生,得到活性较强的GlcNAc合成模块;之后,通过sRNA与Hfq蛋白的组合,调控6-磷酸果糖激酶(Pfk)和1-磷酸氨基葡萄糖变位酶(GlmM)的表达水平,获得不同活性的糖酵解模块和肽聚糖合成模块;最后将不同活性强度的3个模块进行组合组装,筛选活性相对平衡的最优重组菌,成功地提高了GlcNAc的产量。通过模块途径工程改造后单位菌体的最高GlcNAc产率达到2.0g/g,是改造前的4.3倍。Wu等[24]利用模块化策略优化黄酮骨架化合物的从头合成途径,通过4个不同拷贝数的质粒来改变模块的代谢通量,优化代谢网络。生松素和柚皮素的产量分别达到40mg/L和50.2mg/L。然而,研究者发现芳香族氨基酸到黄酮骨架物质的合成途径是整个合成途径的瓶颈,因此再次引入模块优化策略对该步骤进行精细改造。最终生松素和柚皮素的产量分别提高至84.2mg/L和105.1mg/L[25]。
4 系统代谢工程
系统代谢工程是将组学分析技术与传统代谢工程及下游工程技术相结合,主要过程为:①进行局部代谢改造,构建起始工程菌株;②进行组水平系统分析和计算模拟代谢分析,获得下一步代谢改造靶点;③系统分析重组代谢网络,揭示产物合成的限制性因素;④进行工业水平发酵过程优化,进一步提高菌体性能。Lee等[26]在改造大肠杆菌生产缬氨酸时,利用基因工程手段首先去除了胞内缬氨酸的反馈抑制、转录消除效应以及缬氨酸的竞争代谢途径,并过表达了合成途径关键基因,获得一株转化率达到0.66g/g葡萄糖的工程菌株;然后通过转录组学的分析,找出其他能够促进缬氨酸合成的基因,强化这些基因的表达,重组大肠杆菌的转化率提高了一倍;之后通过代谢网络模型的分析,又获得了改造靶点,删除这些基因后,转化率达到0.378g/g葡萄糖。Park等[27]首先通过随机诱变技术获得一株高产精氨酸的突变株,并对突变株进行基因组测序,找出突变位点,验证突变位点对精氨酸合成的影响;然后通过系统代谢工程进一步提高菌体的生产性能,具体方法包括去除负向调控因子、优化胞内的NADPH水平、增加合成前体、强化限速 步骤。最终发酵罐精氨酸产量达到81.2g/L,转化率为0.35g/g(葡萄糖和蔗糖),达到精氨酸工业化生产的标准。
5 动态调控策略
动态调控指是通过某些策略和方法可以实现动态的调控或者改变胞内代谢流流向(图1)[9,28,29]。Mahadevan等[28]于2008年首先提出动态代谢工程(dynamic metabolic engineering)的概念。动态调控主要包括过程水平的两阶段调控、基因水平的两阶段调控、基因水平的持续调控[9]。基因水平的持续动态调控系统应具有可以监测胞内某种信号的感应元件,并且可以有效地根据信号信息的变化调控基因的表达[30-31]。基因水平的动态调控系统中最理想的调控元件是一些转录因子,这类转录因子能够根据胞内代谢物的变化精确地调控相关基因的转录和表达[9,32]。然而大部分的调控元件会受到菌体自身调节机制的限制无法应用于动态调控,与此同时细胞内很多代谢途径和代谢产物的调控机制还未完全解析,因此使得代谢途径的动态调控的实现变得异常困难[9,31,33]。特别是异源表达的合成途径,由于这类合成途径及代谢产物往往在宿主中缺乏调控机制,容易造成中间代谢物的积累,导致限速步骤产生,抑制产物的合成[34]。近年来,微生物发酵动态调控策略受到众多研究者的关 注,越来越多的调控元件被发现并应用。
5.1 过程水平的两阶段调控
微生物发酵过程中最常见的动态调控的策略就是过程水平的两阶段调控,该调控策略可以实现将菌体生长与产物合成阶段简单的分开,使得细胞能够在生长阶段快速并大量的积累,之后改变发酵条件迫使细胞进入到产物合成阶段。该调控策略已成功应用于乳酸的生产,菌体在有氧的条件下迅速生长,菌体生长完成后进入厌氧发酵状态,开始大量合成乳酸。两阶段发酵生产乳酸与传统完全厌氧发酵相比优势更加明显,生产强度达到3.32g/(L·h),是传统厌氧发酵的10倍[11,35]。目前该策略也被应用于1,4-丁二醇的微生物发酵。另外pH也常被用于过程水平的两阶段调控,如酮戊二酸、丙酮酸的生产[36]。张等[37]在发酵生产α-酮戊二酸时,通过控制初期pH为6.0、菌体生长至10g/L后,让pH自然降至3.0,并保持到发酵结束。α-酮戊二酸的产量达到54.0g/L,产量和生产强度分别比控制pH为6.0时提高了19.3%和17.8%。过程水平的两阶段发酵也常应用于蛋白和酶制剂的微生物发酵。通常情况下,蛋白的合成会与菌体生长竞争共同底物,进而抑制菌体生长。因此在微生物发酵生产蛋白和酶制剂时需要先让菌体生长起来,然后通过添加诱导物(IPTG等)诱导相关基因的表达,进入蛋白合成阶段[38]。然而过程水平的两阶段调控因其应用条件的局限性和昂贵的诱导物也限制了该策略的广泛应用。

图1 微生物动态调控策略
5.2 基因水平的两阶段调控
近年来,单一的基因开关以及由多个基因开关相互关联组成的复杂的基因开关已被用来调控代谢途径和研究细胞内代谢调控[39]。Zhou等[40]将重组大肠杆菌的染色体上ldhA(乳酸脱氢酶基因)的原始启动子(ldhAp)替换成γ噬菌体的温敏型启动子Pr和PL(图2a),通过调控发酵培养条件控制乳酸脱氢酶基因的表达水平,实现了动态、高效的调控重组大肠杆菌乳酸合成与菌体量的积累,将好氧菌体转化率提高了9%,发酵阶段体积生产强度提高了51%,乳酸比合成速率提高了46%,化学纯度提高到98.6%,有效解决了菌体生长与产物合成之间的代谢与调控的矛盾。Williams等[30]在酿酒酵母中通过使用RNA干扰(RNAi)调控生长必须基因ARO7的表达实现了对羟基苯甲酸合成途径的两阶段调控(图2b)。在菌体处于生长阶段时,对羟基苯甲酸合成途径相关基因被抑制,菌体可以迅速的大量生成,当菌体积累一定量后RNA干扰特异的关闭基因ARO7的表达,菌体进入对羟基苯甲酸合成阶段。Soma等[41]在大肠杆菌发酵法生产异丙醇的研究中(图2c),构建了可以控制菌体生长和产物合成基因表达的转换器(inverter)开关,菌体生长完成后向培养体系中添加IPTG,抑制菌体生长相关基因,迫使代谢流流向产物合成途径,实现了大肠杆菌生产异丙醇的两阶段发酵,有效提高了异丙醇的产量。
5.3 基因水平的持续调控
微生物发酵培养时,细胞所处的环境是不断变化的,通过简单的两阶段调控(过程水平和基因水平)并不能真正意义上地解决菌体生长和合成途径竞争的关系。在此背景下,研究者提出了持续调控的策略,通过设计感应元件动态检测细胞内环境的变化,并能根据信号反馈即时地调控细胞代谢活动。Koffas等[33]构建了能够识别胞内丙二酸单酰辅酶A水平的生物开关,根据细胞本身的状态,细胞自身能够决定哪些基因需要激活或者抑制(图2d)。当细胞感知到胞内的丙二酸单酰辅酶A水平较低时,就会增加合成丙二酸单酰辅酶A的基因的表达。相反,当细胞感知到丙二酸单酰辅酶A水平较高时,就会促进合成脂肪酸合酶,从而消耗积累的丙二酸单酰辅酶A。其生物开关主要是基于两个转录调控的启动子,这两个启动子对细胞内的丙二酸单酰辅酶A表现出相反的转录活性,当胞内丙二酸单酰辅酶A积累时,其中一个启动子能够关闭丙二酸单酰辅酶A的合成途径,当胞内丙二酸单酰辅酶A较少时,另一个启动子能够打开丙二酸单酰辅酶A的合成途径。这一动态调控策略优化了丙二酸单酰辅酶A的生物合成,克服了自然界中微生物不能过量合成脂肪酸的瓶颈。Dahl等[42]通过增加胞内合成途径的中间代谢产物的浓度对菌体施加压力,结合转录组学技术,通过DNA芯片技术,对微生物细胞内的mRNA进行分析,比较原始菌和被施加压力菌的转录组,鉴定出变化显著的基因,找出相应的启动子并构建相应的启动子文库,利用这些启动子调控细胞代谢和目的产物的合成。Mahadevan等[28]通过将群体感应系统(quorum-sensing system)与双稳态开关进行组合并整合至细胞的基因组上,使得细胞自身能够感应反应器中细胞密度,并自动调控pta(与生长相关且是副产物的编码基因)基因的表达。在生长阶段,pta能够正常表达,菌体可以快速生长;当细胞密度达到一定程度后,菌体会自动关闭pta基因的表达,进入产物合成阶段从而提高代谢产物乙醇和琥珀酸的产量和生产强度。
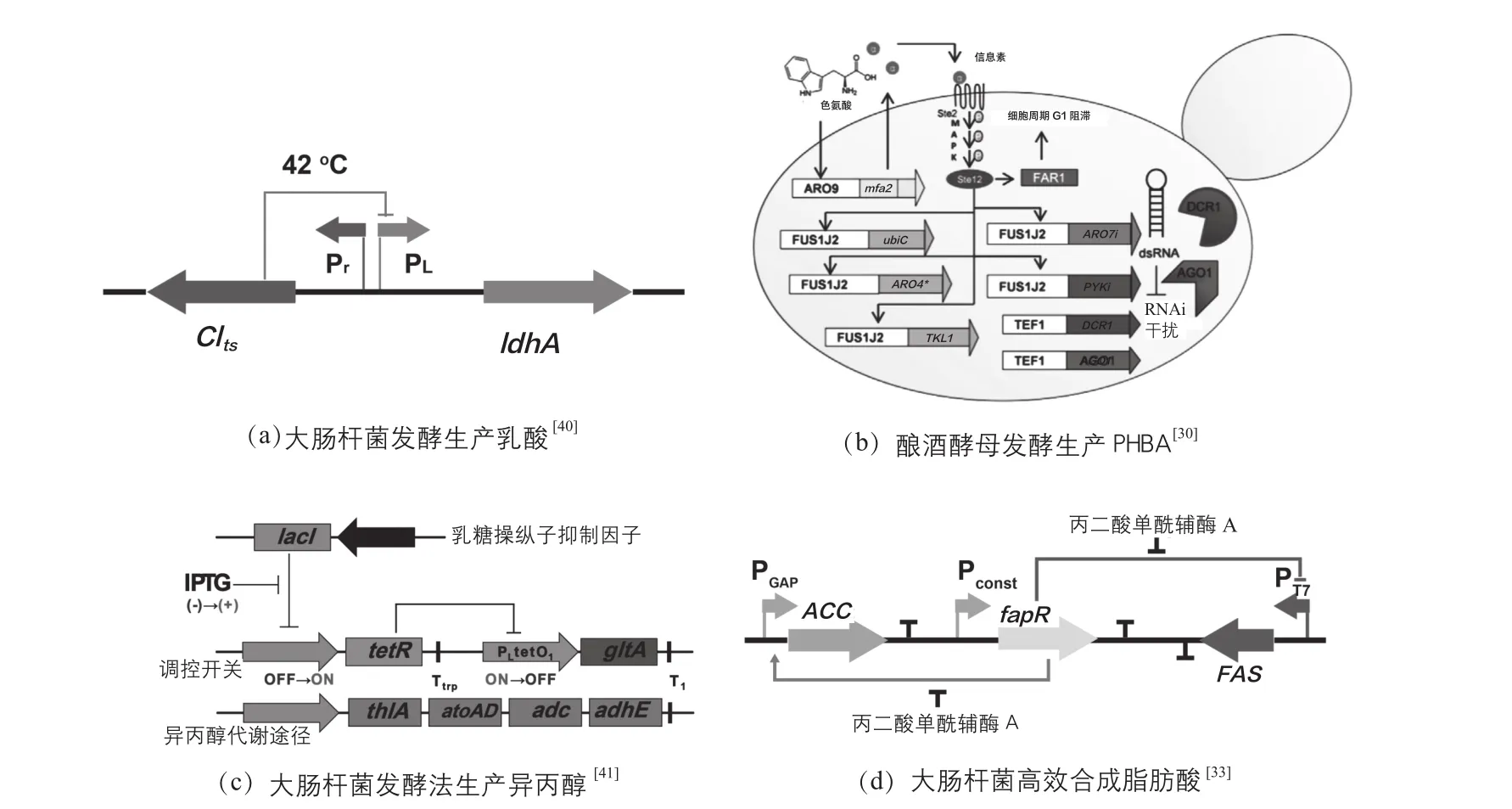
图2 动态代谢工程
5.4 动态调控策略的问题
持续动态调控策略虽然能够很有效地提高微生物发酵的生产强度和效率,但是由于调控元件的特异性,这类元件很难应用于其他产品中,因此针对特定的化合物研究者还需要花费大量时间和精力去开发、寻找新的调控元件[9,29,40,42]。同时,由于合成生物学技术的限制,动态代谢工程尚存在诸多待改进的地方:①部分动态调控策略使用的基因开关的起始需要添加诱导剂或者改变培养条件,增加调控系统的不稳定性;②众多的调控系统还建立于质粒水平,相对来说质粒的遗传稳定性较差,容易丢失;③在细胞中构建群体感应调控系统,一般需要合成额外的信号物质,增加了菌体的负担;④部分特殊代谢途径的关闭需要消耗特定的生物大分子,导致代谢途径不能被及时调控;⑤基因水平的动态调控,虽然可以在很短时间内关闭相关基因的表达,但已存在的酶和蛋白往往需要几个小时或者更长的时间才会失活。因此,动态调控策略还有待继续完善,需要综合考虑转录水平、翻译水平和翻译后水平。近年来,动态调控受到越来越多研究者的关注。目前,过程水平的两阶段调控已广泛应用于工业生产。
6 展 望
代谢反应速率受到很多因素的影响,包括中间代谢物的浓度、途径酶表达的水平、酶的催化能力等。目前代谢工程的研究主要都集中于控制不同途径酶的表达水平来平衡各个代谢途径,比如模块代谢工程。然而很少研究途径酶自身的性质,如与底物的结合能力等,往往这些不确定的因素就导致了限速步骤的产生。因此,系统地将酶工程和代谢工程相结合,将有利于突破产物合成途径的瓶颈。
随着合成生物学技术的发展,新的基因编辑工具的陆续出现,给研究者提供了更多的方法来系统探究细胞基因组综合改造或者遗传上的重新编码对微生物发酵或者生产能力的影响。如在真核细胞内,RNA干扰技术已经发展成为一种便捷有效的调节基因表达的工具;在原核细胞内,反义RNA技术、小RNA调控技术、CRISPR技术等也提供了有效的基因编辑工具,促进了胞内代谢网络及调控机制的解析。随着新的调控机制的阐明和调控元件的开发,动态代谢工程将会成为构建微生物细胞工厂和代谢调控的重要方法。
[1] PADDON C J,WESTFALL P J,PITERA D J,et al. High-level semi-synthetic production of the potent antimalarial artemisinin [J]. Nature,2013,496(7446):528-532.
[2] FOSSATI E,EKINS A,NARCROSS L,et al. Reconstitution of a 10-gene pathway for synthesis of the plant alkaloid dihydrosanguinarine in Saccharomyces cerevisiae [J]. Nat Commun,2014,5:3283.
[3] SAXENA R K,ANAND P,SARAN S,et al. Microbial production of 1,3-propanediol:recent developments and emerging opportunities [J]. Biotechnology Advances,2009,27(6):895-913.
[4] SONG H,LEE S Y. Production of succinic acid by bacterial fermentation [J]. Enzyme and Microbial Technology,2006,39(3):352-361.
[5] YIM H,HASELBECK R,NIU W,et al. Metabolic engineering of Escherichia coli for direct production of 1,4-butanediol [J]. Nature Chemical Biology,2011,7(7):445-452.
[6] ATSUMI S,HANAI T,LIAO J C. Non-fermentative pathways for synthesis of branched-chain higher alcohols as biofuels [J]. Nature,2008,451(7174):86-89.
[7] LIU Y F,SHIN H D,LI J H,et al. Toward metabolic engineering in the context of system biology and synthetic biology:advances and prospects[J]. Applied Microbiology and Biotechnology,2015,99(3):1109-1118.
[8] LIU L,LIU Y F,SHIN H D,et al. Developing Bacillus spp. as a cell factory for production of microbial enzymes and industrially important biochemicals in the context of systems and synthetic biology[J]. Applied Microbiology and Biotechnology,2013,97(14):6113-6127.
[9] VENAYAK N,ANESIADIS N,CLUETT W R,et al. Engineering metabolism through dynamic control[J]. Curr Opin Biotechnol,2015,34:142-152.
[10] 张学礼. 代谢工程发展20年[J]. 生物工程学报,2009,25:1285-1295.
[11] ZHOU S,YOMANO L P,SHANMUGAM K T,et al. Fermentation of 10%(w/v) sugar to D(-)-lactate by engineered Escherichia coli B[J]. Biotechnology Letters,2005,27(23-24):1891-1896.
[12] JANTAMA K,ZHANG X,MOORE J C,et al. Eliminating side products and increasing succinate yields in engineered strains of Escherichia coli C [J]. Biotechnology and Bioengineering,2008,101(5):881-893.
[13] LEE J H,JUNG S C,BUI L M,et al. Improved production of L-threonine in Escherichia coli by use of a DNA scaffold system [J]. Applied and Environmental Microbiology,2013,79(3):774-782.
[14] DUEBER J E,WU G C,MALMIRCHEGINI G R,et al. Synthetic protein scaffolds provide modular control over metabolic flux [J]. Nature Biotechnology,2009,27(8):753-759.
[15] DELEBECQUE C J,SILVER P A,LINDNER A B. Designing and using RNA scaffolds to assemble proteins in vivo[J]. Nature Protocols,2012,7(10):1797-1807.
[16] CONRADO R J,WU G C,BOOCK J T,et al. DNA-guided assembly of biosynthetic pathways promotes improved catalytic eff ciency [J]. Nucleic Acids Research,2012,40(4):1879-1889.
[17] AGAPAKIS C M,BOYLE P M,SILVER P A. Natural strategies for the spatial optimization of metabolism in synthetic biology[J]. Nature Chemical Biology,2012,8(6):527-535.
[18] WANG Y C,YU O. Synthetic scaffolds increased resveratrol biosynthesis in engineered yeast cells [J]. Journal of Biotechnology,2012,157(1):258-260.
[19] XU P,GU Q,WANG W Y,et al. Modular optimization of multigene pathways for fatty acids production in E. coli [J]. Nature Communications,2013,4:8.
[20] BIGGS B W,DE PAEPE B,SANTOS C N S,et al. Multivariate modular metabolic engineering for pathway and strain optimization [J]. Current Opinion in Biotechnology,2014,29:156-162.
[21] YOO S M,NA D,LEE S Y. Design and use of synthetic regulatory small RNAs to control gene expression in Escherichia coli [J]. Nature Protocols,2013,8(9):1694-1707.
[22] NA D,YOO S M,CHUNG H,et al. Metabolic engineering of Escherichia coli using synthetic small regulatory RNAs [J]. Nature Biotechnology,2013,31(2):170-174.
[23] LIU Y F,ZHU Y Q,LI J H,et al. Modular pathway engineering of Bacillus subtilis for improved N-acetylglucosamine production[J]. Metabolic Engineering,2014,23:42-52.
[24] WU J J,LIU P R,FAN Y M,et al. Multivariate modular metabolic engineering of Escherichia coli to produce resveratrol from L-tyrosine [J]. Journal of Biotechnology,2013,167(4):404-411.
[25] WU J J,ZHOU T T,Du G C,et al. Modular optimization of heterologous pathways for de novo synthesis of (2S)-naringenin in Escherichia coli[J]. PLoS One,2014,9(7):9.
[26] PARK J H,LEE K H,KIM T Y,et al. Metabolic engineering of Escherichia coli for the production of L-valine based on transcriptome analysis and in silico gene knockout simulation [J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(19):7797-7802.
[27] PARK S H,KIM H U,KIM T Y,et al. Metabolic engineering of Corynebacterium glutamicum for L-arginine production [J]. Nat Commun,2014,5:4618.
[28] ANESIADIS N,CLUETT W R,MAHADEVAN R. Dynamic metabolic engineering for increas ing bioprocess productivity [J]. Metabolic Engineering,2008,10(5):255-266.
[29] ZHUANG K,YANG L,CLUETT W R,et al. Dynamic strain scanning optimization:an efficient strain design strategy for balanced yield,titer,and productivity. DySScO strategy for strain design [J]. Bmc Biotechnology,2013,13:15.
[30] WILLIAMS T C,AVERESCH N J H,WINTER G,et al. Quorumsensing linked RNA interference for dynamic metabolic pathway control in Saccharomyces cerevisiae[J]. Metabolic Engineering,2015,29:124-134.
[31] ZHANG F Z,CAROTHERS J M,KEASLING J D. Design of a dynamic sensor-regulator system for production of chemicals and fuels derived from fatty acids[J]. Nature Biotechnology,2012,30(4):354-359.
[32] BROCKMAN I M,PRATHER K L J. Dynamic metabolic engineering:new strategies for developing responsive cell factories [J]. Biotechnology Journal,2015,10(9):1360-1369.
[33] XU P,LI L Y,ZHANG F M,et al. Improving fatty acids production by engineering dynamic pathway regulation and metabolic control [J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(31):11299-11304.
[34] WILLIAMS T C,ESPINOSA M I,NIELSEN L K,et al. Dynamic regulation of gene expression using sucrose responsive promoters and RNA interference in Saccharomyces cerevisiae[J]. Microbial Cell Factories,2015,14:10.
[35] ZHOU L,ZUO Z R,CHEN X Z,et al. Evaluation of genetic manipulation strategies on D-lactate production by Escherichia coli [J]. Current Microbiology,2011,62(3):981-989.
[36] YOVKOVA V,OTTO C,AURICH A,et al. Engineering the alphaketoglutarate overproduction from raw glycerol by overexpression of the genes encoding NADP(+)-dependent isocitrate dehydrogenase and pyruv ate carboxylase in Yarrowia lipolytica[J]. Applied Microbiology and Biotechnology,2014,98(5):2003-2013.
[37] 张海林,方芳,刘松. 强化解脂亚洛酵母菌体积累的α-酮戊二酸的pH调控策略[J]. 过程工程学,2017,17(1):86-90.
[38] ROSANO G L,CECCARELLI E A. Recombinant protein exp ression in Escherichia coli:advances and challenges[J]. Frontiers in Microbiology,2014,5:172.
[39] HOLTZ W J,KEASLING J D. Engineering static and dynamic control of synthetic pathways [J]. Cell,2010,140(1):19-23.
[40] ZHOU L,NIU D D,TIAN K M,et al. Genetically switched D-lactate production in Escherichia coli[J]. Metabolic Engineering,2012,14(5):560-568.
[41] SOMA Y,TSURUNO K,WADA M,et al. Metabolic flux redirection from a central metabolic pathway toward a synthetic pathway using a met abolic toggle switch [J]. Metabolic Engineering,2014,23:175-184.
[42] DAHL R H,ZHANG F,ALONSO-GUTIERREZ J,et al. Engineering dynamic pathway regulation using stress- response promoters [J]. Nature Biotechnology,2013,31(11):1039-1046.
Progress and prospect in microbial metabolic engineering
GU Yang1,LI Jianghua1,DU Guocheng1,2,CHEN Jian1,2,LIU Long1,2
1. Jiangnan University, Key Laboratory of Industrial Biotechnology, Ministry of Education, Wuxi 214122, China
2. Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Wuxi 214122, China
Metabolic engineering has been proven crucial for the construction of microbial cell factories. The main objective of metabolic engineering is to increase the titer, yield and productivity of target chemicals through genetic engineering. However, genetic manipulations usually result in lower productivity due to growth impairment. With the development of tools in synthetic biology, there has been increasing interest in the dynamic regulation of metabolic f ux to overcome the issues. Some metabolic engineering strategies allow trade-offs between growth and production to be better managed and can help avoid build-up of undesired intermediates. This paper summarizes the recent progress in the metabolic engineering and also prospects the future trends in this f eld.
metabolic engineering; metabolic control; synthetic biology; fermentation
10.3969/j.issn.1674-0319.2017.01.010
顾洋,博士研究生。研究方向:代谢工程。
E-mail:857597623@qq.com
国家优秀青年基金(31622001),自然基金面上项目(31671845)