光合生产植物天然产物的代谢工程蓝藻研究现状
2017-02-24倪俊陶飞许平
倪俊,陶飞,许平
上海交通大学生命科学技术学院,上海 200240
光合生产植物天然产物的代谢工程蓝藻研究现状
倪俊,陶飞,许平
上海交通大学生命科学技术学院,上海 200240

许平,微生物代谢国家重点实验室副主任,上海交通大学特聘教授,美国国家发明家科学院(NAI)院士,美国生物医学工程院(AIMBE)会士。担任SCI期刊如《Engineering in Life Sciences》编辑和《Scientific Reports》、《Process Biochemistry》、《Bioprocess and Biosystems Engineering》、《Biodegradation》等杂志的编委。近年主要从事环境与工业微生物技术的研究,在污染环境的生物修复天然食品添加剂发酵和生物催化生产技术等方面取得多项原创性的重要成果。E-mail:pingxu@sjtu.edu.cn
蓝藻是植物天然产物光合生产的理想平台,它们不仅具有遗传背景简单、营养需求低和高CO2固定效率等优势,还可以解决生物法制备天然产物所面临的植物源酶适配性、还原力供应和对昂贵底物依赖等限制因素。介绍了近年来利用蓝藻光合生产植物天然产物及前体物质的最新研究进展和发展趋势,分析了蓝藻生产天然产物的优势,为进一步开发天然产物的光合平台提供指导,并对产业化发展方向进行了展望。
蓝藻;植物天然产物;合成生物学;代谢工程;光合微生物
植物次生代谢物在其生长发育、环境适应、抵御病虫害等方面发挥着重要作用,根据其合成路径的差异,可以分为生物碱类、萜类、苯丙烷类。这些天然产物通常具有特殊生物活性,被广泛应用于医药、轻化工、食品及农药等领域[1]。目前有75%抗感染性疾病药物和超过60%的抗癌药来源于天然产物或其类似物,这些天然产物大多属于植物次生代谢物[2]。如紫杉醇是目前最有效的天然抗癌药物之一,青蒿素是一种抗疟疾药。植物天然产物主要从天然植物中提取,但是由于种植面积有限、生长慢、化合物含量低和分子类似物多等限制,使得产量难以满足市场需求[3]。化学合成法产量较高,但副产物多导致分离相对困难,生产过程也会给环境带来较大压力[4]。同时,化学法获得的天然产物通常价格较低,如合成香兰素一般在15美元/千克左右,而天然香兰素价格约比其高300倍[5]。
合成生物学和代谢工程是未来生物技术经济的主要推动力,为生物法制备天然产物带来了新契机,其具有环境友好、生产周期短、易于工业化放大生产、产量相对较高、产物易于分离纯化和不依赖于气候、土地等诸多优势[6]。生物法制备植物天然产物通常依赖昂贵的前体物质,较高底物成本限制了其应用。近年,在微生物中人工设计合成途径,利用葡萄糖等廉价碳源合成植物天然产物已成为现实[7]。然而,植物源酶适配性、还原力和能量供应等限制因素的存在,使得生产效率并不高。同时,底物成本依然是生产成本不可忽视的部分。因此,尽管生物法制备香兰素发展较快,但实现经济可持续的生产仍是巨大的挑战,而光合微生物的引入为天然产物生产带来了新契机。
1 蓝藻是植物天然产物生产的理想宿主
光合微生物蓝藻用于光合生产有许多优势,如细胞结构简单、易于基因操作、生长速度较快、不受气候和土地限制等[8]。尤为重要的是,蓝藻具有较高的太阳能利用效率,比大多数微生物的营养需求低,仅需要太阳能、水、CO2、N和P等无机营养,不依赖于有机碳源[9]。这使得其得到广泛的关注,并用于生产生物燃料和大宗化学品,如正丁醇、异丁醛、2,3-丁二醇、脂肪酸和异丙醇等[10]。
蓝藻在生产植物天然产物方面有着许多与生俱来的独特优势。在植物天然产物的合成过程中,涉及到许多植物酶,其中细胞色素P450单加氧酶对苯丙烷类、生物碱类和萜类等天然产物的合成至关重要。然而,许多真核生物的 P450单加氧酶都是膜结合蛋白,难以在大肠杆菌等大多数原核微生物中异源表达,因为这类微生物缺少内生的膜系统[11]。蓝藻与大多数原核微生物不同,其细胞内拥有类囊体膜系统,使得植物源P450单加氧酶可以功能性的表达。先前的研究也证实了这一点,Xue等[12]在蓝藻Synechocystis sp. PCC6803中功能性表达了 拟南芥(Arabidopsis thaliana)P450对香豆酸-3-羟化酶,成功将对香豆酸转化为咖啡酸。经过免疫印迹分析,发现对香豆酸氢化酶定位于工程菌的类囊体。Ni等[13]在蓝藻Synechococcus elongatus PCC7942中表达了相同的P450单加氧酶,利用分离出的类囊体测定了对香豆酸氢化酶的酶活,进一步确定了植物P450在蓝藻中的功能性表达。值得注意的是,蓝藻有许多代谢途径与植物相近,在大多数蓝藻基因组中也存在P450序列,如Synechocystis PCC6803中的cyp120A1/slr0574[14],Anabaena sp. PCC7120中有6个P450基因[15]。此外,植物天然产物的合成通常需要消耗大量还原力和能量,而大肠杆菌等大多数微生物中还原力和能量不足以支撑这些天然产物的合成。但蓝藻光合作用的效率要高于陆生植物,可以利用太阳能产生大量的ATP和NADPH,从而利用这些化学能和还原力推动许多天然产物的合成[16]。
2 利用蓝藻生产植物天然产物
基于合成生物学和代谢工程的理念,在光合微生物中可以设计和重构植物天然产物的合成途径,已经成功生产了多种植物天然产物及前体物质(表1)。这些外源途径通常基于蓝藻的光合作用,与初级代谢相连接(图1)。
2.1 萜类化合物
萜类化合物是异戊二烯(C10H16)的聚合体及其含氧的饱和程度不等的衍生物,是许多中草药中的有效成分,同时也是化妆品和食品工业不可缺少的原料。其中,萜类的单体异戊二烯是重要的工业原料,可通过聚合合成橡胶、塑料以及萜烯类化合物[32]。Lindberg等[17]在蓝藻 Synechocystis sp. PCC6803中表达了葛麻姆(Pueraria montana)中的 异戊二烯合酶基因( ispS),成功获得了异戊二烯,通过对ispS进行密码子优化和启动子psbA2的使用,使得产率达到 2.1μg/[(g DCW)·h]。Bentley等[18]在 Synechocystis sp. PCC6803中表达了粪肠球菌(Enterococcus faecalis)和肺炎链球菌(Streptococcus pneumoniae)中甲羟戊酸途径(MVA pathway)的7个基因,使碳流更多引向异戊二烯的前体异戊烯二磷酸(IPP)和二甲基烯丙基二磷酸酯(DMAPP)。异源表达异戊二烯合酶基因后,相比于仅含有自身非甲羟戊酸途径(MEP pathway)的Synechocystis sp. PCC6803,MVA途径的引入可以使得异戊二烯的光合产量提高约2.5倍。Gao等[19]将不同来源的异戊二烯合酶引入S. elongatus PCC7942,发现蓝桉树(Eucalyptus globulus)来源的ispS比其他来源的基因在蓝藻中可溶性表达更好。随后,他们利用动态代谢流分析揭示MEP途径的瓶颈,构建了异戊二烯焦磷酸异构酶(IDI)和IspS融合酶并高表达了 1-脱氧-D-木酮糖5-磷酸合酶基因(dxs)和4-羟基-3-甲基-2-烯基二磷酸合酶基因(ispG),重组菌株可以在21d光合生产1.26g/L异戊二烯。柠檬烯是一种重要的萜类香料,并且具有显著的生物活性,用途广泛。Kiyota等[20]在Synechocystis sp. PCC6803中表达了荆芥(Schizonepeta tenuifolia)的 柠檬烯合酶基因(lms),重组菌株每天可以光合生产41μg/L柠檬烯。通过过表达MEP途径中的dxs、crtE和ipi基因来增加柠檬烯合成的底物牻牛儿基焦磷酸(GPP)的供应,使得柠檬烯的光合产量提高了1.4倍。Halfmann等[21]在Anabaena sp. PCC7120中表达了北美云杉(Sitka spruce)的柠檬烯合酶基因,同时引入了DXP操纵单元(dxs-ipphp-gpps)来高表达MEP途径的限速酶,重组菌株的柠檬烯产率可达到3.6μg/(L·O.D.·h) 左右。Davies等[22]在Synechococcus sp. PCC 7002中表达了留兰香(Mentha spicata)的柠檬烯合酶基因或者巨冷杉(Abies grandis)的α- 红没药烯合酶基因(bis),分别可以得到4mg/L的 柠檬烯和0.6mg/L的 红没药烯,生产过程中,十二烷膜的使用可能会解除反馈抑制,使得柠檬烯和红没药烯的产量进一步提高。Bentley等[23]在Synechocystis sp. PCC6803中表达密码子优化后的薰衣草(Lavandula angustifolia)β-水芹烯合酶基因,重组菌可以光合合成133mg/g DCW水芹烯。Formighieri等[24]将β-水芹烯合酶与占细胞内总蛋白20%的藻青蛋白β亚基在Synechocystis sp. PCC6803中进行融合表达,同时引入甲羟戊酸途径和牻牛儿基焦磷酸合酶,使得进入萜类合成途径的碳流增加,重组菌可以在48h内光合生产10mg/g DCW水芹烯。Reinsvold等[25]将青蒿(Artemisia annua)的β-石竹烯合酶基因在Synechocystis sp. PCC6803中表达,光合合成了约4mg/g DCW的石竹烯。Halfmann等[26]在Anabaena sp. PCC7120中表达了密码子优化的法呢烯合酶基因,光合生产了法呢烯,产率达到(69.1±1.8)μg/(L·O.D.·d)。Kudoh等[27]在Synechocystis sp. PCC6803中过表达了1-脱氧-D-木酮糖5-磷酸合酶基因,使得多烯色素类胡萝卜素的含量比野生型菌株提高了1.5倍。

表1 基因工程蓝藻生产的植物天然产物
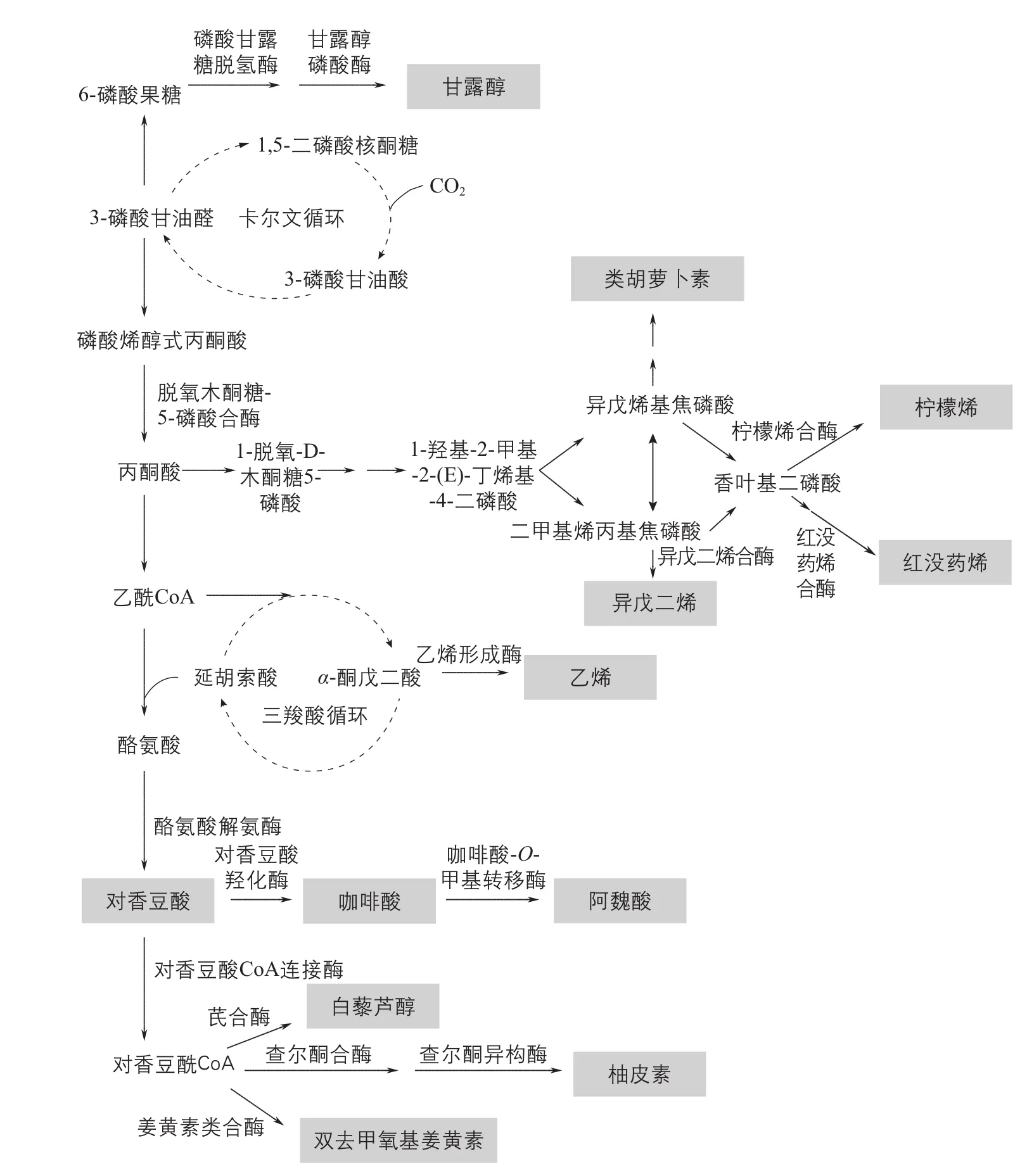
图1 蓝藻中重构植物天然产物合成途径
2.2 苯丙烷类化合物
苯丙烷类化合物及其衍生物涵盖了植物中多数的天然芳香族化合物,这类化合物可以广泛用于药物、保健品、调味剂、香料和激素等[33]。Xue等[12]在蓝藻Synechocystis sp. PCC6803中表达了拟南芥的对香豆酸氢化酶基因(ref8),将对香豆酸转化为7.2mg/L的咖啡酸,证实蓝藻可以功能性表达植物P450单加氧酶,适于合成其他微生物难以生产的植物天然产物。Xue等[28]在Synechocystis sp. PCC6803表达了西班牙糖丝菌(Saccharothrix espanaensis)的酪氨酸解氨酶基因(sam8),使得蓝藻初级代谢的酪氨酸进入苯丙烷类合成途径,得到大量对香豆酸脱羧产物4-乙烯基苯酚的聚合物,在对蓝藻自身的漆酶基因(slr1573)进行敲除后,重组菌株在添加葡萄糖的情况下成功合成82.6mg/L的对香豆酸。Ni等[13]的研究表明大多数苯丙烷类物质可以在蓝藻中顺利合成,他们在S. elongatus PCC7942中表达比较了不同来源酪氨酸解氨酶的活性,同时,引入解反馈的3-脱氧-D-阿拉伯庚酮糖-7-磷酸合成酶基因(aroGfbr),使得碳流更多进入芳香化合物的合成,在不添加有机碳源的情况下,重组菌株可以在12d内光合合成128.2mg/L的对香豆酸。拟南芥中对香豆酸-3-羟化酶的编码基因(ref8)和咖啡酸-O-甲基转移酶的编码基因(comt)的依次引入,使得重组菌可以分别光合合成4.7mg/L咖啡酸和6.3mg/L阿魏酸。随后,欧芹(Petroselinum crispum)中对香豆酰辅酶A连接酶基因(4cl)分别与矮牵牛(Petunia hybrida)中查耳酮合酶基因(chs)、落花生(Arachis hypogaea)中芪合酶基因(sts)和水稻(Oryza sativa)中姜黄素合酶基因(cus)进行融合表达,并分别引入对香豆酸生产菌株,光合合成了柚皮素、白藜芦醇和双去甲氧基姜黄素;浅蓝菌素可以抑制脂肪酸的合成,从而增加这些苯丙烷类合成所需丙二酰CoA的供给,使得柚 皮素、白藜芦醇和双去甲氧基姜黄素产量分别达到4.6mg/L,7.1mg/L和4.1mg/L。
2.3 其他天然产物
除了萜类和苯丙烷类化合物,蓝藻还用作光合合成其他多种植物天然产物。Takahama等[29]在S. elongatus PCC7942表达了丁香假单胞菌(Pseudomonas syringae)中的乙烯形成酶基因(efe),光 合合成了约512μg/(L·O.D.·h)的乙烯。Jindou等[30]利用嗜热纤维梭菌(Clostridium thermocellum)和解纤维醋弧菌(Acetivibrio cellulolyticus)中的黏合锚定蛋白将番茄(Solanum lycopersicum)中的两个乙烯形成酶进行连接,并在S. elongatus PCC7942中进行表达,光合合成约3.9μg/(L·O.D.·h)的乙烯。J acobsen等[31]在Synechococcus sp. PCC7002中表达了大肠杆菌的磷酸甘露醇脱氢酶基因(mtlD)和艾美球虫(Eimeria tenella)的甘露醇磷酸酶基因(mlp),每天可以光合生产0.15g/L的甘露醇。将糖原合成途径失活后,甘露醇的产量可以提高3.2倍。Dong等[34]在Synechococcus sp. PCC7002中表达了S ynechocystis sp. PCC6803中的Δ15去饱和酶和Δ6去饱和酶,当表达Δ15去饱和酶时,α-亚麻酸的量比野生型提高了5.4倍;表达Δ6去饱和酶时,重组菌可以同时光合合成γ-亚麻酸(GLA)和亚麻油酸(SDA);共表达Δ15去饱和酶和Δ6去饱和酶可以使得亚麻油酸的量占到总脂肪酸量的11.64%。
3 适于植物天然产物光合生产的定向改造
许多蓝藻已经可以进行外源基因表达,成功光合生产植物天然产物,以下介绍蓝藻生产植物天然产物时,值得考虑的几点因素。糖原是蓝藻中碳的主要储存形式,当蓝藻在缺氮培养时,糖原可占细胞干重的60%[35]。因此,将糖原合成途径阻断,可以使得碳更多流向产物合成。如Jacobsen等[31]在Synechococcus sp. PCC7002中表达了甘露醇的合成途径,使得甘露醇达到细胞干重的10%,当阻断糖原合成途径时,甘露醇的量提高到细胞干重的32%。漆酶存在于许多物种,可以将多种酚类化合物氧化为不稳定的自由基,发生水合、聚合和歧化等非酶促反应[36]。尽管关于蓝藻中漆酶功能的研究较少,但这些酶可能会对苯丙烷类物质的合成产生影响。如Xue等[28]对Synechocystis sp. PCC6803中潜在的漆酶基因slr1573进行了敲除,使得含有酪氨酸解氨酶基因的重组菌株对香豆酸的产量提高了25倍。光合生产植物天然产物时,重组蓝藻的稳定性也应该加以考虑,有一些研究表明重组蓝藻并不稳定。Takahama等[29]在生产乙烯的重组S. elongatus PCC7942中发现乙烯合酶基因中的重复序列被截短,使得基因失去功能。Kusakabe等[37]在S. elongatus PCC7942中表达了丙酮丁醇梭菌(Clostridium acetobutylicum)、拜氏梭菌(Clostridium beijerinckii)和大肠杆菌中异丙醇合成的4个基因,他们重复发现atoD基因发生突变,导致酶活降低。天然产物的生产过程通常需要涉及P450单加氧酶,这类酶需要还原力的驱动,可以将这些酶与电子传递链相连接,以提高效率。Lassen等[38]对高粱(Sorghum bicolor)P450单加氧酶CYP79A1进行了研究,他们将CYP79A1的催化区域与Synechococcus sp. PCC 7002的光合体系I亚单元相连接,锚定至类囊体,光合电子传递链推动了酶促反应的进行,将酪氨酸转化为羟基苯乙醛肟。
4 展 望
蓝藻作为合成生物学的底盘具有一系列良好的特质,已经用于合成生物燃料和大宗化学品[39-40]。然而,由于这类物质低廉的价格,使得相关技术的工业化进展缓慢。欧洲藻类生物质协会预计,藻类生物燃料从实验室走向工业化规模生产还需要10~15年的时间。植物天然产物的相对经济价值通常远远高于生物燃料等化学品,光合生产高值植物天然产物可以避免成本高而难于商业化应用的问题[41]。近年来,蓝藻光合生产植物天然产物已经获得了令人振奋的进展,然而,蓝藻光合效率的优化和合成产物的外排等方面仍需要进一步研究。同时,功能基因组学、代谢模型构建等系统生物学手段也有助于蓝藻代谢网络的改造。随着合成生物学和代谢工程的不断发展,蓝藻可以更加高效地合成价值高昂的植物天然产物,人类对于健康和环境的日益关注会使得相关研究走向大规模工业化应用,这也将为生物燃料和大宗化学品的规模化高效生产奠定基础。
[1] ACAMOVIC T,BROOKER J D. Biochemistry of plant secondary metabolites and their effects in animals[J]. Proceedings of the Nutrition Society,2005,64(03):403-412.
[2] CRAGG G M,NEWMAN D J. Nature:a vital source of leads for anticancer drug development[J]. Phytochemistry Reviews,2009,8(2):313-331.
[3] VERPOORTE R,CONTIN A,MEMELINK J. Biotechnology for the production of plant secondary metabolites[J]. Phytochemistry Reviews,2002,1(1):13-25.
[4] XU P,HUA D L,MA C Q. Microbial transformation of propenylbenzenes for natural f avour production[J]. Trends in Biotechnology,2007,25(12):571-576.
[5] B ROCHADO A R,MATOS C,MØLLER B L,et al. Improved vanillin production in baker’s yeast through in silico design[J]. Microbial Cell Factories,2010,9(1):84-98.
[6] S HAW A J,LAM F H,HAMILTON M,et al. Metabolic engineering of microbial competitive advantage for industrial fermentation processes[J]. Science,2016,353(6299):583-586.
[7] HAWKINS K M,SMOLKE C D. Production of benzylisoquinoline alkaloids in Saccharomyces cerevisiae[J]. Nature Chemical Biology,2008,4(9):564-573.
[8] DUCAT D C,WAY J C,SILVER P A. Engineering cyanobacteria to generate high-value products[J]. Trends in Biotechnology,2011,29(2):95-103.
[9] YU Y,YOU L,LIU D Y,et al. Development of Synechocystis sp. PCC 6803 as a phototrophic cell factory[J]. Marine Drugs,2013,11(8):2894-2916.
[10] OLIVER N J,RABINOVITCH-DEERE C A,CARROLL A L,et al. Cyanobacterial metabolic engineering for biofuel and chemical production[J]. Current Opinion in Chemical Biology,2016,35:43-50.
[11] WALKER K,CROTEAU R. Taxol biosynthetic genes[J]. Phytochemistry,2001,58(1):1-7.
[12] XUE Y,ZHANG Y,GRACE S,et al. Functional expression of an Arabidopsis p450 enzyme,p-coumarate-3-hydroxylase,in the cyanobacterium Synechocystis PCC 6803 for the biosynthesis of caffeic acid[J]. Journal of Applied Phycology,2014,26(1):219-226.
[13] NI J,TAO F,WANG Y,et al. A photoautotrophic platform for the sustainable production of valuable plant natural products from CO2[J]. Green Chemistry,2016,18:3537-3548.
[14] KE N,BAUDRY J,MAKRIS T M,et al. A retinoic acid binding cytochrome P450:CYP120A1 from Synechocystis sp. PCC 6803[J]. Archives of Biochemistry and Biophysics,2005,436(1):110-120.
[15] ROBERT F O,PANDHAL J,WRIGHT P C. Exploiting cyanobacterial P450 pathways[J]. Current Opinion in Microbiology,2010,13(3):301-306.
[16] NIELSEN A Z,ZIERSEN B,JENSEN K,et al. Redirecting photosynthetic reducing power toward bioactive natural product synthesis[J]. ACS Synthetic Biology,2013,2(6):308-315.
[17] LINDBERG P,PARK S,MELIS A. Engineering a platform for photosynthetic isoprene production in cyanobacteria,using Synechocystis as the model organism[J]. Metabolic Engineering,2010,12(1):70-79.
[18] BENTLEY F K,ZURBRIGGEN A,MELIS A. Heterologous expression of the mevalonic acid pathway in cyanobacteria enhances endogenous carbon partitioning to isoprene[J]. Molecular Plant,2014,7(1):71-86.
[19] GAO X,GAO F,LIU D,et al. Engineering the methylerythritol phosphate pathway in cyanobacteria for photosynthetic isoprene production from CO2[J]. Energy & Environmental Science,2016,9(4):1400-1411.
[20] KIYOTA H,OKUDA Y,ITO M,et al. Engineering of cyanobacteria for the photosynthetic production of limonene from CO2[J]. Journal of Biotechnology,2014,185:1-7.
[21] HALFMANN C,GU L,ZHOU R. Engineering cyanobacteria for the production of a cyclic hydrocarbon fuel from CO2and H2O[J]. Green Chemistry,2014,16(6):3175-3185.
[22] DAVIES F K,WORK V H,BELIAEV A S. Engineering limonene and bisabolene production in wild type and a glycogendeficient mutant of Synechococcus sp. PCC 7002[J]. Frontiers in Bioengineering and Biotechnology,2014,2:21.
[23] B ENTLEY F K,GARCÍA-CERDÁN J G,CHEN H C. Paradigm of monoterpene(β-phellandrene)hydrocarbons production via photosynthesis in cyanobacteria[J]. BioEnergy Research,2013,6(3):917-929.
[24] FORMIGHIERI C,MELIS A. Sustainable heterologous production of terpene hydrocarbons in cyanobacteria[J]. Photosynthesis Research,2016,130(1):123-135.
[25] REINSVOLD R E,JINKERSON R E,RADAKOVITS R,et al. The production of the sesquiterpene β-caryophyllene in a transgenic strain of the cyanobacterium Synechocystis[J]. Journal of Plant Physiology,2011,168(8):848-852.
[26] HALFMANN C,GU L,GIBBONS W,et al. Genetically engineering cyanobacteria to convert CO2,water,and light into the long-chain hydrocarbon farnesene[J]. Applied Microbiology and Biotechnology,2014,98(23):9869-9877.
[27] KUDOH K,KAWANO Y,HOTTA S,et al. Prerequisite for highly eff cient isoprenoid production by cyanobacteria discovered through the over-expression of 1-deoxy-d-xylulose 5-phosphate synthase and carbon allocation analysis[J]. Journal of Bioscience and Bioengineering,2014,118(1):20-28.
[28] XUE Y,ZHANG Y,CHENG D,et al. Genetically engineering Synechocystis sp. Pasteur Culture Collection 6803 for the sustainable production of the plant secondary metabolite p-coumaric acid[J]. Proceedings of the National Academy of Sciences,2014,111(26):9449-9454.
[29] TAKAHAMA K,MATSUOKA M,NAGAHAMA K,et al. Construction and analysis of a recombinant cyanobacterium expressing a chromosomally inserted gene for an ethyleneforming enzyme at the psbAI locus[J]. Journal of Bioscience and Bioengineering,2003,95(3):302-305.
[30] JINDOU S,ITO Y,MITO N,et al. Engineered platform for bioethylene production by a cyanobacterium expressing a chimeric complex of plant enzymes[J]. ACS Synthetic Biology,2014,3(7):487-496.
[31] JACOBSEN J H,FRIGAARD N U. Engineering of photosynthetic mannitol biosynthesis from CO2in a cyanobacterium[J]. Metabolic Engineering,2014,21:60-70.
[32] SHARKEY T D,WIBERLEY A E,DONOHUE A R. Isoprene emission from plants:why and how[J]. Annals of Botany,2008,101(1):5-18.
[33] WEISSHAAR B,JENKINS G I. Phenylpropanoid biosynthesis and its regulation[J]. Current Opinion in Plant Biology,1998,1(3):251-257.
[34] DONG X,HE Q,PENG Z,et al. Production of γ-linolenic acid and stearidonic acid by Synechococcus sp. PCC7002 containing cyanobacterial fatty acid desaturase genes[J]. Chinese Journal of Oceanology and Limnology,2015,34(4):772-780.
[35] ALLEN M M,SMITH A J. Nitrogen chlorosis in blue-green algae[J]. Archiv für Mikrobiologie,1969,69(2):114-120.
[36] THURSTON C F. The structure and function of fungal laccases[J]. Microbiology,1994,140(1):19-26.
[37] KUSAKABE T,TATSUKE T,TSURUNO K,et al. Engineering a synthetic pathway in cyanobacteria for isopropanol production directly from carbon dioxide and light[J]. Metabolic Engineering,2013,20:101-108.
[38] LASSEN L M,NIELSEN A Z,OLSEN C E,et al. Anchoring a plant cytochrome P450 via PsaM to the thylakoids in Synechococcus sp. PCC 7002:evidence for light-driven biosynthesis[J]. PLoS One,2014,9(7):e102184.
[39] ATSUMI S,HIGASHIDE W,LIAO J C. Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde[J]. Nature Biotechnology,2009,27(12):1177-1180.
[40] OLIVER J W,MACHADO I M,YONEDA H,et al. Cyanobacterial conversion of carbon dioxide to 2,3-butanediol[J]. Proceedings of the National Academy of Sciences,2013,110(4):1249-1254.
[41] DUCAT D C,WAY J C,SILVER P A. Engineering cyanobacteria to generate high-value products[J]. Trends in Biotechnology,2011,29(2):95-103.
Photosynthetic production of plant natural products in genetically engineered cyanobacteria
NI Jun,TAO Fei,XU Ping
School of Life Sciences & Biotechnology, Shanghai Jiao Tong University, Shanghai 200240, China
Cyanobacteria are photosynthetic microorganisms that have several advantages for producing plant natural products, such as simple input requirement, high solar conversion eff ciency, and being tractable for genetic engineering. Moreover, they can solve some limitations in biosynthesis of plant natural products, such as diff cult to express plant enzymes, require the addition of organic carbon feedstocks, and an inadequate supply of NADPH. The research progresses and development trend of the photosynthetic production of plant natural products are introduced. The review analyses the advantages of photosynthetic production of plant natural products in genetically engineered cyanobacteria, and supplies guidance for biosynthesis of natural products. Future developments of industrialization in photosynthetic production of plant natural products are prospected.
cyanobacteria; plant natural products; synthetic biology; metabolic engineering; photosynthetic microbe
10.3969/j.issn.1674-0319.2017.01.008
倪俊,微生物学博士,上海交通大学微生物代谢国家重点实验室博士后。主要从事高值植物天然产物微生物发酵和光合生产的研究。E-mail:tearroad@sjtu.edu.cn