AKAP12基因启动子甲基化在哈萨克族食管鳞癌中研究
2017-02-22耿月华杨立民卢晓梅刘美莲孟加榕
耿月华, 杨立民, 卢晓梅, 刘美莲, 孟加榕*
(1解放军175医院,厦门大学附属东南医院病理科,漳州 363000;2新疆医科大学第一附属医院临床医学研究院; *通讯作者,E-mail:mengjiarong@sina.com)
AKAP12基因启动子甲基化在哈萨克族食管鳞癌中研究
耿月华1, 杨立民1, 卢晓梅2, 刘美莲1, 孟加榕1*
(1解放军175医院,厦门大学附属东南医院病理科,漳州 363000;2新疆医科大学第一附属医院临床医学研究院;*通讯作者,E-mail:mengjiarong@sina.com)
目的 研究A激酶锚定蛋白12(A kinase anchoring protein 12,AKAP12)基因在哈萨克族食管鳞癌(esophageal squamous cell carcinoma,ESCC)中,是否发生高度甲基化及其与临床病理参数间的关系。 方法 应用甲基化特异性PCR(MSP)检测用5-aza-CdR处理及正常培养的食管鳞癌细胞系Eca109和18对哈萨克族食管鳞癌组织中AKAP12的甲基化状态。通过实时荧光定量PCR(RT-PCR)检测食管鳞癌细胞系Eca109和18对哈萨克族食管鳞癌组织中AKAP12的表达量。 结果 AKAP12在Eca109细胞系,5-aza-CdR处理组及正常培养组中甲基化率为0;在18对哈萨克族食管鳞癌组织中甲基化率为5.6%(1/18)。AKAP12在5-aza-CdR组表达量与对照组以β-actin为内参相差0.99倍(P=0.96),以GAPDH为内参相差1.93倍(P=0.47);在18对哈族食管鳞癌组织中,癌组织与癌旁组织表达量以β-actin为内参相差0.86倍(P=0.74),以GAPDH为内参相差2.87倍(P=0.11)。AKAP12表达量及甲基化率与性别、大体类型、分化程度及有无转移无相关性(P>0.05)。 结论 AKAP12在食管鳞癌中甲基化发生率低,与病理参数之间无相关性。
食管鳞癌; DNA甲基化; AKAP12
在世界范围内恶性肿瘤中,食管癌(esophagel cancer,EC)的发病率和致死率分别位于第8位和第6位[1],且其早期症状不明显,临床诊治大部分都处于中晚期,预后极差,5年生存率不足10%[2]。我国是食管癌的高发国家,占全球食管癌发病率的50%以上[3],亦是食管癌死亡率最高的国家,其死亡率仅次于胃癌居第二位[4]。食管癌的组织类型主要有两种:食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌(esophageal adenocacinoma,EAC),我国以ESCC为主。在我国食管癌中,新疆哈萨克族发病率较高,远高于全国平均水平[5]。
DNA 高度甲基化主要发生在基因启动子区域CpG小岛,导致基因转录失活或基因沉默(gene silencing),在基因表达调控、细胞增殖、分化及发育等方面起着重要的作用,并与肿瘤的发生、发展关系密切。基因启动子高度甲基化不改变蛋白质编码序列,但可以使基因转录表达失活,产生一系列基因的沉默,导致基因表达调控网络紊乱[6,7]。近年来,研究结果表明若干抑癌基因启动子CpG岛区域高度甲基化,与消化道肿瘤的形成密切相关。如通过对抑癌基因DNA甲基化研究,可能成为食管癌进行早期诊断、预防及治疗、预后的重要工具[8]。
A激酶锚定蛋白12(A kinase anchoring protein 12,AKAP12;或被认为酪氨酸抑制的蛋白激酶C底物(SSeCK)及Gravin)是多价锚定蛋白,最初是在重症肌无力患者血清中发现[9,10]。AKAP12定位于6q24-25.2,这个区域在人类癌症中经常发生基因的缺失[11,12]。最近研究报道,在胃癌、结肠癌中AKAP12启动子区CpG岛发生甲基化,同时显示在结直肠癌和胃癌细胞系,通过去甲基化试剂5杂氮2’脱氧胞苷(5-aza-2’-deoxycytidine,5-aza-CdR),可以逆转AKAP12启动子区甲基化,恢复表达[13,14]。本课题组成员前期实验用5-aza-CdR处理人食管鳞癌细胞系Eca109,发现其增殖速率降低,且呈现典型的凋亡细胞形态改变[15]。为了研究在哈萨克族食管鳞癌中AKAP12基因是否甲基化,本实验通过采用MSP及RT-PCR检测在食管鳞癌细胞系Eca109及哈萨克族食管鳞癌中AKAP12基因甲基化状态及表达量,并探讨AKAP12甲基化,5-aza-CdR处理组和正常培养组表达差异与哈萨克族食管鳞癌病理参数的相关性。
1 材料与方法
1.1 材料
1.1.1 标本来源 人食管鳞癌细胞株Eca109由中国科学院上海细胞生物研究所细胞库提供。18对组织样本取自2008-12~2011-07新疆医科大学第一附属医院胸外科行手术治疗的哈萨克族食管鳞癌患者。所有患者在手术前均未经过任何的放疗和化疗,且所有样本均经HE染色病理确诊为鳞癌,每例标本取肿瘤组织及其远端5 cm的正常食管组织,其中18对新鲜组织(离体后30 min内置于液氮保存)。所有患者均获得知情同意书,并且项目通过医院伦理委员会审核。
1.1.2 引物与试剂 RT-PCR、MSP引物由大连宝生物公司合成。小牛血清购自Gibico公司;DMEM培养基和Trizol试剂购自美国Invitrogen公司;5-aza-CdR购自美国Sigma公司; CpGenomeTMDNA Modification Kit(S7820)试剂盒购自chemicon 公司;反转录试剂盒、r-taq酶及SYBR Premix购自大连宝生物公司。
1.2 方法
甲基化特异性PCR(MSP)检测用5-aza-CdR处理的及正常培养的Eca109和18对哈萨克族ESCC组织中AKAP12的甲基化状态。通过RT-PCR检测Eca109和18对哈萨克族ESCC组织中AKAP12的表达量。
1.2.1 细胞培养及抑制剂处理 Eca109细胞用含5%小牛血清的DMEM培养基,在37℃、5%CO2培养箱中培养传代。按照1×105浓度接种在培养,瓶,培养24 h。在对数生长期的Eca109中加入10-4mol/L浓度的5-aza-CdR处理96 h,以不加抑制剂为阴性对照组,同步培养,收集细胞用于后续实验。
1.2.2 RNA提取 按1×106细胞,Trizol法提取总RNA并经检测符合RT-PCR要求;100 mg组织Trizol法提取组织总RNA符合RT-PCR要求。
1.2.3 DNA提取 按动物组织/细胞基因组DNA提取试剂盒说明书,提取哈族食管鳞癌及癌旁正常组织总DNA,用于后续实验。
1.2.4 AKAP12表达检测 利用反转录试剂盒将1 μg总RNA反转录为cDNA,进行RT-PCR反应,每个样本设2个复孔。AKAP12反应参数为95 ℃预变性3 min、95 ℃ 5 s、58 ℃ 30 s,荧光检测,反应35个循环;内参β-actin、GAPDH反应参数为95 ℃预变性10 min、95 ℃ 5 s、55 ℃ 30 s,荧光检测,反应35个循环。绘制溶解曲线,记录每个反应管中的荧光信号值,利用每组与内参SQ Mean比值,计算食管鳞癌细胞系、食管鳞癌组织中AKAP12表达量。
1.2.5 AKAP12甲基化检测(MSP检测) 取1 μg DNA加入3 mol/L NaOH进行解链,之后用CpGenomeTMDNA Modification Kit(S7820)试剂盒进行修饰,修饰后DNA在甲基化特异性PCR反应中用甲基化引物序列(5′-TTCGTTTTTGGGCGAGTTGAAAGTCG-3′和5′-CAAAAACGCTACGACGCGCC-3′)和非甲基化引物(5′-TGGATTTGTTTTTGGGTGAGTTGAAAGTT-3′和5′-AACCAAAAACACTACAACACACC-3′)分别扩增AKAP12基因启动子区5′CpG岛甲基化和非甲基化的等位基因,扩增产物长度分别为238 bp和245 bp。反应参数为95 ℃预变性5 min,95 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,35个循环,72 ℃ 延伸10 min。扩增行2%琼脂糖凝胶电泳。
1.3 统计方法
数据用SPSS 17.0软件包处理,采用配对t检验。Fisher’s确切概率法用来评价基因甲基化与病理参数的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 形态学结果
倒置显微镜下观察,食管鳞癌细胞系Eca109在DMEM培养96 h,细胞成贴壁生长,呈多角形,不规则生长,轮廓清晰,细胞间结构紧密,细胞生长旺盛(见图1A);在10-4mol/L 5-aza-CdR中培养96 h,细胞密度降低,细胞间接触变松,细胞体积增大,细胞内可见大量空泡,呈凋亡形态,存活数减少(见图1B)。
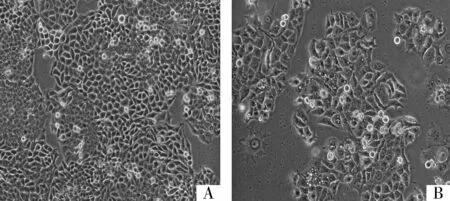
A.对照组培养96 h;B.10-4 mol/L 5-aza-CdR干预组培养96 h可见处理组细胞明显减少,且处于凋亡状态,细胞内可见大量空泡图1 Eca109细胞形态(倒置显微镜,10×10)Figure 1 Eca109 cell morphology under inverted microscope (10×10)
2.2 RT-PCR检测AKAP12 mRNA表达
在食管鳞癌Eca109细胞中,5-aza-CdR处理组与正常培养组的AKAP12表达量,以β-actin为内参相差0.99倍,P=0.96,以GAPDH为内参相差1.93倍,P=0.47;在18对哈族食管鳞癌组织中,癌组织与癌旁组织表达量以β-actin为内参相差0.86倍,P=0.74,以GAPDH为内参相差2.87倍,P=0.11(见图2-5)。
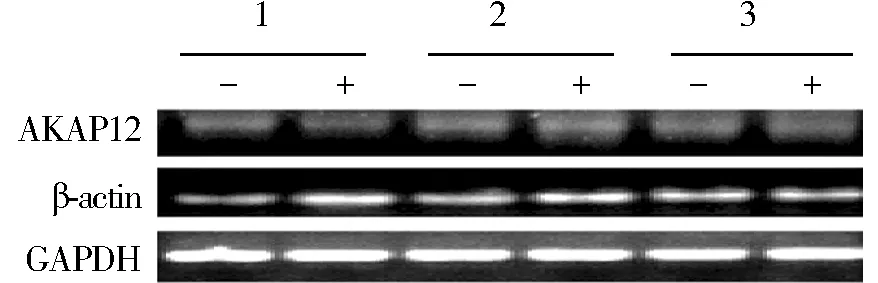
+,5-aza-CdR处理组; -,未处理组;1,2,3为重复次数 图2 RT-PCR分析AKAP12在Eca109细胞表达,以GAPDH、β-actin作为内参Figure 2 AKAP12 expression in Eca109 by qRT-PCR with GAPDH and β-actin as the internal reference
2.3 甲基化特异性PCR(MSP)检测
AKAP12基因启动子区甲基化结果:经MSP检测,在Eca109细胞中,重复3次的结果中甲基化率为0;在18对哈萨克族食管鳞癌患者的癌组织和癌旁正常组织中,甲基化阳性率为5.6%(1/18)(见图6,7)。
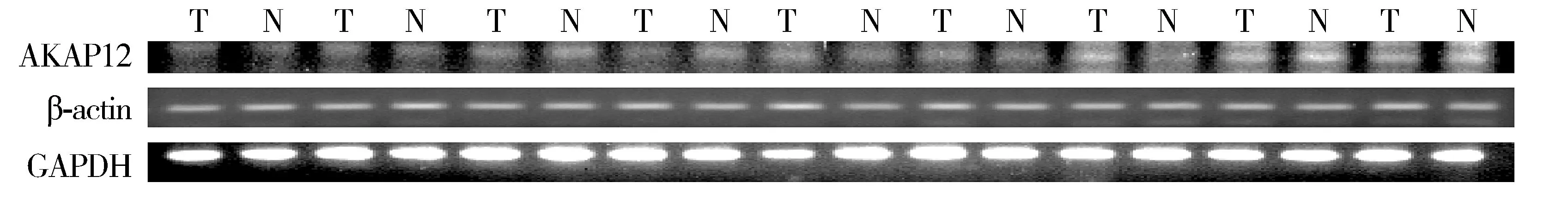
T.癌组织; N.癌旁组织图3 RT-PCR分析AKAP12在哈萨克族食管鳞癌及癌旁表达(GAPDH、β-actin作为内参)Figure 3 TFPI2 expression in Kazak ESCC tissues by qRT-PCR with GAPDH and β-actin as the internal reference
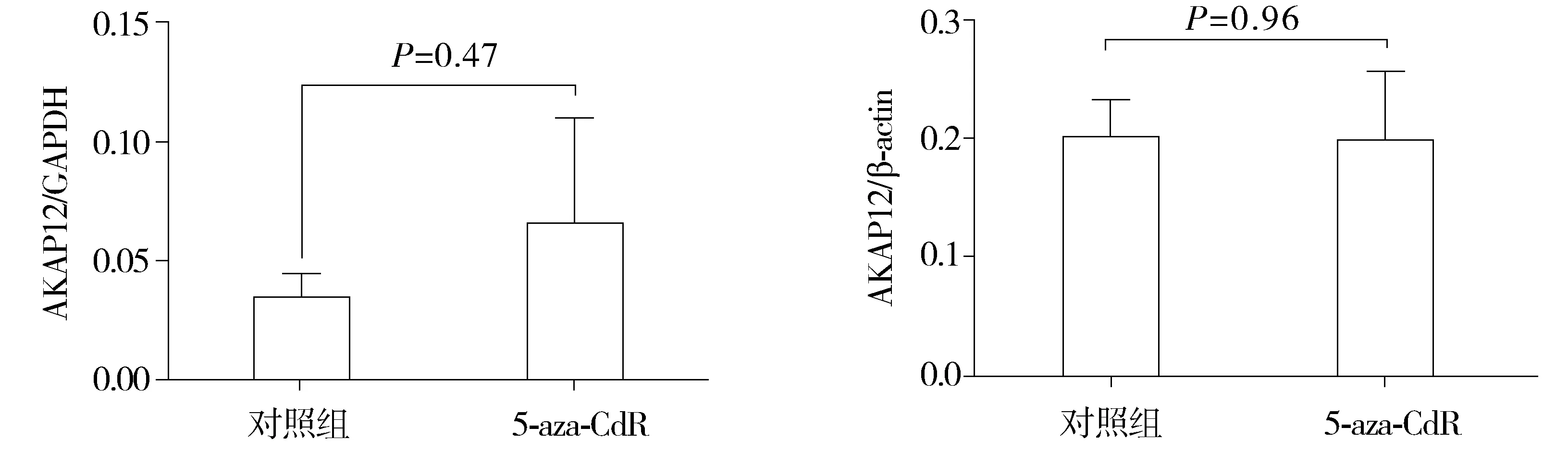
图4 对照组与处理组AKAP12表达差异(GAPDH、β-actin为内参)Figure 4 The diffierence of AKAP12 expression in 5-aza-CdR-treated group and control group with GAPDH and β-actin as internal reference
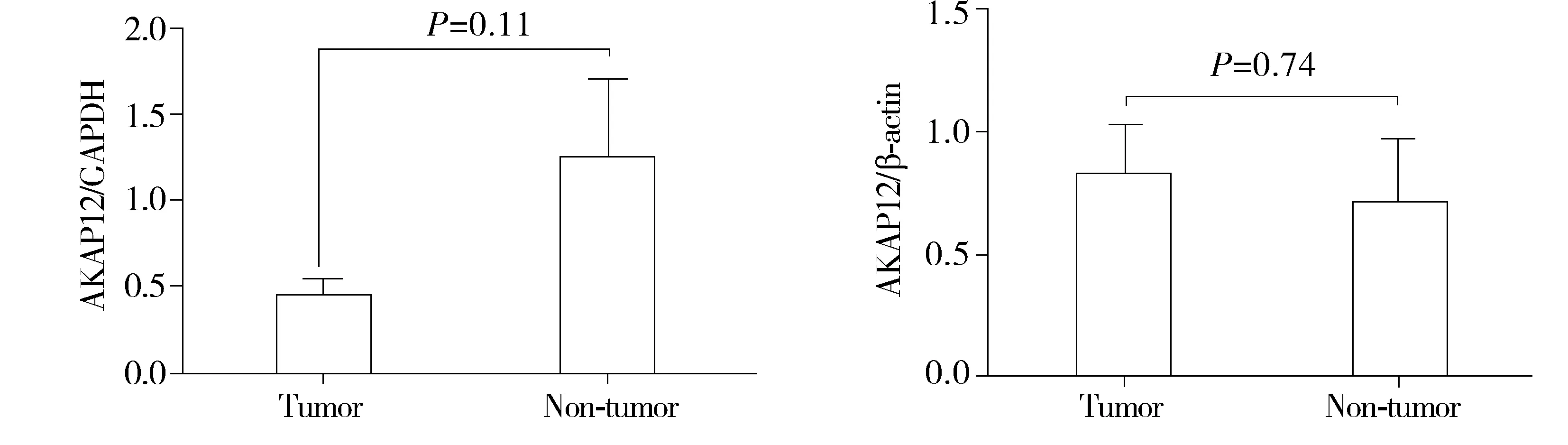
图5 18对哈萨克族食管鳞癌组织中AKAP12表达差异(GAPDH、β-actin为内参)Figure 5 TFPI2 expression in 18 paired Kazak ESCC tissues with GAPDH and β-actin as internal reference

+,5-aza-CdR处理组; -,未处理组; M.238 bp,甲基化引物扩增结果;U.235 bp,非甲基化引物扩增结果图6 AKAP12基因在Eca109细胞重复3次的甲基化MSP分析结果Figure 6 The methylation of AKAP12 in Eca109 by MSP

-为阴控;T.癌组织;N.癌旁组织;M.238 bp,甲基化引物扩增结果;U.235 bp,为非甲引物扩增结果图7 AKAP12基因在18对哈萨克族食管鳞癌组织MSP分析结果Figure 7 The methylation of AKAP12 in 18 pairs of Kazak ESCC tissues by MSP
2.4 18对哈萨克族食管鳞癌组织甲基化率与病理参数之间的关系
通过Fisher’s确切概率法分析18对癌组织表达量及甲基化率与其病理参数之间的关系分析,发现AKAP12基因甲基化与性别、大体分型、分化程度、转移之间无相关性(P>0.05,见表1,2)。
3 讨论
5-aza-CdR是DNA甲基转移酶1(DNMT1)的抑制剂,在DNA复制过程中与DNA分子相结合,并与DNMT1形成共价复合物,抑制该酶的甲基转移活性,生成低甲基化子链,从而实现去甲基化功能[16]。很多体外研究证实,5-aza-CdR通过去甲基化作用使多种CpG岛过度甲基化的抑癌基因重新表达,而恢复抑癌功能[17]。还有证据可以诱导肿瘤细胞凋亡[18]。本课题组成员前期实验用5-aza-CdR处理人食管鳞癌细胞系Eca109,发现其增殖速率低,且呈现典型的凋亡细胞形态改变[15]。本次试验中,在食管鳞癌细胞系Eca109应用甲基化酶抑制剂5-aza-CdR干预组细胞较正常培养组细胞,细胞形态发生改变,细胞密度降低,细胞间接触变松,细胞体积增大,细胞内可见大量空泡,呈凋亡形态,存活数减少。提示,5-aza-CdR在浓度10-4mol/L,培养96 h后,抑制作用明显,说明5-aza-CdR对Eca109细胞的生长有抑制作用。
表1 AKAP12 mRNA在哈萨克族食管鳞癌组织中的表达与临床病理资料的关系
Table 1 Correlation of AKAP12 mRNA expression with clinical parameters in Kazak patients with ESCC
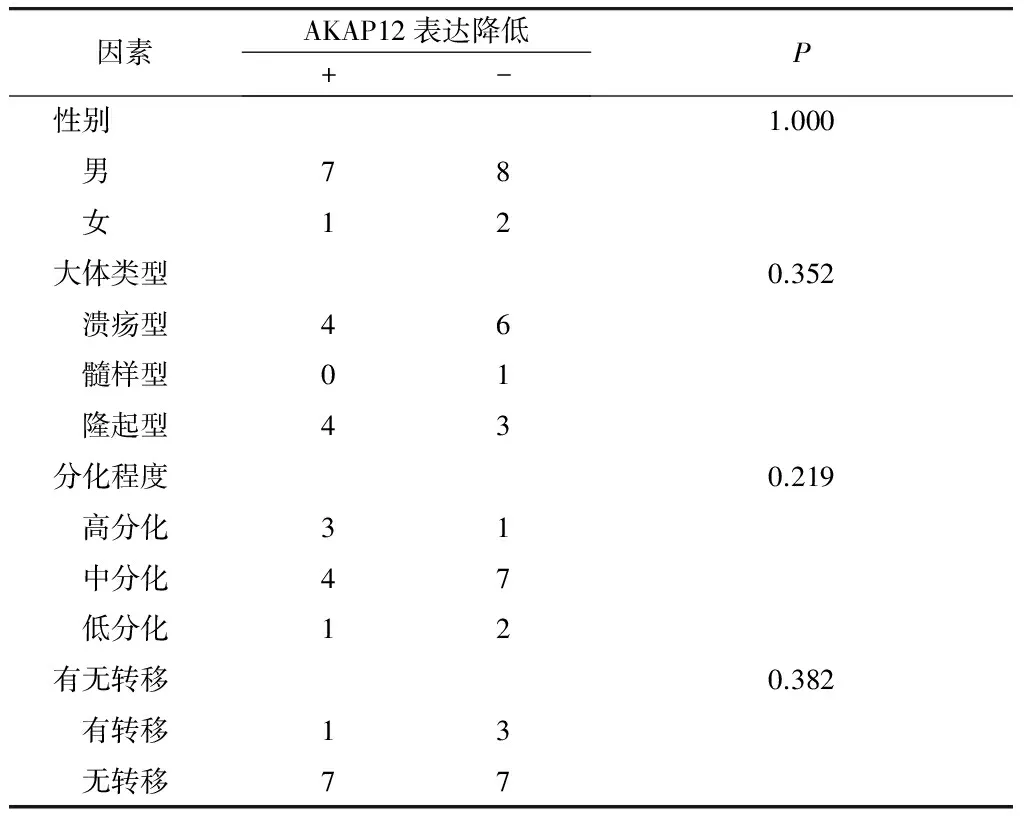
因素AKAP12表达降低+-P性别1.000 男78 女12大体类型0.352 溃疡型46 髓样型01 隆起型43分化程度0.219 高分化31 中分化47 低分化12有无转移0.382 有转移13 无转移77
表2 AKAP12 基因启动子区甲基化与哈萨克族食管鳞癌临床病理资料的关系
Table 2 Correlation of promoter region methylation of AKAP12 with clinical parameters in Kazak patients with ESCC
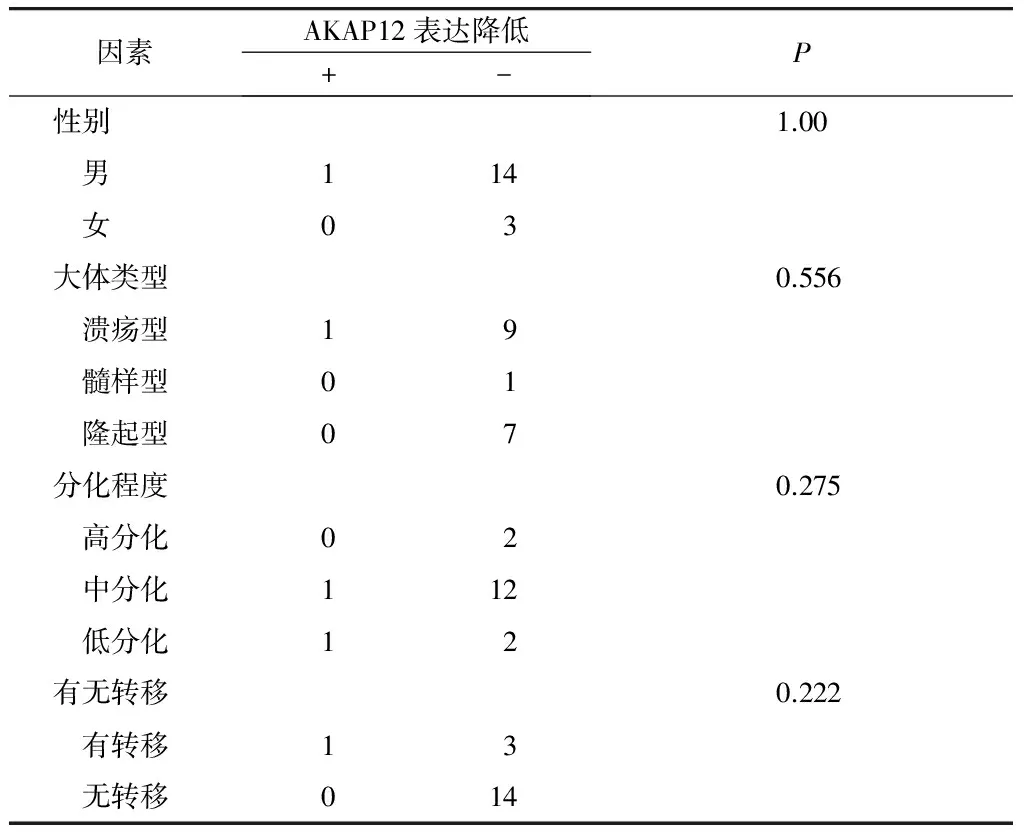
因素AKAP12表达降低+-P性别1.00 男114 女03大体类型0.556 溃疡型19 髓样型01 隆起型07分化程度0.275 高分化02 中分化112 低分化12有无转移0.222 有转移13 无转移014
AKAP12是一种通过锚定关键信号蛋白(如蛋白激酶A和蛋白激酶C)和调节细胞周期蛋白的表达和凋亡来调节有丝分裂的蛋白激酶A。AKAP12通过诱导凋亡Caspase-3,使Bax上调,Bcl-2下调,抑制肿瘤细胞活性和增殖。AKAP12通过诱导细胞周期关键蛋白Cip1/p21和Kip/p27,使其表达增加,cyclin D1表达量减少,使细胞周期停滞[19]。AKAP12可以使血管内皮生长因子(VEGF)表达减少,抑制血管生长,这对肿瘤的生长和转移是关键的。在小鼠实验中,SSeCKS(人鼠同源的AKAP12)过表达可以减少前列腺癌细胞向肺的恶性转移[20]。有报道AKAP12调控RAS信号通路,启动子甲基化使基因沉默,在青少年单核细胞白血病中发挥很大作用[21]。在多种肿瘤中,如胃癌、前列腺癌、卵巢癌和乳腺癌等,AKAP12基因的抑癌作用被强烈抑制,而且在胃癌、儿童髓系恶性肿瘤中报道AKAP12启动子区甲基化介导AKAP12基因失活[22,23]。
因5-磷酸甘油醛脱氢酶(GAPDH)和β-肌动蛋白(β-actin)mRNA水平一般相对恒定,常用于基因表达研究时样本加样量的校正[24]。GAPDH和β-actin应用于本实验,来校正实验数据,使实验结果更严谨。
本次实验结果提示,AKAP12在Eca109细胞系5-aza-CdR处理组及正常培养组中甲基化率为0;在18对哈萨克族食管鳞癌组织中甲基化率为5.6%(1/18)。AKAP12在5-aza-CdR组表达量与对照组以β-actin为内参相差0.99倍,P=0.96,以GAPDH为内参相差1.93倍,P=0.47;在18对哈族食管鳞癌组织中,癌组织与癌旁组织表达量以β-actin为内参相差0.86倍,P=0.74,以GAPDH为内参相差2.87倍,P=0.11。AKAP12表达量及甲基化率与临床病理参数,无相关性(P>0.05)。据文献报道,AKAP12基因启动子区甲基化在食管腺癌中比较普遍且具有组织特异性,在食管腺癌甲基化率为52.2%,而在食管鳞癌中AKAP12的甲基化率仅为7.7%[25]。且在相关腺癌中均有AKAP12启动子区高甲基化报道,如肺腺癌[26]、乳腺癌等[22]。在组织水平上,AKAP12基因与病理参数之间也没有统计学意义,可能是由于样本例数造成的,因此需要进一步加大样本例数对其进行进一步的研究。AKAP12基因虽然在前期实验中被筛选出属于经5-aza-CdR处理组及正常培养组的差异表达基因,且表达倍数具有一定意义,但通过对其分别在食管鳞癌细胞系及食管鳞癌组织的验证过程中,发现AKAP12基因在mRNA表达水平和甲基化水平,均没有差异。得出结论,AKAP12基因具有组织特异性,在食管鳞癌中其甲基化发生率低。
综上所述,5-aza-CdR作为甲基转移酶的抑制剂之一,可以促进凋亡,抑制Eca109细胞生长,可以为EC治疗提供一种方法。在本次实验AKAP12基因在ESCC细胞系Eca109及其18对哈族ESCC组织中,甲基化率低,表达量差异无统计学意义,但说明该基因甲基化具有组织特异性,对AKAP12基因甲基化做进一步研究时,需考虑该特性。
[1] Pakin DM,Bray FI,Devesa SS.Cancer burden in the year 2000.The global picture[J]. Eur J Cancer,2001,37(Suppl 8):S4-S66.
[2] Jemal A,Siegel R,Xu JQ,etal.Cancer Statistics,2010[J].Ca Cancer J Clin,2010,60(5):277-300.
[3] 林东昕.中国食管癌分子流行病学研究[J].中华流行病学杂志,2003,24(10):939-943.
[4] Lu XM,Zhang YM,Lin RY,etal. Relationship between genetic polymorphisms of metabolizing enzymes CYP2E1,GSTM1 and Kazakh’s esophageal squamous cell cancer in Xinjiang,China[J].World J Gastroenterol,2005,11(24):3651-3654.
[5] Koshy M,Esiashvilli N,Landry JC,etal.Multiple management modalities in esophageal cancer:combined modality management approaches[J].Oncologist,2004,9(2):147-159.
[6] Esteller M.CpG island hypermethylation and tumor suppressor genes:a booming present,a bright future[J].Oncogene,2002,21(35):5427-5440.
[7] Egger G,Liang G,Aparicio A,etal.Epigenetics in human disease and prospects for epigenetic therapy[J].Nature,2004,429(6990):457-463.
[8] Belinsky SA.Gene-moter hypermethyltion as a biomarker in lung cancer[J].Nat Rev Cancer,2004,4(9):707-717.
[9] Nauert JB,Klauck TM,Langeberg LK,etal.Gravin,an autoantigen recognized by serum from myasthenia gravis patients,is a kinase scaffold protein[J].Curr Biol,1997,7(1):52-62.
[10] Lin X,Tombler E,Nelson PJ,etal.A novel src-and ras-suppressed protein kinase C substrate associated with cytoskeletal architecture[J].J Biol Chem,1996,271(45):28430-28438.
[11] Wan M,Sun T,Vyas R,etal.Suppression of tumorigenicity in human ovarian cancer cell lines is controlled by a 2 cM fragment in chromosomal region 6q24-25[J].Oncogene,1999,18(8):1545-1551.
[12] Xia W,Unger P,Miller L,etal.The Src-suppressed C kinase substrate,SSeCKS,is a potential metastasis inhibitor in prostate cancer[J].Cancer Res,2001,61(14):5644-5651.
[13] Choi MC,Jong HS,Kim TY,etal.AKAP12/Grain is inactivated by epigenetic mechanism in human gastric carcinoma and shows growth suppressor activity[J].Oncogene,2004,23(42):7095-7103.
[14] Mori Y,Cai K,Cheng Y,etal.A genome-wide search identifies epigenetic siliencing of somatostatin,tachykinin-1,and 5 other genes in colon cancer[J].Gastroentreology,2006,131(3):797-808.
[15] 杨婷,徐淑永,马磊,等.DNA甲基转移酶抑制剂5-杂氮-2′-脱氧胞苷对人食管癌细胞株Eca109的影响[J].新疆医科大学学报,2007,30(4):349-351.
[16] Cisneros FJ,Branch S.5-AZA-2’-deoxycytidine(5-AZA-CdR):a demethylating agent affecting development and reproductive capacity[J].J Appl Toxicol,2003,23(2):115-120. [17] Zhang B,Huang T,Liu K,etal.Effects of 5-Aza-CdR on cell proliferation of breast cancer cell line MDA-MB-435S and expression of maspin gene[J].J Huazhong Univ Sci Technolog Med Sci,2007,27(5):543-546.
[18] Xiong H,Qiu H,Zhuang L,etal.Effects of 5-Aza-CdR on the proliferation of human breast cancer cell line MCF-7 and on the expression of Apaf-1 gene[J].J Huazhong Univ Sci Technolog Med Sci,2009,29(4):498-502.
[19] Yoon DK,Jeong CH,Jun HO,etal.AKAPl2 induces apoptotic cell death in human fibrosarcoma cells by regulating CDKI-cyclin D1 and cspase-3 activity[J].Cancer Lett,2007,254(1):111-118.
[20] Su B,Zheng Q,Vaughan MM,etal.SSeCKS metastasis-suppressing activity in MatLyLu prostate cancer cells correlates with vascular endothelial growth factor inhibition[J].Cancer Res,2006,66(11):5599-5607.
[21] Wilhelm T,Lipka DB,Witte T,etal.Epigenetic silencing of AKAP12 in juvenile myelomonocytic leukemia[J].Epigenetics,2016,11(2):110-119.
[22] Choi MC,Jong HS,Kim TY,etal.AKAPl2/Gravin is inactivated by epigenetic mechanism in human gastric carcinoma and shows growth suppressor activity[J].Oncogene,2004,23(42):7095-7103.
[23] Flotho C,Paulan A,Batz C,etal.AKAPl2,a gene with tumour suppressor properties,is a target of promoter DNA methylation in childhood myeloid malignancies[J].Br J Haematol,2007,138(5):644-650.
[24] 徐安定,Schmidt-Ott KM,Tuschick S,etal.缺氧对脑星状细胞GAPDH和-Actin基因表达的影响[J].暨南大学学报(自然科学与医学版),1998,1(6):128-130.
[25] Zhe J,James PH,Jian Y,etal.Hypermethylation of the AKAP12 promoter is a biomarker of Barret’s-associated esophageal neoplastic progression[J].Cancer Epidemiol Biomarkers Prev,2008,17(1):111-117.
[26] Tessema M,Willink R,Do K,etal.Promoter methylation of genes in and around the candidate lung cancer susceptibility locus 6q23-25[J].Cancer Res,2008,68(6):1707-1714.
Promoter methylation of AKAP12 in Kazakh patients with esophageal squamous cell carcinoma
GENG Yuehua1, YANG Limin1, LU Xiaomei2, LIU Meilian1, MENG Jiarong1*
(1Departmentofpathology,PLA175hospital,XiamenUniversityAffiliatedSouthestHospital,Zhangzhou363000,China;2ClinicalMedicalResearchInstitute,FirstAffiliatedHospitalofXinjiangMedicalUniversityofXinjiangMedicalUniversity;*Correspondingauthor,E-mail:mengjiarong@sina.com)
ObjectiveTo explore the promoter methylation of AKAP12 gene in patients with esophageal squamous cell carcinoma(ESCC), and its relationship with clinical parameters.MethodsAKAP12 methylation status was detected in Eca109 treated by 5-aza-CdR or normal culture, and 18 pairs of Kazakh’s ESCC tissues by methylation specific PCR(MSP). The expression of AKAP12 in ESCC cell lines Eca109 and 18 pairs of Kazakh ESCC tissues was detected by real time PCR(RT-PCR).ResultsThe methylation rate of AKAP12 and the normal cells was 0 in 5-aza-CdR-treated Eca109 cells and 5.6%(1/18) in ESCC tissues. The expression of AKAP12 in 5-aza-CdR group was 0.99 times as high as control group with β-actin as the internal reference(P=0.96), 1.93 times with GAPDH as the internal reference(P=0.47). The expression of AKAP12 in the tumor tissues of 18 pairs Kazakh’s ESCC was 0.86 times as high as that of paracancerous tissues with β-actin as the internal reference(P=0.74),2.87 times with GAPDH as the internal reference(P=0.11). The expression and the methylation rate of AKAP12 were not correlated with sex, morphologic type, differentiation and metastases(P>0.05).ConclusionThe methylation of AKAP12 is relatively low in esophageal squamous cell carcinoma.
esophageal squamous cell carcinoma; DNA methylation; AKAP12
解放军175医院苗圃基金资助项目(14Y005)
耿月华,女,1984-10生,硕士,住院医师,E-mail:gengyuehua888@163.com
2016-09-20
R735.1
A
1007-6611(2017)01-0016-06
10.13753/j.issn.1007-6611.2017.01.004
