蠡湖沉积物不同形态氮赋存特征及其释放潜力
2017-02-22王雯雯王书航郑丙辉陈俊伊北京师范大学水科学研究院北京100875中国环境科学研究院环境基准与风险评估国家重点实验室北京10001
王雯雯,王书航,姜 霞*,郑丙辉*,赵 丽,陈俊伊(1.北京师范大学水科学研究院,北京 100875;.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 10001)
蠡湖沉积物不同形态氮赋存特征及其释放潜力
王雯雯1,2,王书航2,姜 霞2*,郑丙辉2*,赵 丽2,陈俊伊2(1.北京师范大学水科学研究院,北京 100875;2.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012)
为了揭示蠡湖沉积物中氮对上覆水体的影响,采用连续分级提取法研究了各形态氮的空间分布特征;根据Fick第一扩散定律及相关性分析识别了潜在生物可利用性氮对沉积物氮释放的影响;同时,结合室内矿化实验,评估了有机氮的矿化潜力及其主要来源.结果表明:沉积物w(TN)均值为1417.97mg/kg,东蠡湖明显高于西蠡湖,TN主要存在形式为HN(酸解态氮),w(HTN)占w(TN)的平均比例为66.5%.沉积物NH4+-N释放通量为1.93~20.88mg/(m2·d),主要受F-NH4+-N(游离态NH4+-N)和E-NH4+-N(可交换态NH4+-N)的影响.沉积物氮平均矿化势为 248.55mg/kg,F-ON(游离态有机氮)和 AAN(酸解氨基酸态氮)是可矿化态有机氮最有效的贡献者,直接影响沉积物向上覆水体释放氮的能力.
蠡湖;沉积物;连续提取;氮形态;扩散通量
外源输入是导致湖泊富营养化的主要因素,而沉积物作为重要的内源,对水体营养盐含量及其营养状态有着不可忽视的影响.现有研究[1-3]表明,表层沉积物在成岩过程中导致沉积物-水界面的物理化学性质发生剧烈变化,污染物通过浓度差扩散、生物及物理搅动等作用向上覆水迁移和转化,造成上覆水的二次污染.
氮素是水体初级生产力的关键限制营养元素之一,也是引发湖泊富营养化的关键因子之一
[4].沉积物中氮的赋存形态及含量可以直接影响湖泊水生态系统中氮的地球化学循环及其环境质量状况.研究[5-7]表明,沉积物中可交换态氮是沉积物氮素中最为‘活跃’的部分,可以被初级生产者直接吸收利用,从而加快有机氮的矿化进程.酸解态氮是湖泊沉积物中主要的有机氮形态,可通过强酸水解为可鉴定的铵态氮(AN)、氨基酸态氮(AAN)、氨基糖态氮(ASN)和酸解未鉴定态氮(HUN),可通过矿化作用被沉水植物和藻类直接吸收利用,进而对藻类氮素供应甚至湖泊富养化产生显著影响[6].
蠡湖作为太湖伸入陆地而形成的湖泊,其换水周期较长(约400d).近年来,通过各种整治环境工程,蠡湖外源得到基本控制,水质也得到显著改善,但部分区域,尤其是东蠡湖沉积物没有疏挖的河口或者部分湖湾的水质仍处于 IV~V类水平,部分点位的水体总氮仍可达到 2mg/L以上[8].为了进一步探讨沉积物污染物释放对水质的影响,尤其是这种以内源为主,且水质受已开展的生态修复工程影响较大的半封闭水体中沉积物营养盐对上覆水体的影响,本次研究采用沉积物氮形态的连续提取法,结合室内沉积物氮的矿化实验,详细分析表层沉积物中氮的赋存形态及其释放风险,以期为进一步研究湖泊系统氮在沉积物-水界面间的迁移过程及其对湖泊富营养化的影响等提供依据,同时为进一步深入开展蠡湖生态修复工作提供依据.
1 材料与方法
1.1 研究区域
蠡湖位于太湖北部(120.22ºE~120.29ºE,31.48ºN~31.55ºN),东西长约6.0km,南北宽0.3~1.8km,面积约8.6km2.经梁溪河闸、五里湖闸与梅梁湖相通,通过曹王泾、长广溪等分别与京杭大运河、贡湖相连接,湖周围还有一些小河及断头浜,是一个既相对独立又与太湖相通的水体.
整个研究区被蠡堤、宝界桥和蠡湖大桥等阻隔物划分为4个“大围隔”,分别命名为A区、B区、C区和D区(图1).4个区域虽然可通过桥洞相通,但由于蠡湖的面积不大,且出入口都有闸控,故除风浪较大外,水体基本没有流动.A区,即退渔还湖区,原有大量鱼塘,采用干湖清淤的方式去除底泥;B区为综合整治前的“西蠡湖”,西北部开展了环保疏浚工程,两边沿岸开展了水生植被重建工程;C区以宝界桥和蠡湖大桥为界,部分区域开展了环保疏浚工程,两边实施了沿岸整治工程,夏季和秋季漂浮植物较多,死亡后大量沉积在底泥中;D区为蠡湖“东出口区”,沿岸居民区较多,开展了两岸截污和沿岸整治工程,未开展环保疏浚工程.注入40mL超纯水,加塞、密闭,在温度为40℃的恒温培养箱内培养1d、3d、7d、15d后取出,振荡(25℃,220r/min)2h后离心(7000r/min,15min),取出上清液测定溶解性总氮(DTN)、氨氮(NH4+-N)和硝酸盐氮(NO3--N).
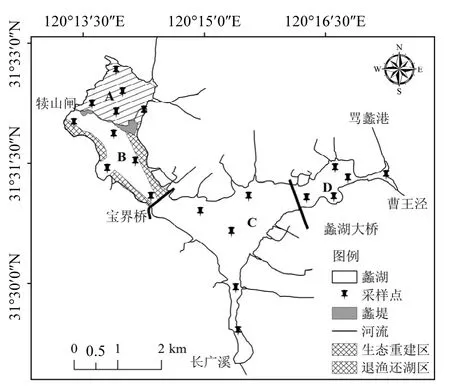
图1 蠡湖采样点分布示意Fig.1 Sampling points and location of Lihu Lake

表1 蠡湖表层沉积物基本理化性质Table 1 Basic physico-chemical properties of surface sediment of Lihu Lake
1.3 样品分析
间隙水和上覆水中水质指标的测定参照《水和废水监测分析方法》[10],ρ(DTN)采用碱性过硫酸钾消解-紫外分光光度法测定;ρ(NO3--N)采用紫外吸收法测定;ρ(NH4+-N)采用纳氏试剂分光光度法测定.由于 ρ(NO2--N)极低,该研究中不予以计算,故:ρ(DON)=ρ(DTN)-ρ(NH4+-N)-ρ(NO3
--N).
参照国内其他氮形态分级提取方法[11-13],将沉积物氮形态分为:游离态氮(FN)、可交换态氮(EN)、酸解态氮(HN)和残渣态氮(RN).FN、EN、HN的提取液分别为超纯水、2mol/L的氯化钾溶液、6mol/L的盐酸,提取液和土的比例分别为1:20、1:20、1:5.RN采用凯氏定氮法.具体测定方法参考《沉积物质量调查评估手册》[14].
1.4 数据处理
沉积物-水界面 NH4+-N扩散通量估算公式
[15-16]为:

式中:F为分子扩散通量,mg/(m2·d); φ为表层沉积物的孔隙度,采用沉积物湿容重和含水量计算;为上覆水-沉积物界面 NH4+-N的浓度梯度(用表层沉积物间隙水与上覆水 NH4+-N的浓度差估算求得),mg/(L·cm);Ds为考虑了沉积物效应的实际分子扩散系数,cm2/s. Ds与φ之间的经验关系式:

式中:Do为营养盐在无限稀释溶液中理想扩散系数,对于NH4+-N,Do取19.1×10-6cm2/s.
所有样品分析均做3次平行,试验结果均以3次样品分析的平均值表示(3次分析结果的误差<5%),并用沉积物标准品(GSD-3a)进行检验.数据采用Excel 2007、Origin 8.0、ArcGIS 9.3、Surfer 11以及SPSS 17.0软件进行统计检验、绘图和分析.
2 结果与分析
2.1 沉积物中FN空间分布特征
FN主要来源于间隙水或者以物理吸附态附着于碳酸盐、氧化物或粘土矿粒等其它相而存在的NH4+-N、NO3--N 和小分子溶解态有机氮(SON),是极易迁移的氮形态[17].蠡湖表层沉积物FN空间分布特征见图2.
蠡湖表层沉积物 w(F-TN)为 30.00~115.32mg/kg,平均值为 66.03mg/kg,存在显著的空间分布差异(图 2d),整体呈现由东向西降低的趋势,分区特征表现为:D区>C区>B区>A区.各游离态氮形态空间分布特征与 w(F-TN)相似,整体均呈由东向西降低的趋势,且C区和D区明显高于A区和B区.F-TN以游离态无机氮(F-IN)为主,w(F-IN)占 w(F-TN)的平均比例为 56.9%, NH4+-N 为沉积物 F-IN 的的主要氮形态, w (F-NH4+-N)为 10.48~60.86mg/kg,平均值为29.96mg/kg,w(F-NH4+-N)占 w(F-TN)的平均比例为44.2%;w(F-NO3--N)为2.74~16.33mg/kg,平均值为 8.09mg/kg,仅占 w(F-TN)的 12.7%. w(F-SON)为 6.92~42.36mg/kg,平 均 值 为27.98mg/kg,占 w(F-TN)的平均比例为 43.1%. w(F-TN)与w(F-NH4+-N)、w(F-NO3--N)、w(FSON)均呈极显著正相关(P<0.01),其中 w(F-TN)与w(F-NH4+-N)的相关性最好,相关系数达0.915. w(F-SON)与w(F-NH4+-N)和w(F-NO3--N)相关性不大,说明沉积物中游离态无机氮和有机氮来源可能不同.而w(F-NH4+-N)和 w(F-NO3--N)之间呈显著正相关,相关系数为 0.783,说明其来源相同,并且之间存在着较为强烈的相互转化过程.这主要是因为,FN除了来源于间隙水体外,还有很大一部分是以物理吸附状态附着在碳酸盐、氧化物或粘土矿粒上,吸附力极弱,在水体扰动等作用下,即可进入水体,微生物作用、氧化还原、硝化等一系列生化作用为不同氮形态之间的相互转化提供了可能.
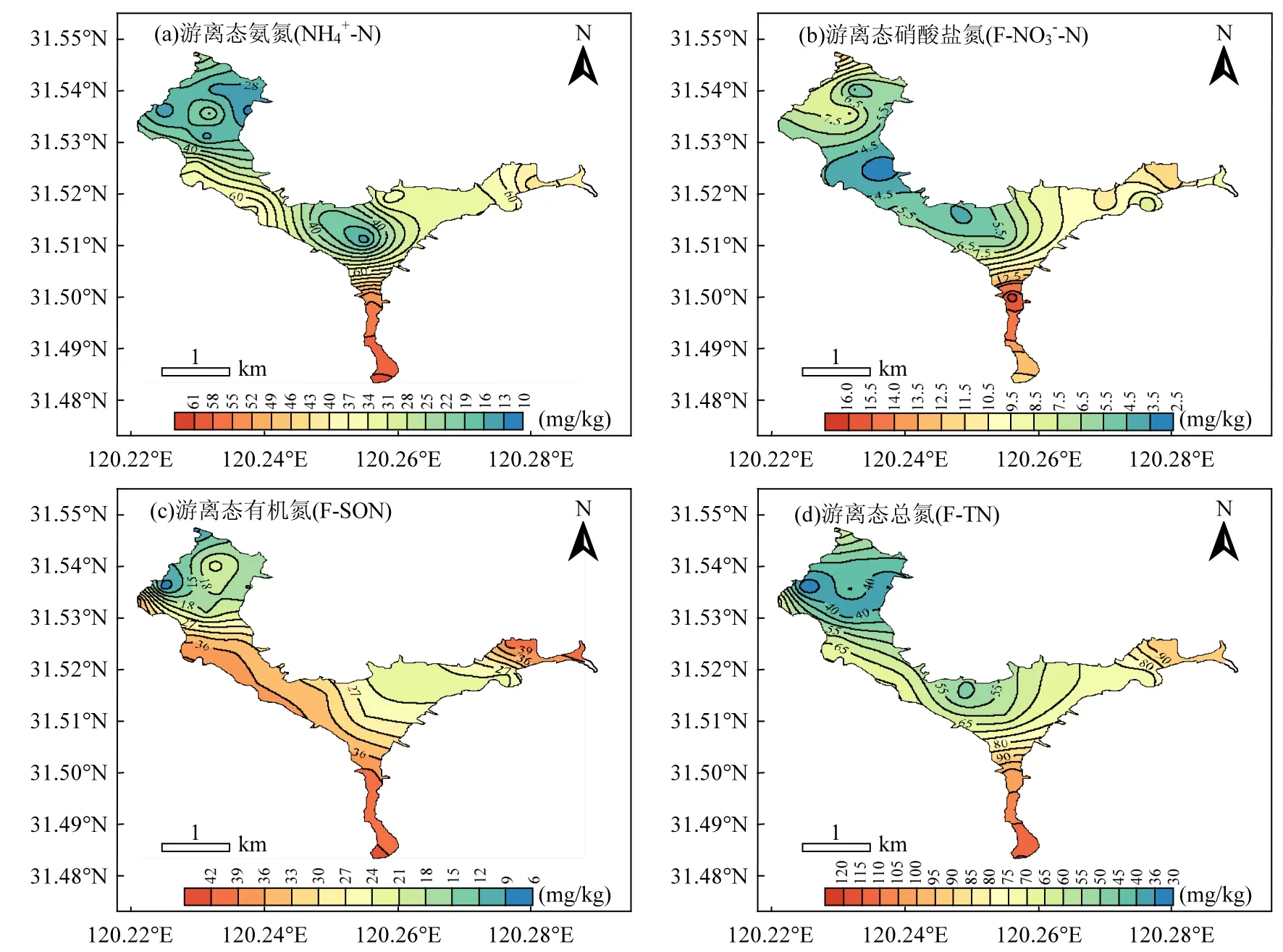
图2 蠡湖表层沉积物中FN的空间分布Fig.2 The spatial distribution of free nitrogen in surface sediment of Lihu Lake
2.2 沉积物中可EN的空间分布特征
沉积物中 EN主要包括离子交换态NH4+-N、NO3--N以及 SON,可以通过吸附-解吸作用、离子交换作用以及各种生物扰动作用不断与间隙水体保持动态平衡,是可以直接被湖泊初级生产力利用的氮源,在沉积物氮循环中占有极其重要的地位[18-20].蠡湖沉积物中各形态 EN含量的空间分布如图3所示.
蠡湖沉积物中w(E-TN)为38.42~134.95mg/ kg,平均值为78.13mg/kg,A区、B区、C区、D区w(E-TN)的平均值分别为55.93、62.49、88.83、 105.29mg/kg,空间分布与 w(F-TN)相似,整体上呈现出东蠡湖高于西蠡湖的特征(图 3d),这主要是因为在西蠡湖的A区和B区已经开展的底泥疏浚工程清除了大量含有污染物的底泥,导致底泥中氮磷污染负荷大幅降低;而在C区仅部分区域开展过底泥疏浚,加之长广溪地区水生植物茂盛,植物腐败也增加了底泥中氮的含量;D区尚未开展大规模的底泥疏浚,因此底泥中的氮含量相对最高.E-TN以E-NH4+-N为主,w(E-NH4+-N)为 22.69~96.80mg/kg,平均值为 49.83mg/kg,占w(E-TN)的比例在 49.6%~82.5%之间,平均值为63.8%;其次为 E-SON,w(E-SON)为 11.92~55.94mg/kg,平均值为 26.81mg/kg,占 w(E-TN)的平均比例为 34.4%;w(E-NO3-N)最小,在 0.05~ 4.14mg/kg之间,平均值为 1.49mg/kg,仅占 w(ETN)的 1.9%,这可能主要是因为沉积物为相对厌氧环境,硝化反应较弱,不利于硝化反应的进行[21].

图3 蠡湖表层沉积物中EN的空间分布Fig.3 The spatial distribution of exchangeable nitrogen in the surface sediment of Lihu Lake
如图3所示,各形态可交换态氮含量的空间分布特征相似,整体均表现为东蠡湖高于西蠡湖,但是不同分区之间略有差异.w(E-NH4+-N)在 D区最高(图3a),平均值为61.82mg/kg,其次为C区,平均值为60.20mg/kg,与D区含量相差不多,A区含量最小,平均值为 31.98mg/kg,不足 D 区w(E-NH4+-N)的1/2, w(E-NH4+-N)在各分区的大小依次为:D区>C区>B区>A区.w(E-SON)在D区平均值为 41.34mg/kg,明显高于其他区域(图3c),w(E-SON)在各分区的大小依次为:D区>C区>A区>B区.w(E-NO3-N)的空间分布特征(图3b)与w(E-SON)相似,w(E-NO3-N)在各分区的大小依次为:D区>C区>A区>B区.
相关性分析结果表明,w(E-TN)与 w(ENH4+-N)、w(E-NO3-N)、w(E-SON)均呈极显著正相关(P<0.01),其中 w(E-TN)与 w(E-NH4+-N)之间相关性最大,相关性系数为 0.914,加之E-NH4+-N为E-TN的主要组分,因此可知ETN主要受 E-NH4+-N的控制.不同氮形态之间, w(E- NH4+-N)与 w(E-NO3-N)相关性不显著,与w(E- SON)显著正相关(P<0.05,r=0.531),而w(ENO3-N)与 w(E-SON)之间呈极显著正相关(P<0.01,r=0.694),这说明E-NH4+-N与E-NO3-N之间的相关转化关系较弱,主要是因为在厌氧条件下,硝化反应不易发生;而 w(E-SON)和 w(ENO3-N)、w(E-NH4+-N)之间具有较好的相关性,主要是因为有机氮在厌氧微生物作用下可以发生矿化作用转化为无机氮.
2.3 沉积物中HN的空间分布特征
蠡湖表层沉积物中 w(H-TN)在 451.30~1452.04mg/kg之间,平均值为 953.29mg/kg,空间分布特征整体表现为东蠡湖高于西蠡湖,各分区大小依次为:D区>C区>B区>A区.沉积物中HN是在矿化作用下可被转化而释放的氮形态,主要以有机氮的形式存在,其中主要可鉴别的有机化合物是AAN(氨基酸态氮)、ASN(氨基糖态氮)、AN(氨态氮),还有一些 HUN(酸解未知态含氮化合物)[12],蠡湖表层沉积物各酸解态氮形态的空间分布如图4所示.
AN和AAN为HN的主要存在形态,w(AN)和 w(AAN)分别为 147.04~496.64mg/kg和125.12~741.62mg/kg,平均值分别为 347.10mg/kg和 391.53mg/kg,分别占 w(H-TN)的 37.4%和38.5%.如图4所示,w(AN)(图4a)和w(AAN) (图4b)的空间分布特征也相似,整体均表现为由东蠡湖向西蠡湖递减的趋势,分区特征表现为:D区>C区>B区>A区.w(HUN)为109.47~284.84mg/ kg,平均值为 186.60mg/kg,空间分布特征(图 4d)表现为:D区>C区>A区>B区,w(HUN)占w(H-TN)的比例在 10.8%~34.7%之间,平均值为21.3%. ASN为HN中含量最小的氮形态,w(ASN)的平均值为 25.06mg/kg,仅占 w(H-TN)的 2.8%,其空间分布特征(图4c)表现为:C区>D区>B区>A区.
相关性分析结果表明,w(H-TN)与 w(AN)、w(AAN)、w(ASN)、w(HUN)均呈极显著正相关(P<0.01),其中w(H-TN)与w(AN)、w(AAN)之间的相关性最大,相关性系数分别为0.898和0.980,说明表层沉积物中 w(H-TN)的大小主要取决于w(AN)和 w(AAN).不同组分之间,只有 w(HUN)与 w(ASN)之间的相关性不显著,其他组分之间均呈有较好的相关性,其中 w(AN)与 w(AAN)之间的相关性最大,相关系数为 0.817(P<0.01). w(HUN)与 w(ASN)相关性差,说明其可能具有不同的来源.沉积物酸解态ASN的主要组成是葡萄糖胺氮,其次是乳糖胺氮,这两种胺之和接近于氨基糖氮量,ASN的主要来源是微生物和水生昆虫细胞物质[22].HUN是在有机质或腐殖质分解过程中,氨基酸发生缩合作用,生成溶胶状的含氮化合物,主要以非a-氨基酸、N-苯氧基氨基酸态氮和嘧啶、嘌呤等杂环氮以及少量的脂肪胺和芳胺等形式存在[23]. w(AN)、w(AAN)、w(ASN)之间具有较好的相关性,说明这3种氮形态除了可能具有相似的来源外,之间还存在着较为频繁的转化过程.
2.4 沉积物中RN的空间分布特征

图5 蠡湖表层沉积物中RN的空间分布Fig.5 The spatial distribution of residual nitrogen in the surface sediment of Lihu Lake
沉积物中 RN主要是是以有机杂环态存在,或者与杂环或芳香环键结合在一起的有机结合氮,这部分氮主要来源于缩合程度较高的腐殖质结构成分[24-25].蠡湖表层沉积物中 w(RN)为187.76~488.00mg/kg,平均值为 320.51mg/kg. w(RN)空间分布特征如图 5所示,整体由东蠡湖向西蠡湖递减,分区特征表现为:D区>C区>B区>A区.
3 讨论
3.1 空间差异性分析
自20世纪90年代开始,蠡湖水体中氮、磷污染加剧,水质迅速恶化至劣Ⅴ类,呈重度富营养化状态.为防止湖区富营养化程度进一步加深,从2003年开始,无锡市政府对蠡湖实施了一系列的治理措施,包括退渔还湖、环保疏浚、生态重建以及对周边污染河道进行闸控或封堵;治理工程实施后总氮的外源污染基本得到消除,同时蠡湖水质有了大幅的改善,总体水质也由劣V类水体转变为 IV类.该研究中,蠡湖沉积物中不同形态氮在空间分布上差异十分显著,西蠡湖的A区和B区相对于东蠡湖的C区和D区污染程度较低,4个区域沉积物 w(TN)分别为(1008.62±373.22)、(1168.91±240.44)、(1583.67±471.93)和(1918.67± 148.92) mg/kg.可能因为A区和B区经过底泥环保疏浚,污染底泥大部分被消除,而C区和D区,虽然周边岸带的植被覆盖较好,外源也被切断,但底泥污染依然严重,尤其是 D区,水深较浅,淤泥厚度基本在1m以上.
A区现阶段已经有大片的狐尾藻、轮叶黑藻、苦草等沉水植物,其他区域分布有较多的水鳖、水葫芦、菱角等漂浮植物.相对于漂浮植物,沉水植物的生长周期相对较长,并且死亡后的残体以有机氮的形式存在于沉积物中,通过矿化作用缓慢地释放出来,并且释放出来后能很快被水生植物所吸收合成自身物质,进而导致A区的沉积物w(TN)及其各形态氮含量在底泥疏浚10a后没有显著增加.
3.2 释放通量与无机氮形态之间的相关分析
沉积物和上覆水之间的营养盐交换是水体中营养盐来源和归趋的重要过程[26-27].沉积物间隙水中营养盐含量往往比上覆水中高许多,这种物质浓度梯度引起的物质扩散转移过程,是沉积物-水界面物质循环的主要过程之一[28-29].先前的研究[30]表明,沉积物中有机物质经过微生物矿化作用产生的 NH4+-N向上覆水释放的过程是沉积物中氮对上覆水的营养盐供给的一个重要机制.本次研究中,NH4+-N是间隙水体中的主要氮形态,ρ(NH4+-N)占 ρ(DTN)的平均比例为54.5%,占ρ(DIN)的77.6%,并且在沉积物EN中占有绝对优势.对蠡湖沉积物-水界面的NH4+-N进行扩散通量的初步估算表明,NH4+-N释放通量在 1.93~20.88mg/(m2·d)之间,平均值为 7.91mg/ (m2·d),其中A区、B区、C区、D区各区平均值分别为3.76、5.00、9.70和13.18mg/(m2·d).为了识别潜在生物可利用性的氮形态对沉积物释放的影响,采用多元统计分析方法对 NH4+-N释放通量与沉积物中各形态无机氮做相关性研究,见图6.

图6 蠡湖沉积物氨氮释放通量与游离态无机氮和可交换态无机氮相关性Fig.6 Relationship between ammonia nitrogen release flux and free inorganic nitrogen,exchangeable inorganic nitrogen in sediment of Lihu Lake
从图6可以看出,蠡湖沉积物NH4+-N释放通量与 w(F-NH4+-N)、w(F-NO3--N)以及 w(ENH4+-N)呈显著正相关,且与 w(F-NH4+-N)和(E-NH4+-N)的相关性更好,说明目前蠡湖沉积物氮释放通量主要受FN和EN含量的影响,尤其受其中w(NH4+-N)的控制.
A区的释放通量较小,可能与A区分布着较大面积的沉水植物有关.沉水植物在吸收无机氮的同时,根部释放的O2将加速NH4+-N的硝化过程,显著降低水体(间隙水)的营养盐浓度,进而减小沉积物中 NH4+-N的释放通量以及各形态氮的含量.
3.3 有机氮的矿化潜力及其来源分析
沉积物氮素矿化过程实质上是由微生物驱动的将有机氮转化为无机氮的过程,由酶动力学性质所决定,符合一级化学反应原理,因此,用一级反应动力学模型描述氮矿化在理论上比较合理.其一级反应动力学模型[31]为:

式中:Nt为累积矿化氮量,mg/kg;N0为氮矿化势,mg/kg;k为一级反应速率常数,d-1;t为培养时间,d;N0是一定条件下沉积物中能够矿化成无机态氮的有机态氮数量的最大值,可用来表示沉积物供氮潜力,mg/kg.本次研究中,沉积物 N0在93.64~444.67mg/kg之间,平均值为248.55mg/kg.先前的研究[32]表明,土壤或者沉积物有机质是由降解程度各异的多种组分组成,而氮矿化势包括易矿化部分的矿化势和难矿化部分的矿化势.矿化刚开始时,容易分解的物质被氨化微生物迅速分解.随着易矿化有机物的消耗和氨氮的累积,氨化微生物活动受到抑制,其他微生物大量繁殖,继续分解较难矿化的有机物.本次研究中,矿化时间较短,仅有 15d,没能识别出易矿化部分的矿化势和难矿化部分的矿化势,下阶段将通过室内模拟进一步开展带有多“有机质库”的模型研究.
沉积物中复杂有机氮在微生物的作用下,经氨基化作用逐步分解为简单有机态氨基化合物,再经氨化作用转化成氨和其他较简单的中间产物.氨化作用释出的氨大部分与有机或无机酸结合成铵盐.淹水培养条件下,沉积物有相当长时间处于厌氧环境中,连续淹水培养更能模拟沉积物在自然状态下的氮矿化过程.为了识别矿化有机氮的主要来源,本次研究通过N0与F-ON(游离态有机氮)、E-ON(可交换态有机氮)、AN、AAN、ASN、HUN和RN做多元回归分析,试图找出与N0最相关的氮形态,见表2.

表2 蠡湖沉积物氮的矿化势与有机氮形态(FON、EON、AN、AAN、ASN、HUN和RN)相关关系Table 2 Correlation between N0and FON, EON, AN, AAN, ASN, HUN, RN in sediment of Lihu Lake
从表1可以看出,虽然各形态有机氮与N0的相关系数大小差异较大,但都成显著正相关,说明可能在有机氮矿化过程中各形态氮都参与其中,也可能是与蠡湖本身通过综合整治工程后各湖区水环境差异性有关.同时,在多元回归分析中,各自变量之间往往存在多重共线性,直接建立因变量与自变量的线性回归模型,可能给偏回归系数带来不合理的解释,因此,本研究采用多元逐步回归分析法,以期建立沉积物中不同形态有机氮(F-ON、E-ON、AN、AAN、ASN和HUN)对N0的“最优”回归方程,结果为:N0=2.83×w(FON)+0.45×w(AAN)-7.83.可以看出,F-ON 和AAN是可矿化态有机氮最有效的贡献者.结合F-ON和AAN在连续提取法的步骤及其相对含量可以看出,FON作为快速矿化有机氮、AAN作为缓慢矿化有机氮,其含量的高低将直接影响到沉积物向上覆水体释放氮的能力.
4 结论
4.1 表层沉积物中w(TN)在712.22~2098.23mg/ kg之间,空间分布差异性显著,分区特征表现为:D区>C区>B区>A区.HN为TN的主要存在形式,w(H-TN)占w(TN)的平均比例为66.5%.
4.2 沉积物 NH4+-N 释放通量在 1.93~20.88mg/(m2·d)之间,空间分布特征表现为:D区>C区>B区>A区.相关性分析结果表明,沉积物氮释放通量主要受FN和EN含量的影响,尤其受其中w(NH4+-N)的控制.
4.3 沉积物氮矿化势 N0在 93.64~444.67mg/kg之间,平均值为 248.55mg/kg.N0与 w(F-ON)、w(E-ON)、w(AN)、w(AAN)、w(ASN)、w(HUN)和 w(RN)均显著正相关,其最优多元逐步回归方程为: N0=2.83×w(F-ON)+0.45×w(AAN)-7.83,表明F-ON和AAN是可矿化态有机氮最有效的贡献者,其含量的高低将直接影响到沉积物向上覆水体释放氮的能力.
[1] 周伟华,吴云华,陈绍勇.南沙群岛海域表层沉积物中有机物、铁和锰的分布特征 [J]. 热带海洋学报, 2003,22(1):43-49.
[2] 李俐俐,武安泉,覃雪波.沙蚕生物扰动对河口沉积物中菲释放的影响 [J]. 环境科学学报, 2014,(9):2355-2361.
[3] Chen M S, Ding S M, Liu L, et al. Kinetics of phosphorus release from sediments and its relationship with iron speciation influenced by the mussel (Corbicula fluminea) bioturbation [J]. Science of The Total Environment, 2016,542,Part A:833-840.
[4] 金相灿,屠清瑛.湖泊富营养化调查规范(第二版) [M]. 北京:中国科学出版社, 1990.
[5] 王书航,姜 霞,钟立香,等.巢湖沉积物不同形态氮季节性赋存特征 [J]. 环境科学, 2010,31(4):946-953.
[6] 王雯雯,王书航,姜 霞,等.洞庭湖沉积物不同形态氮赋存特征及其释放风险 [J]. 环境科学研究, 2013,26(6):598-605.
[7] Wang P D, Zhao L, Wang C, et al. Nitrogen distribution and potential mobility in sediments of three typical shallow urban lakes in China [J]. Environmental Engineering Science, 2009, 26(10):1511-1521.
[8] 胡佳晨,姜 霞,李永峰,等.环境治理工程对蠡湖水体中氮空间分布的影响 [J]. 环境科学研究, 2013,26(4):380-388.
[9] 欧阳媛,王圣瑞,金相灿,等.外加氮源对滇池沉积物氮矿化影响的研究 [J]. 中国环境科学, 2009,29(8):879-884.
[10] 国家环境保护总局.水和废水监测分析方法(第四版) [M]. 北京:中国环境科学出版社, 2009.
[11] 吴丰昌,万国江,蔡玉蓉,等.沉积物-水界面的生物地球化学作用[J]. 地球科学进展, 1996,11(2):191-197.
[12] Bremner J M. Organic forms of soil nitrogen [C]//Bremner J M, Black C A (cds). Methods of Soil Analysis. USA: Madison,American Society of Agronomy, 1965:1148-1178.
[13] Stevenson F J. Organic forms of soil nitrogen [M]. Humus Chemistry, Wiley, New York, 1997:55-119.
[14] 姜 霞,王书航.沉积物质量调查评估手册 [M]. 北京:科学出版社, 2012.
[15] Bolalek J, Graca B. Ammonium nitrogen at the water-sediment interface in Puck Bay (Baltic Sea) [J]. Estuarine Coastal and Shelf Science, 1996,43:767-779.
[16] Billen G. A budget of nitrogen recycling in North Sea sediments off the Belgian coast [J]. Estuarine Coastal and Shelf Science, 1978,7:127-146.
[17] 钟立香,王书航,姜 霞,等.连续分级提取法研究春季巢湖沉积物中不同结合态氮的赋存特征 [J]. 农业环境科学学报, 2009,28(10):2132-2137.
[18] Delange G J. Distribution of exchangeable, fixed, organic and total nitrogen in interbedded turbiditic pelagic sediments of the Madeira abyssal-plain, eastern north-Atlantic [J]. Marine Geology, 1992,109(1/2):95-114.
[19] 王圣瑞,焦立新,金相灿,等.长江中下游浅水湖泊沉积物总氮、可交换态氮与固定态铵的赋存特征 [J]. 环境科学学报, 2008,28(1):37-43.
[20] Depinto J V, Schmidt M, Paul J F. Transport and transformation of contaminants near the sediment-water interface [M]. New York: Lewis Publisher, 1993.
[21] 陈国元,李建秋,李清曼,等.武汉月湖沉积物不同形态氮含量与转换途径的垂直变化 [J]. 湖泊科学, 2008,20(4):463-469.
[22] Stevenson F J. Humus chemistry: Genesis, composition, reactions [M]. New York: John Wiley & Sons, 1994:55-119.
[23] Schulten H R. The three-dimensional structure of humic substances and soil organic matter studied by computational analytical chemistry [J]. Fresenius Journal of Analytical Chemistry, 1995,351(1):62-73.
[24] Sowden F J, Chen Y, Schnitzer M. The nitrogen distribution in soils formed under widely differing climatic conditions [J]. Geochim Cosmochim Acta, 1997,41:1524-1526.
[25] Sulce S, Palma L D, Jaquin F,et al. Study of immobilization and remobilization of nitrogen fertilizer in cultivated soils by hydrolytic fractionation [J]. European Journal of Soil Science, 1996,47:249-255.
[26] Qiu H M, Geng J J, Ren H Q, et al. Phosphite flux at the sediment—water interface in northern Lake Taihu [J]. Science of the Total Environment, 2016,543, Part A:67-74.
[27] Kalkhoff S J, Hubbard L E, Tomer M D, et al. Effect of variable annual precipitation and nutrient input on nitrogen and phosphorus transport from two Midwestern agricultural watersheds [J]. Science of the Total Environment, 2016,559: 53-62.
[28] Mayer T, Ptacek C, Zanini L. Sediments as a source of nutrients to hypereutrophic marshes of Point Pelee, Ontario, Canada [J]. Water Research, 1999,33(6):1460-1470.
[29] Li Q M, Zhang W, Wang X X, et al. Phosphorus in Interstitial Water Induced by Redox Potential in Sediment of Dianchi Lake, China [J]. Pedosphere, 2007,17(6):739-746.
[30] Geurts J J M, Smolders A J P, Banach A M, et al. The interaction between decomposition, net N and P mineralization and their mobilization to the surface water in fens [J]. Water Research, 2010,44(11):3487-3495.
[31] Stanford G, Smith S L. Nitrogen mineralization potentials of soils [J]. Soil Science Society of America Journal, 1972,36:465-470.
[32] 付会芳,张兴昌.旱地土壤氮素矿化的动力学研究 [J]. 干旱区资源与环境, 1997,11(1):53-58.
Occurrence characteristics and release potential of nitrogen fractions in sediment of Lihu Lake.
WANG Wen-wen1,2, WANG Shu-hang2, JIANG Xia2*, ZHENG Bing-hui2*, ZHAO Li2, CHEN Jun-yi2
(1.College of Water Sciences, Beijing Normal University, Beijing 100875, China;2.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China). China Environmental Science, 2017,37(1):292~301
To reveal the impacts of sediment nitrogen on overlying water of Lihu Lake, the spatial distribution characteristics of nitrogen species were studied by sequential extraction method, the impacts of potential bioavailable nitrogen on nitrogen release from sediment were identified by Fick’s first diffusion law and correlation analysis. And the potential for mineralization of organic nitrogen and its main source were assessed by mineralization experiment in laboratory at the same time. Results showed that the mean value of w(TN) was 1417.97mg/kg, w(TN) in the east lake was significantly higher than the west. HN (hydrolysable nitrogen) was the main form for TN, and w(HTN) accouted for 66.5% of w(TN). Emission flux of NH4+-N ranged from 1.93 to 20.88mg/(m2·d), and was manly affected by F-NH4+-N (free ammonia nitrogen) and E-NH4+-N (exchangeable ammonia nitrogen). The average nitrogen mineralization potential was 248.55mg/kg. F-ON (free organic nitrogen) and AAN (amino acid nitrogen) are the biggest contributors to mineralization of organic nitrogen, and they can directly influence the capacity of sediment nitrogen release into overlying water.
Lihu Lake;sediment;sequential extraction;nitrogen speciation;emission flux
X524
A
1000-6923(2017)01-0292-10
王雯雯(1987-),女,黑龙江哈尔滨人,工程师,硕士,主要从事湖泊水环境研究.发表论文10余篇.
2016-05-28
国家水体污染控制与治理科技重大专项(2012ZX07101-013)
* 责任作者, 研究员, jiangxia@craes.org.cn; 研究员, zhengbinghui @craes.org.cn
