抗菌医用金属材料的研究与发展
2017-02-21任玲杨春光杨柯
任玲,杨春光,杨柯
中国科学院 金属研究所,辽宁 沈阳110016
抗菌医用金属材料的研究与发展
任玲,杨春光,杨柯
中国科学院 金属研究所,辽宁 沈阳110016

栏目主编:杨柯
中国科学院金属研究所研究员,1982年毕业于大连工学院机械系金属材料专业,1985年和1989年在中国科学院金属研究所分别获得工学硕士和工学博士学位,1991~1993年获英国皇家学会奖学金在英国牛津大学材料系工作,1993年在中科院金属所破格晋升为研究员,1996年被评为博士生导师,已培养博士研究生60余名。多年来一直从事新型医用金属材料与器件、先进钢铁结构材料、贮氢合金的研究与开发工作。主持或参与完成多项国家973、国家863、国家自然科学基金等国家级的科研项目。目前担任中国生物材料学会医用金属材料分会主任委员,并在从事医用高氮无镍不锈钢、可降解镁合金、抗感染金属等新型医用金属材料及其在骨科、齿科、心血管支架领域中的应用等方面的研究与开发工作。曾获得中科院科技进步一等奖、中科院自然科学二等奖、辽宁省科技进步一等奖、辽宁省科技进步二等奖(2次)等多项奖励以及国务院政府特别津贴、中科院院长奖学金、中科院青年科学家奖等多项荣誉奖励。已发表期刊学术论文500余篇,授权中国发明专利60余项,出版和翻译专著 5 部。
由植入器械引发的细菌感染是临床上迫切解决的重要问题。不锈钢、钛合金、钴基合金等医用金属材料广泛应用于制造各类植入医疗器械。通过在这些医用金属材料中加入适量具有强烈抗菌功能的铜元素,使其在生理环境中持续和微量释放铜离子,从而起到显著的抗菌作用,是降低临床上发生细菌感染的一个新思路和有效途径。本文综述了相关研究进展,表明抗菌医用金属材料具有强烈的广谱杀菌功能,抑制细菌生物膜的形成,具有广阔的应用前景。
医用金属材料;植入医疗器械;铜元素;抗菌;细菌生物膜;细菌感染
引言
医用金属材料是一类重要的生物医用材料,因其具有优异的综合力学性能(强度、硬度、塑形、冲击韧性、疲劳等)、优良的耐腐蚀性能、良好的生物相容性,以及优异的加工成形等工艺性能,而广泛应用于医学临床。目前临床应用的医用金属材料主要有不锈钢、钛及钛合金、钴基合金等,生物可降解镁合金是近年来快速发展的新型医用金属材料,有诱人的临床应用潜力。医用金属材料主要应用于骨科、齿科及矫形外科的内植入物及人工假体等植入医疗器械的制造,以心血管支架为典型代表的各类管腔支架,以及各式各样的外科手术器械和工具,为延长患者寿命、改善患肢功能、提高患者的整体生活质量发挥了重要作用。
但统计数据显示,美国每年200万例院内感染病例中约一半与植入物有关[1],英国每年植入物相关感染约花费700~1100万英镑[2]。世界卫生组织(WHO)颁布的《院内感染防治实用手册》中的数据显示,每天全世界有超过1400万人正在遭受院内感染的痛苦,其中60%的细菌感染与使用的医疗器械有关[3]。采取各种措施,降低院内感染发生率,是医疗领域中的长期而艰巨的任务。
以骨科临床为例,即使是在手术严格执行无菌操作以及全身预防性抗炎治疗前提下,首次全髋关节置换术后的感染发生率仍在0.5%~3.0%内,全膝关节置换后,感染是导致翻修的第二原因,肿瘤切除后大量骨缺损的体内假肢置换的感染率在5%~35%之间,外固定支架手术病例的2%~30%存在术后感染[4]。植入物相关感染一旦出现,可能会引起局部组织破坏,病原体的全身播散和植入物的失效,并且可能导致严重的疾病和并发症如骨髓炎和败血症,严重时甚至需要截肢手术[5]。而且这种感染会反复发作,难以控制,通常不得不彻底取出植入物,进行长期的抗感染治疗以及感染控制后的再次手术,因而给患者带来了严重的问题:增加住院时间、费用,再次手术的附加风险,甚至导致截肢或死亡。因此,对植入物感染的积极预防显得尤为重要。
提高手术环境洁净度、控制术中污染,以及在手术期预防性抗生素的应用是目前临床上的主要预防措施。但在降低感染率方面,自抗生素应用后的50 多年来尚未有根本性突破。另外,随着抗生素耐药菌株的增多,植入物感染的问题日益严重。因此,与医疗器械或植入材料相关的细菌感染正在成为医学领域内亟待解决的重要问题之一。由此可见,发展防治植入物感染的新策略,对减少医疗卫生费用的支出,保障患者的健康,具有重大的社会意义和可观的经济价值。
1 植入物引发的细菌感染
David等[3]在骨科植入器械相关感染问题的评述性文章中指出,金黄色葡萄球菌和表皮葡萄球菌是引起骨科植入器械感染的主要细菌,分别占到34%和32%。王化芬等[5]对国内708例采自骨科病房及骨科门诊病人的细菌感染患者的3年统计数据表明,金黄色葡萄球菌是骨科病人感染单菌株的首位感染菌,3年平均占到33.0%;但以大杆菌为代表的革兰阴性杆菌的总菌株数在3年平均已占到分离菌总数的52%,且有逐年增高的趋势。Leonhardt等[6]研究表明,引起口腔正畸器械细菌感染的主要是变形链球菌、牙龈卟啉单胞菌等厌氧菌。因此对葡萄球菌和革兰氏阴性杆菌在毒理和致病机制的充分认识,可以为预防和治疗植入物感染提供有益的线索。细菌对抗生素的耐药性也是需要警惕的重要问题,在与生物材料相关的骨科感染致病菌中,大约有80%的菌种对盘尼西林类药物(如头胞菌素)耐药,而对甲氧西林和苯唑西林耐药的菌株也接近40%。这些菌株还经常表现出多重耐药性,如对几种不同类型的抗生素耐药,包括胺基糖苷、大环内酯、林可霉素、四环素、甲氧苄氨嘧啶、磺胺等药物[7]。
针对上述耐药细菌的耐药机制,研究者开展了大量相关实验,发现植入物周围感染的发病机理较为特殊,这是由于内植入物的存在所导致的-假体与植入物界面周围通常是宿主免疫受抑制且抵抗力较低的区域,被称为免疫缺陷纤维性炎症区域,细菌很容易在此定植并引发感染[8]。而假体微动和磨损颗粒的释放均能损伤植入物周围组织,亦能加速宿主免疫防御缺陷区域的形成。研究表明,内植物周围形成感染所需的临界污染微生物数量远小于正常数值[9]。此外,植入物材料本身的化学性质和表面结构形态对早期微生物的黏附和定植也有重大影响。此外,细菌可分泌黏附素和复杂的蛋白质-多糖复合物,黏附于生物材料表面形成生物膜[10-11],这使细菌更能抵抗宿主防御和抗生素的作用,即所谓细菌生物膜理论[12],目前已被广泛接受。
细菌生物膜是指细菌群落在水性环境下的定居繁殖场所,其形成主要包括3个过程:细菌在植入物表面的粘附、细菌的增殖、宿体细菌的增加与分离,而细菌粘附是引发植入物感染的起始动因[13]。成熟的细菌生物膜可产生胞外多聚物(EPSs),帮助细菌从周围环境中捕获营养物质[14]。最后,随着细菌的扩增繁殖,生物膜细菌又可在适宜条件下释放出游离细菌。生物膜中含有多糖类、蛋白类、核酸类、脂类物质等多种物质[15-16],能够保持生物膜的结构完整性,为细菌提供了免受自身免疫防御机制及抗菌药物作用的理想宿居场所,因此细菌生物膜对抗菌药物具有很强的耐药性[17]。此外,膜内细菌群营养物质相对缺乏,细菌处于饥饿状态,生长缓慢,大多处于静止期,对抗菌药物多不敏感,导致了细菌的耐药性得到增强[17-18]。
为了治疗内植物周围感染,目前的临床标准策略是应用抗生素系统治疗,即通过口服和注射等方式进行抗生素的全身给药。这种治疗策略的缺点在于经血液循环输送的药物在内植物周围组织往往难以达到足够和有效抑菌浓度而无法发挥理想的治疗效果,另一方面反而增加了抗生素副作用的风险。由此可见,如果能直接从植入材料自身的角度上解决植入器件引发的细菌感染问题,会有效降低细菌感染发生的风险性,避免抗生素的耐药问题,减少因全身给药而给患者带来的抗生素副作用,达到对内植物周围感染的有效治疗和预防,因而具有重要的临床应用价值。
2 抗菌医用金属材料的研究与发展
以抑制细菌生物膜的形成过程为目标,研究开发自身具有抗感染功能的新型医用金属材料,是有效减少上述感染发生的途径之一。这一研究的基本思路是在现有医用金属材料的整体中或其表面改性涂层中加入抗菌成分组元,使材料表面具有强烈的抗菌功能,使之难以生成细菌生物膜,从而从根本上避免或减少细菌感染的发生[19]。这是目前生物材料研究领域中的一个热点,具有广阔的临床应用价值。
表面改性是进一步提高现有医用金属材料表面性能的重要途径,已经广泛应用于各类金属植入器件。因此,在医用金属材料表面改性层中添加适量具有强烈抗菌作用的铜(Cu)、银(Ag)等金属元素或抗菌肽等其它类型抗菌物质[20-21]是应对金属植入器件相关感染的直接措施,受到了人们的广泛关注,并为之开展了大量的相关研究。研究人员用等离子喷涂、磁控溅射、离子注入等多种不同工艺以及不同的化学方法[22],将Cu、Ag等抗菌金属元素、氟(F)等抗菌非金属元素以及抗菌化合物(包括药物)等添加到医用金属材料表面涂层中,从而使其具备一定的抗菌性能。例如,王素琴等[23]采用MEVVA离子注入技术,对医用317L不锈钢、纯钛和Ti-6A1-7Nb钛合金进行表面改性,表明随着Cu、Ag离子注入剂量的增加,材料的抗菌性能逐渐提高。Dong等[24]采用等离子喷涂方法在不锈钢表面制备出含Ag氮化涂层,表明涂层在提高不锈钢耐磨性的同时,对细菌还有强烈的杀灭作用。Kalaivani等[25]在钛合金表面制备含Cu离子的CaSiO3陶瓷涂层,其对大肠杆菌和金黄色葡萄球菌均表现出了强烈的杀灭作用。然而,通过表面改性处理来赋予医用金属材料抗菌功能,虽然理论上行得通,但由于涂层材料多为与基底金属性质相差甚远的陶瓷材料或高分子材料,存在涂层易脱落,抗菌性能难以持续,进一步加工成形困难等诸多缺点,在临床上的应用受到了极大限制。
如果医用金属材料自身就具有强烈的抗菌功能,那么就会克服上述抗菌涂层的诸多缺点,从而使金属植入器件具备稳定而持久的抗菌功能,对于消除或有效降低临床中出现的细菌感染现象将会更加有效,因此临床应用意义更大。利用铜(Cu)离子杀菌的历史十分悠久,自1761年Schulthees采用硫酸铜防治小麦腥黑病起至今已有200多年的历史。1885年法国人Milharde成功研发出具有杀菌功能的含Cu离子波尔多液,化解了法国波尔多庄园葡萄连年遭受病虫害的危机,随后相继出现了很多种含Cu离子杀菌剂,开创了应用Cu离子杀菌的时代。Cu是钢铁及其它类型合金中常见的一种合金化元素,加入Cu元素可提高钢的强度和耐均匀腐蚀性能,并改善钢的冷变形加工性能,为通过合金化途径来发展自身具有抗菌功能的新型含铜医用金属材料创造了条件。
另一方面,铜也是人体不可缺少的微量营养元素,对于结缔组织的形成,神经系统、心血管系统以及骨骼的发育都十分重要。铜也参与铁和能量的代谢,在许多酶的反应中消耗分子氧而充当还原剂的作用。铜在人体内含量约100~150 mg,血清铜正常值为100~120 μg/dL,是人体中含量排名第二的必需微量元素。世界卫生组织建议成人每天应摄入Cu 0.03 mg/kg。铜主要通过胆汁排泄,胆汁中含有低分子和高分子量的铜结合化合物,前者多存在肝胆汁中,后者则多在胆囊胆汁中,少量经肠壁排泄,微量经尿液排泄[26]。人体缺乏铜可导致贫血、骨质疏松、冠心病等疾病[27-28]。铜的以上生理学特性使得含铜金属材料具备了作为骨植入物材料的生物安全性基础。
近年来,笔者研究团队利用Cu离子所具有的强烈和广谱杀菌能力,在国际上首先开展了新型含铜医用金属材料的抗菌功能研究,取得了令人振奋的研究进展,具有诱人的临床应用前景。到目前为止,利用金属材料自身具有的抗菌功能来实现临床上的抗感染功能的相关研究还鲜有报道,这无疑是一项具有国际领先性的创新研究。
2.1 医用含铜抗菌不锈钢
针对临床上亟待解决的与植入器件相关的细菌感染问题,笔者研究团队在已有含铜抗菌不锈钢研究方面的大量相关工作基础上,通过在目前骨科等领域广泛临床应用的316L、317L不锈钢中添加适量Cu元素,在国际上首次设计和制备出具有强烈抗菌能力的316L-Cu、317L-Cu抗感染医用不锈钢[29]。在此基础上,开展了大量的体外及部分体内植入相关实验研究[30-31],证明含铜抗菌不锈钢对骨科中典型感染细菌具有强烈的抗细菌感染能力,有望成为具有抗感染功能的新型医用不锈钢而得到临床应用。
研究结果表明:① 含铜抗菌不锈钢的基体中会弥散析出一定量的纳米尺度富Cu相,其会有助于不锈钢在人体环境中持续溶出微量Cu离子,从而起到强烈和广谱杀菌作用;② 含铜抗菌不锈钢对金黄色葡萄球菌(S. aureus)、大肠杆菌(E. coli)等常见感染细菌均具有强烈的杀灭作用(见图1),与细菌接触24 h后的杀菌率达到99%以上;③ 含铜抗菌不锈钢可强烈抑制其表面上形成细菌生物膜(见图2~3),因而具有抑制或降低细菌感染的作用;④ 将同时沾有菌液的普通不锈钢和含铜抗菌不锈钢螺钉植入兔子骨内一定时间后,发现前者螺钉周围组织中含有大量的炎性细胞,具有较强的细菌感染倾向,而后者的相应组织中很难发现有炎性细胞存在,从而证明含铜抗菌不锈钢在体内具有抗感染能力。
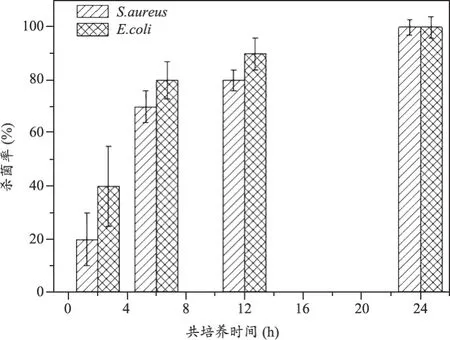
图1 317L-Cu不锈钢分别与金黄色葡萄球菌(S. aureus)和大肠杆菌(E. coli)在37℃共培养2~24 h后的杀菌率

图2 不锈钢与金黄色葡萄球菌共培养24 h后的表面扫描电镜照片

图3 不锈钢与大肠杆菌共培养24 h后的表面扫描电镜照片
此外,笔者团队还在304不锈钢的成分基础上,通过添加3%~4%的Cu元素,设计和制备出304-Cu抗菌不锈钢,并针对口腔中引起牙周炎的主要致病菌之一,牙龈卟啉单胞菌(Porphyromonas gingivalis,厌氧菌),开展了抗菌功能实验研究。研究结果表明[32],304-Cu抗菌不锈钢对牙龈卟啉单胞菌具有强烈的杀灭作用,与细菌接触10 h以上杀菌率达到99%以上。
从生物安全性的角度考虑,将317L-Cu抗菌不锈钢样品在生理盐水中浸泡不同时间后,利用原子吸收光谱(AAS)测得样品每天的Cu溶出量约为5×10-6mg/cm2。对于一只尺寸为40 mm×10 mm×2 mm的317L-Cu抗菌不锈钢骨板,则其每天的Cu溶出量约为5×10-6mg,远低于世界卫生组织推荐的成人每日2~3 mg的Cu摄入量[33]。所以,可以判断含Cu不锈钢应该是生物安全的。研究表明,适量Cu元素的加入对304、317L等类型抗菌不锈钢的力学性能和耐均匀腐蚀能力影响很小,因此含铜不锈钢在生理环境中的金属元素释放量应该与同类普通医用不锈钢相当,因而应该具有相同的生物安全性。此外,细胞毒性试验结果表明[34-35],304-Cu抗菌不锈钢对L929细胞(小鼠成纤维细胞)、MG63细胞(人骨肉瘤细胞)、KB细胞(人口腔上皮癌细胞)的细胞毒性与纯钛及304不锈钢相同,均为1级,满足对外科植入物材料的细胞毒性要求。
2.2 其它医用含铜抗菌金属材料
纯钛(Ti)及Ti-6Al-4V等医用钛合金以其高强度、低密度、高耐蚀性等优势已被广泛应用于骨科、齿科等医疗领域。Shirai等[36]首先报道了Ti-Cu合金的杀菌性能研究,发现Ti-2%Cu合金就有一定的杀菌能力。在含铜抗菌不锈钢的成功开发经验基础上,笔者研究团队又率先在国际上分别发展出Ti-Cu和Ti-6Al-4V-Cu系列含铜抗菌钛合金[37-38]。研究结果表明[39],3%~5%的Cu添加量可使含铜钛合金对金黄色葡萄球菌、大肠杆菌等常见致病细菌具有强烈的杀灭作用。XRD分析结果表明,适量Cu元素的加入会在钛基体中形成一定量的Ti2Cu相,其可能是使合金具有抗菌功能的关键因素之一。近期的研究结果表明,含铜钛合金的热处理工艺参数不同,会导致形成不同的显微组织形貌,进而会影响合金的力学性能,甚至会影响到合金的抗菌能力[40]。研究证明,含铜钛合金的耐蚀性能优异,无细胞毒性[41]。最近东北大学张二林等[42]发表的采用粉末冶金方法制备含铜钛合金的研究报道也证明了其具有的强烈抗菌功能。
在上述工作基础上,以现有医用钴基合金的化学成份,笔者研究团队还发展出具有强烈抗菌功能的含铜钴基合金[43-45],将含铜抗菌金属的设计思路拓展到目前临床普遍应用的主要金属植入材料体系中。
2.3 镁基金属降解的抗菌作用
近年来,随着生物可降解镁基金属材料研究的不断深入和拓展,可降解镁合金骨内植入器件和心血管支架产品的研究与开发已经逐步展开,并已有骨科产品进入临床应用。由于镁基金属在人体环境中的降解会引起周围环境的碱性大幅增大,即pH值的显著升高,这也会明显破坏细菌的生存条件,从而起到杀菌的作用。Robinson等人[46]和笔者课题组[47]的研究均证实了镁基金属(纯镁和镁合金)在人体环境中的降解可以强烈杀死大肠杆菌、金黄色葡萄球菌等常见感染细菌。
进一步的研究表明,镁基金属的这一杀菌作用可以通过表面改性来调控[47]。当镁基金属表面改性效果较好时(如采用氟处理),由于明显降低了镁基金属的降解速度,会使其抗菌作用下降或消失;如果表面改性效果相对较弱时(如采用阳极氧化处理),则其仍会保持较强的杀灭细菌功能。更深入的研究表明[47],镁基金属降解能够强烈杀死细菌的主要原因是由镁基金属在降解过程中造成的周围环境中pH值的大幅升高(即碱性增大),而并非Mg2+浓度增大。镁基金属的杀菌作用在笔者研究团队开展的动物实验中得到证实[48],表明利用镁基金属在体内降解起到的杀菌功能(见图4),有望成为一种防治骨髓炎等与细菌感染相关疾病的新方法。近期,笔者研究团队又利用Cu离子的强烈杀菌作用,设计并制备出新型生物可降解Mg-Cu合金[49],证明它在中性环境中(体液缓冲),由于Cu离子的持续溶出,同样具有强烈的杀菌效果,因而进一步增强了镁基金属降解所产生的杀菌功能[50]。
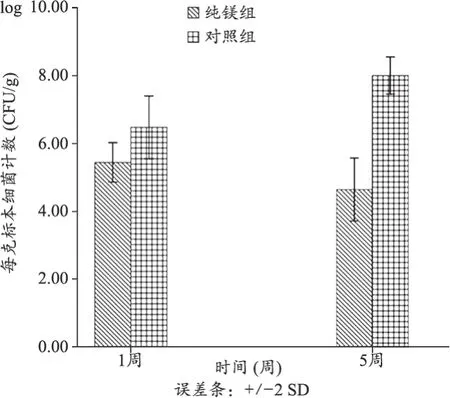
图4 各组单位标本细菌计数图
3 应用展望
细菌感染是临床上亟待解决的重大问题,从植入器件材料入手是避免或有效减少这类问题发生的重要途径。以释放具有杀菌功能的金属离子或改变微环境为主要特征的抗菌医用金属材料的研发为避免或有效降低由金属植入器件引发的细菌感染发生提供了新的重要途径,具有广阔的临床应用前景,期望其能够尽早投入医疗市场,惠及于民。目前笔者课题组开发的抗菌金属骨针(见图5)、抗菌不锈钢外科手术器械(见图6)、抗菌钛合金牙种植体、抗菌钴基合金牙冠等产品均以进入临床试验阶段。

图5 抗菌金属内外固定骨针产品

图6 抗菌不锈钢外科手术器械
[1] Darouiche RO.Treatment of infections associated with surgical implants[J].N Engl J Med,2004,350(14):1422-1429.
[2] Flock JI,Brennan F.Antibodies that block adherence of to fibronectin[J].Trends Microbiol,1999,(7):140-141.
[3] DavideC,Lucio M,Carla RA.The significance of infection related to orthopedic devices and issues of antibiotic resistance[J]. Biomaterials,2006,(27):2331.
[4] Shirai T,Shimizu T,Ohtani K,et al.Antibacterial iodine-supported titanium implants[J].Acta Biomaterials,2011,(7):1928-1933.
[5] 王化芬,王晓军,于茜,等.骨科感染病原菌谱与抗菌谱3年报告[J].中华矫形外科杂志,2007,(4):313-315.
[6] Leonhardt A,Adolfsson B,Lekholm U,et al.Putative periodontal pathogens on titanium implants and teeth in experimental gingivitis and periodontitis in beagle dogs[J].Clin Oral Implan Res,1992(3):112-116.
[7] Baquero F.Gram-positive resistance:challenge for the developmentof new antibiotics[J].J Antimicrob Chemother,1997,(39SA): 1-6.
[8] Schierholz JM,Beuth J.Implant infections:a haven for opportunisticbacteria[J].J Hosp Infect,2001,(49):87-93.
[9] Cordero J,Munuera L,Folgueira MD.Influence of bacterial strainson bone infection[J].J Orthop Res,1996,(14):663-667.
[10] Hudson MC,Ramp WK,Frankenburg KP.Staphylococcus aureus adhesion to bonematrix and bone-associated biomaterials[J]. FEMS Microbiol Lett,1999,(173):279-284.
[11] Arciola CR,Campoccia D,Montanaro L.Detection of biofilmforming strains of Staphylococcus epidermidis and S. aureus[J]. Expert Rev Mol Diagn,2002,(2):478-484.
[12] Stewat PS,Costerton JW.Antibiotic resistance of bacteria in biofilms[J].Lancet,2001,358(9276):135.
[13] Mack D,Rohde H,Dobinsky S.Identification of three essential regulatory gene loci governing expression of staphylococcus epiderrnidis polysaccharide intercellular adhesion and biofilm formation[J].Infect Immun,2000,(68):3799.
[14] VanHoudt R,Michiels CW.Role of bacterial cell surface structures in Escherichia coli biofilm formation[J].Res Microbiol, 2005,(156):626-633.
[15] Lewis K.Riddle of biofilm resistance[J].J Antimicrob Chemother, 2001,(45):999-1007.
[16] Sutherland IW.Biofilm exopolysaccharides:a strong and sticky framework[J].Microbiology,2001,(147):3-9.
[17] Bjarnsholt T,Kirketerp-Moller K,Kristiansen S,et al.Silver against Pseudomonas aeruginosa biofilms[J].APMIS,2007,(115):921-928.
[18] Hentzer M,Eberl L,Givskov M.Transcriptome analysis of Pseu domonas aeruginosa biofilm development:anaerobic respiration and iron limitation[J].Biofilms,2005,(2):37-61.
[19] Hetrick EM,Schoenfisch MH.Reducing implant-related infections: active release strategies[J].Chem Soc Rev,2006,(35):780-789.
[20] Kazemzadeh-Narbat M,Lai BFL,DingC,et al.Multilayered coating on titanium for controlled release of antimicrobial peptides for the prevention of implant-associated Infections[J]. Biomaterials,2013,34:5969-5977.
[21] Zhong LJ,Pang LQ,Che LM,et al.Nafion coated stainless steel for anti-biofilm application[J].Colloid Surfaces B,2013,(111):252-256. [22] Popat KC,Eltgroth M,LaTempa TJ,et al.Titania nanotubes: A novel platform for drug-eluting coatings for medical implants[J]. Small,2007,3(11):1878-1881.
[23] 王素琴.Ag.Cu离子注入医用金属材料表面改性研究[D].天津:天津大学,2006.
[24] Dong Y,Li X,Tian L,et al.Towards long-lasting antibacterial stainless steel surfaces by combining double glow plasma silvering with active screen plasma nitriding[J].Acta Biomater,2011,(7): 447-457.
[25] Kalaivani S,Singh RK,Ganesanb V,et al.Effect of copper (Cu2+) inclusion on the bioactivity and antibacterial behavior of calcium silicate coatings on titanium metal[J].J Mater Chem B,2014,(2):846-858.
[26] Harris ED.Basic and clinical aspects of copper[J].Crit Rcv Clin Lab Sci,2003,(40):547-586.
[27] Shim H,Harris ZL.Genetic defects in copper metabolism[J].J Nutr,2003,(133):1527S-1523IS.
[28] Wapnir RA.Copper absorption and bioavailability[J].Am J Clin Nutr,1998,(67):1054-1060.
[29] 杨春光,任玲,杨柯.一种新型医用抗菌不锈钢[P].中国:201410 219935.9.
[30] Ren L,Yang K,Guo L,et al.Preliminary study of anti-infective function of a Cu-bearing stainless steel[J].Mater Sci EngC,2012, (32):1204-1209.
[31] Chai HW,Guo L,Wang XT,et al.Antibacterial effect of 317L stainless steel contained copper in prevention of implant-related infection in vitro and in vivo[J].J Mater Sci Mater Med,2011, (22):2525-2535.
[32] Zhang D,Ren L,Zhang Y,et al.Antibacterial Activity against Porphyromonas gingivalis and Biological Characteristics of Antibacterial Stainless Steel[J].Colloids Surf B Biointerfaces, 2013,(105):51-57.
[33] IPCS(1998).Copper: Environmental Health Criteria 200,Geneva,International Programme on Chemical Safety,World Health Organisation.
[34] 张丹,张扬,卢利,等.新型抗菌不锈钢微螺钉种植体的细胞毒性分析[J].中国组织工程与临床康复,2010,(14):2916-2920.
[35] 薛楠,张丹,张扬,等.抗菌不锈钢材料的细胞毒性评价研究[J].口腔医学,2010,(30):712-715.
[36] Shirai T,Tsuchiya H,Shimizu T,et al.Prevention of Pin Tract Infection with Titanium-Copper Alloys[J].J Biomed Mater Res B Appl Biomater,2009,(91):373-380.
[37] 任玲,李述军,杨柯,等.抗感染医用钛合金[P].中国:ZL201110 232842.6.
[38] 任玲,李述军,杨柯,等.一种抗感染医用钛合金[P].中国:ZL2011 10232840.7.
[39] Ren L,Ma Z,Li M,et al.Antibacterial Properties of Ti-6Al-4V-xCu Alloys[J].J Mater Sci Technol,2014,(30):699-705.
[40] Ma Z,Ren L,Liu R,et al.Effect of Heat Treatment on Cu Distribution,Antibacterial Performance and Cytotoxicity of Ti-6Al-4V-5Cu Alloy[J].J Mater Sci Technol,2015,(31):723-732.
[41] Ma Z,Yao MY,Liu R,et al.Study on antibacterial activity and cytocompatibility of Ti-6Al-4V-5Cu alloy[J].Materials Techno logy:Advanced Performance Materials,2015,(30B2):B80-B85.
[42] Zhang E,Li FB,Wang HY,et al.A new antibacterial titaniumcopper sintered alloy: Preparation and antibacterial property[J]. Mater Sci EngC,2013,(33):4280-4287.
[43] 杨春光,王帅,任玲,等.一种外科植入物用抗细菌感染锻造钴基合金及其制备方法发明专利[P].中国:201310578730.5.
[44] 杨春光,王帅,任玲,等.一种抗细菌感染用铸造钴基合金及其热处理工艺[P].中国:201310578365.8.
[45] Wang S,Yang CG,Shen MG,et al.Study on antibacterial per for mance of Cu-bearing cobalt-based alloy[J].Mater Let,2014,129:88-90.
[46] Robinson DA,Griffith RW,Shechtman D,et al.In vitro antibacterial properties of magnesium metal against Escherichia coli,Pseudomonas aeruginosa and Staphylococcus aureus[J].Acta Biomater,2010,(6):1869-1877.
[47] Ren L,Lin X,Tan L,et al.Effect of surface coating on antibacterial behavior of magnesium based metals[J].Mater Let,2011, (65):3509-3511.
[48] Zeng J,Ren L,Yuan Y,et al.Short-term effect of magnesium im plantation on the osteomyelitis modeled animals induced by Staphy lococcus aureus[J].J Mater Sci:Mater Med,2013,(24):2405-2416.
[49] 林潇,任玲,杨柯.一种具有强烈抗菌功能的新型生物可降解镁合金[P].中国:201310598693.4.
[50] LiuC,Fu XK,Pan HB,et al.Biodegradable Mg-Cu alloys with enhanced osteogenesis,angiogenesis,and long-lasting antibacterial effects[J].Sci Rep,2016,6.
本文编辑 苏欣
Research and Development of Antibacterial Medical Metal Material
REN Ling, YANG Chun-guang, YANG Ke
Institute of Metal Research, Chinese Academy of Sciences, Shenyang Liaoning 110016, China
Bacterial infections associated with implantable devices are serious clinical problems that need to be solved urgently. Medical metal materials including stainless steels, titanium alloys, cobaltbased alloys, etc are widely used to manufacture various medical implantable medical devices. These medical metals will be significantly antibacterial once added with proper amount of copper element with strong antibacterial ability and thus continuously release trace amount of copper ions in the biological environment, which is a new idea and an effective approach to reduce bacterial infections in clinic. This article reviews the relevant research progress, indicating that antibacterial medical metal materials possess strong and broad-spectrum antibacterial functions and can inhibit formations of bacterial biofilms, thus have wide application prospects.
medical metal materials; implantable medical device; Cu ; antibacterial; bacterial biofilm; bacterial infection
TG174.2;TG14
A
10.3969/j.issn.1674-1633.2017.01.001
1674-1633(2017)01-0001-06
2016-11-03
国家自然科学基金重点项目(51631009);国际自然科学基金面上项目(51371168)。
杨柯,研究员,博士生导师,研究领域包括新型医用金属材料、先进钢铁材料、储氢合金等。
通讯作者邮箱:kyang@imr.ac.cn
