慢性特发性轴索性多神经病的病理及免疫组化研究
2017-02-20漆学良王朝霞
漆学良, 李 颖, 张 巍, 王朝霞, 袁 云
慢性特发性轴索性多神经病的病理及免疫组化研究
漆学良1, 李 颖2, 张 巍3, 王朝霞3, 袁 云3
目的 研究慢性特发性轴索性多神经病(chronic idiopathic axonal polyneuropathy,CIAP)病理改变特点,并探索腓肠神经炎细胞CD3、CD20、CD68抗体及其微小血管内皮细胞膜结合性血栓调节蛋白(thrombomodulin,TM)、内皮源性一氧化氮合酶(endothelial-nitricoxide synthase,eNOS)的表达规律。方法 10例经过临床、电生理、腓肠神经活检病理检查证实的CIAP患者,均进行腓肠神经活检标本的常规病理组织学染色以及以抗CD3、CD20、CD68、TM、eNOS、vWF(von Willebrand factor,vWF)抗体作为第一抗体的免疫组织化学染色。结果 10例患者腓肠神经病理检查显示有髓神经纤维轻-中度减少,伴随轴索变性和再生,部分可见轻微脱髓鞘改变,4例患者出现毛细血管基底膜肥厚。4例患者腓肠神经神经束衣间小血管周围有散在分布的CD68阳性单核细胞浸润。所有患者血管内皮细胞vWF、eNOS、TM均正常表达。结论 CIAP病理特点为轴索损害为主,发病可能和体液免疫异常有关,部分患者毛细血管基底膜肥厚提示血管内皮细胞可能受损,但内皮细胞功能相关蛋白表达初步提示正常。
慢性特发性轴索性多神经病; 腓肠神经; 血栓调节蛋白; 内皮源性一氧化氮合酶
慢性特发性轴索性多神经病(chronic idiopathic axonal polyneuropathy,CIAP),是一种病因不明中老年发病的慢性周围神经病,一般在50岁以后隐袭发病,出现四肢感觉或感觉运动障碍,具有缓慢进展或缓解复发病程;电生理检查常显示轴索性损害为主;病理改变特点是周围神经存在轴索损害伴随毛细血管基底膜肥厚[1~3]。CIAP病因不明,目前初步研究提示代谢综合征如空腹血糖升高、糖耐量异常、高血压、肥胖等可能为CIAP的高危因素,氧化应激可能是参与发病的一个重要环节[4,5]。但部分患者对免疫抑制剂或丙种球蛋白有效,Vrethem等研究提示CIAP患者组织型谷氨酰胺转移酶等IgA抗体升高,提示CIAP发病可能和免疫异常有关[6],但是否属于慢性炎性脱髓鞘性多发性神经根神经病(chronic inflammatory demyelinating polyneuropathy,CIDP)的轴索变异型还存在一定争议。
内皮源性一氧化氮合酶(endothelia nitricoxide synthase,eNOS)是血管内皮细胞中一种酶,能够通过精氨酸合成一氧化氮,血管内皮细胞膜结合血栓调节蛋白(thrombomodulin,TM)是抗凝血过程中凝血酶的高亲和力受体。TM可以传递信号到eNOS调节蛋白偶联受体,两者在抗血栓和抗炎过程中发挥重要作用。既往研究ANCA相关性血管炎周围神经病外周血管存在血管内皮细胞TM和eNOS弥漫性下降,两者下降程度在不同亚型的ANCA相关性血管炎之间存在差异[7]。CIAP病理改变特点是周围神经存在轴索损害伴随毛细血管基底膜肥厚,但其炎细胞表达以及微小血管内皮细胞TM和eNOS存在哪些变化缺乏系统性研究,为此我们对10例CIAP患者进行腓肠神经活检标本病理及免疫组化研究,以探讨腓肠神经炎细胞浸润及血管内皮细胞中TM和eNOS的改变规律。
1 材料和方法
1.1 临床资料 本试验纳入在北京大学第一医院神经内科就诊的10例患者,均经临床、电生理和病理检查诊断为CIAP,病程超过8 w,排除中毒、肿瘤、内分泌疾病、遗传病和其他结缔组织病所致周围神经病。诊断标准参考Notermans的CIAP 标准[2]:(1)中老年发病,年龄≥50岁,病程在8 w以上,无家族史;(2)慢性进行性或缓解复发病程,出现双下肢为主的对称性肢体远端感觉减退和无力;(3)以轴索损害为主的周围神经电生理改变特点;(4)腓肠神经活检提示存在活动性轴索损害;(5)多数患者出现脑脊液蛋白轻度升高;(6)除外其他原因导致的周围神经病。10例患者,男6例,女4例,发病年龄从43~72岁,平均发病年龄62.9岁,病程从3 m到2 y,平均13.1 m。1例感觉性神经病、8例感觉运动性神经病、1例运动性神经病。8例表现为缓慢进展,2例出现缓解复发。10例患者均出现肢体的麻木或无力,其中7例以双下肢麻木无力为首发症状,3例为四肢对称的麻木无力,2例伴双足烧灼感疼痛。8例中有7例出现脑脊液蛋白细胞分离现象。细胞数均正常,蛋白升高(5例轻度升高,脑脊液蛋白在0.45~1.0 g/L;2例患者脑脊液蛋白>2 g/L),1例脑脊液蛋白正常,平均脑脊液蛋白水平(1.20±0.93) g/L。神经传导检查:感觉神经、运动神经动作电位和复合肌肉动作电位波幅明显下降,神经传导速度轻-中度减慢。
1.2 研究方法 经过知情同意,对患者进行腓肠神经活检。腓肠神经标本进行石蜡包埋、切片和下列染色:(1)常规组织学染色,包括苏木精-伊红染色(HE)、LFB-HE染色和刚果红染色;(2)免疫组化染色(Envision二步法),第一抗体为炎细胞标志抗体(CD68、CD3、CD20单克隆抗体)和血管内皮功能相关抗体(TM、eNOS以及vWF)。在免疫组织化学染色中血管内皮细胞呈棕黄色反应为阳性,根据染色强度分3级,阴性为血管内膜无着色,弱阳性为轻度或部分着色,阳性为明显均匀着色。
2 结 果
2.1 神经病理 10例患者腓肠神经有髓神经纤维轻-中度减少,伴随轴索变性(见图1a)和再生,部分可见轻微脱髓鞘改变,4例患者出现毛细血管基底膜肥厚(见图1b)。
2.2 免疫组织化学染色 10例结果见:患者血管内皮标志vWF均呈阳性均匀表达(见图2a),血管内皮细胞功能相关蛋白TM(见图2b)与eNOS(见图2c)呈阳性表达。炎细胞标志CD3和CD20均呈阴性表达,4例患者神经束衣血管周围出现散在个别CD68阳性的单核细胞浸润(见图2d、见表1)。
表1 10例CIAP患者血管内皮细胞相关蛋白及炎细胞免疫组织化学染色情况
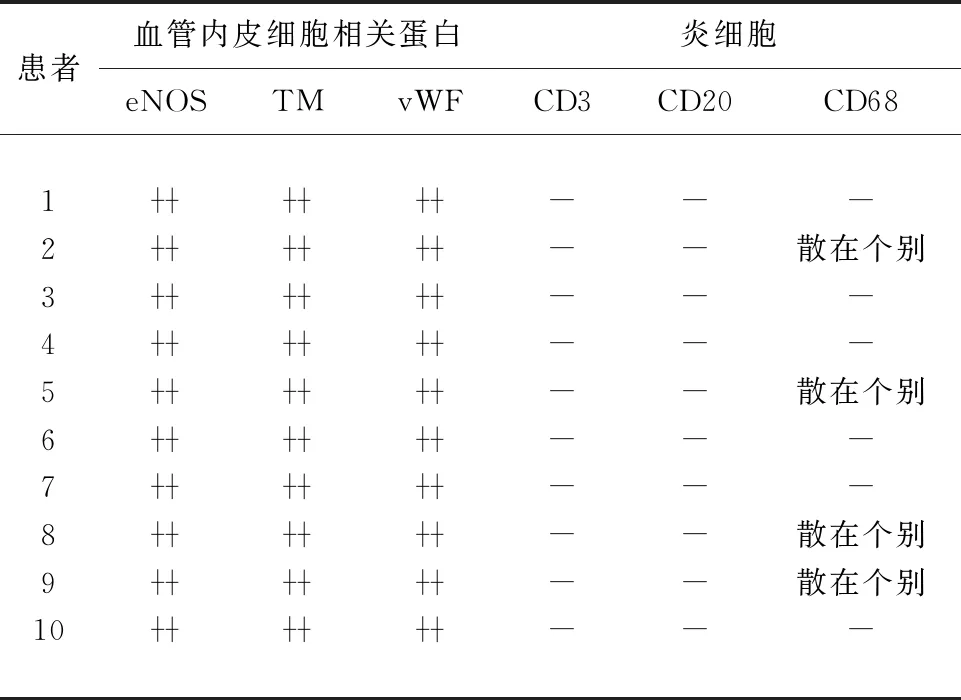
患者血管内皮细胞相关蛋白eNOSTMvWF炎细胞CD3CD20CD6812345678910---------------------散在个别--散在个别--散在个别散在个别-
注:-阴性;+弱阳性;阳性

图1a 有髓神经纤维轴索变性形成的髓球样结构(红色箭头所指,患者1,甲苯胺兰×1000);图1b 毛细血管基底膜肥厚(红色箭头所指,患者1,半薄切片甲苯胺兰×1600)

图2a 小血管及毛细血管vWF阳性均匀表达(患者1,Envision 二步法×400);图2b 小血管及毛细血管TM阳性均匀表达(患者1,Envision二步法×400);图2c 小血管及毛细血管eNOS阳性均匀表达(患者1,Envision 二步法×400);图2d神经束衣间小血管周围数个CD 68阳性表达的炎细胞浸润(患者5,Envision二步法×400)
3 讨 论
和其他报道一样[1~3],我们发现CIAP主要病理特点是出现有髓神经纤维不同程度轴索损害,不伴或仅伴轻微髓鞘损害。所有患者均出现有髓神经纤维数目轻度减少,与周围神经病临床症状一致。不同神经束有髓神经纤维密度下降程度无明显差异,提示病变较均一,没有发现CIDP或血管炎性神经病常见的不同神经束间有髓神经纤维密度下降不均匀特点[8]。我们发现多数患者出现不同阶段轴索变性所致髓球样结构,所有患者均可见到小的有髓神经纤维轴索再生现象,但没有发现有髓神经纤维再生后现象,提示处于活动期的疾病存在短期修复过程。而部分患者出现有髓神经纤维轻微脱髓鞘改变,与电生理结果较一致,也见于其他文献报道[2]。没有出现CIDP和遗传性运动感觉神经病1型的典型“洋葱球”结构[9,10]。其病变程度轻微,应当考虑为CIAP伴随的脱髓鞘损害,CIAP是一种和吉兰-巴雷综合征不同的疾病[11]。
我们发现部分患者毛细血管存在基底膜肥厚,类似病理改变也见于Teunissen的报道[12]。这些改变超出了增龄改变的严重程度,可能和合并糖耐量异常、血脂升高以及高血压病有关,可能属于伴随性改变,不应当作为CIAP特征之一[2,4,5]。我们也没有发现神经内衣及血管周围出现明显炎细胞浸润,特别是没有发现血管炎性神经病病理改变特点,即出现血管壁纤维素样坏死和大量炎细胞浸润[13]。少数患者出现个别散在分布的CD68阳性单核细胞浸润,可能是对轴索急性变性的反应[14]。没有发现CD3和CD20阳性淋巴细胞浸润,提示CIAP可能存在体液免疫异常。
形态学检查发现该病存在毛细血管基底膜增厚[12],提示血管内皮细胞存在功能异常,但血管内皮细胞在vWF染色正常,提示血管内皮细胞没有脱落,进一步的观察发现血管内皮细胞eNOS和TM均呈阳性表达,显然血管内皮细胞血管舒张调节功能以及抗血栓功能没有出现异常改变。微小血管轻微结构异常可能在CIAP发病中没有特殊意义。
腓肠神经病理检查发现神经束内CD68阳性单核细胞增多,该细胞的出现和轴索型吉兰-巴雷综合征发病存在密切关系[15],推测单核细胞可能和CIAP发病有关,由于没有发现CD3或CD20阳性T、B淋巴细胞浸润,也说明单核细胞而非淋巴细胞导致轴索慢性损害。由于CIDP也存在轴索损害[16],我们推测CIAP可能是CIDP轴索变异型。该变异型是否存在特殊的抗轴索相关蛋白抗体,还需要进一步分析。
[1]Zis P,Sarrigiannis PG,Rao DG,et al. Chronic idiopathic axonal polyneuropathy:a systematic review[J]. J Neurol,2016,263(10):1903-1910.
[2]Notermans NC,Wokke JH,Franssen H,et al. Chronic idiopathic polyneuropathy presenting in middle or old age:a clinical and electrophysiological study of 75 patients[J]. J Neurol Neurosurg Psychiatry,1993,56(10):1066-1071.
[3]Vrancken AF,Franssen H,Wokke JH,et al. Chronic idiopathic axonal polyneuropathy and successful aging of the peripheral nervous system in elderly people[J]. Arch Neurol,2002,59(4):533-540.
[4]Visser NA,Vrancken AF,van der Schouw YT,et al. Chronic idiopathic axonal polyneuropathy is associated with the metabolic syndrome[J]. Diabetes Care,2013,36(4):817-822.
[5]Singer MA,Vernino SA,Wolfe GI. Idiopathic neuropathy:new paradigms,new promise[J]. J Peripher Nerv Syst,2012,17(Suppl 2):43-49.
[6]Vrethem M,Lindh J,Tondel M,et al. IgA antibodies against tissue transglutaminase,endomysium and gliadin in idiopathic polyneuropathy[J]. Acta Neurol Scand,2013,127(2):109-115.
[7]李 颖,漆学良,张 巍,等. ANCA相关性血管炎存在血管内皮细胞血栓调节蛋白以及内皮源性一氧化氮合酶弥漫性丢失[J]. 中国神经精神疾病杂志,2011,37(6):358-361.
[8]Vital C,Vital A,Lagueny A,et al. Chronic inflammatory demyelinating polyneuropathy:immunopathological and ultrastructural study of peripheral nerve biopsy in 42 cases[J]. Ultrastruct Pathol,2000,24(6):363-369.
[9]Chin RL,Latov N,Sander HW,et al. Sensory CIDP presenting as cryptogenic sensory polyneuropathy[J]. J Peripher Nerv Syst,2004,9(3):132-137.
[10]Bennett CL,Lawson VH,Brickell KL,et al. Late-onset hereditary axonal neuropathies[J]. Neurology,2008,71(1):14-20.
[11]王毅敏,袁 云,赵伟秦. 慢性特发性轴索性周围神经病[J]. 中华神经科杂志,2005,38(11):715-716.
[12]Teunissen LL,Notermans NC,Jansen GH,et al. Thickness of endoneurial vessel basal lamina area in chronic idiopathic axonal polyneuropathy[J]. Acta Neuropathol,2000,100(4):445-450.
[13]Vrancken AF,Notermans NC,Jansen GH,et al. Progressive idiopathic axonal neuropathy--a comparative clinical and histopathological study with vasculitic neuropathy[J]. J Neurol,2004,251(3):269-278.
[14]Koller H,Kieseier BC,Jander S,et al. Medical progress:Chronic inflammatory demyelinating polyneuropathy[J]. N Engl J Med,2005,352(13):1343-1356.
[15]Griffin JW,Li CY,Ho TW,et al. Pathology of the motor-sensory axonal Guillain-Barre syndrome[J]. Ann Neurol,1996,39(1):17-28.
[16]栾兴华,王毅敏,郑日亮,等. 慢性炎症性脱髓鞘性多神经病的轴索损害[J]. 中华神经科杂志,2007,40(11):754-757.
Pathological and immunohistochemical studies in chronic idiopathic axonal polyneuropathy patients
QIXueliang,LIYing,ZHANGWei,etal.
(DepartmentofNeurology,PekingUniversityFirstHospital,Beijing100034,China)
Objective To investigate the pathological features of chronic idiopathic axonal polyneuropathy,and the expression of endothelial-nitricoxide synthase and thrombomodulin in the endothelium of the vascular in sural nerve in patients with CIAP. Methods We collected 10 patients with CIAP confirmed by clinical and electrophysiological examination and nerve pathologydiagnosis. Sural nerve biopsies were performed in all of them. We did the routine histological staining and Envision immunohistochemical staining with first antibodies against inflammatory cell markers of CD3,CD20,CD68 and endothelial cell markers of eNOS,TM and vWF. Results Sural nerve biopsies showed mild to moderate loss of myelinated fibers with axonal degeneration and regeneration. A few of them showed slight demyelination of myelinated fibers and thick basal membrane of capillary. 4 patients had CD68-positive mononuclear cells within the fascicular. No CD3 and CD20-positive lymphocytes were found. All of the patients had positive expression with eNOS,TM,vWF in the endothelial cells of the blood vessels. Conclusion The main pathological features were axonal damage. The pathogenesis of CIAP might relate to humoral immunological abnormalities. Thick basal membrane of capillary in some patients indicated the vascular endothelial cell functions injured,but the expression of vascular endothelial cell functional proteins was normal.
Chronic idiopathic axonal neuropathy; Sural nerve biopsy; Endothelial nitricoxide synthase; Thrombomodulin
1003-2754(2017)01-0013-03
2016-09-25;
2016-12-21
(1.南昌大学第二附属医院神经内科,江西 南昌 330006;2.首都医科大学附属北京安贞医院神经内科,北京 100029;3.北京大学第一医院神经内科,北京 100034)
袁 云,E-mail:yuanyun2002@sohu.com
R745
A
