油菜素内酯对氯化钠胁迫下樟树幼苗光合色素和叶绿素荧光参数的影响
2017-02-20王金平张金池岳健敏尤炎煌
王金平,张金池,岳健敏,尤炎煌,张 亮
(南京林业大学 江苏省南方现代林业协同创新中心 江苏省水土保持与生态修复重点实验室,江苏 南京210037)
油菜素内酯对氯化钠胁迫下樟树幼苗光合色素和叶绿素荧光参数的影响
王金平,张金池,岳健敏,尤炎煌,张 亮
(南京林业大学 江苏省南方现代林业协同创新中心 江苏省水土保持与生态修复重点实验室,江苏 南京210037)
为了研究油菜素内酯(BRs)浸根处理对盐胁迫下樟树Cinnamomum camphora光合功能的调节作用,为樟树耐盐性的提高提供理论依据,采用盆栽法,以不同质量浓度(0.1,0.2,0.3 mg·L-1)的BRs对樟树幼苗浸根48 h,蒸馏水浸根为对照,然后用0,50,100,150 mmol·L-1的氯化钠溶液进行处理。结果表明:BRs浸根处理能降低盐害指数,减小随着氯化钠浓度的增加叶绿素a、叶绿素b、叶绿素总量、类胡萝卜素和叶绿素a/b的下降幅度以及胡萝卜素/叶绿素总量的上升幅度,提高高盐胁迫下叶片的相对含水量,Fv/Fm,Fv/Fo,Fv′/Fm′和ФPSⅡ,提高非光化学能量的耗散。以上说明BRs有利于樟树在盐胁迫下对光能的捕获、吸收、传递和转换,提高叶片的光合活性,缓解高盐溶液对其光合系统的胁迫影响,降低高盐对樟树的抑制作用。图3表1参35
植物生理学;樟树;油菜素内酯;盐胁迫;光合色素;叶绿素荧光参数
樟树Cinnamomum camphora为高大常绿乔木,是优良的绿化树、行道树及庭荫树,其材质上乘,是制造家具的好材料,可提制樟脑和提取樟油,是南方珍贵用材和特用经济树种。樟树喜光,喜温暖湿润气候,对土壤要求不严,较耐水湿,存活期长,抗海潮风,在南方沿海地区极具应用价值,但它不耐干旱、瘠薄和盐碱土,土壤含盐量要求在2‰以内,这制约着它在南方沿海地区的引种栽培。国内外关于樟树的耐盐性研究较少,且主要集中在樟树对盐胁迫的生理响应上[1-3],而对于如何提高樟树耐盐性方面,仅有研究表明施氮能缓解樟树盐胁迫带来的毒害[4]。光合作用是植物生长发育的基础,决定着植物的生产力,且对环境的变化较敏感。叶绿素荧光技术是近年来探测和分析植物光合功能的有效手段,光合色素和叶绿素荧光参数可以反映逆境对植物光合功能的影响,进而反映植物的耐受性。油菜素内酯(brassinosteroids,BRs)是一种广泛存在于植物中的甾醇类新型植物生长调节物质,在植物体内含量极低,但生理活性极高,植物经其低浓度处理便能表现出明显的生理效应[5]。它广泛参与植物各种生理过程,尤其在植物生长发育及其对逆境的响应等方面具有重要的调节作用[6]。关于外源BRs对植物抗盐性影响方面的研究已有一些报道:外源BRs可有效促进盐胁迫下植物种子萌发、幼苗生长[7-8],提高叶片光合色素含量和光合能力[9],增强抗氧化酶活性,降低膜脂过氧化产物丙二醛质量分数和质膜透性[10-11],显著改善离子稳态和渗透调节能力[12],且不同的BRs处理方式和浓度对盐胁迫下植物的调控效果存在差异[13-14]。这些研究都表明:BRs能不同程度地提高植物的耐盐性,但是BRs对盐胁迫下木本植物的研究却鲜有报道,BRs对盐胁迫下樟树幼苗的影响方面的研究更是未见报道。本实验主要研究BRs浸根处理对盐胁迫下樟树幼苗盐害指数、盐害率、相对含水率、光合色素和荧光参数的影响,揭示BRs对樟树幼苗光合功能的调节作用,为樟树耐盐能力的提高提供依据。
1 材料与方法
1.1 实验设计与处理
2014年11月3日从南京林业大学校园内收集樟树种子,种子先用自来水加少许洗衣粉漂洗,除去不饱满的种子,用质量分数为15%过氧化氢(H2O2)处理30 min,将瓶口包纱布,自来水流动冲洗24 h倒掉;取出种子,用滤纸将其表面的水分吸干,放于45℃恒温培养箱中,培养24 h,取出后均匀放于沙床上,放入温度25℃,3 000 lx光照培养箱诱导发芽,待种子露白,播种于15 cm×20 cm的育苗袋,置于南京林业大学江苏省句容市下蜀林场智能温室中。
油菜素内酯为24-表油菜素内酯(C28H48O6,分子量为480 kg·mol-1),粉末状,溶解于体积分数为95%的乙醇中,配制质量浓度为0.1,0.2,0.3 mg·L-1的BRs溶液。2015年5月2日,苗高超过50 cm,取大小、长势一致的苗木192株,分4组,48株·组-1,于上午8:00用蒸馏水将其表面冲洗干净,根部浸泡于0.1,0.2,0.3 mg·L-1的BRs溶液中48 h,以蒸馏水浸泡为对照,该溶液含有质量分数为0.02%吐温20(polyoxyethylenesorbitan monolaurate,Sigma Chemicals,英国),取出定植于25 cm×25 cm的花盆中,苗木的培养基质为m(土)∶m(砂)=2∶1。
每种BRs质量浓度处理下设置4个氯化钠浓度,分别为0,50,100,150 mmol·L-1,盐溶液加入Hoagland营养液,12株·处理-1。2015年6月13日用可调智能浇水控制器进行浇盐溶液。使用时探头插入土壤,将装置的土壤湿度值设置为40%,当探头探测到花盆内土壤湿度低于40%时装置会自动浇盐溶液。2015年8月15日统计盐害指数并采样。
1.2 测定指标与方法
1.2.1 盐害指数与盐害率的测定[15]对全部植株进行观察统计,计算各处理的盐害指数和盐害率。盐害分级标准为0级:无盐害症状;1级:轻度盐害,有少部分(约1/5)叶片的叶尖、叶缘变黄;2级:中度盐害,有约1/2叶片叶尖、叶缘变黄;3级:重度盐害,大部分叶片叶缘、叶尖焦黄;4级:极重度盐害,叶片焦枯脱落、枝枯,最终死亡。盐害指数及盐害率计算公式为盐害指数(%)=∑(盐害级值×相应盐害级值株数)/(总株数×盐害最高级值)×100%;盐害率(%)=出现盐害症状株数/总株数×100%。
1.2.2 相对含水率 采用蒸馏水浸泡及烘干称量法[16-17]测定。具体操作为取待分析新鲜植物叶片,称取鲜叶质量0.3 g左右,在蒸馏水中浸泡24 h后称其饱和鲜质量,105℃下杀青30 min后降至 80℃烘干至恒量,称其干质量。用下面公式计算叶片相对含水量:
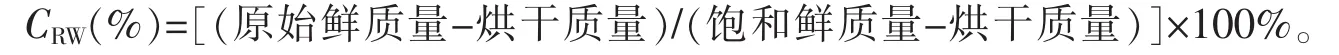
1.2.3 光合色素 采用容积比1∶1的体积分数为95%乙醇和体积分数为85%丙酮混合溶液浸泡提取。取不同处理的植株上生长一致的新鲜叶片0.1 g,重复3次·处理-1,剪碎放入装有10 mL混合溶液的25 mL试管中,置暗处浸泡24 h,直到叶片发白,叶绿素全部浸提为止,浸泡过程中隔8 h振荡摇匀1次,保证叶绿素全部进入混合溶液中。浸提液分别在波长663,646和470 nm处测定吸光度D(λ)值。按下列公式计算:叶绿素a(Chla)质量分数=[12.7×D(663)-2.69×D(645)]×V/1 000W;叶绿素b(Chlb)质量分数=[22.9×D(645)-4.68×D(663)]×V/1 000W;类胡萝卜素(Car)质量分数=[(1 000×D(470)-3.27×叶绿素a质量分数-104×叶绿素b质量分数)/229]×V/1 000W。其中:V为提取液体积(mL),W为叶片质量(g),并计算叶绿素(Chl)总量=Chla质量分数+Chlb质量分数,Chla/b值,Car/Chl值[18]。
1.2.4 叶绿素荧光参数 利用叶绿素荧光成像系统(CFI)测定。随机选择3株·处理-1,选择成熟叶3片·株-1,鲜叶暗适应30 min后于荧光室中测定最大光化学效率(Fv/Fm),潜在光化学效率(Fv/Fo),有效光化学量子产量(Fv′/Fm′),实际光化学量子产量(ФPSⅡ),光化学猝灭系数(qP),非光化学猝灭系数(qN),测定过程中仪器光强设定为500 μmol·mol-1。
1.3 数据处理
用Excel 2003对实验数据进行统计,并用SPSS 19.0进行相关性分析,用Origin 8.5作图。
2 结果与分析
2.1 BRs对盐胁迫下樟树盐害指数和盐害率的影响
盐害指数和盐害率可以直观表现出樟树盐害状况。由表1可以看出:随着氯化钠浓度的增加,樟树的盐害指数变大,经过BRs处理后,各氯化钠浓度下的盐害指数均显著减少,其中0.3 mg·L-1的BRs减少最显著,在50,10,150 mmol·L-1的氯化钠浓度下分别减少52.9%,45.3%,53.1%,而BRs对樟树的盐害率影响不大。

表1 BRs对氯化钠胁迫下樟树盐害指数和盐害率的影响Table 1 Effects of BRs on the salt injury index and rate of salt injury of Cinnamomum camphora under NaCl stress
2.2 BRs对盐胁迫下樟树叶片相对含水率的影响
相对含水率是反映植物体内水分状况的重要生理指标,也是反映植物抗逆性的可靠指标[19]。由图1可以看出:50 mmol·L-1的盐胁迫对樟树的相对含水率影响不大,当氯化钠浓度达到100和150 mmol·L-1时,相对含水率显著降低。与对照相比,BRs处理过的樟树叶片,相对含水率在低氯化钠浓度下几乎不变,在高氯化钠浓度下,当BRs质量浓度为0.2和0.3 mg·L-1时显著升高。
2.3 BRs对盐胁迫下樟树叶片光合色素的影响
由图2可以看出:50 mmol·L-1氯化钠处理对樟树的光合色素几乎没有影响,此后随着氯化钠浓度的增加,Chla,Chlb,Chl,Car质量分数和chla/b均明显降低,而Car/Chl明显上升。BRs明显影响樟树盐胁迫下光合色素的质量分数;与对照相比,50 mmol·L-1氯化钠浓度下BRs明显降低了Chla/b,Chla,Chlb,Car和Chl质量分数;当氯化钠浓度继续加大到100 mmol·L-1时,与50 mmol·L-1盐胁迫相比,对照 Chla/b,Chla,Chlb,Car和Chl质量分数降幅较大,Car/Chl升幅较大,而经过BRs处理过的樟树仅Chla/b下降显著,0.3 mg·L-1的BRs更促使樟树Chla,Chlb,Car和Chl质量分数不降反升,Chla/b也有小幅度上升,Car/Chl下降较大;当氯化钠浓度达到150 mmol·L-1时,与100 mmol·L-1的盐胁迫相比,经过BRs处理过的樟树Chla,Chlb,Car和Chl质量分数降幅比对照小很多,Chla/b反而上升,Car/Chl增幅小很多,Chla,Chlb,Chl质量分数和Chla/b超过对照,Car接近对照,Car/Chl远远低于对照。
2.4 BRs对盐胁迫下樟树叶片荧光参数的影响
2.4.1 BRs对盐胁迫下樟树叶片Fv/Fm和Fv/Fo的影响 由图3可以看出:樟树叶片的PSⅡ最大光化学效率Fv/Fm和潜在光化学效率Fv/Fo随着氯化钠浓度的增加逐渐降低,与对照相比,100和150 mmol·L-1氯化钠浓度下,Fv/Fm和Fv/Fo有显著降低。当用BRs浸根处理后,不同BRs质量浓度对同一氯化钠浓度胁迫下的Fv/Fm和Fv/Fo影响不一样;樟树没受到胁迫时,BRs质量浓度越大,Fv/Fm和Fv/Fo越低;受到低盐胁迫时,BRs质量浓度对Fv/Fm和Fv/Fo影响不大;受到高盐胁迫时,BRs对Fv/Fm影响显著,100 mmol·L-1氯化钠浓度下,0.3 mg·L-1的BRs对应的Fv/Fm和Fv/Fo最高,150 mmol·L-1的盐浓度下,0.2 mg·L-1的 BRs对应的 Fv/Fm和 Fv/Fo最高,0.2和 0.3 mg·L-1BRs处理的樟树叶片Fv/Fm和Fv/Fo随着氯化钠浓度的变化不显著。
2.4.2 BRs对盐胁迫下樟树叶片Fv′/Fm′和ФPSⅡ的影响 图3表明:有效光化学量子产量Fv′/Fm′和实际光化学量子产量ФPSⅡ有相似的变化趋势,当樟树没受到盐胁迫时,BRs降低了Fv′/Fm′和ФPSⅡ值,随着氯化钠浓度的增加对照的Fv′/Fm′和ФPSⅡ有明显的下降趋势,BRs减缓了这种下降趋势,且以质量浓度为0.2,0.3 mg·L-1的BRs减缓效果最好。当氯化钠浓度达到100 mmol·L-1以后,经过BRs处理过的樟树叶片Fv′/Fm′和ФPSⅡ值比对照高,氯化钠浓度为150 mmol·L-1时,经过0.2 mg·L-1的BRs处理的樟树Fv′/ Fm′和ФPSⅡ值比对照分别高15.4%,4.9%。

图1 BRs对氯化钠胁迫下樟树叶片相对含水量的影响Figure 1 Effects of BRs on the relative water content of Cinnamomun camphora leaf under NaCl stress
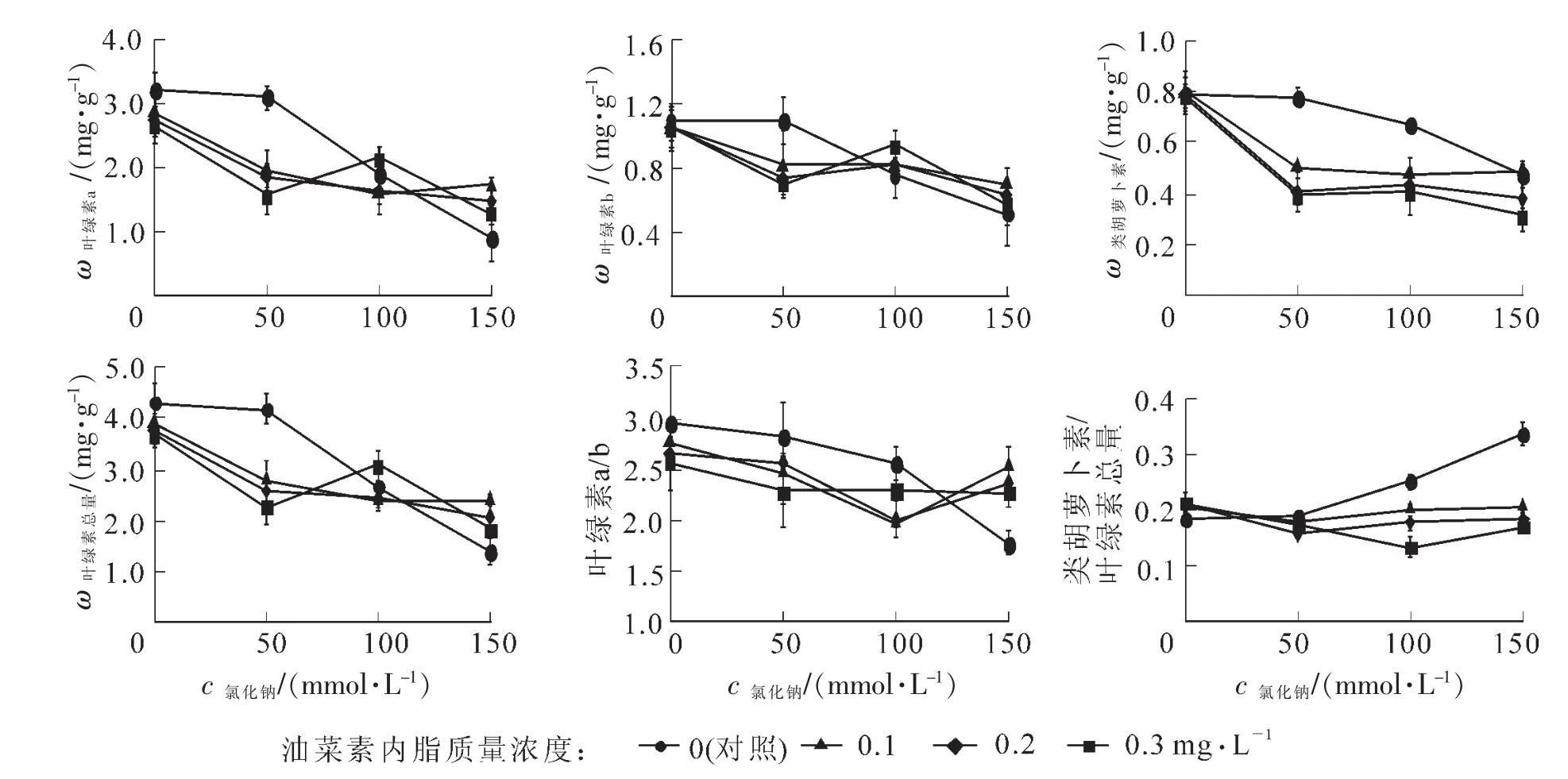
图2 BRs对氯化钠胁迫下樟树叶片光合色素的影响Figure 2 Effects of BRs on the photosynthetic pigments of Cinnamomun camphora leaf under NaCl stress
2.4.3 BRs对盐胁迫下樟树叶片qP和qN的影响 当樟树没受到盐胁迫时,BRs增加了光化学猝灭系数qP和非光化学猝灭系数qN的值,随着氯化钠浓度的增加,对照的qP逐渐加大,qN先增大后减少,当氯化钠浓度达150 mmol·L-1时,显著低于对照。经过0.3 mg·L-1的BRs处理过的樟树在氯化钠浓度为50 mmol·L-1时,qP和qN的值显著低于对照,当氯化钠浓度为100和150 mmol·L-1时,qP略高于对照,qN显著高于对照,0.2 mg·L-1的BRs对这2个氯化钠浓度处理下的qN也有显著增高作用。

图3 BRs对氯化钠胁迫下樟树叶片叶绿素荧光参数的影响Figure 3 Effects of BRs on the chlorophyll fluorescence parameters of Cinnamomun camphora leaf under NaCl stress
3 结论与讨论
盐分对植物的危害主要是离子毒害、渗透胁迫,引起养分亏缺[20]。盐害指数是反映盐胁迫对幼苗伤害程度的一个重要指标。本研究中经过BRs处理过的樟树盐害指数显著低于对照,0.3 mg·L-1的油菜素内酯(BRs)处理的樟树在150 mmol·L-1的氯化钠浓度下,盐害指数为45.8%,远低于对照组在50 mmol· L-1盐浓度下的盐害指数,说明BRs减轻了樟树幼苗的盐害症状。研究证明,植物受盐胁迫越严重,其叶片吸水越困难,相对含水量也越低[21]。本研究中0.2和0.3 mg·L-1的BRs显著提高了樟树叶片相对含水量,显著减缓了相对含水量随着氯化钠浓度快速降低的趋势。
光合作用是植物最基本的生命活动,是植物合成有机物质和获取能量的根本源泉,它的强弱对于植物生长、产量及抗逆性都具有重要的影响。叶片光合色素含量是反映植物光合能力的一个重要指标,许多研究证实,环境因子的改变可以引起光合色素含量的变化,进而引起光合功能的改变[22]。色素是类囊体膜的重要组成成分,是光能的受体,其中叶绿素a有利于吸收长波光,叶绿素b有利于吸收短波光,类胡萝卜素既是光合色素,又是内源抗氧化剂,除在光合作用中具有一定的功能外,在细胞内还可吸收剩余能,猝灭活性氧,从而防止膜脂过氧化[23]。胡萝卜素/叶绿素比值的高低与植物忍受逆境的能力有关,叶绿素a/b比值的变化能反映叶片光合活性的强弱。本试验中,在高盐胁迫下,叶绿素a,叶绿素b,叶绿素总量,类胡萝卜素,叶绿素a/叶绿素b均明显降低,而类胡萝卜素/叶绿素比值明显上升,主要原因是高盐胁迫下叶绿素酶失活,使叶绿素分解[24];另外,由于类胡萝卜素质量分数的降低,减少了对活性氧的猝灭,导致细胞内积累较多的氧自由基,破坏叶绿体膜结构,加速叶绿素的分解[25],从而降低光合作用中光能的吸收和传递。经过BRs处理过的樟树在低盐浓度下虽然叶绿素a,叶绿素b,叶绿素总量,类胡萝卜素,叶绿素a/b均低于对照,但随着盐浓度的增加,却降低很小,胡萝卜素/叶绿素比值也并不升高,可能是由于BRs的作用提高了高盐胁迫下叶绿素酶的活性,促进了叶绿素的合成,还可能是由于BRs的作用,稳定了细胞内某些抗氧化酶类及抗氧化物质(如类胡萝卜素)的活性,使活性氧产生降低,减轻了叶绿体膜结构受损程度,使植物更有利于吸收光能,增强了植物的光合活性[26],还有可能是BRs降低了高盐浓度对樟树叶片类囊体垛叠程度的削弱程度,缓解了叶片的光抑制,增强了抵抗氧化胁迫的能力[27]。
叶绿素荧光参数与光合作用中的各种反应密切相关,包含许多光合作用信息,极易受逆境的影响,它的变化可反映出逆境对光合作用某些过程的影响,是快速、灵敏、无损伤的研究和探测逆境条件下光合机构运转情况的理想方法[28]。Fv/Fm和Fv/Fo分别代表PSⅡ原初光能转化效率和PSⅡ的潜在活性,Fv/ Fm(最大光能转化效率)在非胁迫环境下因植物种类的不同而异,但其降低程度是反应植物光合机构受环境胁迫损伤程度的重要指标[29],Fv/Fo代表从Chla/b蛋白复合体LHCP到PSⅡ的光能传递能力[30]。本研究中,在高盐胁迫下,Fv/Fm和Fv/Fo均显著下降,此时PSⅡ产生伤害,PSⅡ的光化学活性及能量转化率下降,光合作用降低,经过BRs处理过的樟树叶片下降趋势变缓,且均高于对照组的Fv/Fm和Fv/Fo,这是由于BRs缓解了这种伤害,经过BRs处理过的樟树叶片光合机构比对照更不受盐胁迫影响,尤以质量浓度为0.2 mg·L-1效果最佳。
Fv′/Fm′为光适应下PSⅡ有效光化学量子产量,反映了在光适应条件下PSⅡ反应中心完全开放时的光化学效率[31],ФPSⅡ为作用光下PSⅡ实际光化学效率[32],能够反映PSⅡ反应中心原初光能捕获效率,是叶片用于光合电子传递的能量占所吸收光能的比例,常用于表示植物光合作用的电子传递量子产额,较高的ФPSⅡ值有利于提高植物的光能转化效率,促进碳同化的高效运转和有机物的积累[33]。本研究中,在100和150 mmol·L-1氯化钠浓度下,0.2和0.3 mg·L-1的BRs显著提高了樟树叶片的Fv′/Fm′和ФPSⅡ。这表明BRs能提高樟树高盐胁迫下叶片的光能转换效率。
光化学猝灭系数qP反映的是PSⅡ天线色素吸收的光能用于光化学电子传递的份额,其值增加,说明PSⅡ的电子传递活性增高;其值下降,说明PSⅡ反应中心的开放比例和参与固定的能量减少[34],非光化学猝灭系数qN反映的是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分,非光化学能量耗散的提高,有助于耗散过剩的激发能,缓解环境对光合作用的影响[35]。研究结果显示:在高盐浓度下,樟树叶片的qN显著降低,而经过0.2和0.3 mg·L-1BRs处理过的樟树叶片qN却降幅很小,这表明BRs提高了樟树在高盐浓度下非光化学能量的耗散,使得过剩的激发能降低,从而缓解了高盐胁迫对其光合系统的影响。
[1] 韩浩章,王晓立,章颖,等.盐胁迫对秋季香樟幼苗抗氧化酶系统和光合特性的影响[J].浙江农业学报,2014,26(5):1235-1239.
HAN Haozhang,WANG Xiaoli,ZHANG Ying,et al.Effect of salt stress on photosynthetic characteristic and antioxidant enzyme system of Cinnamomum camphora seedlings in autumn[J].Acta Agric Zhejiang,2014,26(5):1235-1239.
[2] 梅海军,王宁,李自阳,等.NaCl和Na2SO4胁迫对香樟幼苗生理特性的影响[J].西北林学院学报,2011,26(6):30-34.
MEI Haijun,WANG Ning,LI Ziyang,et al.Effects of NaCl and Na2SO4saline stress on ecophysiological characteristics of Cinnamomum camphora seedling[J].J Northwest For Univ,2011,26(6):30-34.
[3] 赵清贺.香樟抗寒抗盐生理特性的的研究[D].郑州:河南农业大学,2009.
ZHAO Qinghe.Studies on Characteristics of Physiological of Cinnamomum camphora under Chilling Stress and Salt Stress[D].Zhengzhou:Henan Agricultural University,2009.
[4] 冯娟.NaCl胁迫对樟树苗木生理特性的影响及氮素的缓解效应[D].福州:福建农林大学,2013.
FENG Juan.Effects of NaCl Stress on Physiological Characteristics of Cinnamomum camphora and the Mitigative Effect of Nitrogen[D].Fuzhou:Fujian Agriculture and Forestry University,2013.
[5] BAIGUZ A,HAYAT S.Effects of brassinosteroids on the plant responses to enviromental stresses[J].Plant Physiol Biochem,2009,47(1):1-8.
[6] STEBER C M,MCCOURT P.A role for brassinosteroids in germination in Arabidopsis[J].Plant Physiol,2001,125(2):763-769.
[7] 寇江涛,师尚礼.2,4-表油菜素内酯对盐胁迫下紫花苜蓿种子萌发及幼苗生长的影响[J].草原与草坪,2015,35(1):1-7.
KOU Jiangtao,SHI Shangli.Effects of 2,4-epibrassinolide on seed germinafion and seedling growtn of Medicago sativa under salt stress[J].Grassl Turf,2015,35(1):1-7.
[8] 吴雪霞,查丁石,朱宗文,等.外源2,4-表油菜素内酯对盐胁迫下茄子种子萌发和幼苗生理特性的影响[J].植物生理学报,2011,47(6):607-612.
WU Xuexia,CHA Dingshi,ZHU Zongwen,et al.Effects of exogenous 2,4-epibrassinolide on seed germination,physiological characteristics of eggplant seedlings under NaCl stress[J].Plant Physiol J,2011,47(6):607-612.
[9] 刘金隆,高会玲,洪立洲,等.植物色素在 24-表油菜素内酯调节耐盐性中的作用[J].西北植物学报,2013,33(1):90-100.
LIU Jinlong,GAO Huiling,HONG Lizhou,et al.Role of plant pigments in the 24-epibrassinplide ameliorating salt stress in canola[J].Acta Bot Boreal-Occident Sin,2013,33(1):90-100.
[10] 束红梅,郭书巧,沈新莲,等.油菜素内酯对NaCl胁迫下棉花幼苗生理特性的影响[J].江苏农业学报,2011,27(6):1198-1202.
SHU Hongmei,GUO Shuqiao,SHEN Xinlian,et al.Cotton physiology affected by brassinosteroid under NaCl stress[J].Jiangsu J Agric Sci,2011,27(6):1198-1202.
[11] 陆晓民,杨威.油菜素内醋对氯化钠胁迫下黄瓜幼苗的缓解效应[J].应用生态学报,2013,24(5):1409-1414.
LU Xiaomin,YANG Wei.Alleviation effects of braddinolide on cucumber seedlings under NaCl stress[J].Chin J Appl Ecol,2013,24(5):1409-1414.
[12] 马梅,刘冉,郑春芳,等.油菜素内酯对盐渍下油菜幼苗生长的调控效应机器生理机制[J].生态学报,2015,35(6):1837-1844.
MA Mei,LIU Ran,ZHENG Chunfang,et al.Regulation of exogenous brassinosteroid on growth of salt-stressed canola seedling and its physiological mechanism[J].Acta Ecol Sin,2015,35(6):1837-1844.
[13] SHU Hongmei,GUO Shuqiao,GONG Yuanyong,et al.Effects of brassinosteroid on salinity tolerrance of cotton[J].Agric Sci Technol,2014,15(9):1433-1437.
[14] 刘金隆.油菜素内酯调控双子叶植物耐盐性的效应及其机制[D].南京:南京农业大学,2013.
LIU Jinlong.The Effects and Mechanisms of Brassinolide Regulating Salt Resistance of Three Dicotyledons[D]. Nanjing:Nanjing Agricultural University,2013.
[15] 史燕山,骆建霞,张涛,等.核果类果树砧木耐盐性差异的研究[J].西北农林科技大学学报(自然科学版)2004, 32(3):45-48.
SHI Yanshan,LUO Jianxia,ZHANG Tao,et al.Study on difference of salt-tolerance between stone fruit rootstock[J].J Northwest A&F Univ Nat Sci Ed,2004,32(3):45-48.
[16] 李合生,孟庆伟,夏凯,等.现代植物生理学[M].北京:高等教育出社,2002.
[17] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出社,2000.
[18] 高俊凤,孙群.植物生理学实验指导[M].西安:陕西科学技术出版社,1986.
[19] 蒋明义,荆家海,王韶唐.渗透胁迫对水稻幼苗膜脂过氧化及体内保护系统的影响[J].植物生理学报,1991,17(1):80-84. JIANG Mingyi,JING Jiahai,WANG Shaotang.Effects of osmotic stress on membrane-lipid peroxidation and endogenous protective systems in rice seedlings[J].Acta Phytophysiol Sin,1991,17(1):80-84.
[20] BAYUELO-JIMENEZ J S,CRAIG R,LYNCH J P.Salinity tolerance of phaseolus species during germination and early seedling growth[J].Crop Sci,2002,42(5):1584-1594.
[21] 郑延海.盐胁迫对不同冬小麦品种的影响及钾营养对其缓解机理研究[D].泰安:山东农业大学,2007.
ZHENG Yanhai.Research of Effects on Different Winter Wheat Cultivars under Salinity Stress and Potassium Nutrition Allevitory Mechaniam[D].Tai’an:Shandong Agricultural University,2007.
[22] 朱新广,张其德.NaCl对光合作用影响的研究进展[J].植物学通报,1999,16(4):332-338.
ZHU Xinguang,ZHANG Qide.Advances in the research on the effects of NaCl on photosynthesis[J].Chin Bull Bot,1999,16(4):332-338.
[23] WILLEKENS H,van CAM W,van MONTAGU M,et al.Ozone,sulfur dioxide,and ultraviolet-B have similareffects on mRNA accumulation of antioxidant genes in Niwtiana plumbaginifolia L.[J].Plant Physiol,1994,106(3):1007-1014.
[24] 刘家尧,衣艳君,张其德.盐胁迫对不同抗盐性小麦叶片荧光诱导动力的影响[J].植物学通报,1998,15(2):46-49.
LIU Jiayao,YI Yanjun,ZHANG Qide.Effects of salt stress on chlorophyll a fluorescence induction kinetics in wheat leaves with different salt tolerance[J].Chin Bull Bot,1998,15(2):46-49.
[25] SAKAKI T,KONDO N,SUGAHARA K.Breakdown of photosynthetic pigment and lipids in spinach leaves with ozone fumigation:role of active oxygens[J].Physiol Plant,2006,59(1):28-34.
[26] OWLES S B.Photoinhibition of photosythesis induced by visible light[J].Ann Rev Plant Physiol,1984,35(1):15-44.
[27] MCCORD J M,FRIDOVICH I.Superoxide dismutase:an enzymic funnction for erythrocuprein(hemocuprein)[J]. J Biol Chem,1969,244(22):6049-6055.
[28] GENTY B,BRLANTAIS J M,BAKER N R.The relationship between quantum yield of photosynthetic electron transportand quenching of chlorophyll fluorescence[J].Biochim Biophys Acta Gen Subiect,1989,990(1):87-92.
[29] 陈建明,俞晓平,程家安.叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].浙江农业学报,2006,18(1):51-55.
CHEN Jianming,YU Xiaoping,CHENG Jiaan.The application of chlorophyll fluorescence kinetics in the study of physiological responses of plants to environmental stresses[J].Acta Agric Zhejiang,2006,18(1):51-55.
[30] 苏行,胡迪琴,林植芳,等.广州市大气污染对两种绿化植物叶绿素荧光特性的影响[J].植物生态学报,2002,26(5):599-604.
SU Xing,HU Diqin,LIN Zhifang,et al.Effect of air pollution on the chlorophyll fluorescence characters of two afforestation olants in Guangzhou[J].Acta Phytoecol Sin,2002,26(5):599-604.
[31] 孙宪芝,郑成淑,王秀峰.高温胁迫对切花菊 ‘神马’光合作用与叶绿素荧光的影响[J].应用生态学报,2008,19(10):2149-2154.
SUN Xianzhi,ZHENG Chenshu,WANG Xiufeng.Effects of high temperature stress on photosynthesis and chlorophyll flurescence of cut flower chrysanthemum(Dendranthem agrandiflora‘Jinba’)[J].Chin J Appl Ecol,2008,19(10):2149-2154.
[32] 周朝彬,宋于洋,王炳举,等.干旱胁迫对胡杨光合和叶绿素荧光参数的影响[J].西北林学院学报,2009,24(4):5-9.
ZHOU Chaobin,SONG Yuyang,WANG Bingju,et al.Effects of drought stress on photosynthesis and chlorophyll flurescence parameters of Populus euphratica[J].J Northwest For Univ,2009,24(4):5-9.
[33] 吕芳德,徐德聪,侯红波,等.5种红山茶叶绿素荧光特性的比较研究[J].经济林研究,2003,21(4):4-7.
LÜ Fangde,XU Decong,HOU Hongbo,et al.Comparative study on chlorophyll flurescence character of five kinds of Camellia[J].Nonwood For Res,2003,21(4):4-7.
[34] 曹玲,王庆成,崔东海.土壤镉污染对4种阔叶树苗木叶绿素荧光特性和生长的影响[J].应用生态学报,2006,17(5):769-772.
CAO Ling,WANG Qingcheng,CUI Donghai.Impact of soil cadmium contamination on chlorophyll flurescence characters and biomass accumulation of four broad-leaved tree species seedlings[J].Chin J Appl Ecol,2006,17(5):769-772.
[35] 赵佐平.施肥对渭北旱塬富士苹果产量及品质的影响[D].杨凌:西北农林科技大学, 2009.
ZHAO Zuoping.Effect of Fertilization on Yield and Quality of Fuji Apple in Wei-bei Drd-land of Shaanxi[D]. Yangling:Northwest A&F University,2009.
BRs,photosynthetic pigments,and chlorophyll fluorescence parameters in Cinnamomum camphora seedlings with NaCl stress
WANG Jinping,ZHANG Jinchi,YUE Jianmin,YOU Yanhuang,ZHANG Liang
(Collaborative Innovation Center of Sustainable Forestry in Southern China of Jiangsu Province,Key Laboratory of Soil and Water Conservation and Ecological Restoration in Jiangsu Province,Nanjing Forestry University,Nanjing 210037, Jiangsu,China)
To provide a theoretical basis for improvement of Cinnamomum camphora(camphor)salt resistance, a photosynthetic adjustment function of the brassinosteroids (BRs)root treatment to camphor with NaCl stress was studied.Potted plants having different concentrations(0.1,0.2 and 0.3 mg·L-1)of BR root treatments were added to camphor seedlings with distilled water as a control.Salt stress was applied with NaCl concentrations of 0,50,100,and 150 mmol·L-1,3 replications was designed.Results showed that BRs reduced the salt injury index.With an increase in salt concentration,BRs also lessened the decrease in Chla,Chlb,Chl,Car,and Chla/b;improved the increase in range of Car/Chl.When the salt concentrations from 100 mmol·L-1to 150 mmol·L-1,BRs can inhibit the decrease in Chla/b and the increase in range of Car/Chl signifigantly(P<0.05). BRs can also improved the relative water content of leaves,Fv/Fm,Fv/Fo,Fv′/Fm′,and ФPSⅡfor salt stress with higher values;improved the photochemical energy dissipation,and when the concentrations of BRs is 0.2 and 0.3 mg·L-1,it can improved the relative water,Fv/Fm,Fv/Foand the photochemical energy dissipation signifigantly(P<0.05).Thus,with camphor,BRs were beneficial for capturing,absorbing,transferring,and convert-ing light energy,for improving leaf photosynthetic activity,for alleviating the impact of high salt stress on the photosynthetic system,and for reducing the inhibitive effect of high salt on camphor. [Ch,3 fig.1 tab.35 ref.]
plant physiology;Cinnamomum camphora;brassinosteroids (BRs);NaCl stress;photosynthetic pigment;chlorophyllfluorescence parameters
Q945.78;S792.23
A
2095-0756(2017)01-0020-08
2015-12-01;
2016-01-20
江苏省科学技术计划项目(BE2012344);江苏省高校优势学科建设工程资助项目(PAPD);江苏省林业 “三新”工程资助项目(LYSX[2014]05)
王金平,从事水土保持研究。E-mail:943517134@qq.com。通信作者:张金池,教授,博士生导师,从事林业生态工程、水土保持与荒漠化防治等研究。E-mail:zhang8811@njfu.edu.cn
浙 江 农 林 大 学 学 报,2017,34(1):28-35
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2017.01.005
