羟基自由基诱导DNA损伤机理研究进展
2017-02-18樊岫珊
樊岫珊
(陕西师范大学 体育学院, 西安 710119)
羟基自由基诱导DNA损伤机理研究进展
樊岫珊
(陕西师范大学 体育学院, 西安 710119)
自由基反应在生命科学中扮演重要的角色。在正常情况下,人体内自由基的产生与清除处于平衡状态,从而确保人体健康。运动时,一系列的生化反应导致机体内清除自由基的能力不足以平衡运动应激产生大量自由基,而使机体内自由基含量急剧增加。过多的自由基会导致DNA的结构改变,如糖苷脱落或碱基氧化,从而引起DNA永久性损伤,导致代谢异常,从而诱发各种疾病。重点阐述羟基自由基(·OH)诱导DNA所含4种碱基氧化和糖苷断裂机制的研究进展,旨在对DNA的损伤机理、过程有全面理解,以期对后期实验提供理论基础。
自由基;运动;DNA;损伤
自由基在生命科学中扮演重要的角色[1-2]。自由基数量轻微增长可增加机体抗氧化剂系统活力,增强预防机体损伤能力;但当机体中的自由基超过一定数量时,这些自由基就会攻击细胞膜,对身体造成各种各样的伤害,并随着破坏层次逐渐扩展造成功能性损伤,从而导致机体的衰老和疾病[3-4]。运动时身体的耗氧量和耗能量急剧增加,这促使机体产生更多的自由基,导致细胞分子损伤[5],进而诱发疾病[6-9]。研究表明[10],与生命活动相关的自由基,主要有O、C、N、S、H中心自由基以及过渡金属离子,但对O中心自由基的探究最为活跃。近年来,有关活性氧(ROS)自由基对DNA损伤机理受到人们广泛关注,ROS自由基诱导DNA损伤的机理研究也成为控制和改造基因研究的一个重要课题。
自由基的产生与人体运动训练、机体疲劳损伤和恢复机制存在着密切关系。在运动训练中如何快速清除体内产生的自由基,实现机体快速恢复,这对提高运动能力、减轻运动疲劳和损伤有着重要的现实意义。因此,深入研究自由基诱导的DNA损伤,了解自由基反应对机体分子损伤机理具有十分重要的意义。本文将就ROS中的一类重要自由基——·OH自由基对DNA损伤进行了综述,从分子角度探讨运动损伤与自由基产生的机理,为科学的训练,提高运动成绩提供理论依据。
1 DNA损伤类型
DNA结构的完整性对于正常生理活动至关重要,然而,DNA时刻面临着来自于生物体内部自由基的侵袭,而造成各种损伤。从其损伤形式主要可分为自由基对DNA碱基的修饰以及DNA链断裂[11-16]。如果这些损伤得不到及时修复,细胞的正常生命活动就会受到影响,生物体将产生深刻的功能性、遗传性变化,从而引起衰老和疾病[17-18]。
1.1 自由基与碱基组分的反应
DNA中的碱基包括鸟嘌呤、腺嘌呤、胸腺嘧啶和胞嘧啶。这4类碱基是富含电子的芳杂环结构物质,性质非常活泼,容易被自由基氧化损伤。所以,嘌呤和嘧啶碱基也是自由基进攻的主要靶点[19]。
1.1.1 鸟嘌呤
在这4类碱基中,由于鸟嘌呤(G)的还原电位最低,因而G是·OH自由基进攻DNA的首要位点[20]。·OH自由基容易与G反应导致DNA的损伤,但是对于其反应机理,文献中一直存在争议。如图1所示,Galano等[21]认为是·OH自由基直接单电子氧化G(产物Ⅴ),Candeias等[22]认为是·OH与G加成(产物Ⅰ、Ⅱ、Ⅲ、Ⅳ),则Chatgilialoglu等[23]认为是·OH直接夺取G的H原子(产物Ⅵ)。Kumar等[24]针对Singh等[25]提出的·OH自由基加成到G的反应机理,通过理论方法进行比较,认为·OH加成到C=C键上反应路径相对于·OH直接抽取G上的氢具有竞争优势。
·OH自由基与G反应的位点为G分子中的C4、C5、C8以及C2位置[23],但C2位置加合物的量非常小。生成的自由基加合产物量中,C4-OH>C8-OH>C5-OH>C2-OH。这些自由基加合物具有氧化、还原的两面性,如C4-OH和C5-OH加合自由基脱水能转化成具有氧化性的自由基。C4-OH的脱水产物如图1所示,C5-OH有相似的脱水产物。Mundy等[26]研究了气相下G与·OH自由基的抽氢反应。结果表明,在C4、C8和NH2位都会发生脱氢反应,但NH2位是最易脱氢位点。G受到损伤后还可使嘌呤开环,生成甲酰氨基嘧啶。它与8-OH鸟嘌呤构成DNA氧化性损伤体外检测的重要标志[27]。 但食物中的8-OH鸟嘌呤可以通过消化系统进入机体,不能精确反映机体DNA损伤程度;8-OH脱氧鸟苷则不能通过此途径进入机体,故8-OH脱氧鸟苷可精确反映机体DNA损伤程度。由于自由基对DNA的氧化损伤产物众多,仅测定一种产物并不能完全代表DNA的损伤程度。现在,亦有人测定8-OH脱氧腺苷和5-羟基胞嘧啶的含量来确定DNA的损伤程度。

图1 鸟嘌呤与羟基自由基主要反应机理Fig 1 Reactions of guanine with hydroxyl radicals
Ⅰ为C2-OH加合自由基;Ⅱ为C5-OH加合自由基;Ⅲ为C4-OH加合自由基;Ⅳ为C8-OH加合自由基;Ⅴ为鸟嘌呤自由基阳离子;Ⅵ为N中心自由基;Ⅶ为C4-OH加合自由基异构体
1.1.2 腺嘌呤
一些课题组研究了腺嘌呤与·OH自由基的反应[28-29],但理论上得到的结果却很少。对于腺嘌呤不同位点的脱氢有过一些研究和报道,但重要的脱氢反应的机理并没有阐明。Cheng等[30]针对·OH自由基加成到腺嘌呤上的反应做了深入的理论研究,并分析了各个位点上脱氢反应,最终得出N62的过渡态能量最低、动力学上最容易进行脱氢。
研究[31-32]表明,·OH自由基会攻击腺嘌呤的C4-C5双键和C8位置,生成C4-OH(产物Ⅱ)、C5-OH(产物Ⅲ)和C8-OH(产物Ⅳ)自由基,如图2所示。由于腺嘌呤的还原电势比G高,因而它不易与氧发生反应。与G一样,腺嘌呤与·OH自由基的反应主要发生在双键上,从而形成各种自由基加合物。其中加合物的量与G加合产物的量有类似的数量关系,即C4-OH>C8-OH>C5-OH>C2-OH。与G的C4-OH自由基加合物不同,腺嘌呤的C4-OH与O2较易发生反应,但腺嘌呤的C8-OH自由基加合物更易与O2反应。Evangelista等[33]研究了氢原子加成到腺嘌呤的反应过程,并预测腺嘌呤的C8位是氢原子最易加成的位点。自由基与腺嘌呤反应物C8-OH腺嘌呤加合机理相似加合物自由基上一个电子氧化和一个电子被还原,分别生成8-OH腺嘌呤和4,6-二氨基-5-甲酰胺基嘧啶,从而造成DNA损伤。

图2 腺嘌呤与羟基自由基主要反应机理Fig 2 Reactions of adenine with hydroxyl radicals
1.1.3 胸腺嘧啶
如图3所示,·OH自由基在DNA分子中能与胸腺嘧啶的C5-C6的双键加成可形成胸腺嘧啶5-羟基-6-基自由基(Ⅰ)和6-羟基-5-基自由基(Ⅱ),也可与胸腺嘧啶分子中的CH3发生抽氢反应,生成烯丙基自由基(Ⅲ)。
由于·OH自由基具有强的亲电性,使得胞嘧啶中电子密度较高的C5位优先被进攻,故产物中5-羟基-6-基自由基含量较高。对胸腺嘧啶而言,·OH自由基加合到C5位置上能达60%,C6位置能达30%。胸腺嘧啶C5-OH加合物具有还原性,然而其C6-OH加合物具有强氧化性。理论计算表明,C6-OH自由基的氧化性是DNA碱基中所有具有氧化性的自由基中碱性最强的物质。烯丙基自由基既无氧化性,又无还原性。
自由基本身可以被氧化或还原,取决于其氧化还原性大小以及反应对象[34]。如胸腺嘧啶C5-OH自由基加合·OH自由基通过氧化或还原过程均可形成胸腺嘧啶二元醇。
在氧化体系中,胸腺嘧啶的5-羟基-6-基自由基反应形成5-羟基-6-过氧基自由基,再脱氧,最终形成胸腺嘧啶二元醇,此过程可以清除体内的O2。胸腺嘧啶乙二醇也是体外检测DNA氧化性损伤的重要标志。与鸟嘌呤类似,食物中的胸腺嘧啶乙二醇也可以通过消化系统进入机体,但胸腺嘧啶二醇脱氧核苷则不可以。故胸腺嘧啶二醇脱氧核苷可精确反映机体DNA氧化损伤。
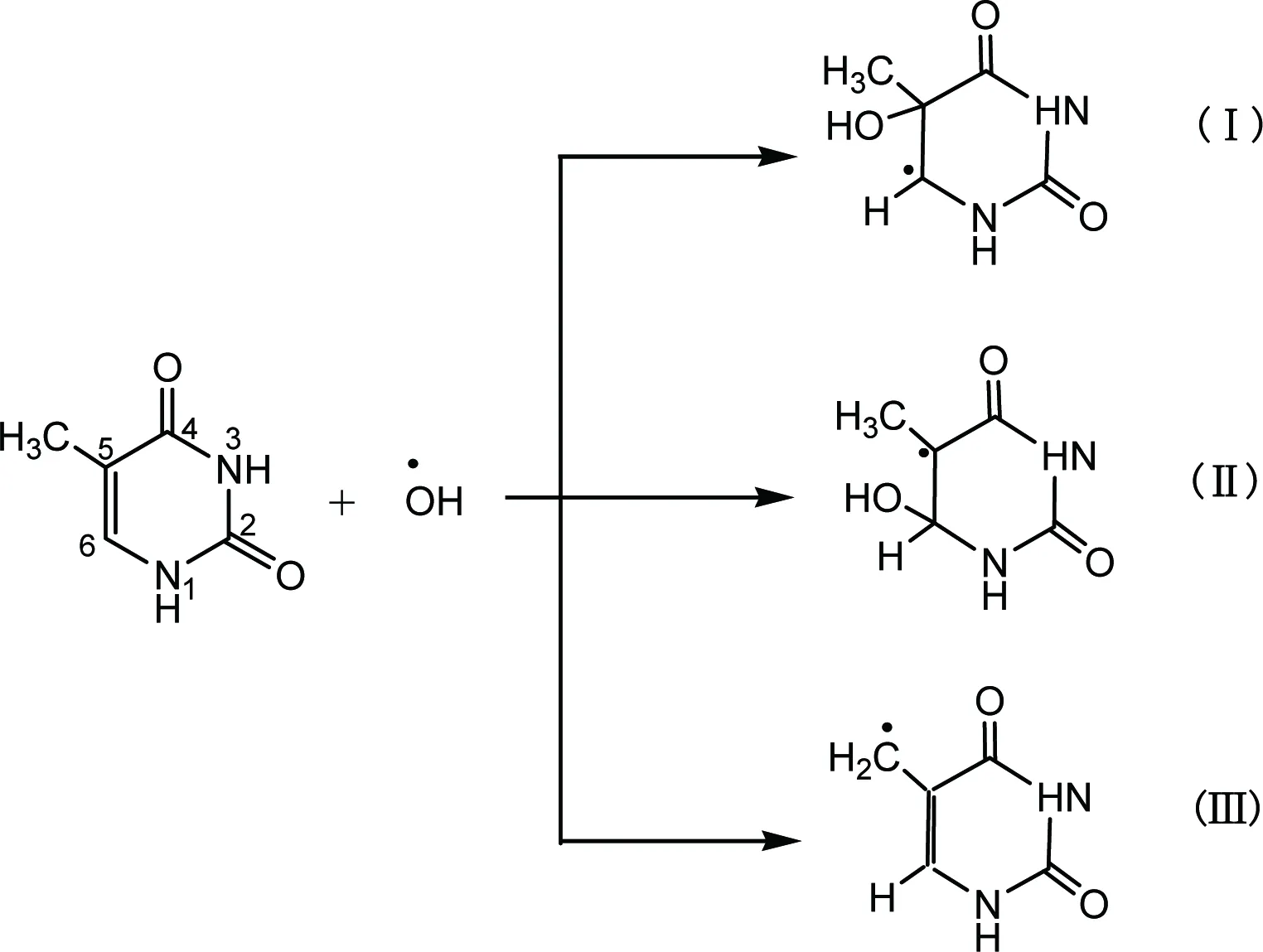
图3 胸腺嘧啶与羟基自由基反应机理Fig 3 Reactions of thymine with hydroxyl radicals
1.1.4 胞嘧啶
·OH自由基在胞嘧啶的C5和C6位发生加成,分别生成C5-OH(产物Ⅰ)、C6-OH(产物Ⅱ)和C4-OH(产物Ⅲ)加合物自由基(图4)。对胞嘧啶而言,·OH加合到C5位置量远大于C6位置。C5-OH加合物自由基具有还原性,而C6-OH加合物自由基具有弱氧化性,C4-OH加合物自由基也可被氧化,但其形成机理尚不明确。胞嘧啶有类似与胸腺嘧啶的机理形成胞嘧啶二元醇。胞嘧啶C5位羟基化的特征产物5-OH胞苷是一类重要的DNA氧化损伤产物,也是诱导突变的一种关键物质[35]。
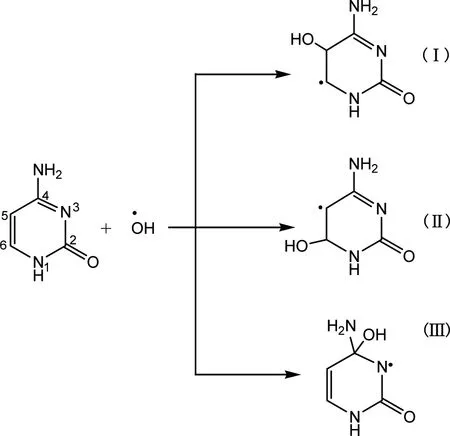
图4 胞嘧啶与羟基自由基反应机理Fig 4 Reactions of cytosine with hydroxyl radicals
1.2 自由基与DNA链断裂
DNA损伤的另一具体表现就是链断裂[15-16],图5为DNA一级结构片段。由图5可知,DNA糖环上有7个H原子,·OH自由基对DNA链的损伤,主要表现为·OH自由基对糖环上H的抽提。该反应是自由基诱发的DNA链断裂初始过程中的重要反应。

图5 DNA结构链片段Fig 5 The structure of DNA chain
·OH自由基对DNA中脱氧核糖的进攻量不足20%,但脱氧核糖分子中不同位点上的H原子均可被夺取,进而形成脱H自由基,这些自由基导致磷酸二酯键断裂进而引起DNA主链断裂。·OH直接夺取糖环上的H原子后形成了以C为中心的自由基,H原子转移顺序以及转移后形成的自由基的稳定性是研究糖环损伤要考虑的重要问题。目前认为C-H键的强度和H原子被氧化剂攻击的可能性决定H被夺取的难易程度。实验结果表明[36-37],夺取糖环上不同H原子的难易程度为H5′> H4′> H3′≈H2′> H1′。DNA链中,不同位置上的H原子被夺取后形成分子链断裂的标志产物如表1[16]。
表1 DNA糖环中不同位置抽取损伤产物
Table 1 The DNA scission product from sugar moiety
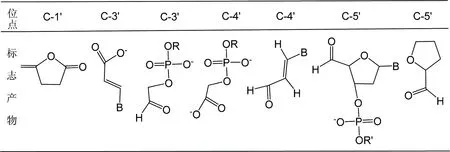
结果表明,DNA链断裂的数量远高于·OH自由基进攻脱氧核糖的量,这也印证了从碱基加合物自由基向脱氧核糖自由基的转化。如·OH加合到嘌呤碱基上形成C8-OH加合物自由基后,部分发生单分子开环反应,进而形成分子内或分子间的氢抽取反应,最后导致核酸链的断裂。此外,H原子还可通过加成反应加合到DNA碱基的双键上,形成的H-加合物自由基,从而引起链断裂;电子加成到DNA结构中的糖-磷酸盐-糖片段上,形成不同位点为中心的自由基离子,而后导致C-N糖苷键或C-O磷酸二酯键等的断裂,最终造成DNA损伤。
2 结论
本文对·OH自由基引起的DNA损伤机理过程展开了讨论,综述了·OH自由基对不同碱基损伤以及DNA分子链断裂的机理。纵观目前的研究可知,DNA的损伤机理十分复杂多样,且有不同种类的最终损伤产物。同时,这也为损伤DNA的检测、修复以及各种疾病的诊治提供了理论依据。当然,还存在许多未知,继续深入的研究将有助于我们增强对DNA损伤的理解,为后期实验提供理论指导。
[1]VALAVANIDIS A,VLAHOGIANNI T,DASSENAKIS M,et al. Molecular biomarkers of oxidative stress in aquatic organisms in relation to toxic environmental pollutants [J]. Ecotoxicol Environ Saf, 2006, 64(2):178-189.
[2]VALDEZ L B,ARNAIZ S L,BUSTAMANTE J,et al. Free radical chemistry in biological systems [J]. Biol Res, 2000, 33(2):65-70.
[3]SOHAL R S,ORR W C. The redox stress hypothesis of aging [J]. Free Radic Biol Med, 2012, 52(3):539-555.
[4]CANUGOVI C,MISIAK M,FERRARELLI L K,et al. The role of DNA repair in brain related disease pathology [J]. DNA Repair,2013, 12(8):578-587.
[5]KALYANARAMAN B. Teaching the basics of redox biology to medical and graduate students: oxidants,antioxidants and disease mechanisms [J]. Redox Biol, 2013, 1:244-257.
[6]ZIECH D,FRANCO R,PAPPA A,et al. Reactive oxygen species (ROS)-induced genetic and epigenetic alterations in human carcinogenesis [J]. Mutat Res, 2011, 711(1-2):167-173.
[7]BORGHINI A,CERVELLI T,GALLI A,et al. DNA modifications in atherosclerosis: from the past to the future [J]. Atherosclerosis,2013, 230(2):202-209.
[8]苟三玉,顾玉海. 氧自由基在部分肺部疾病发病中的作用[J]. 当代医学,2016,22(4):14-15.
[9]姜 玥,王 丹,姚 遥,等. 平哮饮对哮喘模型小鼠氧自由基代谢的影响[J]. 宁夏医学杂志,2016,38(2):103-105.
[10]CAI H X, LUO J M, LONG X, et al. Free-radical oxidation and superoxide dismutase activity in synovial fluid of patients with temporomandibular disorders [J]. J Orofac Pain, 2006, 20(1):53-58.
[11]CADET J, RAVANAT J L, TAVERNAPORRO M, et al. Oxidatively generated complex DNA damage: tandem and clustered lesions [J]. Cancer letter, 2012, 327(1-2):5-15.
[12]CUI L, YE W J, PRESTWICH E G, et al. Tannenbaum comparative analysis of four oxidized guanine lesions from reactions of DNA with peroxynitrite,singlet oxygen,and γ-radiation[J]. Chem Res Toxicol, 2013, 26(2):195-202.
[13]FLEMING A M, BURROWS C J. G-Quadruplex folds of the human telomere sequence alter the site reactivity and reaction pathway of guanine oxidation compared to duplex DNA[J]. Chem Res Toxicol, 2013, 26(4):593-607.
[14]DEDON P C. The chemical toxicology of 2-deoxyribose oxidation in DNA[J]. Chem Res Toxicol, 2008, 21(1):206-219.
[15]PITIé M, PRATVIEL G. Activation of DNA carbon-hydrogen bonds by metal complexes[J]. Chem Rev, 2010, 110(2):1018-1059.
[16]POGOZELSKI W K, TULLIUS T D. Oxidative strand scission of nucleic acids: routes initiated by hydrogen abstraction from the sugar moiety[J]. Chem Rev, 1998, 98(3):1089-1108.
[17]XIE H J, SUN T T, LEI Q F,et al. Understanding hydrogenation of the adenine-thymine base pairs and their anions: a density functional study[J]. Int J Quantum Chem, 2012, 112(2):609-618.
[18]PHANIENDRA A, JESTADI D B, PERIYASAMY L. Free radicals:properties,sources,targets,and their implication in various diseases [J]. Ind J Clin Biochem, 2015, 30(1):11-26.
[19]BREEN A P, MURPHY J A. Reactions of oxyl radicals with DNA[J]. Free Radic Biol Med, 1995, 18(6):1033-1077.
[20]MURAKAMI, HANEDA, MAKINO, et al. Prooxidant action of furanone compounds: implication of reactive oxygen species in the metal-dependent strand breaks and the formation of 8-hydroxy-2′-deoxyguanosine in DNA [J]. Food Chem Toxicol, 2007, 45(7):1258-1262.
[21]GALANO A, ALVAREZ-IDABOY J R. Guanosine + OH radical reaction in aqueous solution: a reinterpretation of the UV-vis data based on thermodynamic and kinetic calculations [J]. Org Letter, 2009, 11(22):5114-3117.
[22]CANDEIAS L P, STEENKEN S. Reaction of HO*with guanine derivatives in aqueous solution: formation of two different redox-active OH-adduct radicals and their unimolecular transformation reactions. Properties of G (-H)*[J]. Chemistry, 2000, 6(3):475-484.
[23]CHATGILIALOGLU C, ANGELANTONIO M, GUERRA M, et al. A reevaluation of the ambident reactivity of the guanine moiety towards hydroxyl radicals [J]. Angew Chem Int Ed Engl, 2009, 48(12):2114-2117.
[24]KUMAR A, POTTIBOYINA V, SEVILLA M D. Hydroxyl radical (·OH) reaction with guanine in an aqueous environment: a DFT study[J]. J Phys Chem B, 2011, 115(50):15129-15137.
[25]SINGH T A, RAO B S, O′NEILL P. Radical chemistry of 8-oxo-7,8-dihydro-2′-deoxyadenosine and 8-oxo-7,8-dihydro-2′-deoxyguanosine: a pulse radiolysis study[J]. J Phys Chem B, 2010, 114(49):16611-16617.
[26]MUNDY C J, COLVIN M E, QUONG A A. Irradiated guanine: a car-parrinello molecular dynamics study of dehydrogenation in the presence of an OH radical[J]. J Phys Chem A, 2002, 106(43):10063-10071.
[27]LODOVICI M, CASALINI C, CARIAGGI R,et al. Levels of 8-hydroxydeoxyguanosine as a marker of DNA damage in human leukocytes [J]. Free Radic Biol Med, 2000, 28(1):13-17.
[28]NAUMOV S, VON SONNTAG C. The energetics of rearrangement and water elimination reactions in the radiolysis of the DNA bases in aqueous solution: DFT calculations[J]. Radiat Res, 2008, 169(3):355-363.
[29]EVANGELISTA F A, PAUL A, SCHAEFER H F. Radicals derived from adenine: prediction of large electron affinities with a considerable spread [J]. J Phys Chem A, 2004, 108(16):3565-3571.
[30]CHENG Q, GU J, COMPAAN K R,et al. Hydroxyl radical reactions with adenine: reactant complexes,transition states,and product complexes[J]. Chemistry, 2010, 16(39):11848-11858.
[31]PHADATARE S D, SHARMA K K, RAO B S, et al. Spectral characterization of guanine C4-OH adduct: a radiation and quantum chemical study[J]. J Phys Chem B, 2011, 115(46):13650-13658
[32]AGNIOHTRI N, MISHRA P C. Reactivities of radicals of adenine and guanine towards reactive oxygen species and reactive nitrogen oxide species: ·OH and NO2·[J]. Chem Phys Letter, 2011, 503(4-6):305-309.
[33]EVANGELISTA F A, SCHAEFER H F. Hydrogen atom and hydride anion addition to adenine: structures and energetics[J]. Chem Phys Chem, 2006, 7(7):1471-1480.
[34]EVANS M D, DIZDAROGLU M, COOKE M S. Oxidative DNA damage and disease: induction,repair and significance [J]. Mutat Res, 2004, 567(1):1-61.
[35]GANGULY M, SZULIK M W, DONAHUE P S, et al. Thermodynamic signature of DNA damage: characterization of DNA with a 5-hydroxy-2′-deoxycytidine center dot 2′-deoxyguanosine base pair [J]. Biochemistry, 2012, 51(9):2018-2027.
[36]KODAMA T, GREENBERG M M. Preparation and analysis of oligonucleotides containing lesions resulting from C5′-oxidation[J]. J Org Chem, 2005, 70(24):9916-9924.
[37]HONG I S, GREENBERG M M. Efficient DNA interstrand cross-link formation from a nucleotide radical[J]. J Am Chem Soc, 2005, 127(11):3692-3693.
The research progress in DNA damage induced by hydroxyl radicals
FAN Xiu-shan
(School of Physical Education, Shaanxi Normal University, Xi′an 710119, China)
Free radical plays a key role in the biological science. Under the normal situation, the equilibrium state of generation and elimination of the free radicals is assured to the health of the body. When the generation of free radicals increases and tissues fail to remove it, bio-molecules will be damaged. Many lesions are produced by the highly reactive hydroxyl radical and the DNA bases or the sugar moiety in the body. DNA can be permanently damaged by free radicals, manifested as decomposition of pentose and oxidation of bases. There is an obvious evidence for an important role of free radical-induced DNA damage in the etiology of numerous diseases. This paper provides an overview of the mechanisms of DNA damage, such as oxidation of bases, breakup of sugar moiety which induced by hydroxyl radicals. A deep understanding to the mechanisms of DNA damages induced by free radical would be of outmost importance for disease prevention and treatment, and the prospect of research in DNA damage by free radicals was also presented in this paper.
free radical; sports; DNA; damage
2016-07-04;
2016-07-19
陕西师范大学科研启动基金(1110010290)
樊岫珊,博士,研究方向为运动生物化学相关研究,E-mail:xshfan@snnu.edu.cn
Q523;G804.2
A
2095-1736(2017)01-0080-05
doi∶10.3969/j.issn.2095-1736.2017.01.080
