乙肝前S1抗原的磁性免疫层析检测的影响因素研究
2017-02-18徐晓巍崔正权王祎龙贾鑫明
杜 娟, 徐晓巍, 崔正权, 王祎龙, 贾鑫明, 卢 瑛
(1. 上海海洋大学 食品学院 农业部水产品贮藏保鲜质量安全风险评估实验室 上海水产品加工及贮藏工程技术研究中心, 上海 201306; 2. 南京爱纳玛斯医药科技有限公司, 南京 211100;3. 同济大学 医学院 生物医学工程与纳米科学研究院, 上海 200092;4. 同济大学 医学院免疫学教研室, 上海 200092)
乙肝前S1抗原的磁性免疫层析检测的影响因素研究
杜 娟1, 徐晓巍1, 崔正权2, 王祎龙3, 贾鑫明4, 卢 瑛1
(1. 上海海洋大学 食品学院 农业部水产品贮藏保鲜质量安全风险评估实验室 上海水产品加工及贮藏工程技术研究中心, 上海 201306; 2. 南京爱纳玛斯医药科技有限公司, 南京 211100;3. 同济大学 医学院 生物医学工程与纳米科学研究院, 上海 200092;4. 同济大学 医学院免疫学教研室, 上海 200092)
以免疫磁珠作为检测探针,构建了以血清中前S1抗原为标志物的乙肝检测层析试纸条,并重点分析了磁珠粒径、抗体偶联量、pH值、缓冲液和反应温度对该层析检测的影响作用。研究表明,磁珠的分散稳定性对免疫层析检测有显著的影响,因此,磁珠粒径可以作为一项评判其分散稳定性的质控指标。同时,优化抗体添加量,控制层析样本pH值在6.5 ~ 9.0之间,并使用pH值更加稳定的PBS基础缓冲液都可以提高层析试纸条检测乙肝抗原的灵敏度和稳定性。可为高灵敏和高稳定性磁性免疫层析试纸条产品的研发提供理论依据。
前S1抗原; 血清样本; 乙肝检测; 免疫层析试纸条; 免疫磁珠
乙型肝炎是目前流行最广泛、危害最严重的病毒性肝炎之一。乙型肝炎病毒(Hepatitis B Virus,HBV)是一种嗜肝细胞病毒,主要引发肝细胞炎症、坏死、纤维化甚至肝癌[1-2]。在临床上,乙肝五项是HBV感染的常规检查项目。HBV的免疫学标记共3对,即表面抗原(HBsAg)和表面抗体(抗HBs或HBsAb)、e抗原(HBeAg)和e抗体(抗HBe或HBeAb)以及核心抗原(HBcAg)和核心抗体(抗HBc或HBcAb)。由于核心抗原在血液中不易检测到,因此临床上主要检测另外两对半抗原抗体,也称为“乙肝两对半”检测。研究表明,表面抗原(HBsAg)基因组分别编码S、前S1、前S2 3种蛋白[3-4]。前S1抗原(PreS1Ag)位于病毒颗粒的表面是外膜蛋白的重要组成部分,具有高度的免疫原性,是一种反映HBV复制且易于检测的血清标志物,因此检测前S1可以起到早期诊断乙肝的作用,具有重要的临床意义[5-9]。
乙肝检测的主要方法是PCR[10]和ELISA[11]。其中,HBV-DNA定量PCR因具有较高的特异性和灵敏度是目前乙肝检测的黄金标准,但是,该方法对检测人员的技术要求非常高,且成本大、耗时长,因此也限制了它的应用范围。随着技术的突破,一项基于ELISA原理设计的免疫层析检测技术逐步发展起来,该技术具有操作简便、成本低廉和检测快捷等优点,已被广泛应用于食源性致病菌、毒素或病毒的检测中[12-16]。目前,研究人员已将这种快速检测技术应用于HBV检测,获得较传统ELISA法更高的检测灵敏度和特异性,诊断效率达到97 %以上[17-19]。作为免疫层析检测中常用的标记探针,磁性纳米材料凭借其独特的磁性能,可在外加磁场的作用下方便快捷地实现目标物的分离和纯化[20-21],同时,可定量且稳定的磁信号也使得磁性免疫层析技术拥有高于其他标记探针10倍甚至1000倍的灵敏度[22]。
本课题组在磁性免疫层析试纸条检测方面已做了大量研究工作,并已经建立了以前S1为乙肝检测标志物的磁性免疫层析试纸条[23]。在此工作基础上,本研究以乙肝患者血液作为检测样本,主要分析了磁珠粒径、抗体偶联量、pH值、基础缓冲液和反应温度对乙肝检测层析试纸条的影响作用,为提高检测灵敏度及优化该项检测技术提供了思路,同时也为今后进一步开发高灵敏、高稳定性磁性免疫层析试纸条产品提供科学依据。
1 材料与方法
1.1 材料
人血清样本和前S1(PreS1)单克隆抗体由同济大学医学院免疫与炎症研究中心及南京爱纳玛斯医药科技有限公司联合提供;羧基磁珠来自同济大学医学院生物医学工程与纳米科学研究院;小鼠IgG、山羊抗小鼠二抗、硝酸纤维素膜、吸水垫、样品垫、结合垫购自上海捷宁生物科技有限公司;底板、卡槽、覆膜购自美国Magna Bioscience公司;MES(2-吗啉乙磺酸)购自Alafa公司;EDC(1-乙基-3-二甲基氨基丙基碳酰二亚胺盐酸盐)、NHS(N-羟基琥珀酰亚胺)购自美国PIERCE公司;Tween-20、蔗糖、四硼酸钠、硼酸、BSA牛血清白蛋白购于上海生工生物工程技术服务有限公司;磁信号分析仪(Magnetic assay reader,MAR)购自Magna Bioscience公司。实验用水均为去离子水,试剂均为分析纯。
1.2 方法
1.2.1 免疫磁珠的制备
采用NHS/EDC法进行抗体偶联[24]。偶联过程包括活化、偶联、封闭和保存4个步骤。首先,取1 mg羧基磁珠,以MEST(pH 5.0,含0.05 %Tween-20(V/V)的MES溶液)作为活化缓冲液,加入5 μL EDC(0.5 g/mL)和10 μL NHS(0.25 g/mL)活化剂,室温圆周反应30 min以活化磁珠表面的羧基;接着以硼酸盐吐温缓冲液(简称BST,pH 9.0,含0.05 % Tween-20)作为偶联缓冲液,加入一定量的抗体室温圆周反应3 h,将抗体偶联到磁珠上;偶联结束后,加入含1 % BSA(M/V)的BST溶液(简称BST-BSA)室温圆周反应30 min以封闭残留的活化羧基;最后将偶联好的免疫磁珠悬浮于含0.05%(M/V) NaN3的BST-BSA溶液中,4℃保存待用。
1.2.2 ELISA法测定抗体偶联量
由于偶联过程后留存的上清液中还残留未偶联的抗体,因此我们利用ELISA法定量偶联上清液中抗体量,并根据下面公式计算得到偶联量和偶联率:
抗体偶联量(μg)=加入的抗体的量-上清中的抗体量
抗体的偶联率(%)=(加入的抗体量-上清中的抗体量)/加入的抗体量×100%
标准曲线是用一系列梯度浓度的小鼠IgG为样品,并测试其在490 nm处的吸光度值。待测样品为免疫磁珠相应的偶联上清液。
1.2.3 免疫层析试纸条的组装
所用层析试纸条均为实验室自制[25-26]。首先将硝酸纤维素膜CN140贴在透明底板上,然后将吸水垫、结合垫、样品垫依次衔接在底板上,之后用喷膜仪在硝酸纤维素膜上喷点抗体,其中,乙肝表面抗体(HBsAb)喷点在T线区域作为检测线,山羊抗小鼠IgG喷点在C线区域作为质控线,之后37℃烘干2 h,然后将透明覆膜覆盖在硝酸纤维素膜上,最后将组建好的试纸裁切成0.5 cm宽的免疫层析试纸条(图1)。

图 1 免疫层析试纸条结构示意图Fig 1 Structure schematic of immunochromatographic test strip
1.2.4 检测流程
检测前,首先取一定量保存液中的免疫磁珠用BST洗涤2次,然后加入磁珠悬浮液(含10 mg/mL海藻糖、10 mg/mL蔗糖的BST)进行适当超声分散后制成免疫磁珠悬浮液。检测时,以10 mmol/L磷酸盐缓冲液(PBS,pH 7.2)为层析体系的基础缓冲液。小牛血清为阴性样本,乙肝患者血清样本为阳性样本。取120 μL血清样本、14 μL层析体系、6 μL免疫磁珠悬浮液室温混合均匀,然后将混合溶液滴加到试纸条的样品垫上,层析一段时间后,肉眼观察C线、T线区域的条带进行定性检测,并待层析完全后,将试纸条卡入卡槽中置于磁信号分析仪(MAR)中读取磁信号值以获得定量检测结果。
1.2.5 层析体系加速破坏实验
将分别由PBS和BS缓冲液配置的层析体系置于37℃下加速破坏2、4、6、8、10、12和14 d,并在每个时间节点下分别测试pH值和层析试纸条检测。
2 结果与分析
2.1 结果判定
本实验构建的免疫层析试纸条是基于“双抗夹心”的反应原理,因此若在检测区域呈现两条明显的条带或者T线条带比C线条带颜色浅均为阳性结果;若仅在C线处出现一条带为阴性结果;若C线处没有条带,则试纸条存在问题,结果视为无效。在定量测试时,MAR仪可同时读取试纸条上C线和T线处的磁信号值。因此,我们以阳性样本与阴性样本的T线磁信号的比值(S/N)对检测结果进行评价,当S/N≥ 2.1,其结果视为阳性,当S/N< 2.1,其结果视为阴性。另外,当磁信号值低于60时,条带肉眼不可见,其结果也视为阴性。同时,我们以S/N值和T线磁信号值作为层析性能的间接评价指标。
2.2 磁珠粒径对层析检测的影响
分别将6种不同粒径大小的磁珠在免疫PreS1抗体后进行层析检测评价,结果如表1所示。从表1中可见,6种磁珠在免疫层析检测中的阴性样本值都比较低,并随着粒径增大有逐渐降低的趋势。从阳性血清样本检测值来看,在不同样本稀释度下,T线磁信号值均随着磁珠粒径增大而逐渐降低。对比发现,当检测低浓度血清样本时(1∶128),1号和2号磁珠的T线磁信号分别为119和73,在肉眼可见范围,其S/N值分别为4.31和2.29,结果为阳性;而其他4种磁珠(3号~ 6号)的T线磁信号值均低于60,肉眼不可见,检测结果均判为阴性。这说明了1号和2号磁珠的层析性能最好,更适用于开发高灵敏度层析检测。
从表中6种磁珠的多分散系数(PDI)可以看出,随着水合粒径的增大,6种磁珠的PDI在逐渐增大,这说明了磁珠在溶液中的分散稳定性逐渐降低[27-28]。并且在偶联抗体实验中,5号和6号磁珠极易团聚成大颗粒,出现沉降现象。在类似的研究中,Yan等[29]对比200 nm和1000 nm磁珠在免疫层析检测副溶血性弧菌时发现,200 nm的磁珠更适用于免疫层析检测,并发现随着磁珠粒径增大,磁响应越强,粒子间因各向异性产生的偶极矩作用增大,在溶液中有更大的团聚倾向,因此在层析检测中较大团聚体的免疫磁珠更容易滞留在结合垫和硝酸纤维素膜接合处,出现堵塞现象,从而导致C线和T线条带颜色变浅、检测值降低。因此,我们认为磁珠的分散稳定性对免疫层析应用有很大影响,并且,磁珠的粒径可以作为一个质控指标来判断磁珠的分散稳定性能。
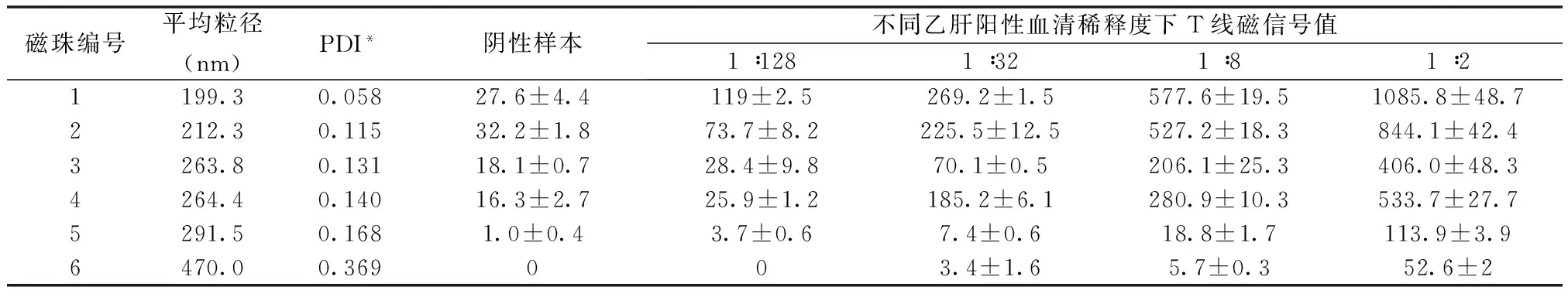
表1 磁珠粒径对免疫层析检测的影响Table 1 Effect of hydrodynamic size of magnetic nanobeads on the immunochromatographic assay
*:PDI为多分散系数
2.3 抗体偶联量对层析检测的影响
为探讨抗体偶联量对层析检测的影响,我们取1 mg磁珠分别在80 μg、100 μg、120 μg和140 μg的抗体添加量下进行PreS1抗体偶联,并将制得的4种免疫磁珠用于免疫层析检测乙肝血清样本。其中,以乙肝弱阳性血清和阳性血清作为阳性血清样本,牛血清作为阴性血清样本。
经ELISA法测定的抗体偶联量和偶联率如图2-a所示。当添加80 ~120 μg抗体时,偶联量和偶联率均随着抗体添加量的增加而增加,并当抗体添加量为120 μg时,偶联率达到最大;而当添加140 μg时,虽然抗体偶联量进一步增大,但相应的偶联率却在降低。图2-b中显示了4种免疫磁珠的层析T线磁信号值。从图中可见,抗体添加量对4种免疫磁珠检测阴性和弱阳性样本的磁信号值影响不大。但对比阳性样本磁信号值,我们发现随着抗体添加量增加其磁信号值逐渐增大,而对于添加140 μg的免疫磁珠,其磁信号值却在降低。因此,我们认为在制备免疫磁珠时,抗体添加量的增加有利于磁珠表面实际偶联量的增加,并对免疫层析检测有促进作用,然而当抗体添加量进一步增大时,虽然实际抗体偶联量增大,但其偶联率却降低,并且因较多抗体包覆也会降低免疫磁珠的分散稳定性,从而降低其免疫层析性能[30]。所以综合考虑,选择合适的抗体添加量在制备免疫磁珠和免疫层析检测时都是一个需要重点关注的因素。

图2 抗体偶联量对免疫层析检测的影响Fig 2 Effect of coupled antibody on immunochromatographic assay
a:抗体偶联量和偶联率;b:免疫层析T线磁信号值
2.4 pH值对层析检测的影响
在层析检测前,将待测血清样本与层析液混合得到的层析样本,用4 %乙酸和1 mol/L NaOH分别调节pH值至5.5、6、6.5、7、7.5、8、8.5、9、9.5和10。图3显示了pH值对层析检测的影响。从图3-a中可以看到不同pH值下层析试纸条检测的定性照片,而图3-b是其相应的定量磁信号值。结果显示,当pH值较低或较高时,层析样本的磁信号值都相对较低;而当pH值为8和8.5时,层析磁信号值最高。综合定性和定量结果我们发现,当层析样本的pH值在6.5 ~ 9时,其T线条带颜色变化细微,且相应磁信号值的变化也不大,因此在利用免疫层析试纸条进行乙肝检测时,控制层析样本的pH值在6.5~9之间均可。

图3 pH值对免疫层析检测的影响Fig 3 Effects of pH values on immunochromatographic assay
a:试纸条定性照片;b: 试纸条定量检测值
2.5 基础缓冲液对层析检测的影响
本研究主要对比分析了两种常用的基础缓冲液(PBS和BS)对层析检测的影响,结果如图4所示。在两种基础缓冲液配置的层析体系的加速破坏实验中,我们分别测试了每个时间节点下层析体系的pH值(图4-a),并应用于层析检测评价(图4-b)。结果发现,随时间推移,以PBS为基础的层析体系,其pH值变化极小,而以BS为基础的层析体系pH值变化较大,37℃下加速14 d后,其pH值降低了0.5。从相应时间下的层析磁信号值来看,在PBS为基础的层析体系中,其层析磁信号值相对稳定,CV值为12.33 %,而以BS为基础的层析体系,其层析磁信号值变化较大,CV值为24.76%,且呈下降趋势。采用Origin软件进行t检验分析,我们发现两种层析体系下的层析检测值在0.05水平上具有显著性差异。从2.4中pH值对层析检测的影响可知,当层析样本的pH值低于6.5时,将不利于层析检测,因此,为了保证层析检测的灵敏度和稳定性,使用PBS基础缓冲液来进行层析体系的配置是较好的选择。
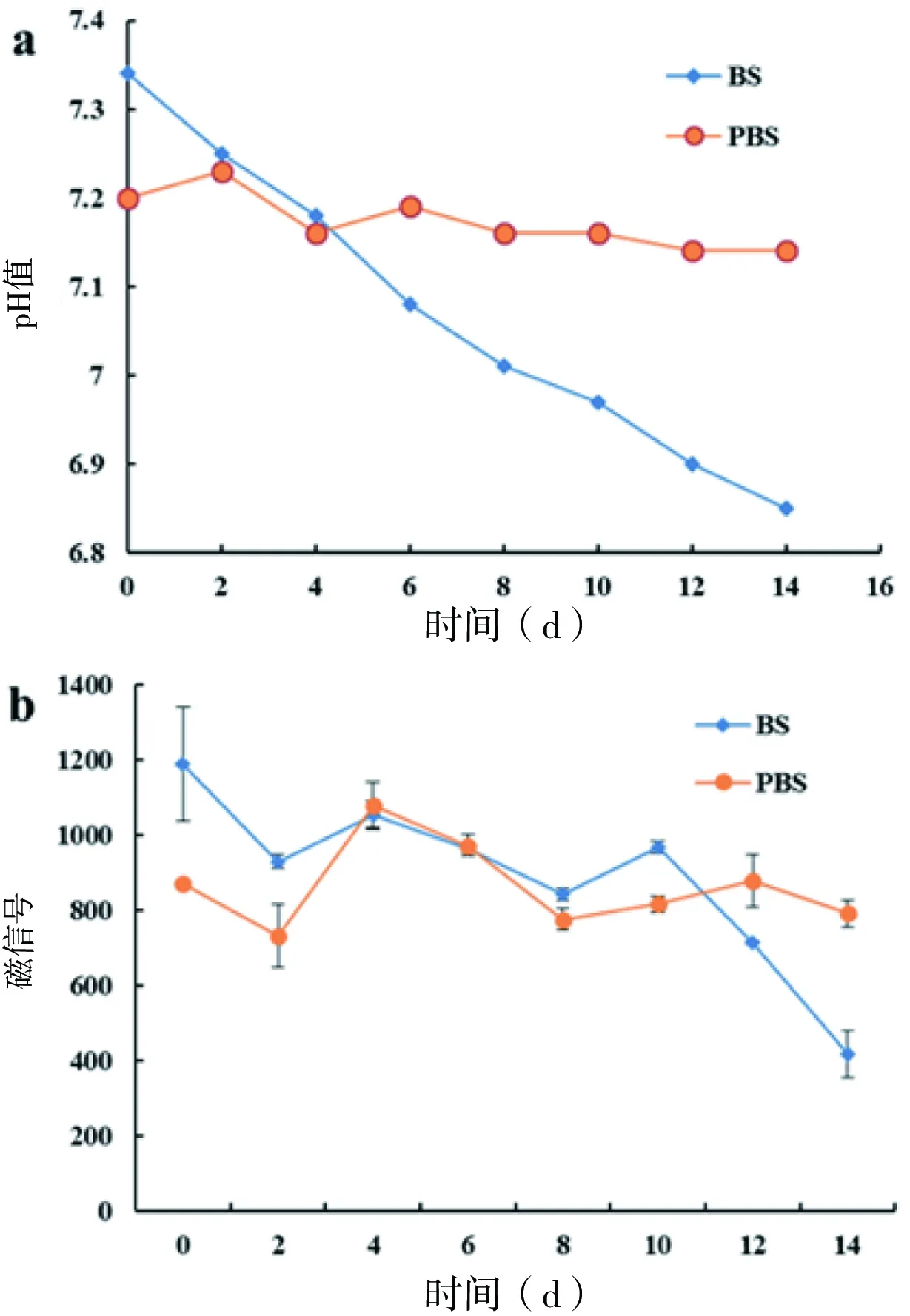
图4 两种基础缓冲液对免疫层析检测的影响Fig 4 Effect of buffer on immunochromatographic assay
a:pH值变化;b:磁信号值变化
2.6 反应温度对层析检测的影响
本实验分别设置了4℃、15℃、25℃和37℃下的层析检测,结果如图5所示。由图5可知,随着层析反应温度增大,其阴性样本检测值均在60以下,变化不大;而其阳性血清样本的层析磁信号值随温度逐渐增大,并在37℃时磁信号值达到最大,其CV值在10 %以下,说明检测值稳定;而在室温下,平行试纸条的磁信号值相差较大,检测稳定性较差。经过分析,这种由反应温度带来的差异很可能是与抗体反应活性有关,37℃是抗原抗体反应的最适温度,因此更有利于免疫层析检测。
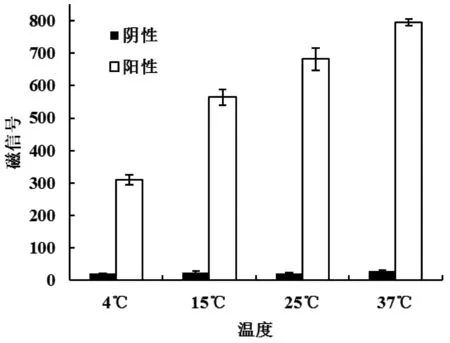
图5 反应温度对层析检测的影响Fig 5 The effect of reaction temperature on immunochromatographic assay
3 结论
本研究以免疫磁珠作为检测探针,构建了以血清中前S1抗原为标志物的乙肝检测层析试纸条,并重点分析了磁珠粒径、抗体偶联量、pH值、缓冲液和反应温度对该层析检测的影响作用。研究表明,磁珠的分散稳定性对免疫层析检测有很大的影响,磁珠的粒径可以作为一个质控指标来判断磁珠的分散稳定性能,在本研究中选用200 nm的磁珠更有利于层析检测。根据文献报道及本课题组多年研究成果可知,单分散且均一的磁珠有利于提高其检测稳定性[31],并且在类似的研究中,Wang等[32]也发现磁珠的粒径会影响层析泳动速率进而影响检测时间,因此粒径越小的磁珠适用于层析检测。另外,优化合适的偶联抗体添加量也是提高层析检测灵敏度的一个关键点,在制备免疫磁珠用于层析检测前S1抗原时,1 mg磁珠添加120 μg抗体是最优条件。同时,控制层析样本pH值在6.5 ~ 9之间,使用pH值更稳定的PBS基础缓冲液,以及37℃的检测温度都有利于提高乙肝检测层析试纸条的灵敏度和稳定性。综上,我们认为本研究结果可为高灵敏和稳定的磁性免疫层析试纸条的研发提供理论指导,进而拓展这项检测技术的应用范围。
[1]邓燕玲. 乙肝DNA定量及五项与S1抗原联合检测的临床意义[J]. 海南医学院学报,2013, 19(3): 399-400.
[2]KIM J H, GRIPON P, BOUEZZEDINE F, et al. Enhanced humanization and affinity maturation of neutralizing anti-hepatitis B virus preS1 antibody based on antigen-antibody complex structure [J]. FEBS Letters, 2015, 589(2): 193-200.
[3]NEBBIA G, PEPPA D, MAINI M K. Hepatitis B infection: current concepts and future challenges [J]. QJM, 2012, 105(2): 109-113.
[4]王黎明,贺洪军. 乙肝前S1抗原在乙肝两对半模式中的表达及意义[J]. 现代医药卫生,2011,27(1):108-109.
[5]GANEM D, PRINCE A M. Hepatitis B virus infection-natural history and clinical consequences [J]. New England Journal of Medicine, 2004, 350(11): 1118-1129.
[6]徐肖丁,张义文,周锦霞,等. 联合检测乙肝五项、前S1抗原与乙肝DNA的临床应用[J]. 实验与检验医学,2011,29(4): 366-368.
[7]ZHANG Z, LI X, YI W, et al. A monoclonal antibody specific to the non-epitope region of hepatitis B virus preS1 contributes to more effective HBV detection [J]. Clinical Biochemistry, 2013, 46(12): 1105-1110.
[8]LIAW Y F, BRUNETTO M R, HADZIYANNIS S. The natural history of chronic HBV infection and geographical differences [J]. Antiviral Therapy, 2010, 15(3): 25-33.
[9]CHEN W, ZHANG J, ZHANG J, et al. Expression of the pres1 peptide of hepatitis B virus and preparation of its polyclonal antibody [J]. Hybridoma(Larchmt), 2011, 30(6): 525-530.
[10]WANG Q, LUAN W, WARREN L, et al. Serum hepatitis B surface antigen correlates with tissue covalently closed circular DNA in patients with hepatitis B‐associated hepatocellular carcinoma [J]. Journal of Medical Virology, 2016, 88(2): 244-251.
[11]KURDI M, ABUGHARARAH M, MULIKE M, et al. Molecular detection of hepatitis B virus (HBV) among voluntary ELISA positive blood donors inAlmadinahAlmunawwarah[J]. Journal of Taibah University Medical Sciences, 2014, 9(2): 166-170.
[12]YANG Q H, WANG X, YANG J M, et al. Development of quantum dot-based lateral flow immunoassay system for rapid quantitative detection of human chorionic gonadotropin [J]. Progress in Biochemistry and Biophysics, 2014, 41(5): 497-507.
[13]SHI L, WU F, WEN Y, et al. A novel method to detect Listeria monocytogenes via superparamagnetic lateral flow immunoassay [J]. Analytical and Bioanalytical Chemistry, 2015, 407(2): 529-535.
[14]NGOM B, GUO Y, WANG X, et al. Development and application of lateral flow test strip technology for detection of infectious agents and chemical contaminants: a review [J]. Analytical and Bioanalytical Chemistry, 2010, 397(3): 1113-1135.
[15]TAKANASHI S, OKAME M, SHIOTA T, et al. Development of a rapid immunochromatographic test for noroviruses genogroups I and II [J]. Journal of Virological Methods, 2008, 148(1-2): 1-8.
[16]KLEWITZ T, GESSLER F, BEER H, et al. Immunochromatographic assay for determination of botulinum neurotoxin type D [J]. Sensors and Actuators B: Chemical, 2006, 113(2): 582-589.
[17]ANSARI M H K, OMRANI M D, VAHID M. Comparative evaluation of immunochromatographic rapid diagnostic tests (Strip and Device) and PCR methods for detection of human hepatitis B surface antigens [J]. Hepatitis Monthly, 2007, 7: 87-91.
[18]MAINET-GONZ LEZ D, PALENZUELA-GARDON D O, RUBIDO J C A, et al. Comparison between an immunochromatographic test with an amplified ELISA for detecting e antigen and anti-e antigen antibodies in chronic Hepatitis B [J]. Biotecnologia Aplicada, 2009, 26(2): 143-145.
[19]XIA X, XU Y, ZHAO X, et al. Lateral flow immunoassay using europium chelate-loaded silica nanoparticles as labels [J]. Clinical Chemistry, 2009, 55(1): 179-182.
[20]YANG Y, XU F, XU H, et al. Magnetic nano-beads based separation combined with propidium monoazide treatment and multiplex PCR assay for simultaneous detection of viableSalmonellatyphimurium,EscherichiacoliO157: H7 andListeriamonocytogenesin food products [J]. Food Microbiology, 2013, 34(2): 418-424.
[21]AMAGLIANI G, OMICCIOLI E, BRANDI G, et al. A multiplex magnetic capture hybridisation and multiplex real-time PCR protocol for pathogen detection in seafood [J]. Food Microbiology, 2010, 27(5): 580-585.
[22]LABORDE R T, O′FARRELL B. Paramagnetic particle detection in lateral-flow assays [J]. IVD Technology, 2002, 8: 36-41.
[23]徐晓巍,崔正权,卢 瑛,等. 基于磁性纳米探针的乙肝前S1抗原的快速磁性免疫层析方法的建立[J]. 生物学杂志, 2016, 33(1): 98-103.
[24]LIU Y, ZHANG Z, WANG Y, et al. A highly sensitive and flexible magnetic nanoprobe labeled immuno-chromatographic assay platform for pathogenVibrioparahaemolyticus[J]. International Journal of Food Microbiology, 2015, 211: 109-116.
[25]ZHENG C, WANG X C, LU Y, et al. Rapid detection of fish major allergen parvalbumin using superparamagnetic nanoparticle-based lateral flow immunoassay [J]. Food Control, 2012, 26(2): 446-452.
[26]李怀明,许恒毅,熊勇华. 免疫层析试纸条技术及其在食源性致病菌检测中应用的研究进展[J]. 食品科学,2011, 32(17): 380-383.
[27]WILHELM C, GAZEAU F, ROGER J, et al. Binding of biological effectors on magnetic nanoparticles measured by a magnetically induced transient birefringence experiment [J]. Physical Review E Stat Nonlin Soft Matter Phys, 2002, 65(3 Pt 1): 031404.
[28]WILHELM C, BILLOTEY C, ROGER J, et al. Intracellular uptake of anionic superparamagnetic nanoparticles as a function of their surface coating [J]. Biomaterials, 2003, 24(6): 1001-1011.
[29]YAN J, LIU Y Y, WANG Y L, et al. Effect of physiochemical property of Fe3O4particle on magnetic lateral flow immunochromatographic assay [J]. Sensors and Actuators B:Chemical, 2014, 197:129-136.
[30]XU Q F, XU H, GU H C, et al. Development of lateral flow immunoassay system based on superparamagnetic nanobeads as labels for rapid quantitative detection of cardiac troponin I [J]. Materials Science and Engineering: C, 2009, 29(3): 702-707.
[32]WANG Y Y, XU H, WEI M, et al. Study of superparamagnetic nanoparticles as labels in the quantitative lateral flow immunoassay [J]. Materials Science and Engineering: C, 2009, 29(3): 714-718.
Influences of magnetic immunochromatographic assay for detection of PreS1region of hepatitis B virus surface antigen
DU Juan1, XU Xiao-wei1, CUI Zheng-quan2, WANG Yi-long3, JIA Xin-ming4, LU Ying1
(1. Laboratory of Quality & Safety Risk Assessment for Aquatic Products on Storage and Preservation, Ministry of Agriculture, Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306; 2. Nanjing iNanoMax Medtech Limited Company, Nanjing 211100;3. The Institute for Biomedical Engineering and Nano Science,Tongji University School of Medicine, Shanghai 200092;4. Department of Immunology,Tongji University School of Medicine, Shanghai 200092, China)
To establish a rapid assay for HBV, a magnetic immunochromatographic assay (MICA) for detection of PreS1Ag in serum samples of people was developed in our study. The influences of hydrodynamic size of magnetic nanobeads, coupled antibody, pH, basal buffer, reaction temperature on the MICA were analyzed emphatically. Results showed that dispersion stability of magnetic nanobeads monitored by hydrodynamic size had a strong effect on MICA. Moreover, optimal antibody addition, proper pH value of 6.5 to 9 and using PBS with more stable pH as the basal buffer could be beneficial to improve the sensitivity and stability of MICA. The results of this research are expected to provide the theoretical guidance for the future development of MICA.
PreS1Ag; serum samples; hepatitis B test; immunochromatographic assay; magnetic nanobeads
2016-04-11;
2016-04-21
上海市科委“科技创新行动计划”生物医药领域科技支撑项目(No. 15441905900);上海市科委工程中心能力提升项目(16DZ2280300)
杜 娟,硕士,主要从事磁性复合纳米材料制备及免疫层析检测研究,E-mail:juandu12350@163.com
卢 瑛,副教授,硕士生导师,主要从事纳米生物技术,食品质量安全研究,E-mail:y-lu@shou.edu.cn
R446.6
A
2095-1736(2017)01-0011-05
doi∶10.3969/j.issn.2095-1736.2017.01.011
