荧光光谱法和分子对接研究拉米夫定、依非韦伦、替诺福韦与牛血清白蛋白的相互作用及机制Δ
2017-02-18上海市公共卫生临床中心药剂科上海201508
刘 荣(上海市公共卫生临床中心药剂科,上海 201508)
荧光光谱法和分子对接研究拉米夫定、依非韦伦、替诺福韦与牛血清白蛋白的相互作用及机制Δ
刘 荣*(上海市公共卫生临床中心药剂科,上海 201508)
目的:研究拉米夫定、依非韦伦、替诺福韦与牛血清白蛋白(BSA)的相互作用及其机制。方法:通过荧光光谱法研究不同温度下不同浓度的拉米夫定、依非韦伦、替诺福韦与BSA的结合反应,分别测定其荧光强度,根据Stern-Volmer方程等公式计算动态猝灭常数(KSV)、表观猝灭常数(Kq)、结合常数(KA)、结合位点(n)和热力学焓变(ΔH)、自由能变(ΔG)、熵变(ΔS),并运用Sybyl 6.7 Flex X模块建立这3种药物与BSA的分子对接模型。结果:3种药物与BSA相互作用的Kq均大于2.0×1010L/(mol·s),且随温度的升高而降低,n均接近于1,其热力学函数ΔG<0、ΔS<0、ΔH<0。分子对接模型显示,3种药物主要与BSA的Sudlow部位Ⅰ亚结构域发生结合。结论:3种药物与BSA之间存在相互作用,荧光猝灭方式以静态猝灭为主,结合反应为自发分子作用过程,结合作用力均以氢键和范德华力为主。荧光试验和分子对接研究结果一致,两者可相互补充。
拉米夫定;依非韦伦;替诺福韦;牛血清白蛋白;荧光光谱法;分子对接
血清白蛋白(SA)作为循环系统中最丰富的可溶性蛋白,在所有蛋白质中一直是研究最广泛的一类[1]。SA能够与许多内源性和外源性物质(如药物、氨基酸、脂肪酸、胆红素、胆汁酸、甲状腺素等)结合,起到存储和转运的作用[2-5]。在药动学(吸收、分配、代谢和排泄)中,由于在血浆中的大多数药物都与人血清白蛋白(HSA)结合,所以HSA控制着药物的分配过程,因而HSA在药动学研究中具有重要意义。前人已经做过很多这方面的研究,如Chaudhuri S等[6]通过荧光光谱法和分子对接模型研究了血红蛋白与抗氧化非瑟酮和3-羟基黄酮的相互作用;Sandhya B等[7]通过荧光光谱法、圆二色性(CD)和三维荧光研究了司他夫定与HSA的相互作用;Bocedi A等[8]通过荧光光谱研究抗人类免疫缺陷病毒(HIV)药物与HSA的结合情况。
在临床治疗中,抗HIV药物的反转录酶抑制剂能够有效抑制耐药病毒株,具有较好的抗病毒作用,目前临床已形成了稳定且有效的联合治疗方案,即高效抗反转录病毒治疗(Highly active antiretroviral therapy,HAART)。替诺福韦(Tenofovir,TFV)和拉米夫定(Lamivudine,3TC)属于核苷类反转录酶抑制剂(Nucleoside reverse transcriptase inhibitors,NRTIs),依非韦伦(Efavirenz,EFV)属于非核苷类反转录酶抑制剂(Non-nucleoside reverse transcriptase inhibitors,NNRTIs),三者联用是重要的一线抗艾滋病治疗的联合用药方案。但是目前在临床使用中发现,在中国人群中有很大部分人群在服药半年后出现耐药情况。故很有必要研究这些药物与HSA的结合情况,其对研究这些药物在体内的运输、分布、代谢是非常重要的。由于牛血清白蛋白(Bovine serum albumin,BSA)简单易得、稳定性高,与HAS高度相似,故在许多生物化学以及药理学研究中,均将BSA作为HSA的替代品[9]。笔者采用荧光光谱法和分子对接研究了拉米夫定、依非韦伦、替诺福韦与BSA的相互作用及其机制。
1 材料
1.1 仪器
LS55型荧光分光光度计(美国PerkinElmer公司);PHS-3C型pH计(上海理达仪器厂)。
1.2 药品与试剂
3TC对照品(英国葛兰素史克公司,批号:K026520,纯度:>99%);TFV对照品、EFV对照品(上海安谱科学仪器有限公司,批号:CDDM-A825000、CDDM-E425000,纯度:均>99%);BSA(上海爱紫特生物科技有限公司,批号:150320,规格:每瓶30 g);三羟甲基氨基甲烷(阿拉丁化学试剂有限公司)。
2 方法
2.1 溶液的制备
2.1.1 BSA贮备液 精密称定BSA溶于Tris-HCl缓冲液(pH 7.4,下同)中制成BSA贮备液(1.0×10-4mol/L),于4℃避光保存。
2.1.2 工作液 精密称定3TC、TFV、EFV对照品溶于Tris-HCl缓冲液中,制成最终浓度均为1.0×10-4mol/L的工作液。
2.2 光谱测定
在9个10 mL的量瓶内用微量取样器分别注入1 000 μL BSA贮备液,再分别加入不同量的工作液,使药物终浓度分别为0、1×10-7、5×10-7、1×10-6、2×10-6、5×10-6、1× 10-5、2.5×10-5、5×10-5mol/L,用Tris-HCl缓冲液定容,混匀,置于25℃的水浴中孵育2 h。于荧光分光光度计上检测,激发波长为280 nm,扫描波长范围为285~450 nm的发射光谱,观察荧光强度大小的变化并记录340 nm波长处荧光发射光谱强度。试验过程中用电子循环水浴控制样品温度。另外用同样的方法扫描在37℃下反应产物的发射光谱,观察340 nm波长处荧光强度大小的变化。
2.3 分子对接
在SGI Fuel R14000工作站上通过计算机辅助设计平台Sybyl 6.7 Flex X模块完成计算工作。BSA的晶体结构来源于蛋白质数据库(Protein databank,PDB)。3TC、TFV、EFV的初始分子结构均从其与相应目标蛋白的晶体复合物中提取。提取分子在进行分子结构修正的基础上,加氢原子及Gasteriger-Huckel电荷后进行分子优化,完成对接的配体准备工作。根据文献[8]报道的化合物类似物结合模式选择相应的结合区域,从结合区域中选择多见于与抗HIV类药物结合的氨基酸残基Trp214作为对接结合亚域的关键性残基,并且以此为中心选择10 Å的对接区域检索。对每个化合物对接计算所获得的构象,对评分排名前10位的对接构象结构进行叠合及相似性分析,选择最有代表性及合理性的对接构象进行分析。
3 结果
3.1 光谱
25℃下反应后,BSA在3种药物不同浓度下的荧光光谱图见图1。
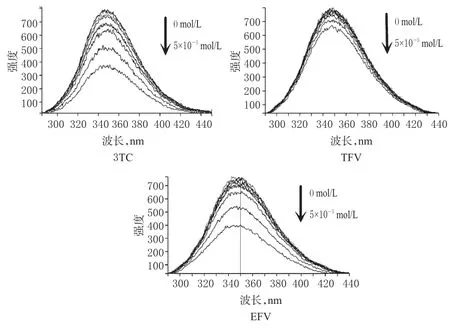
图1 BSA在3种药物不同浓度下的荧光光谱图Fig 1 Fluorescence spectroscopy of BSA under different concentrations of 3 kinds of drugs
由图1显示,保持BSA浓度不变,随着3TC、TFV、EFV浓度的增加,BSA的荧光发射强度有规律地减少,这表明3TC、TFV、EFV可以猝灭BSA的内部荧光,也发生了能量的转移,3TC、TFV、EFV与BSA之间存在相互作用。根据Stern-Volmer方程:
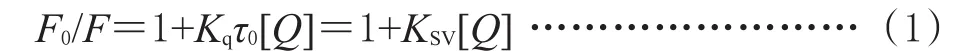
式中,F0、F分别为BSA溶液中加入荧光猝灭分子前后的荧光发射强度,Kq为表观猝灭常数,[Q]为所加入的抗病毒药物的总浓度,KSV为动态猝灭常数,τ0为BSA荧光寿命(约10-8s)。对BSA在340 nm波长处的荧光强度进行数据处理,利用公式(1)对所得数据进行线性拟合,即可求得25、37℃时,BSA与3TC、TFV和EFV相互作用的KSV、Kq和r,结果见表1。

表1 不同温度下3种药物与BSA的KSV、Kq和r测定结果Tab 1 KSV,Kqand r of 3 kinds of drugs with BSA under different temperatures
根据文献[10]中有关动态猝灭的数据,蛋白质等生物大分子的最大双分子猝灭常数是2.0×1010L/(mol·s),KSV随着温度的升高而增加。BSA与3TC、TFV、EFV相互作用的Kq均大于2.0×1010L/(mol·s),且随着温度的升高而降低,说明BSA与3TC、TFV、EFV分子间的能量转移属于非辐射转移过程,静态猝灭是BSA发生荧光猝灭的主要原因,这可能是由BSA在基态时与抗病毒药物反应形成新的配合物引起。
对于静态猝灭,猝灭剂与荧光分子之间的结合常数(KA)可由荧光强度与猝灭剂浓度的关系求出:
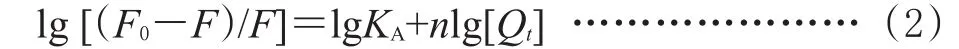
按式(2)即可计算出3TC、TFV、EFV与BSA相互作用的结合常数(KA)以及结合位点(n),结果见表2。
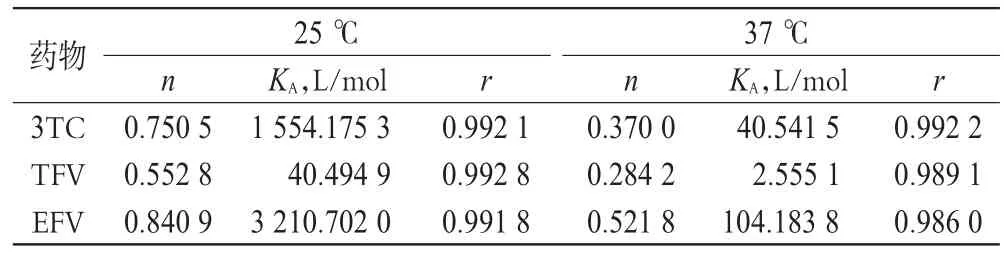
表2 不同温度下3种药物与BSA的KA与n测定结果Tab 2 KAand n of 3 kinds of drugs with BSA under different temperatures
由表2可知,BSA与3TC、TFV、EFV之间n随温度升高而降低,表明3TC、TFV、EFV与BSA之间有很强的结合力,形成了一个结合位点;r均大于0.9,表明3TC、TFV、EFV与BSA之间相互作用的结合模式符合式(2)。
3.2 热力学函数
在温度变化不大时,反应的焓变(ΔH)可以看作一个常数。通过公式可以求出反应的自由能变(ΔG),然后再分别求出ΔH和熵变(ΔS):
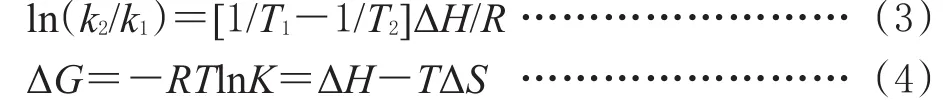
式中k1和k2分别是25、37℃下所得线性方程的截距。SA结构很复杂,其与药物之间往往同时存在几种作用力。本研究用荧光光谱法测定了BSA与3TC、TFV、EFV相互作用体系在25、37℃下的K,结合公式(3)(4)计算3TC、TFV、EFV与BSA的热力学函数,结果见表3。
由表3可知,3TC、TFV、EFV与BSA结合过程的ΔG<0、ΔS<0,表明其作用过程是一个熵和自由能均减小的自发分子作用过程;3TC、TFV、EFV与BSA结合过程的ΔH<0、ΔS<0,说明其作用力均是以氢键和范德华力为主。
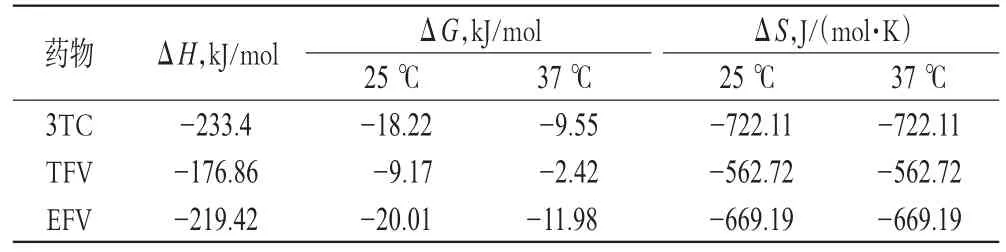
表3 不同温度下3种药物与BSA的ΔH、ΔG、ΔS测定结果Tab 3 ΔH,ΔG and ΔS of 3 kinds of drugs with BSA under different temperatures
3.3 分子对接
3种药物与BSA的分子对接模型图见图2。
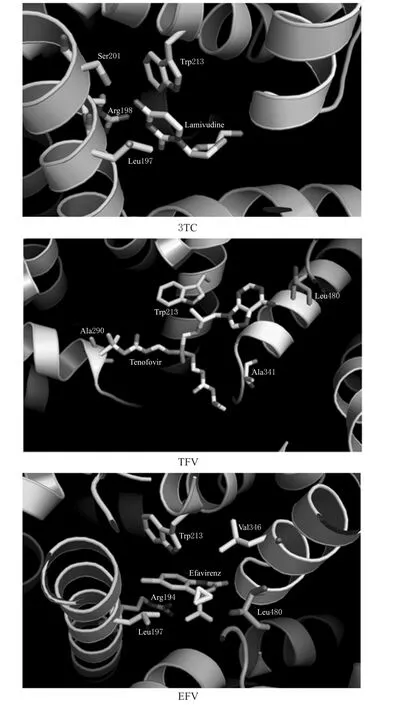
图23 种药物与BSA的分子对接模型图Fig 2 Molecular docking model of 3 kinds of drugs with BSA
由图2显示,3TC、TFV、EFV主要与BSA的SudlowⅠ亚结构域发生结合。TFV分子中的丙基侧链与Trp213形成疏水相互作用;3TC的嘧啶酮结构可与Leu197和Trp213形成“三明治”样的π-π类型相互作用;EFV与 Trp213发生类似的π-π堆积作用。
4 讨论
在本研究中,抗病毒药物与BSA的结合情况通过测定荧光光谱进行。静态猝灭是由于药物与BSA发生了配合反应,合成了不发荧光的基态或激发态的药物-BSA复合物引起的。激发态下的药物-BSA复合物一般不会快速解离而是直接返回到基态,因此复合物是荧光发生改变的主要原因,而温度升高会影响到药物-BSA复合物的合成或降低其稳定性,使KSV随着温度升高而减小。本研究结果显示,3TC、TFV、EFV与BSA间的荧光猝灭主要以静态猝灭为主。同时也发现3TC、TFV、EFV与BSA的n随着温度的升高而降低,这表明在3TC、TFV、EFV与BSA的结合过程中有以共价形式存在的相互作用,但在其中起主要作用的还是以非离子形式存在的相互作用。
药物分子和蛋白质之间的作用力主要有疏水作用力、氢键、范德华力和静电引力等。不同药物与蛋白质结合的作用力类型是不同的。从热力学观点看,在一定的温度和压力下,药物与蛋白质的结合反应能否自发进行取决于体系的ΔG,ΔG<0有利于反应的自发进行。Ross PD等[11]总结出判断生物大分子与小分子结合力性质和生物大分子自身结合力性质的热力学规律,即根据反应前后热力学ΔH和ΔS的相对大小,来判断药物与蛋白质之间的主要作用力类型:ΔH>0、ΔS>0为疏水作用力;ΔH<0、ΔS<0为氢键和范德华力;ΔH<0、ΔS>0为静电引力。本研究结果显示,3TC、TFV、EFV与BSA结合过程的ΔG<0、ΔS<0,表明其作用过程是一个熵和自由能均减小的自发分子作用过程;ΔH<0、ΔS<0,表明其作用力均是以氢键和范德华力为主。
虽然BSA共含有7个不同的结构域,能够与相应的配体发生结合,但与抗HIV药物结合的区域则相对比较保守。3TC、EFV主要与HSA的SudlowⅠ亚结构域发生结合[8]。由于TFV已知是NRTIs,并且在结构上与EFV非常接近,因此可以合理假设TFV也结合在HSA的相同位点上。本研究发现,3TC、TFV、EFV与BSA的结合模式与HSA类似;此外,考虑到BSA与抗HIV药物的相互作用可改变BSA的Trp213构象,并且诱导产生固有的色氨酸荧光猝灭效应,因此选择Trp213作为模拟药物-蛋白相互作用的关键性氨基酸残基。
根据TFV与BSA的分子对接结果,TFV分子中的丙基侧链与Trp213形成疏水相互作用,且其结构上的6-位氨基与Leu480上的酰胺基团形成氢键。3TC的嘧啶酮结构可与Leu197和Trp213形成“三明治”样的π-π类型相互作用;此外,3TC嘧啶酮上的氨基基团还与Ser201、Arg198形成了定向的氢键相互作用。此类相互作用都可能对3TC所表现出的相对较高的BSA亲和力有贡献。而EFV的苯环还可与Trp213发生类似的π-π堆积作用;此外,该苯环还可与Arg194上的碱性胍基产生一个额外的阳离子-π相互作用。这样的疏水作用同样也应对EFV的高BSA亲和力有贡献。本文所考察的3种抗HIV药物都结合在BSA的相同结构亚域(均以Trp213为中心)之中,虽然各自的结合方式并不相同,但其对血浆蛋白结合行为及潜在的药物-药物相互作用产生了影响。若患者同时服用3种药物,可导致药物在血浆中竞争结合相同位点,故三者间存在相互作用。
荧光光谱法与分子对接是研究抗病毒药物与BSA的相互作用的有效互补的2种研究方法。BSA与药物结合的信息可使研究者更好地了解药物在体内的吸收、分布情况以及药物的毒性。
[1] Zhang Y,Lee P,Liang S,et al.Structural basis of nonsteroidal anti-inflammatory drug diclofenac binding to human serum albumin[J].Chem Biol Drug,2015,86(5):1178-1184.
[2] Zsila F,Bikadi Z,Simonyi M.Probing the binding of the flavonoid,quercetin to human serum albumin by circular dichroism,electronic absorption spectroscopy and molecular modelling methods[J].Biochem Pharmacol,2003,65(3):447-456.
[3] Fanali G,Fasano M,Ascenzi P,et al.α-Tocopherol binding to human serum albumin[J].Biofactors,2013,56(3):294-303.
[4] Yue Y,Dong Q,Zhang Y,et al.Synthesis of imidazole derivatives and the spectral characterization of the binding properties towards human serum albumin[J].Spectrochim Acta A Mol Biomol Spectrosc,2016,11(153):688-703.
[5] 兰蕊,龚小保,黄利桂,等.荧光光谱法测定3种黄酮类化合物与人血清白蛋白相互作用的机制研究[J].中国药房,2016,27(22):3054-3057.
[6] Chaudhuri S,Chakraborty S,Sengupta PK.Probing the interactions of hemoglobin with antioxidant flavonoids via fluorescence spectroscopy and molecular modeling studies[J].Biophy Chem,2011,154(1):26-34.
[7] Sandhya B,Hegde AH,Seetharamappa J.Elucidation of binding mechanism and identification of binding site for an anti HIV drug,stavudine on human blood proteins[J]. Mol Biol Rep,2013,40(5):3817-3827.
[8] Bocedi A,Notaril S,Narciso P,et al.Binding of anti-HIV drugs to human serum albumin[J].IUBMB Life,2004,56(10):609-614.
[9] Bujacz A.Structures of bovine,equine and leporine serum albumin[J].Acta Crystallogr D Biol Crystallogr,2012,68(Pt10):1278-1289.
[10] Jahanban-Esfahlan A,Panahi-Azar V,Sajedi S.Spectroscopic and molecular docking studies on the interaction between N-acetyl cysteine and bovine serum albumin[J]. Biopolymers,2015,103(11):638-645.
[11] Ross PD,Subramanian S.Thermodynamics of protein association reactions:forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
Interaction between Bovine Serum Albumin with Lamivudine,Efavirenz,Tenofovir and Its Mechanism by Fluorescence Spectroscopy and Molecular Docking
LIU Rong(Dept.of Pharmacy,Shanghai Public Health Clinical Center,Shanghai 201508,China)
OBJECTIVE:To study the interaction between bovine serum albumin(BSA)with lamivudine,efavirenz,tenofovir and its mechanism.METHODS:Fluorescence spectroscopy was used to determine the interaction between BSA with different concentrations of lamivudine,efavirenz,tenofovir under different temperatures.The fluorescence intensity of them were determined respectively;quenching constant(KSV),apparent quenching constant(Kq),binding constant(KA),binding site(n),thermodynamic enthalpy change(ΔH),free energy diversification(ΔG)and entropy change(ΔS)were calculated according to Stern-Volmer equation and so on.Molecular docking model of 3 drugs with BSA was established by using Sybyl 6.7 Flex X model.RESULTS:Kqfor the interaction between 3 drugs with BSA were all higher than 2.0×1010L/(mol·s),and were decreased with the increase of temperature;all n were close to 1,and thermodynamic functions ΔG<0,ΔS<0,ΔH<0.Molecular docking model showed that 3 drugs were mainly bound with BSA at SudlowⅠ subdomain site.CONCLUSIONS:There are the interaction between 3 drugs with BSA;fluorescence quenching mainly manifests as static quenching;binding reaction belongs to spontaneous molecular action process;binding force mainly includes hydrogen bond and Van der Waals’force.The result of fluorescence experiment is consistent with those of molecular docking,and they complement each other.
Lamivudine;Efavirenz;Tenofovir;Bovine serum albumin;Fluorescence spectroscopy;Molecular docking
O657.3;R978.7
A
1001-0408(2017)01-0049-05
2016-05-17
2016-07-15)
(编辑:邹丽娟)
上海市公共卫生临床中心科研课题计划面上项目(No.2014M07)
*主管药师,硕士。研究方向:药物分析。电话:021-37990333-5313。E-mail:liurong@shaphc.org
DOI10.6039/j.issn.1001-0408.2017.01.13
