超声化学辅助法制备纳米ZnS及其对水中铜离子的吸附性能
2017-02-17刘国清李友凤曾令玮王占强谭谈曾坚贤
刘国清,李友凤,曾令玮,王占强,谭谈,曾坚贤
(1湖南科技大学化学化工学院,湖南 湘潭 411201;2湖南科技大学理论有机化学与功能分子教育部重点实验室,湖南 湘潭 411201)
超声化学辅助法制备纳米ZnS及其对水中铜离子的吸附性能
刘国清1,2,李友凤1,曾令玮1,王占强1,谭谈1,曾坚贤1
(1湖南科技大学化学化工学院,湖南 湘潭 411201;2湖南科技大学理论有机化学与功能分子教育部重点实验室,湖南 湘潭 411201)
铜污染引发的环境问题严重影响着人类的生命健康。本文以Zn(NO3)2·6H2O和Na2S·9H2O为原料,水为溶剂,通过超声化学辅助法制备出纳米ZnS,并将其应用于水中铜离子的吸附脱除。利用FTIR、XRD、SEM和N2物理吸附等手段进行表征,研究了初始浓度、接触时间、处理温度、pH和竞争阳离子等对铜离子吸附容量的影响。结果表明,制得的纳米ZnS为单一立方相闪锌矿,颗粒呈不规则块状,孔道结构主要为纳米ZnS晶粒团聚形成的聚集孔,孔径分布较宽。该纳米ZnS表现出对水中铜离子良好的吸附性能,在吸附剂量200mg/L、铜离子初始浓度400mg/L、接触时间12h、处理温度25℃的条件下,饱和吸附容量高达629.8mg/L,水中Na+和K+对吸附性能无明显影响,且其对水中铜离子的脱除机理为离子交换与吸附的协同作用。
纳米材料;硫化锌;超声化学辅助法;离子交换;吸附
近年以来我国社会经济快速发展,所带来的环境问题也日趋严重,由重金属离子造成的污染问题尤为突出。水体中的重金属离子不能降解,可通过食物链富集,严重影响生态系统[1]。铜是危害最大的重金属污染物之一,主要来源于金属电镀、清洗及漂洗。当其过量存在于人体时,易于引发生理机能紊乱导致各种疾病,严重影响人体的生命健康[2]。目前,去除水中铜金属离子的有效方法包括化学沉淀、絮凝、吸附、膜分离及电化学法等[3-8]。其中,吸附法因操作简单、处理效率高、适应范围广的优点,是目前一种主要的重金属废水处理方法[9-10]。
作为一种过渡金属硫化物,ZnS在众多领域有着广泛的应用[11]。近年以来,人们发现ZnS纳米晶可以快速大容量地脱除水中的重金属离子[12-13]。李良等[14]将纳米ZnS负载于氧化铝颗粒上,用于水中铜离子的吸附脱除,可在1min内快速脱除水中99.0%的铜离子,对Cu2+最大吸附容量高达650.0mg/g。但上述研究中,吸附材料的构效特性及吸附过程影响因素并不明确。鉴于此,本文以Zn(NO3)2.6H2O和Na2S.9H2O为原料,水为溶剂,通过超声化学辅助法制备出ZnS纳米晶,将其应用于水中铜离子的吸附脱除,对其微观结构进行表征分析,并研究了关键因素对其铜离子吸附性能的影响,以期为纳米ZnS应用于含铜废水处理提供理论指导与技术支持。
1 实验部分
1.1 试剂与仪器
Zn(NO3)2·6H2O,分析纯,西陇化工股份有限公司;Na2S·9H2O,分析纯,天津市风船化学试剂科技有限公司;CuSO4·5H2O,分析纯,西陇化工股份有限公司;盐酸、NaCl和KCl,分析纯,国药集团化学试剂有限公司;无水乙醇,分析纯,天津市富宇精细化工有限公司;蒸馏水,实验室自制,其电阻约为15MΩ。
ME204E电子天平,梅特勒-托利多仪器(上海)有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义予华仪器有限责任公司;KQ5200DE超声波清洗器,昆山市超声仪器有限公司;TG16台式高速离心机,长沙英泰仪器有限公司;DZF-6050真空干燥箱,上海精宏实验设备有限公司;雷磁PHE-3E型pH计,上海仪电科学仪器股份有限公司;UV-2600紫外-可见分光光度计,日本岛津。
1.2 纳米ZnS的制备与表征
纳米ZnS的制备参照文献[15],略有改动。称取0.40g Zn(NO3)2·6H2O和0.32g Na2S·9H2O,分别溶于45mL去离子水,然后在强搅拌条件下将Na2S溶液逐滴缓慢加入到Zn(NO3)2溶液中。混合液在室温下搅拌10min,随后转入超声波清洗器,调节功率100W,超声处理5min后去离心,所得白色固体经去离子水和无水乙醇多次交替洗涤离心后,80℃真空干燥,备用,所得材料标记为w-ZnS。为进行对比,将使用溶剂由水转变无水乙醇,其余条件不变,所制得材料标记为e-ZnS。
采用美国Thermo公司的Nicolet-380傅里叶红外光谱仪对ZnS样品进行FTIR分析,KBr压片,扫描范围400~4000cm-1。采用美国Micromeritics公司的ASAP2010V402A型物理吸附仪进行比表面积、孔容与孔径测定,在液氮温度(–196℃)下进行,采用BET模型计算样品的比表面积,利用吸附等温线数据和BJH模型计算样品的孔径分布与孔容。采用德国Bruker公司D8 Advances X射线粉末衍射仪分析样品的物相结构,使用CuKα辐射源,靶电流40mA,靶电压40kV,扫描范围10°~80°,扫描速度5°/min。采用日本株式会社的JSM-6610LV型扫描电镜仪进行形貌分析,加速电压为5KV,分析前样品先经喷金处理。
1.3 纳米ZnS对水中铜离子的吸附测定
采用紫外-可见分光光度计进行水中铜锌离子浓度测定:以pH为9的氨水为溶剂,柠檬酸铵为锌离子掩蔽剂,铜试剂为显色剂,分别配置不同浓度的Cu2+标准溶液,在波长452nm处作Cu2+的工作曲线,得到线性回归方程A=0.1916C–0.0004,R2=0.9999。以硼酸盐缓冲溶液调节pH,以硫代硫酸钠和硫脲为铜离子掩蔽剂,锌试剂为显色剂,分别配置不同浓度的Zn2+标准溶液,在波长为620nm处作Zn2+的工作曲线,得到线性回归方程A=0.369C+0.0766,R2=0.9998。
以制得ZnS样品为吸附剂,在一定的条件下对水中Cu2+进行吸附脱除,其对Cu2+吸附容量q的计算如式(1)所示。

式中,q为吸附剂对Cu2+的吸附容量,mg/g;c0和ct分别为吸附开始时与吸附进行到t时刻吸附液中Cu2+的质量浓度,mg/L;V为吸附液的体积,L;m为投入ZnS的质量,g。
2 结果与讨论
2.1 纳米ZnS的结构表征
2.1.1 FTIR光谱分析
w-ZnS的FTIR光谱谱图见于图1。由图1可知,该样品在3200~3400cm–1范围出现较宽吸收峰,可归属为表面及吸附水羟基的伸缩振动;1630cm–1处为水分子角振动吸收峰;1096cm–1、980cm–1、632cm–1、490cm–1附近则为Zn-S的强振动吸收峰。值得一提的是,FTIR谱图中在420~460cm–1间未出现对应于Zn-O的拉伸振动的弱吸收峰,这说明在制备过程中并未发生氧化反应生成ZnO。
2.1.2 X射线衍射分析
图2为w-ZnS的X射线衍射图谱。由图2可知,该样品在28.81°、47.61°和56.67°附近处出现明显的特征衍射峰,与立方相闪锌矿标准卡片(JCPDS No. 05-0566)高度吻合,分别对应其(111)、(220)和(311)晶面,且图谱中未见其他杂质峰出现,说明w-ZnS 样品为高纯度的单一立方相闪锌矿,与FTIR表征结果一致。此外,w-ZnS衍射峰的宽化表明制备的ZnS晶粒较小,由Debey-Scherrer公式在最强(111)衍射峰计算得到其平均晶粒粒径约为5.6nm。
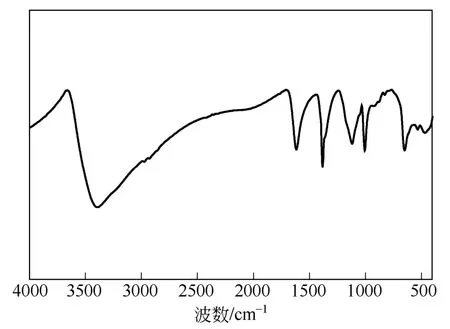
图1 w-ZnS的FTIR谱图
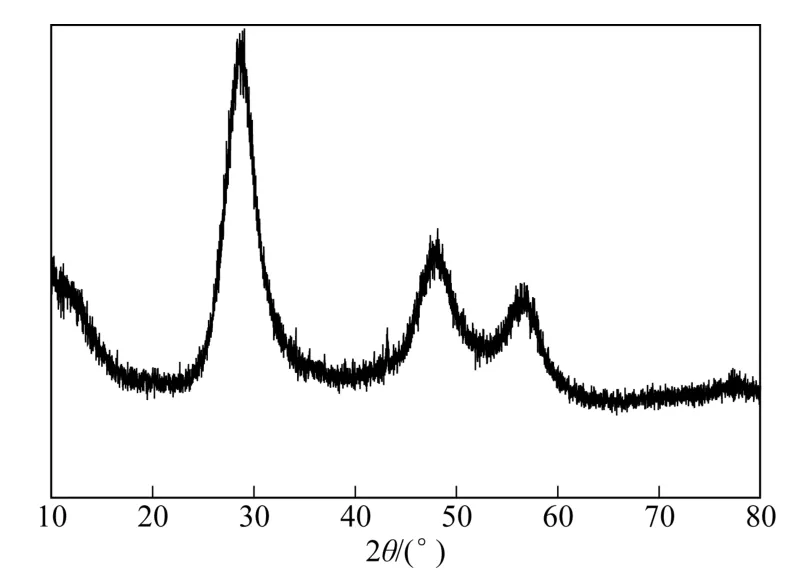
图2 w-ZnS的X射线衍射图谱
2.1.3 SEM分析
图3为w-ZnS的SEM照片。由图3可知,w-ZnS呈现为不规则块状,边缘较为尖锐,表面相对平滑,其块状大小分布在5~10μm间,厚度为3~5μm。结合X射线衍射分析结果,该块状物是由大量较小的纳米ZnS晶粒堆积生成,由于制备过程中经历高速离心收集,其团聚方式较为致密,粉碎后呈现相对较大的不规则块状。
2.1.4 N2物理吸附分析
图4与图5分别为w-ZnS的N2物理吸附脱附等温线及孔径分布曲线。由图4可知,w-ZnS的吸附脱附等温线形状近似为Ⅰ型,但吸附量上升趋势明显较标准Ⅰ型曲线平缓,在P/P0为0.36~0.65处出现明显的滞后环。由图5可知,该样品介孔范围内孔道无集中分布,且未见有大于10nm的介孔分布,计算得平均孔径约为2.2nm。这表明制备w-ZnS中有着一定量的微孔,此外在2~10nm范围内则因ZnS晶粒聚集而形成连续分散的介孔。由BET公式和BJH公式分别计算可知,w-ZnS的比表面积与孔容分别为248.2m2/g和0.15cm3/g。由XRD 结果计算可知w-ZnS的晶粒较小,其比表面积较大,但由于其孔道结构主要为微孔,缺乏集中的介孔分布,测得孔容较小。

图3 w-ZnS的SEM照片
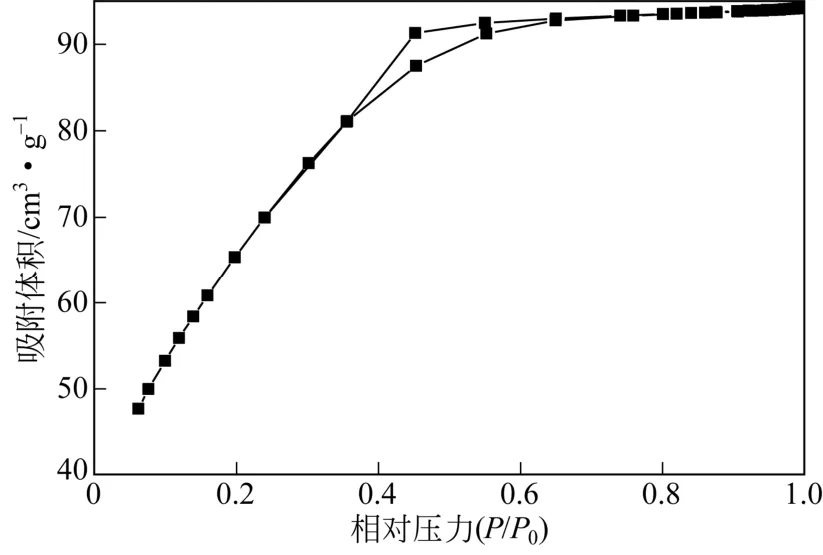
图4 w-ZnS的氮气吸附脱附等温线

图5 w-ZnS的孔径分布曲线
2.2 w-ZnS对水中铜离子吸附性能
配制75mg/L的Cu2+溶液100mL,在w-ZnS用量为1g/L、25℃下磁力搅拌,在不同接触时间下取样,离心后清液进行Cu2+浓度分析。为进行对比,在同样吸附条件下进行以e-ZnS为吸附剂的Cu2+吸附实验。两种ZnS样品对Cu2+吸附性能如图6所示。由图6可知,两种ZnS样品均表现出对水中Cu2+良好的吸附性能。当接触时间为1min,e-ZnS其对Cu2+吸附脱除率达到97.0%,之后水中Cu2+浓度随接触时间延长逐步下降。当接触时间为10min时,溶液中铜离子浓度降至0.31mg/L,超过99.9%的铜离子可被吸附脱除。与之相比,w-ZnS对Cu2+的脱除效率明显更高,1min后其对Cu2+吸附脱除率已超过99.9%,之后铜离子浓度基本维持不变,10min后与e-ZnS基本相等。这可能是因为ZnS脱除水中Cu2+主要基于与Cu2+的离子交换,效率明显高于一般吸附过程[12-14]。对该过程水中Zn2+浓度也进行了测定,其随接触时间变化见于图7。由图7可知,当接触时间为1min时,e-ZnS体系Zn2+浓度已达77.3mg/L,基本与按照离子交换机理计算理论值相等,之后基本保持不变。w-ZnS体系则有着明显不同,当接触时间为1min时,Zn2+离子浓度为66.9mg/L,明显小于离子交换理论计算值,之后其浓度基本保持不变。由N2物理吸附表征分析可知,e-ZnS的比表面积为208.3m2/g,其孔容为0.11cm3/g,均明显小于w-ZnS。因此可以推测e-ZnS对水中Cu2+脱除机理为离子交换,而比表面积和孔容更大的w-ZnS可能为离子交换与吸附的协同作用[14]。
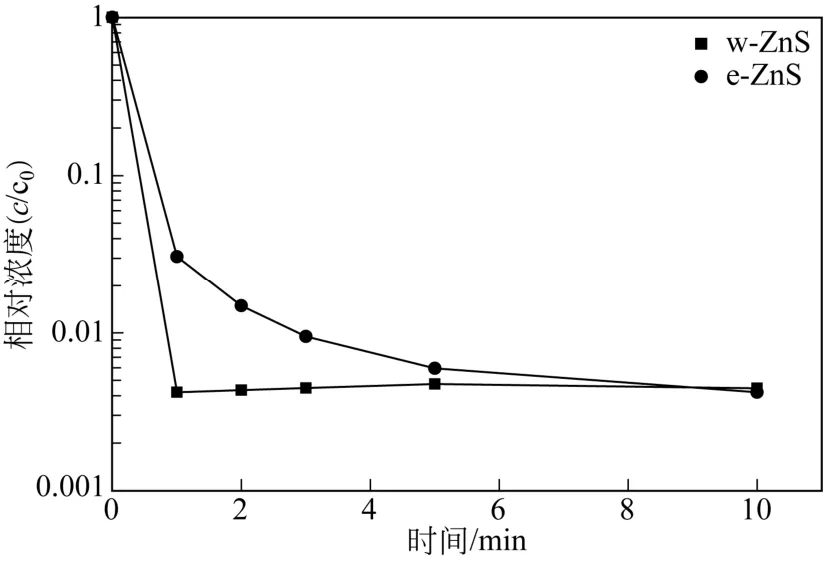
图6 w-ZnS与e-ZnS对水中Cu2+吸附性能
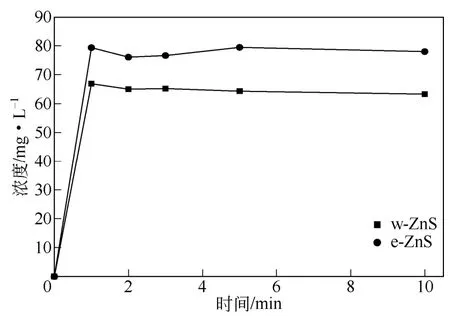
图7 吸附过程中Zn2+浓度变化
2.3 对Cu2+吸附性能的影响因素
2.3.1 初始浓度
分别配制100mL的100mg/L、150mg/L、200mg/L、300mg/L、400mg/L Cu2+溶液,在w-ZnS浓度200mg/L、25℃磁力搅拌12h,取混浊液去离心后分析清夜中Cu2+浓度。w-ZnS对Cu2+的饱和吸附容量如图8所示。由图8可知,随着Cu2+初始浓度增加,w-ZnS对Cu2+饱和吸附容量逐渐增加。当溶液Cu2+中初始浓度为400mg/L时,其饱和吸附容量达629.8mg/g,已经接近理论计算值。这可能是因为当溶液中铜离子浓度增加时,铜离子克服扩散阻力到达ZnS表面和内部孔道中的推动力增大,更有利于ZnS样品离子交换效率的提高,吸附容量相应提高。
2.3.2 接触时间
配置100mL的300mg/L Cu2+溶液,在w-ZnS浓度200mg/L、25℃下磁力搅拌,在不同接触时间取混浊样去离心后分析清液中Cu2+浓度,其随接触时间变化如图9所示。由图9可知,吸附脱除过程开始5min后,w-ZnS对Cu2+吸附容量达511.0mg/g。之后随着接触时间的延长,吸附剂的吸附容量逐渐增加。当接触时间达到120min,其对Cu2+吸附容量达585.6mg/g,基本保持稳定。因此,在该吸附条件下,体系在120min时已经达到吸附平衡或完全离子交换。
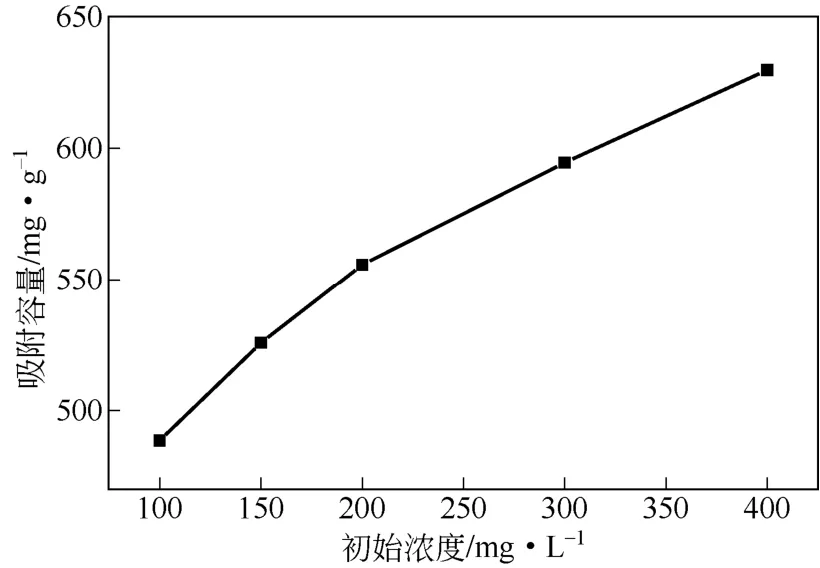
图8 Cu2+初始浓度对吸附性能的影响
2.3.3 处理温度
配置100mL的300mg/L Cu2+溶液,在w-ZnS浓度200mg/L、接触时间2h、在不同处理温度下磁力搅拌,取混浊样去离心后分析清液中Cu2+浓度。w-ZnS对Cu2+吸附容量随温度变化如图10所示。从图10可知,随着处理温度的升高,w-ZnS样品对Cu2+吸附容量无明显变化,保持在580~590mg/g左右。这可能是因为w-ZnS对于溶液中Cu2+的脱除主要是基于离子交换机理,对处理温度变化敏感度不高。
2.3.4 pH
采用稀盐酸调节待吸附Cu2+溶液的pH,为了避免pH过高引起Cu2+沉淀、pH过低造成ZnS与H+发生反应,将pH考察范围定为1~6。分别配置已调好pH的100mL的100mg/L Cu2+溶液,在w-ZnS浓度200mg/L、接触时间2h、25℃下磁力搅拌,取混浊样去离心后分析清液中Cu2+浓度。w-ZnS对Cu2+饱和吸附容量随pH变化如图11所示。由图11可知,随着pH的升高,w-ZnS对Cu2+饱和吸附容量大幅增加。当pH由1.77升高到5.44,Cu2+饱和吸附容量由108.3mg/L大幅提高至488.6mg/L。这可能是因为当pH较低时,溶液中H+浓度相对较高,易于与Cu2+竞争吸附位,影响Cu2+吸附到ZnS表面进而进行离子交换,溶液中Cu2+量相对增加,表观吸附容量下降。
2.3.5 竞争阳离子
称取定量NaCl或KCl于100mL的300mg/L Cu2+溶液中,在w-ZnS浓度200mg/L、接触时间2h、25℃下磁力搅拌,取混浊样去离心后分析清液中Cu2+浓度。Na+和K+对Cu2+吸附性能影响如图12所示。由图12可知,Na+或K+浓度由0上升至200mg/L的过程中,w-ZnS样品对Cu2+吸附容量无明显变化,保持在580mg/g左右,这表明溶液中Na+和K+的加入对Cu2+吸附性能无明显影响。
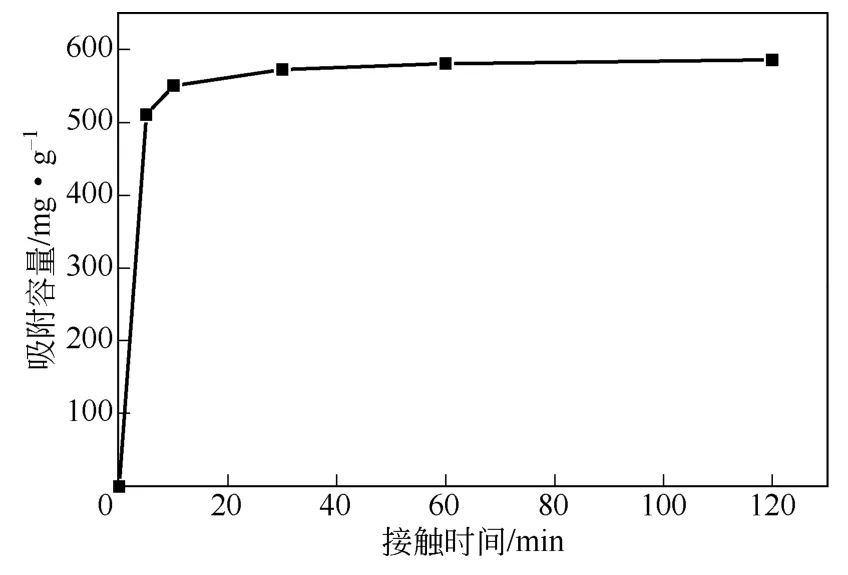
图9 接触时间对吸附性能的影响
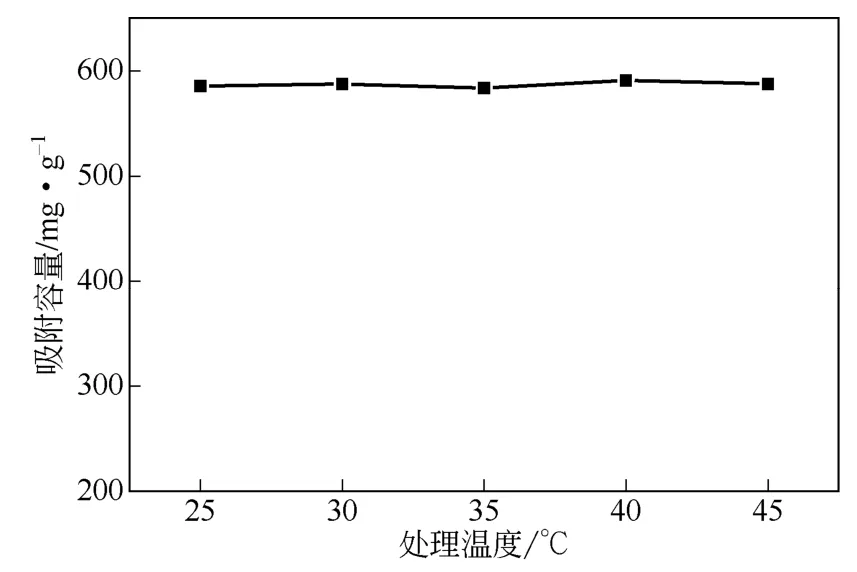
图10 处理温度对吸附性能的影响
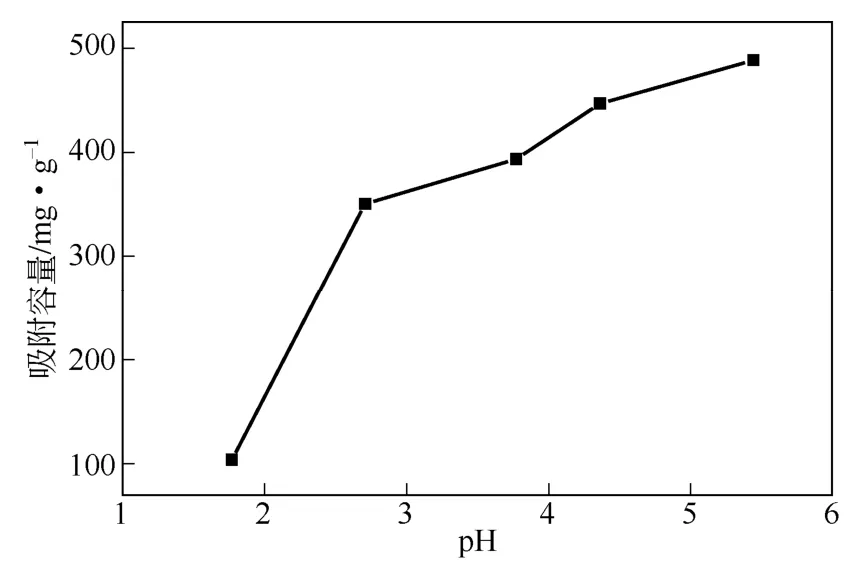
图11 pH对吸附性能的影响
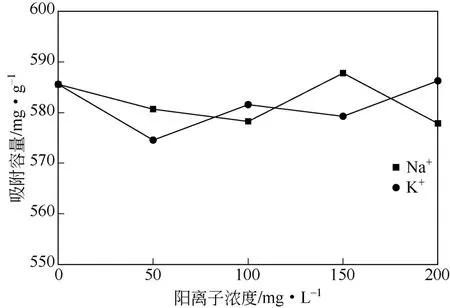
图12 竞争阳离子对吸附性能的影响
3 结论
(1)以Zn(NO3)2·6H2O和Na2S·9H2O为原料,水为溶剂,通过超声化学辅助法制备出具有单一立方相闪锌矿,呈现不规则块状,介孔孔径分布分散的纳米ZnS。
(2)在吸附剂量200mg/L、Cu2+初始浓度400mg/L、接触时间2h、处理温度25℃的条件下,对Cu2+饱和吸附容量可达629.8mg/L,且Na+和K+的加入对吸附性能无明显影响。
(3)吸附实验结果表明,该纳米ZnS对水溶液中Cu2+的脱除是通过离子交换和吸附的协同作用实现的。
[1] 孟祥和,胡国飞.重金属废水处理[M].北京:化学工业出版社,2000:12-16.MENG X H,HU G F.Treatment of heavy metal wastewater[M].Beijing:Chemical Industry Press,2000:12-16.
[2] KHAN A,KHAN S,KHAN M A,et al.The uptake and bioaccumulation of heavy metals by food plants,their effects on plants nutrients,and associated health risk:a review[J].Environmental Science and Pollution Research,2015,22:13772-13799.
[3] 罗曼,蔡旺锋,陈益清,等.磁加载絮凝处理含铜废水[J].化工进展,2015,34(11):4065-4070.LUO M,CAI W F,CHEN Y Q,et al.Study on treatment of copper waste water by magnetic seeding flocculation[J].Chemical Industry and Engineering Progress,2015,34(11):4065-4070.
[4] TANG X M,ZHENG H L,TENG H K,et al.Chemical coagulation process for the removal of heavy metals from water:a review[J].Desalination and Water Treatment,2016,57:1733-1748.
[5] WANG X M,LI Y X,LI H G,et al.Chitosan membrane adsorber for low concentration copper ion removal[J].Carbohydrate Polymers,2016,146:274-281.
[6] MA Y,ZHOU Q,ZHOU S C,et al.A bifunctional adsorbent with high surface area and cation exchange property for synergistic removal of tetracycline and Cu2+[J].Chemical Engineering Journal,2014,258:26-33.
[7] GHAEMI N,MADAENI S S,DARAEI P,et al.Polyethersulfone membrane enhanced with iron oxide nanoparticles for copper removal from water:application of new functionalized Fe3O4nanoparticles[J].Chemical Engineering Journal,2015,263:101-112.
[8] LIAO Q L,ZENG L M,LI L L,et al.Synthesis of functionalized mesoporous silica and its application for Cu(Ⅱ) removal[J].Desalination and Water Treatment,2015,56:2154-2159.
[9] FU F L,WANG Q.Removal of heavy metal ions from wastewaters:a review[J].Journal of Environmental Management,2011,92:407-418.
[10] Samiey B,CHENG C H,WU J N.Organic-inorganic hybrid polymers as adsorbents for removal of heavy metal ions from solutions:a review[J].Materials,2014,7:673-726.
[11] 沈宗华,王安杰,解建国,等.二维硫化锌材料的制备及其研究进展[J].化工进展,2006,25(4):392-396.SHEN Z H,WANG A J,XIE J G,et al.Recent research on preparation of two-dimensional zinc sulfides[J].Chemical Industry and Engineering Progress,2006,25(4):392-396.
[12] PALA I R,BROCK S L.ZnS nanoparticle gels for remediation of Pb2+and Hg2+polluted water[J].ACS Applied Materials & Interfaces,2012,4:2160-2167.
[13] PIQUETTE A,CANNON C,APBLETT A W.Remediation of arsenic and lead with nanocrystalline zinc sulfide[J].Nanotechnology,2012,23:294014.
[14] XU J F,QU Z,YAN N Q,et al.Size-dependent nanocrystal sorbent for copper removal from water[J].Chemical Engineering Journal,2016,284:565-570.
[15] ZHU Y P,LI J,LIU Y P,et al.Sonochemistry- assisted synthesis and optical properties of mesoporous ZnS nanomaterials[J].Journal of Materials Chemistry A,2014,2:1093-1101.
Sonochemistry-assisted preparation of ZnS nanomaterials and its adsorption performance of copper ions in aqueous solution
LIU Guoqing1,2,LI Youfeng1,ZENG Lingwei1,WANG Zhanqiang1,TAN Tan1,ZENG Jianxian1
(1School of Chemistry and Chemical Engineering,Hunan University of Science and Technology,Xiangtan 411201,Hunan,China;2Key Laboratory of Theoretical Organic Chemistry and Function Molecule,Ministry of Education,Xiangtan 411201,Hunan,China)
Environmental issues caused by copper pollution have seriously threatened human health. In this paper,zinc sulfide(ZnS) nanomaterials were successfully synthesized with the assistance of sonochemistry in an aqueous system of Zn(NO3)2·6H2O and Na2S·9H2O for the removal of Cu2+from aqueous solution. The prepared ZnS were characterized by means of FTIR,XRD,SEM and N2physical adsorption. The influence of initial concentration,contact time,treat temperature,pH and competitive cations on adsorption capacities was investigated. The results showed that the prepared ZnS presented a crystalline structure of cubic zinc-blende phase and are in irregular block forms. The pore structure was mainly caused by agglomeration and had a wide pore diameter distribution. It showed excellent adsorption performance and the adsorption capacity can reach as high as 629.8mg/L under the experimental conditions as ZnS dosage of 200mg/L,initial concentration of 400mg/L,contact time of 12h and treat temperature of 25℃. The addition of Na+and K+had no significant effect on the adsorption properties and the Cu2+removal by the ZnS nanomaterials was based on the synergistic effect of ion exchange and adsorption.
nanomaterials;zinc sulfide;sonochemistry-assisted method;ion exchange;adsorption
X703.5
:A
:1000–6613(2017)02–0750–06
10.16085/j.issn.1000-6613.2017.02.048
2016-07-05;修改稿日期:2016-09-08。
国家自然科学基金(51573041)、湖南省科技计划(2015JC3112)、湖南省自然科学基金(14JJ4043, 2015JJ6036)及湖南省化学化工类专业校企合作人才培养示范基地(145812)项目。
及联系人:刘国清(1982—),男,讲师,博士,主要从事功能材料制备及重金属污染处理方面的研究。E-mail:dragwinneres@126.com。
