远程缺血后适应降低心肌缺血再灌注损伤的作用机制研究
2017-02-16蒋钦黄克力张浩胡盛寿
蒋钦,黄克力,张浩,胡盛寿
基础与实验研究
远程缺血后适应降低心肌缺血再灌注损伤的作用机制研究
蒋钦,黄克力,张浩,胡盛寿
目的:探讨远程缺血后适应对心肌缺血再灌注的氧化还原、能量代谢及炎症反应的影响。
心肌再灌注损伤;缺血后适应;反馈,生理
(Chinese Circulation Journal, 2017, 32:85.)
再灌注通过及时的恢复冠状动脉血流虽是挽救缺血心肌的唯一方法,但是可以导致附加损伤[1]。缺血性适应是一种内源性的保护策略,通过多次简短有效的实施缺血、再灌注方式实现保护器官减轻缺血再灌注损伤[2]。按照施行缺血适应与有害缺血的时间先后关系,可分为预适应、间适应以及后适应[3]。远程缺血适应通过在某一组织或血管区域而非靶器官实施数次间断的缺血和再灌注方案,达到降低重要器官缺血再灌注损伤的作用。由于不在目标器官实施缺血因而避免潜在加重靶器官缺血损伤,其临床应用意义尤为突出[4]。但其是否能够达到缺血预适应、缺血后适应的作用效应尚不清楚。本研究旨在探讨远程缺血后适应在心肌再灌注损伤发生时应用的效应,并与缺血预适应及缺血后适应比较其抗氧化还原、抗脂质过氧化反应、抗炎症反应以及影响能量代谢等作用效应。
1 材料与方法
实验动物与方法:实验动物为SPF级SD 大鼠,均由北京市维通利华实验动物技术有限公司提供,6~8周龄,体重250~300 g,雌雄各半。将40只大鼠随机分为5组,如图1所示:(1)缺血预适应组(n=8):心肌缺血30 min再灌注120 min前接受3次30 s缺血与再灌注交替的缺血预处理;(2)缺血后适应组(n=8):心肌缺血30 min后再灌注开始后即行阻断冠状动脉开放30 s,阻断30 s,重复3次,再灌注至缺血完成后120 min;(3)远程缺血后适应组(n=8):心肌缺血30 min后即开放再灌注120 min,同时左下肢腹股沟处行开放股动脉30 s,阻断股动脉血流30 s,重复3次;(4)缺血再灌注组(n=8):心肌缺血30 min后完成再灌注120 min;(5)对照组(n=8):单纯开胸,冠状动脉左前降支只在周围肌层穿线不行结扎。采用冠状动脉前降支阻断法建立心肌缺血再灌注模型[5]。基本方法为以6-0 prolene线于左心耳与肺动脉流出道交汇处以远2 mm处做横向缝扎;缝扎的中点位于左心耳与肺动脉流出道交汇处与心尖连线,进针方向与连线垂直,进针深度为1.5 mm左右。如心脏跳动减弱或心尖区域颜色变白可大致证实心肌缺血模型制作成功,不明显者再次缝扎。如有心律失常发生,给予低浓度利多卡因纱布敷盖左心室或心脏按摩。若缺血30 min后无左心扩大变白或运动不协调,则认为心肌缺血模型制作不合格。
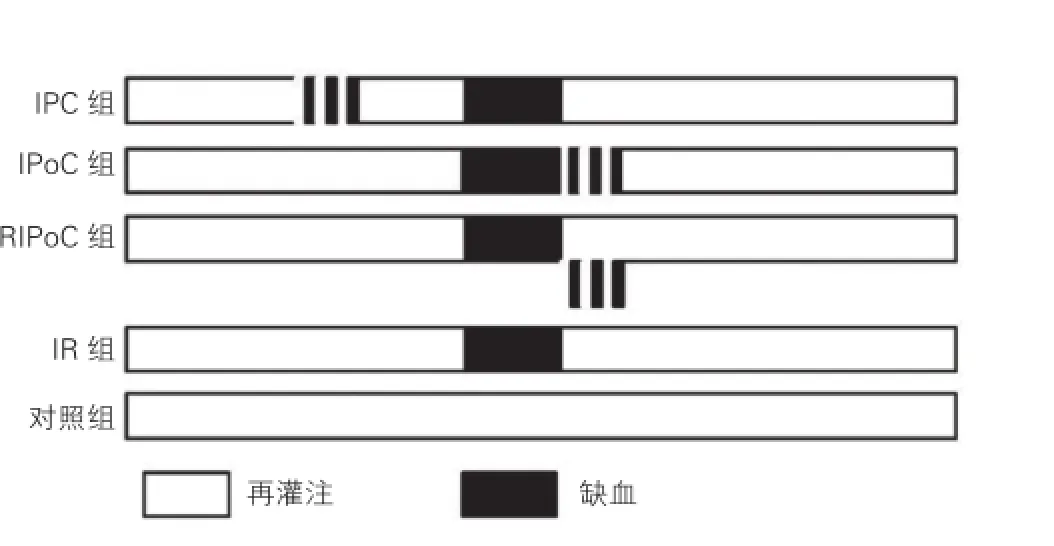
图1 缺血性适应的研究方案(n=8)
观察指标:缺血再灌注治疗后120 min所有组实验观察结束,采用静脉注射氯化钾的方法处死大鼠;收集大鼠左心室的缺血边缘心肌,生理盐水清理后分装入冻存管内,常规液氮保存组织标本待后续实验使用。检测氧化应激、脂质过氧化水平、炎症反应及能量代谢水平;按照试剂供应商提供的检测方案分别以黄嘌呤氧化酶法和硫代巴比妥酸法测定各组预处理后心肌缺血组织中超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量[5],通过化学比色法测定髓过氧化物酶(MPO)活性,生物发光法检测三磷酸腺苷(ATP)含量[6],所选试剂盒均来自南京建成生物工程研究所,采用日本Shimadzu公司分光光度计(UV-1206)检测(n=4);实时定量聚合酶链反应(qRT-PCR)法分别检测各种预处理区内心肌组织中基质细胞衍化因子-1(SDF-1)和血管内皮生长因子(VEGF)的表达,以及线粒体相关基因Ndufa2、Ndufa4、Cox4il、Cox7a2的表达(n=4),采用美国ABI公司的实时荧光定量PCR仪(ABI-7300)检测,参考之前研究方法,引物序列如下,SDF-1正向: TGAGAGCCATGTCGCCAGA,反向:GGATCCACTTTAATTTCGGGTCAA;VEGF正向: GTCCTCACTTGGATCCCGACA,反向:CCTGGCAGGCAAACAGACTTC[6]。
统计学分析:应用SPSS 17.0 软件包进行统计学分析。计量资料用均数±标准差表示;三组及以上比较采用单因素方差分析,若差异有统计学意义,使用SNK法检验确立哪些组间均数不等。组间差异性比较采用独立样本t检验,检验水准α=0.05,以P<0.05 为差异有统计学意义。
2 结果
2.1 实验动物模型结果
心肌缺血模型制作参考既往的工作基础[6],手术方式较固定,大鼠模型的制作成功率约在80%,主要的死亡原因是由于解剖变异因素结扎冠状动脉分支过多或者靠近主干开口导致心肌梗死面积太大,也包括呼吸系统原因如术后气胸形成等。
2.2 缺血心肌中氧化应激与脂质过氧化水平比较
缺血再灌注施行后120 min,各组SOD活性 (图2A)与MDA含量(图2B)水平值如图2所示。再灌注后120 min,缺血预适应组、缺血后适应组、远程缺血后适应组三组间缺血心肌中抗氧化应激指标SOD活性差异无统计学意义,但明显高于缺血再灌注组(P<0.05),但与对照组比较差异均无统计学意义。而脂质过氧化指标MDA含量,对照组最低(P<0.01),缺血预适应组、缺血后适应组、远程缺血后适应组三组间差异无统计学意义,但均明显低于缺血再灌注组(P<0.01)。
2.3 缺血心肌中保护性基因表达水平比较
缺血再灌注施行后120 min各组SDF-1与VEGF表达水平如图2C所示。SDF-1与VEGF在缺血预适应组、缺血后适应组、远程缺血后适应组三组间差异无统计学意义,但均明显高于缺血再灌注组(P<0.05),但均较对照组表达增加(P<0.05)。
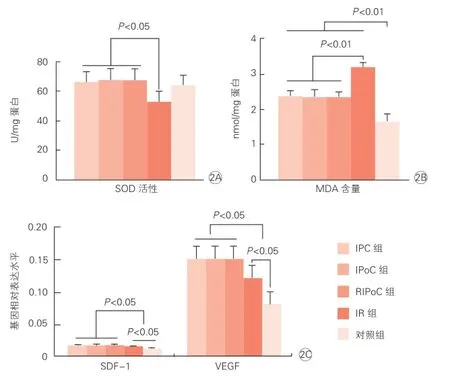
图2 大鼠缺血心肌中氧化应激、脂质过氧化反应与保护性基因表达情况(n=4)
2.4 缺血心肌中线粒体功能相关基因表达水平比较
缺血再灌注施行后120 min各组线粒体功能相关基因Ndufa2、Ndufa4、Cox4il、Cox7a2表达水平如图3A所示。相对于对照组,由于缺血再灌注损伤作用缺血再灌注组显著降低;缺血预适应组、缺血后适应组、远程缺血后适应组三组间差异无统计学意义,但明显高于缺血再灌注组(P<0.05)。
2.5 缺血心肌中能量代谢与炎症反应水平比较
缺血再灌注施行后120 min各组能量代谢与炎症反应水平如图3B、3C所示。心肌内ATP含量在缺血预适应组、缺血后适应组、远程缺血后适应组三组间差异无统计学意义,但明显高于缺血再灌注组,对照组ATP含量最高(P<0.05,图3B)。反应心肌内炎症反应指标的MPO活性在缺血预适应组、缺血后适应组、远程缺血后适应组三组间差异无统计学意义,但明显低于缺血再灌注组, 对照组MPO活性最低(P<0.05,图3C)。
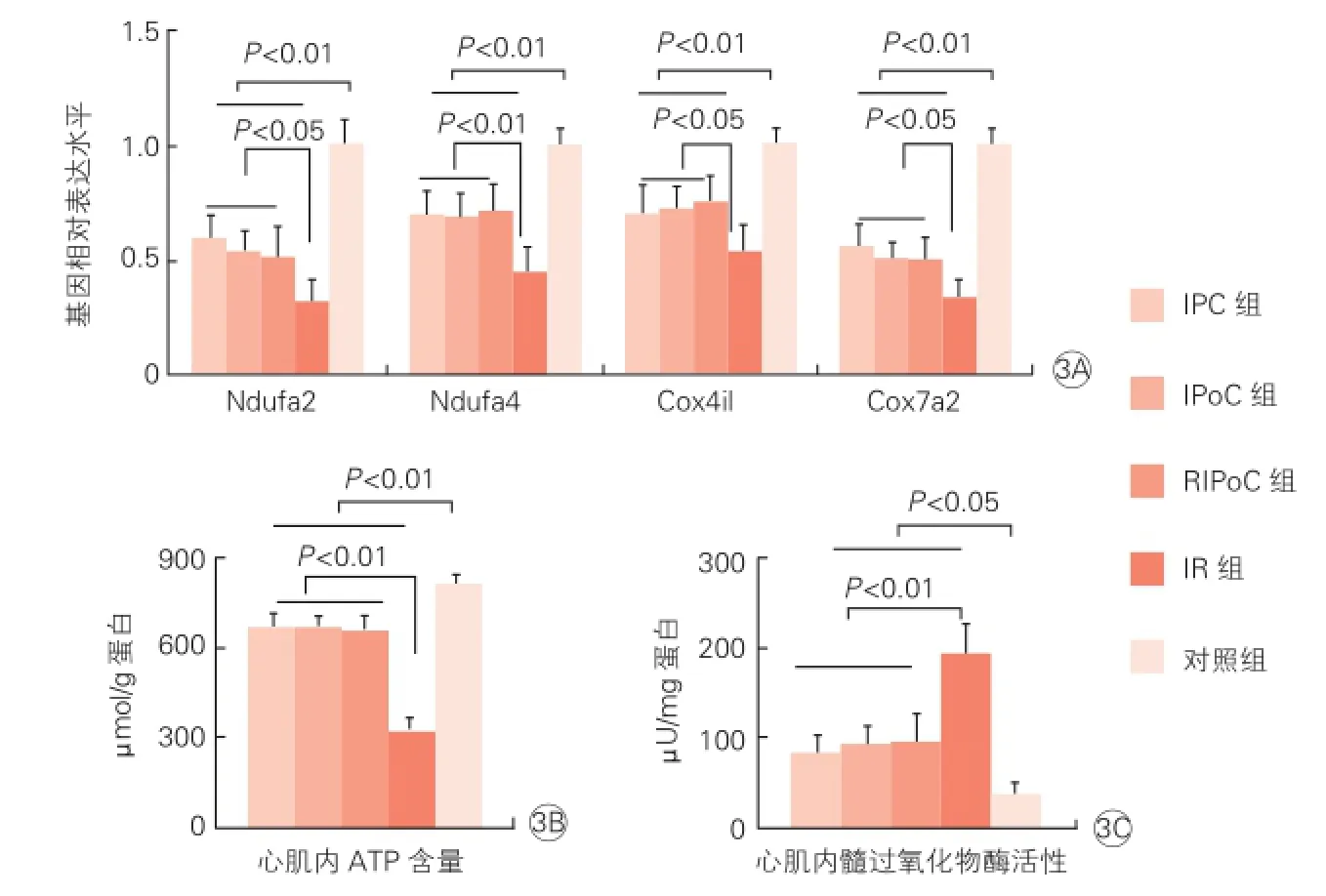
图3 大鼠心肌线粒体能量代谢相关基因表达及炎症反应水平比较(n=4)
3 讨论
缺血再灌注损伤发生的具体机制不清,但主要涉及通过氧化应激反应,线粒体功能异常导致能量代谢障碍,炎症反应等作用[2]。本研究将远程缺血后适应与常规的缺血预适应、缺血后适应分组纳入比较,目的是将作用效果相对确切的两种方案作为参照标准,评价其有无相似的作用效应。
目前,通过这种在远离心脏的一个器官或组织施行简短的缺血和再灌注,最初发现是在不同冠状动脉分支区域,产生急性缺血再灌注损伤的保护作用机制仍不清楚[7]。实验研究表明,在受保护器官中很多潜在的机制通路和信号转导网络可能类似于缺血预适应和缺血后适应[8]。然而,从远程预适应的器官或组织传递心脏保护信号到达心脏的机制通路仍不清楚。
现有研究表明,远程缺血适应主要通过体液因素与神经系统作用。远程缺血适应可以通过其作用体液在不同物种(猪-鼠)间发挥作用[9],传统观点认为体液因素参与机制包括:一氧化氮、腺苷、缓激肽[10]、细胞因子、趋化因子等。通过给予神经节阻断药、切断肢体的神经支配,基因抑制脑干迷走神经节前神经元,切除心脏的迷走神经支配都可以消除肢体缺血适应诱导降低心肌梗死的作用[11]。在远程缺血适应处理后的器官或组织中神经通路刺激看上去是由局部产生活性物质,例如腺苷和缓激肽。一些新颖的小分子物质近年来也被认为是作用分子,如MicroRNA和SDF-1[12,13]。同期我们也观察到缺血后适应可以诱导慢性心肌梗死的SDF-1的表达[14],建立心肌—血液间浓度梯度差,从而产生类似于急性心肌梗死期SDF-1变化,诱导干细胞自发地向缺血心肌“归巢”现象。此研究将三种缺血性适应做横向比较,是先前研究发现通过缺血后适应降低缺血损伤的微环境的证实和补充[6],同时从四个方面比较减轻再灌注损伤的作用效应。不同于传统的效应研究机制,我们从四个方面的指标评价远程缺血后适应的作用机制。第一:抗氧化还原和脂质过氧化指标,SOD是清除再灌注损伤产生的氧自由基的主要物质,MDA是膜脂质过氧化的重要产物,可以反应细胞膜因缺血破坏的严重程度。相对于缺血再灌注作用结果,三种缺血性适应均可增加SOD活性且降低MDA含量,证实了远程缺血后适应同样具有抗氧化应激,减轻膜脂质过氧化作用。第二:远程缺血后适应增加心肌损伤后的保护因子合成,缺血损伤后心脏具有一定的适应应激损伤的能力,通过改变表型使其更耐受损伤[15]。SDF-1是具有募集干细胞和直接修复双重作用的重要蛋白[16]。SDF-1可在缺血后表达上调具有一定的心脏适应修复作用,但这种效应具有短暂且有限的时空效应。这与之前缺血后适应可以诱导慢性心肌梗死后心肌SDF-1的表达上调类似,我们观察到远程缺血后适应可以增加缺血再灌注心肌SDF-1的表达,这种效应可以进一步增加心脏修复损伤作用。VEGF可以诱导毛细血管新生,降低内皮损伤,也具有直接减轻再灌注损伤的作用[17]。第三:线粒体功能及能量代谢方面,线粒体是心肌细胞中最活跃也是最重要的细胞器,消耗大约90%的氧气,参与95%的心脏ATP合成和氧化磷酸化[18]。因此我们检测直接反应能量储备的ATP水平,缺血再灌注损伤可导致ATP明显下降,而三种缺血性适应均可减轻ATP储备水平的受损;与ATP水平降低一致的表现,缺血再灌注损伤相对于对照组可导致能量代谢相关基因表达下降[19],远程缺血后适应诱导线粒体能量代谢相关的基因表达上调。第四:炎症反应情况,我们使用MPO指标,一种存在于白细胞内,作为组织炎症细胞侵入的指标[20]。再灌注损伤的一种表现即为微血管堵塞[8],甚至心肌出血,这种无复流现象发生在约40%成功再灌注的ST段抬高型急性心肌梗死患者,其发病机制包括微血管舒张受损、微血管栓塞、血小板微栓、中性粒细胞堵塞[21]。
与晚期后适应的作用不同,再灌注即时或早期缺血后适应的保护机制涉及到激活再灌注损伤挽救激酶信号通路和幸存活化增强信号因子途径通路[22],这与缺血预适应的作用机制存在部分重叠。研究发现缓激肽与其受体在缺血预适应诱导的心脏保护作用主要通过激活磷脂酰肌醇-3激酶-蛋白质丝氨酸/苏氨酸激酶/内皮型一氧化氮合酶(PI3K/ Akt/eNOS)和通过释放一氧化氮调节氧化还原状态;缺血后适应诱导的保护作用主要是增加抗氧化还原和激活线粒体抗凋亡通路;而在远程缺血预适应中通过激活B2受体介导神经源性通路并内化B2受体形成信号体[23],这些单元里包括各种信号通路的酶,迁移到线粒体后激活线粒体ATP敏感性钾通道,转导细胞内细胞保护信号通路[10]。由此可见各种缺血性适应的心脏保护作用可能通过一些共同的信号通路实现。本研究中三种缺血适应方式降低缺血再灌注损伤的作用效果相似,其作用发生的信号通路也可重叠,从而产生相同心脏保护作用,但这三种方式具体的作用机制和交互关系仍有待将来的研究阐明。
[1] Gerczuk PZ, Kloner RA. An update on cardioprotection: a review of the latest adjunctive therapies to limit myocardial infarction size in clinical trials. J Am Coll Cardiol, 2012, 59: 969-978.
[2] Hausenloy DJ, Yellon DM. Targeting Myocardial Reperfusion Injury——The Search Continues. N Engl J Med, 2015, 373: 1073-1075.
[3] Heusch G. Molecular basis of cardioprotection: signal transduction in ischemic pre-, post-, and remote conditioning. Circ Res, 2015, 116: 674-699.
[4] Heusch G, Bøtker HE, Przyklenk K, et al. Remote ischemic conditioning. J Am Coll Cardiol, 2015, 65: 177-195.
[5] 侯剑峰, 袁昕, 张浩, 等. 低能激光照射对梗死后心肌微环境影响的实验研究. 中国循环杂志, 2015, 30: 47-49.
[6] Jiang Q, Yu T, Huang K, et al. Remote Ischemic Postconditioning Ameliorates the Mesenchymal Stem Cells Engraftment in Reperfused Myocardium. PLoS One, 2016, 11: e0146074.
[7] Hausenloy DJ, Yellon DM. Remote ischaemic preconditioning: underlying mechanisms and clinical application. Cardiovasc Res, 2008, 79: 377-386.
[8] Hausenloy DJ, Yellon DM. Ischaemic conditioning and reperfusion injury. Nat Rev Cardiol, 2016, 13: 193-209.
[9] Skyschally A, Gent S, Amanakis G, et al. Across-Species Transfer of Protection by Remote Ischemic Preconditioning With Species-Specific Myocardial Signal Transduction by Reperfusion Injury Salvage Kinase and Survival Activating Factor Enhancement Pathways. Circ Res, 2015, 117: 279-288.
[10] Sharma R, Randhawa PK, Singh N, et al. Bradykinin in ischemic conditioning-induced tissue protection: Evidences and possible mechanisms. Eur J Pharmacol, 2015, 768: 58-70.
[11] Mastitskaya S, Marina N, Gourine A, et al. Cardioprotection evoked by remote ischaemic preconditioning is critically dependent on the activity of vagal pre-ganglionic neurones. Cardiovasc Res, 2012, 95: 487-494.
[12] Li J, Rohailla S, Gelber N, et al. MicroRNA-144 is a circulating effector of remote ischemic preconditioning. Basic Res Cardiol, 2014, 109: 423.
[13] Davidson SM, Selvaraj P, He D, et al. Remote ischaemic preconditioning involves signalling through the SDF-1α/CXCR4 signalling axis. Basic Res Cardiol, 2013, 108: 377.
[14] Jiang Q, Song P, Wang E, et al. Remote ischemic postconditioning enhances cell retention in the myocardium after intravenous administration of bone marrow mesenchymal stromal cells. J Mol Cell Cardiol, 2013, 56: 1-7.
[15] Medzhitov R, Schneider D, Soares MP. Disease tolerance as a defense strategy. Science, 2012, 335: 936-941.
[16] 蒋钦, 黄克力, 张浩, 等. 基质细胞衍生因子1在心梗及缺血性适应中的作用. 中国分子心脏病学杂志, 2016, 16: 1813-1816.
[17] Luo Z, Diaco M, Murohara T, et al. Vascular endothelial growth factor attenuates myocardial ischemia-reperfusion injury. Ann Thorac Surg, 1997, 64: 993-998.
[18] Pham T, Loiselle D, Power A, et al. Mitochondrial inefficiencies and anoxic ATP hydrolysis capacities in diabetic rat heart. Am J Physiol Cell Physiol, 2014, 307: C499-507.
[19] Yu P, Zhang J, Yu S, et al. Protective Effect of Sevoflurane Postconditioning against Cardiac Ischemia/Reperfusion Injury via Ameliorating Mitochondrial Impairment, Oxidative Stress and Rescuing Autophagic Clearance. PLoS One, 2015, 10: e0134666.
[20] Meybohm P, Gruenewald M, Albrecht M, et al. Hypothermia and postconditioning after cardiopulmonary resuscitation reduce cardiac dysfunction by modulating inflammation, apoptosis and remodeling. PLoS One, 2009, 4: e7588.
[21] White SK, Hausenloy DJ, Moon JC. Imaging the myocardial microcirculation post-myocardial infarction. Curr Heart Fail Rep, 2012, 9: 282-292.
[22] Barsukevich V, Basalay M, Sanchez J, et al. Distinct cardioprotective mechanisms of immediate, early and delayed ischaemic postconditioning. Basic Res Cardiol, 2015, 110: 452.
[23] Quinlan CL, Costa AD, Costa CL, et al. Conditioning the heart induces formation of signalosomes that interact with mitochondria to open mitoKATP channels. Am J Physiol Heart Circ Physiol, 2008, 295: H953-H961.
Investigation of Remote Ischemic Post-conditioning on Reducing Ischemic Reperfusion Injury in Experimental Rats
JIANG Qin, HUANG Ke-li, ZHANG Hao, HU Sheng-shou.
Center of CardiacSurgery, Sichuan Provincial People’s Hospital, Chengdu (610072), Sichuan,China Corresponding Author: HUANG Ke-li, Email: huangkeli1968@163.com
Objective:To explore the effect of remote ischemic post-conditioning (RIPoC) on oxidation/reduction response, energy metabolism and inflammatory reaction of ischemic myocardial tissue in rats with ischemic reperfusion (IR) injury.Methods: IR model was established by 30 min left anterior descending (LAD) artery occlusion followed by 120 min reperfusion, conditioning was defined as 3 cycles of 30 seconds ischemia followed by 30 seconds reperfusion in adult rats. The rats were divided into 5 groups:①ischemic pre-conditioning (IPC) group, the rats received the conditioning prior to IR treatment,②ischemic post-conditioning (IPoC) group, the rats received 30 min LAD occlusion followed by conditioning at the beginning of 120 min reperfusion,③remote ischemic post-conditioning(RIPoC) group, the rats received 30 min LAD occlusion, followed by femoral artery conditioning at the beginning of 120 min reperfusion,④IR group,⑤Sham group. n=8 in each group.Ischemic myocardial tissue was collected at the end of experiment, superoxide dismutase (SOD) activity was assayed by xanthine oxidase method,malondialdehyde (MDA) content was examined by thiobarbituric acid method, myeloperoxidase (MPO) activity was determined by chemistry colorimetric method, adenosine triphosphate(ATP)amount was measured by bioluminescence method; expressions of myocardial stromal cell derived factor-1 (SDF-1) and vascular endothelial growth factor (VEGF), mitochondrial function related genes Ndufa2, Ndufa4, Cox4il and Cox7a2 were evaluated by real time quantitative PCR.Results:In IPC, IPoC and RIPoC groups, the ischemic myocardial tissue had increased SOD activity and ATP amount, decreased MDA content and MPO activity; induced expressions of SDF-1, VEGF, mitochondrial function related genes Ndufa2, Ndufa4, Cox4il and Cox7a2.Conclusion: RIPoC may increase anti-oxidation/reduction response, protect energy metabolism and reduce inflammatory reaction in ischemic myocardial tissue, the effect was similar to pre-conditioning and post-conditioningin rats with IR injury.
Myocardial reperfusion injury; Ischemic post-conditioning; Feedback; Physiology
2016-04-23)
(编辑:漆利萍)
四川省人民医院博士科研基金(30305030842)
610072 四川省成都市,四川省人民医院 心脏外科中心(蒋钦、黄克力);中国医学科学院 北京协和医学院 国家心血管病中心阜外医院 心血管疾病国家重点实验室(张浩、胡盛寿)
蒋钦 主治医师 博士 主要从事冠心病外科基础与临床研究 Email: jq349@163.com 通讯作者:黄克力 Email: huangkeli1968@163.com
R541
A
1000-3614(2017)01-0085-05
10.3969/j.issn.1000-3614.2017.01.020
方法:阻断成年SD大鼠冠状动脉左前降支30 min再灌注120 min的方式建立缺血再灌注模型;分别以3个周期30 s缺血、30 s灌注的方式建立缺血预适应、缺血后适应、远程缺血后适应的缺血适应模型;开胸后不阻断冠状动脉建立对照组模型。实验结束收集大鼠缺血心肌组织,通过黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)活性和硫代巴比妥酸法测定丙二醛(MDA)含量,化学比色法检测髓过氧化物酶(MPO)活性,生物发光法检测三磷酸腺苷(ATP)含量;实时定量聚合酶链反应法分别检测基质细胞衍化因子-1(SDF-1)和血管内皮生长因子(VEGF),以及线粒体功能相关基因Ndufa2、Ndufa4、Cox4il、Cox7a2表达(n=8)。
结果:缺血预适应、缺血后适应、远程缺血后适应均显著增加缺血心肌组织的SOD活性、ATP含量;降低MDA含量、MPO活性;并可以诱导SDF-1、VEGF及线粒体功能相关基因Ndufa2、Ndufa4、Cox4il、Cox7a2的表达。
结论:远程缺血后适应应用在缺血再灌注损伤时有增加缺血心肌组织的抗氧化还原、保护能量代谢、降低炎症反应等作用;远程缺血后适应与缺血预适应及缺血后适应降低缺血再灌注损伤的作用效果类似。
