柯萨奇病毒A16型感染性模型的建立及其相关免疫学指标和应用的评价
2017-02-16高丽美罗永能
张 锋,高 孟,高丽美,罗永能
(浙江省医学科学院病毒病研究所,杭州 310013)
柯萨奇病毒A16型感染性模型的建立及其相关免疫学指标和应用的评价
张 锋,高 孟,高丽美,罗永能*
(浙江省医学科学院病毒病研究所,杭州 310013)
目的 建立简便和可靠的对柯萨奇病毒A16型(coxsackievirus A16, CVA16)敏感的小型啮齿类实验动物模型。方法 选取不同日龄长爪沙鼠,腹腔接种CVA16后连续观察14 d,筛选出对病毒敏感的最适接种日龄段;然后比较接种剂量与效应关系,测定其50%致死剂量(LD50);并测定感染3 d后其血液和主要组织器官中CVA16病毒滴度;最后用CVA16灭活疫苗在1日龄和11日龄免疫2针沙鼠后,在14日龄时用LD50剂量病毒攻毒,观察并记录沙鼠体重、症状及死亡率,2周后眼球采血,应用微量中和试验和ELISA分别检测中和抗体效价和总抗体水平。结果 长爪沙鼠感染CVA16后出现活动减少、后肢无力、麻痹瘫痪、死亡等临床症状,不同日龄沙鼠对CVA16感染的易感能力和感染后发病程度不同,7日龄和14日龄沙鼠易感,28日龄沙鼠不易感染,最敏感和最合适接种日龄为14日龄,其LD50为1×104.5 CCID50,感染3 d后其血液和主要组织器官中均可检测到高滴度的CVA16病毒,免疫两针灭活疫苗的14日龄沙鼠用LD50剂量攻毒,存活率87.5%,疫苗免疫诱导沙鼠产生的CVA16中和抗体几何平均值(GMT)为28.14,抗体阳性率为87.5%。 结论 长爪沙鼠对CVA16敏感并且病毒能在其体内进行有效的复制和繁殖,可作为CVA16致病机制研究、疫苗研发及药物评价的可靠小动物模型。
柯萨奇病毒A16型;长爪沙鼠;动物模型
柯萨奇病毒A16型(coxsackievirus A16, CVA16)属于小RNA病毒科肠道病毒属,是引起手足口病(hand foot and mouth disease,HFMD)的主要病原体之一[1]。手足口病是一种全球性的传染病,世界各地均有不同程度的流行。尤其在亚太地区,近年来疫情呈不断上升的趋势[2]。由于手足口病另一主要致病原肠道病毒71型(enterovirus 71, EV71)自2008年后在大陆及亚太地区多次大规模暴发流行已在易感人群中建立了一定程度的免疫屏障,近几年CVA16等其它肠道病毒感染引发的病例已呈大幅上升趋势,国内少数省份已有暴发流行并报告死亡病例[3]。国内外监测数据也表明CVA16引起的HFMD有逐年增加趋势,每隔一定时间就出现一次高峰[3]。
手足口病至今尚无高效、特异的药物,对症和支持治疗是主要的措施。研发疫苗对全面有效地预防控制手足口病的暴发流行有重大意义,最近我国已完成EV71灭活疫苗的临床试验[4]并批准上市。相关实验动物模型的建立和使用是上述疫苗研制过程中至关重要的环节之一,目前国内外研究CVA16主要是使用小于7日龄的小鼠乳鼠,我们先前的实验和他人报道均发现超过7日龄的小鼠乳鼠就不能感染[5,6]。然而这种小鼠乳鼠模型由于免疫系统发育尚未成熟等原因,在实际使用上有很大限制。因此,我们借鉴Yao等[7]建立肠道病毒71型感染长爪沙鼠模型的成功经验,使用CVA16 YY157株感染清洁级长爪沙鼠,以期建立比小鼠乳鼠模型更加简便和可依赖的对CVA16敏感的小型啮齿类动物模型,用于CVA16的发病机制、疫苗研发和抗CVA16药物评价。
1 材料和方法
1.1 细胞和病毒
Vero细胞来源于美国标准生物品收藏中心(american type culture collection,ATCC);CVA16病毒YY157株由本研究所保存[8-10]。用Vero细胞培养繁殖CVA16 YY157株,并用微量细胞病变法测定病毒的感染性滴度。病毒上清反复冻融3次后,低温离心(5000 r/min,离心力3900 g,20 min)取上清,0.2 μm滤膜过滤后,-80℃冰箱中保存。
1.2 实验动物
清洁级Z:ZCLA长爪沙鼠,由浙江省医学科学院实验动物中心[SCXK(浙)2014-0001]提供,1日龄,8只,体重3~3.5 g;7日龄,16只,体重6~7 g;14日龄,68只,体重10~11 g;21日龄,16只,体重15~17 g;28日龄,16只,体重20~22 g,动物的饲养和实验在浙江省医学科学院实验动物中心进行[SYXK(浙)2011-0166]。并按实验动物使用的3R原则给予人道的关怀。
1.3 实验方法
1.3.1 动物实验
选取7、14、21和28日龄清洁级长爪沙鼠(各日龄8只),各组腹腔内分接种病毒量1×105细胞培养半数感染量(CCID50)/只,每日观察并记录沙鼠的临床症状和存活/死亡情况,连续观察14 d,筛选出对CVA16病毒最敏感和最合适的沙鼠日龄段。取适龄的沙鼠48只,随机分成6组(每组8只),各组腹腔内分别接种CVA16(1×102、1×103、1×104和1×105CCID50/只)和对照MEM液,每日观察并记录沙鼠的症状和存活/死亡情况,连续观察14 d,最后用Reed-Muench法计算出CVA16对沙鼠的LD50剂量, 并以此为基数确定后续实验所需接种的适宜剂量。
1.3.2 临床症状判定标准
根据临床表现划分5个等级:0.正常;1.毛发竖起、体重下降和行动不便;2.后肢无力;3.单肢麻痹;4.双肢麻痹;5.死亡。
1.3.3 感染沙鼠的血液和主要组织器官中CVA16病毒滴度测定
选择14日龄长爪沙鼠3只,腹腔内注射接种LD50剂量(即1×104.5 CCID50)的CVA16,感染3 d后分别取血液、后肢肌肉、心脏、肝脏、肺、脑和肠道等7个组织,称重(除血液外)后加入10倍(体积重量比)的PBS,超声至匀浆后离心,取各上清液用MEM培养液作10倍梯度稀释至10-1~10-8,分别接种于Vero细胞长满单层96孔板中,置5%CO2培养箱中35℃培养7 d后,用显微镜观察CPE产生与否,用Reed-Muench法计算血液和上述各组织提取上清液的CVA16滴度。
1.3.4 CVA16灭活疫苗制备
病毒收获液经离心澄清,按1∶4000的比例加入福尔马林,37℃灭活3 d;超滤浓缩后,采用Sephacryl S-400 HR凝胶过滤层析和Source 30Q离子交换层析2步层析法纯化CVA16,进行各项检定及分析合格后,再除菌过滤,2~8℃保存,用时加入铝佐剂,稀释成蛋白含量10 μg/100 μL的剂量。
1.3.5 CVA16灭活疫苗对长爪沙鼠的免疫保护
新生1日龄的沙鼠腹腔内接种CVA16灭活疫苗(蛋白含量10 μg/100 μL只),10 d后加强免疫一次。等沙鼠14日龄时,用LD50病毒剂量进行攻毒实验,观察并记录沙鼠体重、症状及死亡率,2周后眼球采血,用ELISA检测血清中抗CVA16特异性抗体水平和体外微量中和试验检测其抗血清中和CVA16的能力,评价CAV16灭活疫苗的免疫原性。
1.3.6 体外微量中和试验检测中和抗体滴度
将沙鼠摘眼球采血,血清采用经典体外微量中和试验检测中和抗体效价。将免疫血清自1∶8开始进行2倍系列稀释后,分别与100 CCID50 CVA16等体积混合,接种于Vero细胞长满单层96孔板中,置5%CO2培养箱中35℃培养7 d后,用显微镜观察CPE,以能抑制50%细胞病变的最高稀释度的倒数作为中和抗体效价,每次试验均设细胞、病毒对照,检测结果以中和效价≥1∶8判为CVA16中和抗体阳性。
1.3.7 ELISA检测血清中CVA16特异性抗体水平
将沙鼠血清用1%BSA液稀释100倍后加入包被CVA16抗原的反应孔,100 μL/孔,同时利用BSA和阴性血清设立空白对照和阴性对照,37℃孵育1 h后洗涤5次;将HRP标记的羊抗鼠IgG 进行1∶10000稀释后加入反应孔,100 μL/孔,37℃孵育30 min后洗涤5次;每孔加入100 μL OPD显色液,37℃避光反应15 min后加入50 μL 2 M硫酸终止反应,用酶标仪测定490 nm的吸光度值。以阴性对照孔的平均吸光度值的2.1倍为阈值判定阳性。
1.3 统计学方法
采用GraphPad Prism5软件分析处理数据,组间比较采用独立样本Bonferroni′s Multiple Comparison Test,P< 0.05为差异有统计学意义。
2 结果
2.1 CVA16病毒感染长爪沙鼠的敏感性试验
长爪沙鼠感染CVA16后可出现活动减少、后肢无力、麻痹瘫痪、死亡等临床症状(图1)。不同日龄长爪沙鼠对CVA16 感染的敏感性不同并存在明显差异。7日龄长爪沙鼠在攻毒后第3天出现症状,第8天全部死亡,存活率为0;14日龄长爪沙鼠在攻毒后第4天出现临床症状,第9天全部死亡,存活率为0;21日龄长爪沙鼠也在攻毒后第4天出现症状,但临床症状比7日龄和14日龄鼠轻,第7天有部分感染沙鼠死亡,第8天感染沙鼠症状开始减轻,存活率为62.5%;28日龄长爪沙鼠在攻毒后第4天出现轻微临床症状(毛发竖起,轻微肌无力),第9天起逐步恢复正常,存活率为100%(图2)。7日龄和14日龄沙鼠对CVA16 感染的敏感性有统计学意义(P< 0.05),21日龄和28日龄沙鼠感染CVA16也会出现临床症状或死亡,但差异不具有统计学意义(P> 0.05)。按照长爪沙鼠日龄、临床评分和存活率,确定14日龄长爪沙鼠为CVA16病毒感染最合适的对象,并用于后续试验。

注:(A)正常;(B)病变。图1 14日龄长爪沙鼠感染CVA16出现后肢麻痹 Note.(A)normal.(B)paralysis.Fig.1 Hindlimb paralysis caused by CVA16 infection in 14-day-old Mongolian gerbils

注:组间比较,*P < 0.05。图2 CVA16感染长爪沙鼠的敏感性试验(n=8)Note. Compared with multiple groups,*P < 0.05.Fig.2 Sensitivity test of CVA16 infection in Mongolian gerbils
2.2 CVA16病毒感染长爪沙鼠的剂量与效应关系
14日龄长爪沙鼠注射不同剂量病毒,表现的症状与剂量成正相关性(P< 0.0001)。用1×105CCID50病毒量攻毒,第3天出现临床症状,在注射第8~9天全部死亡,存活率为0。随着病毒量减少,出现症状减轻,存活率提高,1×104CCID50病毒量,平均临床评分2.54,存活率62.5%;1×103CCID50病毒量,平均临床评分1.44,存活率75%;1×102CCID50病毒量,平均临床评分0.88,存活率87.5%。1×105和1×104CCID50病毒量与对照MEM液组比较有明显差异(P< 0.05)。最后用Reed-Muench法计算出CVA16对沙鼠的LD50剂量为1×104.5 CCID50病毒量,结果见图3。

注:与对照组比较,*P < 0.05。 图3 CVA16感染沙鼠的剂量与效应关系(n=8) Note.Compared with control group,*P < 0.05.Fig.3 Dose-dependent consequence of CVA16 infection in Mongolian gerbils
2.3 感染沙鼠的血液和主要组织器官中CVA16病毒的复制繁殖
根据对14日龄长爪沙鼠感染3 d后的血液和所选择主要组织器官提取上清液中CVA16病毒滴度的测定结果(图4),CVA16病毒均有存在,在后肢肌肉和脑组织中滴度最高(达6×105CCID50),表明CVA16确实感染了长爪沙鼠并在其体内进行了有效的复制和繁殖。

图4 CAV16感染14日龄长爪沙鼠3 d后血液和主要组织中的病毒滴度Fig.4 Virus titers in various tissues of CVA16-infected Mongolian gerbils 3 days post-infection
2.4 CVA16灭活疫苗对长爪沙鼠的免疫保护作用
免疫两针CVA16灭活疫苗的14日龄沙鼠用LD50剂量攻毒,注射第5天有2只出 现临床症状,一只症状较轻,另一只第7天死亡,存活率87.5%。疫苗免疫诱导沙鼠产生的CVA16中和抗体几何平均滴度(GMT)为28.14,特异性抗体阳性率为87.5%,而且中和抗体效价高低与ELISA测定的总抗体OD值完全对应,呈现正相关性(表1)。上述结果表明CVA16灭活疫苗对长爪沙鼠有显著的免疫保护效果。
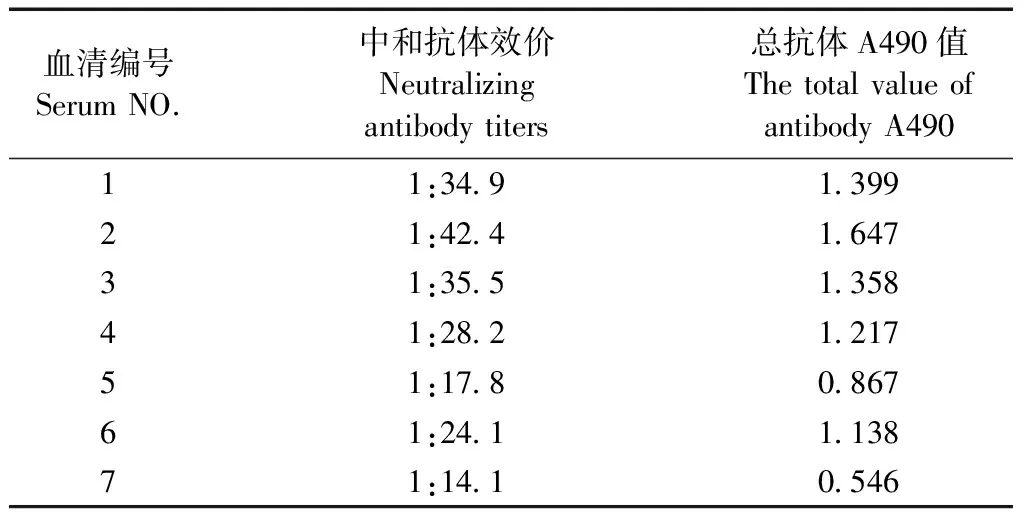
表1 CVA16灭活疫苗对长爪沙鼠的免疫原性
注: GMT为28.14;中和抗体效价≥l:8判断为抗体阳性;以阴性对照2.1倍为阈值判定阳性,cutoff值0.201。
Note. GMT to 28.14.Neutralizing antibody titer ≥1∶8 judged to be antibody positive. To 2.1 times the negative control positive determination, cutoff values for 0.201.
3 讨论
柯萨奇病毒A16型是引起手足口病的主要病原体之一,近年来越来越多报道显示CVA16除引起轻症外,亦可导致心肌、心包、脑部和肺部等疾病,甚至引发致死性心肌炎、脑干脑炎和肺炎等致死性症状[1],研发相应疫苗对全面有效地预防控制手足口病的暴发流行有重大意义。动物模型是疫苗临床前研究阶段评价保护效果等关键指标的重要工具,直接影响疫苗评价的准确性。目前常用的动物模型主要是小鼠乳鼠模型和猴体模型,小鼠乳鼠是相对敏感和常用的小动物感染模型,但由于其感染年龄过低,感染周期短,限制了其在疫苗免疫效果评价和药物筛选中的应用;而最为接近人类的猴体动物模型的研究虽然已经取得了一定的进展,但由于存在动物来源困难、饲养环境要求高、运输条件苛刻、试验费用高等客观原因,极大地限制了该模型的应用和发展。因此,开发建立新的手足口病小动物模型具有实际意义[7]。
长爪沙鼠属于啮齿目、沙鼠属动物,1935年由日本人开始驯化和实验动物化,60年代开始作为实验动物应用于医学研究。其对流行性出血热病毒、幽门螺旋杆菌、寄生虫等多种病原体易感,相比于其他啮齿类实验动物,长爪沙鼠受感染可表现出与人类更相似的病理学特征和临床症状,因此长爪沙鼠作为具有独特生物学特性的“多功能”实验动物,已广泛用于疫苗研制和病原感染等生物医学研究领域[11-13]。Yao等[7]用一株临床分离的EV71病毒感染长爪沙鼠,发现7到28日龄沙鼠感染后展现后肢麻痹、行动迟缓、运动失调和昏睡倦怠等症状并最终致死,另伴有严重的中枢神经系统相关病变,28至49日龄沙鼠对EV71敏感度逐渐降低,而49日龄以上沙鼠感染EV71后没有表观症状但多数产生相应的中和抗体。同时,他们对新生沙鼠腹腔内接种EV71灭活疫苗(20 mg/只)并在一周后加强免疫一次,再隔2周后即21日龄时,用致死剂量(100倍LD50)EV71病毒进行攻毒实验,发现接种EV71灭活疫苗对长爪沙鼠具有完全的免疫保护效果[7]。
CVA16病毒YY157株临床分离后未经小鼠活体驯化传代,前期工作中我们已测定了其基因组核酸全序列(GenBank序列号KC507895)、探索了其在Vero等[8,9]细胞中培养与增殖特性并确定了衣壳蛋白VP1~VP3的B淋巴细胞线性抗原表位[10]。我们将经过体外细胞培养繁殖并收获的CVA16 YY157株病毒通过腹腔注射感染长爪沙鼠,后者出现活动减少、后肢无力、麻痹瘫痪、死亡等临床症状,对CAV16感染的敏感性与沙鼠日龄相关即鼠龄越小越敏感;在剂量与效应关系实验结果显示症状和死亡率与剂量成正相关性,其LD50量与小鼠乳鼠模型接近[5]。先前在成功建立EV71 H3-TY株感染小鼠乳鼠模型基础上,我们也曾尝试建立CAV16 YY157株感染小鼠乳鼠模型,发现5日龄以下乳鼠才能被有效感染并展示类似的表型症状和剂量与效应关系。在本实验中感染CVA16使用的是7日龄以上长爪沙鼠,并通过腹腔注射途径,不同于小鼠乳鼠模型的颅内注射,不会直接破坏神经系统,更能客观反映病毒感染特征,实验结果也显示应该比小鼠乳鼠模型具有更大实用价值。
在疫苗研发中,疫苗免疫原性和保护效果评价是疫苗质量的关键指标。与小鼠乳鼠模型(通过免疫怀孕母鼠,对其所产新生乳鼠攻毒)相比,长爪沙鼠模型避免了前者通过母传抗体间接评价疫苗模式带来的相关问题,同时也降低了由于小鼠乳鼠日龄过小给实验带来的不确定性,更能真实反映疫苗免疫保护效果。本文前述的CVA16灭活疫苗对的长爪沙鼠免疫保护实验中有2只在攻毒后第5天出现临床症状,其中1只在攻毒后第7天死亡,导致存活或免疫保护率不是100%,很可能与免疫剂量低(10 mg/100 mL/只)和个体差异导致的中和抗体滴度不高有关。但CVA16感染长爪沙鼠引发的症状及其灭活疫苗的免疫保护作用均和EV71高度类似[7]。下一步我们将通过分子生物学方法检测相关细胞因子水平等状况。
总之,本实验利用浙江省实验动物中心驯养的Z:ZCLA长爪沙鼠建立了简便和可靠的对CAV16敏感的又一小型动物模型,其进一步优化、完善了CVA16的现有动物模型,可用于CVA16病毒致病机制、感染特点的研究和其相关疫苗及药物效果的评价。
[1] 李兰娟.手足口病[M]. 浙江省科学技术出版社, 2008.
[2] 王一平,毛群颖,梁争论.柯萨奇A组16型研究进展[J].微生物学免疫学进展,2012,40(3): 62-66.
[3] Mao Q, Wang Y, Yao X,etal. Coxsackievirus A16: Epidemiology, diagnosis, and vaccine [J].Hum Vaccin Immunother, 2014, 10(2): 360-367.
[4] Zhu FC, Meng FY, Li JX,etal. Efficacy, safety, and immunology of an inactivated alum-adjuvant enterovirus 71 vaccine in children in China: a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial [J].Lancet,2013, 381(9882): 2024-2032.
[5] Mao Q, Wang Y, Gao R,etal. A neonatal mouse model of coxsackievirus A16 for vaccine evaluation [J]. J Virol,2012, 86(22):11967-11976.
[6] Liu Q, Yan K, Feng Y,etal. A virus-like particle vaccine for coxsackievirus A16 potently elicits neutralizing antibodies that protect mice against lethal challenge [J].Vaccine,2012, 30 (47): 6642-6648.
[7] Yao PP, Qian L, Xia Y,etal. Enterovirus 71-induced neurological disorders in young gerbils, Meriones unguiculatus: development and application of a neurological disease model [J]. PLoS One,2012, 7(12): e51996.
[8] 张锋,朱莲,陈军,等.柯萨奇病毒A16型YY157株在Vero细胞中培养与增殖特性的研究[J].中华实验和临床病毒学杂志,2014,28(6): 446-448.
[9] 陈军,朱莲,张锋,等.柯萨奇病毒YY157株在不同细胞系中的增殖特性[J].国际流行病学传染病学杂志,2015,42(2): 103-106.
[10] 高孟,倪红霞,朱莲,等.柯萨奇病毒A16型衣壳蛋白VP1~VP3的B淋巴细胞线性抗原表位预测与确定[J].中华临床感染病杂志,2015,80(6): 543-548.
[11] 翁景清,朱智勇.双价流行性出血热灭活疫苗的研究和应用[J].医学研究通讯,2000,29(10): 21-22.
[12] 肖丽,戴方伟,宋晓明,等.长爪沙鼠在病原感染研究中的应用[J].中国比较医学杂志,2013,23(7): 61-67.
[13] 卢领群,宋晓明,戴方伟,等.长爪沙鼠的生物净化技术[J].中国比较医学杂志,2014,24(4): 62-65.
Establishment of an animal model for coxsackievirus A16 infection related immunological evaluation
ZHANG Feng, GAO Meng, GAO Li-mei, LUO Yong-neng*
(Institute of Viral Diseases, Zhejiang Academy of Medical Sciences, Hangzhou 310013,China)
Objective To establish a simple and reliable experimental rodent model sensitive to coxsackievirus A16 (CVA16).Methods Mongolian gerbils with different age were selected and inoculated intraperitoneally with live CVA16, and the gerbils were observed daily until 14 days postinoculation to screen for the most optimal ages sensitive to the virus. The dose-dependent symptoms were evaluated and the 50% lethal dose (LD50) was determined. The virus titers were measured in blood and various tissues of CVA16-infected Mongolian gerbils 3 days post-infecton. Finally, the gerbils were immunized twice with inactivated CVA16 vaccine at day 1 and day 11, respectively, followed by challenge with the virus with a dose of LD50 at day 14. The gerbils were then observed for another 2 weeks to record their body weight, symptom and mortality rate. Their blood samples were collected from the eyes, and CVA16-specific neutralizing antibody titers and total antibody titers was checked by microneutralization test and ELISA, respectively. Results Various clinical symptoms, such as inactivity, hind limb weakness, paralysis and even death occurred in gerbils following CAV16 infection. 7-day-old and 14-day-old gerbils are susceptible to CVA16 infection whereas 28-day-old gerbils are resistant. The most sensitive and appropriate age is 14-day-old. The 50% lethal dose was determined to be 1×104.5 CCID50. High titers of the virus were confirmed in blood and various tissues of Mongolian gerbils contracted CAV16 3 days post-infecton. The survival rate is 87.5% for 14-day-old gerbils preimmunized with two doses of inactivated CVA16 vaccine and challenged with the virus. The geometric mean titers (GMTs) of neutralizing antibody was 28.14, and the seroprevalence was 87.5%. Conclusions Mongolian gerbils is sensitive to CVA16 and the virus reproduces actively in Vivo. Thus, it can be used as a reliable small animal model for studies of CVA16 pathogenesis, vaccine development and drug evaluation.
Coxsackievirus A16; Mongolian gerbils; Animal model
浙江省科技计划项目(2014C37014,2016C37102)。
张锋(1974-),男,高级实验师,研究方向:从事医学病毒学研究。E-mail:13957185700@163.com
罗永能(1966-),男,博士,研究员,研究方向:从事医学病毒学研究。E-mail:ynl101@163.com
研究报告
R-332
A
1671-7856(2017) 01-0037-06
10.3969.j.issn.1671-7856.2017.01.008
2016-07-04
