秦岭细鳞鲑代谢及低氧耐受能力对温度驯化的响应
2017-02-15夏继刚付世建
夏继刚 陈 梅 肖 静 付世建
(重庆师范大学进化生理与行为学实验室, 重庆市动物生物学重点实验室, 重庆 401331)
秦岭细鳞鲑代谢及低氧耐受能力对温度驯化的响应
夏继刚 陈 梅 肖 静 付世建
(重庆师范大学进化生理与行为学实验室, 重庆市动物生物学重点实验室, 重庆 401331)
为考察秦岭细鳞鲑(Brachymystax lenok tsinlingensis)代谢及低氧耐受能力对温度驯化的响应, 将实验鱼于6℃、12℃和18℃下驯化4周后, 采用密闭式呼吸代谢测定仪对其静止代谢率(Resting metabolic rate, RMR)和临界氧压(Critical oxygen press, Pcrit)等参数进行测定。结果发现, RMR随驯化温度升高而升高, 在6—12℃、12—18℃温度内, RMR的Q10值分别为2.59和2.77, 表明该物种对温度的敏感性较高; Pcrit值随驯化温度升高而升高且与RMR显著正相关, 在驯化温度范围内(6—18℃), Pcrit提升了76.2%。研究结果提示: 秦岭细鳞鲑应对低氧环境的生理可塑性较差, 在高温下RMR增加可能是导致其低氧耐受能力降低的内在机制之一。
秦岭细鳞鲑; 温度驯化; 静止代谢率; 低氧耐受; 温度系数
温度对动物生理功能和生态学过程的影响是动物生理生态学领域的核心问题[1,2]。在全球气候变化、局域极端气候频繁发生的背景下, 物种的适合度与进化进程受到影响, 那些生境特殊、处于临界分布状态的物种对温度的响应备受科学界关注[3—5]。
秦岭细鳞鲑(Brachymystax lenok tsinlingensis),俗称“梅花鱼”, 是目前世界上分布最南端的几种鲑科鱼类之一[6,7], 为第四纪冰川时期自北方南移的残留物种, 是典型的陆封型冷水性山麓鱼类, 其地域分布范围狭窄、生境特殊、主要分布于秦岭山系海拔1200—2300 m的山涧溪流及深水潭中[8]。调查研究发现, 秦岭细鳞鲑对生境水温有严格要求,易受全球气候变化和人为活动的影响, 近20年来,其种群数量减少, 且生存海拔已经提升了200—300 m[9,10]。鉴于该物种的特殊性及其生境的易损性, 我国政府已将其作为国家Ⅱ级重点保护水生野生动物, 列入《中国濒危动物红皮书》, 并于2009年成立了秦岭细鳞鲑国家级自然保护区。然而, 对秦岭细鳞鲑的研究工作相对滞后, 相关研究也仅限于形态、发育、基因组学等方面[7,10,11]。特别地,尽管水温是决定该物种生存与分布的关键因子, 其热生理学方面的研究却鲜见报道。
一般来说, 温度升高会导致鱼类的静止代谢率(Resting metabolic rate, RMR)提高, 致使鱼体对溶解氧的需求加大; 然而水体的溶氧水平却随着温度的升高而降低, 导致鱼类摄氧难度加大, 对鱼类的低氧耐受(Hypoxia tolerance)能力提出了严峻挑战[12—14]。那么, 温度变化将对鱼类的低氧耐受能力造成何种影响呢?对此, 目前科学界尚无普适性的结论[15,16]。本文探究了秦岭细鳞鲑幼鱼代谢及低氧耐受能力对温度驯化的响应, 旨在为该物种的保护生理学研究提供理论依据。
1 材料与方法
1.1 实验动物
经批准, 实验用秦岭细鳞鲑幼鱼采自太白湑水河珍稀水生生物国家级自然保护区(33°744′N, 107° 460′E), 被带回实验室后, 于360 L自净化循环控温系统驯养适应3周。驯养条件如下: 实验用水为充分曝气脱氯并经过活性炭过滤的自来水, 水温(13.5±0.5)℃ (与采样点的温度接近), 溶解氧>9 mg/L, 氨氮浓度<0.01 mg/L; 每天早晨投喂黄粉虫(Tenebrio molitor)幼虫至饱足。
1.2 代谢水平及耐低氧能力测定
在温度驯化结束后, 将实验鱼禁食48h, 采用密闭式呼吸代谢测定仪[17]对其代谢水平及耐低氧能力进行测定。考虑到不同温度驯化下实验鱼代谢水平的差异, 为了能在相近的时间内完成测定(避免暴露时间不同对实验鱼可能带来的影响), 根据预实验的研究结果, 本实验对各温度驯化组(6℃、12℃和18℃)的测定分别采用体积为360、600和900 mL的呼吸室。呼吸室外以黑色遮光材料贴附,避免外界干扰。实验时, 将实验鱼轻移至呼吸室中,并使其在呼吸室中适应12h以消除转移胁迫, 用纱网封闭端口, 防止实验鱼游出但同时又能实现呼吸室内外水体交换; 测定时, 将呼吸室端口加盖密封并使用溶氧仪(HQ30, Hach Company, Loveland, CO, USA)连续监测呼吸室内溶氧水平的变化, 每2min记录一次溶氧值, 直至水体溶氧值不再下降为止。适应期间和测定过程中, 呼吸室内的温度均与测试鱼前期的驯化温度相同。各温度驯化处理组的测试样本量为n=8。
MO2实验鱼呼吸耗氧率(Oxygen consumption rate, )的计算公式如下:
MO2=(DOk¯DOk+1)V/(t×m0.75)
式中, DOk和DOk+1分别为测定时间点k及k+1时刻呼吸室内的溶氧水平(mg/L); V (L)为呼吸室体积与实验鱼体积的差值; t (h)为时间点k与k+1的时间间隔; m (kg)为实验鱼的体重。为消除体重对代谢率测定的影响, 将实验鱼体重标准化为1 kg, 0.75为体重校正指数[18,19]。
临界氧压(Critical oxygen press, Pcrit)为鱼类能够维持基本生理功能的最低环境氧压, 该指标通常被用来评价鱼类的低氧耐受能力。根据呼吸室内水体DO与实验鱼的关系, 采用“双线法(Twosegmented straight lines)”求出[mg O2/(kg·h)]变化的Pcrit(mg/L)[20]。将Pcrit值出现以前, 所测得MO2的平均值作为实验鱼的RMR。
1.3 数据处理
应用软件SPSS for Windows 16.0 (SPSS Inc., USA)对数据进行统计分析。首先对实验数据进行正态性和方差齐性检验。采用单因素方差分析(ANOVA)和Tukey's HSD法检验差异显著性, 用“双线法”分析求出Pcrit, 用线性回归分析检测Pcrit与RMR的关系。各组数据均以平均值±标准误表示,显著性水平设在P<0.05。
4)为了减少对一般敏感负荷和敏感负荷的影响,希望将短时停电控制为瞬间中断的停电事件,所以重合闸时间不应超过3 s,建议整定为2.5 s较为合适。
2 结果
2.1 对驯化温度和环境溶氧的响应
2
在6℃、12℃和18℃驯化下秦岭细鳞鲑幼鱼
对环境溶氧的响应模式见图 1。从图中可以看出秦岭细鳞鲑幼鱼为“氧调节型”鱼类, 其代谢水平在一定的溶氧范围内维持相对稳定的水平, 直到环境溶氧浓度下降到某一临界值(图中双线的交叉点)时, 代谢水平才随着环境溶氧的下降而下降。
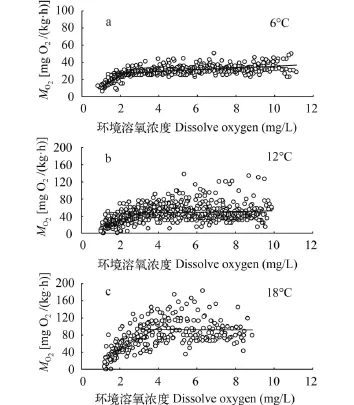
图 1 不同温度驯化下秦岭细鳞鲑幼鱼代谢水平对环境溶氧的响应Fig. 1 The oxygen consumption rateof juvenile Brachymystax lenok tsinlingensis under different acclimation temperatures and dissolved oxygen levels
温度驯化对实验鱼RMR影响显著(F=43.2, P<0.001)。RMR随驯化温度的增加而升高(图 2)。与6℃驯化组相比, 18℃驯化导致实验鱼的RMR提升了226.6%。
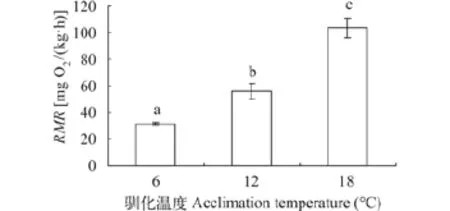
图 2 温度驯化对秦岭细鳞鲑幼鱼静止代谢率(RMR)的影响Fig. 2 Effects of temperature acclimation on the resting metabolic rate (RMR) in juvenile Brachymystax lenok tsinlingensis上标字母不同表示数值间差异显著(P<0.05); 数值以平均值±标准误表示(n=8); 下同Values with different superscript letters denote statistically significant differences (P<0.05) among groups; Values are presented as mean±SEM (n=8); the same applies below
2.2 Pcrit对驯化温度的响应及其与RMR的关系
温度驯化对实验鱼Pcrit影响显著(F=10.0, P= 0.001)。Pcrit随驯化温度的增加而升高(图 3)。与6℃驯化组相比, 18℃驯化导致实验鱼的Pcrit提升了76.2%。线性回归分析检测结果表明, 在各驯化温度下, Pcrit与RMR均显著正相关(P<0.05) (图 4)。
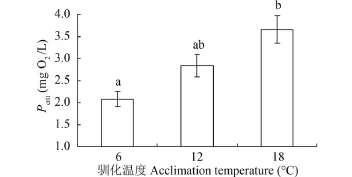
图 3 温度驯化对秦岭细鳞鲑幼鱼临界氧压(Pcrit)的影响Fig. 3 Effects of temperature acclimation on the critical oxygen press (Pcrit) in juvenile Brachymystax lenok tsinlingensis
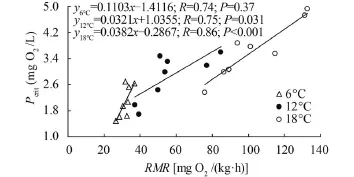
图 4 秦岭细鳞鲑幼鱼临界氧压(Pcrit)与静止代谢率(RMR)的关系Fig. 4 The relationships between critical oxygen press (Pcrit) and resting metabolic rate (RMR) in juvenile Brachymystax lenok tsinlingensis
2.3 温度系数Q10
驯化温度从6℃增加到12℃, RMR和Pcrit的Q10值分别为2.59和1.68; 驯化温度从12℃增加到18℃, RMR和Pcrit的Q10值分别为2.77和1.53(表 1)。

表 1 秦岭细鳞鲑幼鱼临界氧压(Pcrit)与静止代谢率(RMR)的Q10值Tab. 1 The Q10of critical oxygen press (Pcrit) and resting metabolic rate (RMR) in juvenile Brachymystax lenok tsinlingensis
3 讨论
全球升温给鲑科鱼类的生存带来了巨大挑战[12,21,22]。秦岭细鳞鲑作为世界上分布最南端的鲑科鱼类之一, 故而可能更易受到温度变化的影响。本研究结果表明, 温度驯化对秦岭细鳞鲑幼鱼代谢水平及其低氧耐受能力均影响显著。
温度通过影响鱼体内多种代谢酶的活性进而影响其代谢水平[23]。RMR是鱼体在空腹、静止状态下的代谢水平, 反映了机体运行基本生理功能的维持能量消耗。鱼类RMR随温度升高而升高的现象已在很多研究中被证实[22,24]; 然而, 由于各个物种温度敏感性的不同, 其RMR对温度响应的程度往往存在差异性。例如, 鲫(Carassius carassius)、鳊(Parabramis pekinensis)等广温性鲤科鱼类RMR的Q10值往往较小(一般小于2)[16,25], 而冷水性鲑科鱼类RMR的Q10值往往较大(一般大于2)[22,24]。本研究发现, 在6—12℃、12—18℃温度范围内, 秦岭细鳞鲑幼鱼RMR的Q10值分别为2.59和2.77(表 1), 表明该物种对温度的敏感性较高, 研究结果分别与Eliason等[24]对红大马哈鱼(Oncorhynchus nerka)、Remen等[26]对大西洋鲑(Salmo salar)以及Kelly等[22]对湖红点鲑(Salvelinus namaycush)的研究结果相近。
Pcrit值反映了鱼类在环境溶氧水平下降时获取氧气维持其基本生理功能的能力, Pcrit值越低的鱼类低氧耐受能力越强[27]。那么, 鱼类低氧耐受能力对温度的响应模式如何呢?研究发现, 虹鳟(Salmogairdneri)的Pcrit值随温度升高而升高[15], 鲫的Pcrit值不受温度影响[16], 鳊的Pcrit值随温度升高而降低[25]。事实上, 由于不同种类应对低氧环境策略及其可塑性的不同[28], 鱼类低氧耐受能力对温度的响应模式往往呈现出差异性。一般认为, 由于温度增加会引起鱼体代谢水平升高, 导致机体的需氧量增加, 进而导致机体的低氧耐受能力降低[14]; 然而, 在一定程度的升温范围内, 某些鱼类也可能通过一系列的生理生化调节途径来改善生理机能(例如, 血液循环加快、血红蛋白氧亲和力提高、代谢酶活性改变、鳃呼吸面积增大、心跳和呼吸频率增加等),提高机体的摄氧能力[27,29], 故而使机体有可能维持甚至增加其低氧耐受能力。本研究发现, 在高温驯化下秦岭细鳞鲑幼鱼的低氧耐受能力显著降低(Pcrit值显著升高), 在驯化温度范围内(6—18℃), 实验鱼的Pcrit提升了76.2%; 此外, 通过对RMR和Pcrit的回归分析, 发现各个温度驯化处理下的实验鱼Pcrit与RMR均显著正相关(图 4)。基于以上分析, 我们推测: 秦岭细鳞鲑幼鱼应对低氧环境的生理可塑性较差, 高温下RMR增加是导致该物种低氧耐受能力降低的内在机制之一。
致谢:
感谢陕西师范大学生命科学学院梁刚副教授在野外采样过程中给予的大力支持和帮助!
[1]Clarke A. Costs and consequences of evolutionary temperature adaptation [J]. Trends in Ecology and Evolution, 2003, 18(11): 573—581
[2]Machac A, Zrzavý J, Smrckova J, et al. Temperature dependence of evolutionary diversification: differences between two contrasting model taxa support the metabolic theory of ecology [J]. Journal of Evolutionary Biology, 2012, 25(12): 2449—2456
[3]Patarnello T, Verde C, di Prisco G, et al. How will fish that evolved at constant sub-zero temperatures cope with global warming? Notothenioids as a case study [J]. Bioessays, 2011, 33(4): 260—268
[4]Nguyen K D, Morley S A, Lai C H, et al. Upper temperature limits of tropical marine ectotherms: global warming implications [J]. PLoS One, 2011, 6(12): e29340
[5]Kaeriyama M, Seo H, Qin Y X. Effect of global warming on the life history and population dynamics of Japanese chum salmon [J]. Fisheries Science, 2014, 80(2): 251—260
[6]Shaanxi Institute of Zoology. Ichthyography of Qinling Mountains [M]. Beijing: Science Press. 1987, 14—15 [陕西省动物研究所. 秦岭鱼类志. 北京: 科学出版社. 1987, 14—15]
[7]Shi D L, Wei Q W, Sun Q L, et al. Early ontogenesis of Brachymystax lenok tsinlingensis [J]. Journal of Fishery Sciences of China, 2012, 19(4): 557—567 [施德亮, 危起伟, 孙庆亮, 等. 秦岭细鳞鲑早期发育观察. 中国水产科学, 2012, 19(4): 557—567]
[8]Liu H, Li Y, Liu X, et al. Isolation and characterization of eleven novel microsatellite loci of Brachymystax lenok tsinlingensis, a threatened fish endemic to Shaanxi, China [J]. Conservation Genetics Resources, 2013, 5(2): 389—391
[9]Ren J, Liang G. Resource survey report of Brachymystax lenok tsinlingensis in Qianhe River Valleys of Qinling Mountains [J]. Journal of Shaanxi Normal University (Natural Science Edition), 2004, 32(9): 165—168 [任剑,梁刚. 千河流域秦岭细鳞鲑资源调查报告. 陕西师范大学学报 (自然科学版), 2004, 32(9): 165—168]
[10]Zhao Y, Zhang C. Threatened fishes of the world: Brachymystax lenok tsinlingensis Li, 1966 (Salmonidae) [J]. Environmental Biology of Fishes, 2009, 86(1): 11—12
[11]Si S, Wang Y, Xu G, et al. Complete mitochondrial genomes of two lenoks, Brachymystax lenok and Brachymystax lenok tsinlingensis [J]. Mitochondrial DNA, 2012, 23(5): 338—340
[12]Ficke A D, Myrick C A, Hansen L J. Potential impacts of global climate change on freshwater fisheries [J]. Reviews in Fish Biology and Fisheries, 2007, 17(4): 581—613
[13]Rabalais N N, Turner R E, Díaz R J, et al. Global change and eutrophication of coastal waters [J]. ICES Journal of Marine Science, 2009, 66(7): 1528—1537
[14]Sørensen C, Munday P L, Nilsson G E. Aerobic vs. anaerobic scope: sibling species of fish indicate that temperature dependence of hypoxia tolerance can predict future survival [J]. Global Change Biology, 2014, 20(3): 724—729
[15]Ott M E, Heisler N, Ultsch G R. A re-evaluation of the relationship between temperature and the critical oxygen tension in freshwater fishes [J]. Comparative Biochemistry and Physiology Part A: Physiology, 1980, 67(3): 337—340
[16]He W, Cao Z D, Fu S J. Effect of temperature on hypoxia tolerance and its underlying biochemical mechanism in two juvenile cyprinids exhibiting distinct hypoxia sensitivities [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2015, 187 (9): 232—241
[17]Zhang W, Cao Z D, Peng J L, et al. The effects of dissolved oxygen level on the metabolic interaction between digestion and locomotion in juvenile southern catfish (Silurus meridionalis Chen) [J]. Comparative Biochemistry and Physiology Part A: Molecular & IntegrativePhysiology, 2010, 157(3): 212—219
[18]Fu S J, Zeng L Q, Li X M, et al. The behavioural, digestive and metabolic characteristics of fishes with different foraging strategies [J]. Journal of Experimental Biology, 2009, 212(14): 2296—2302
[19]Fu S J, Fu C, Yan G J, et al. Interspecific variation in hypoxia tolerance, swimming performance and plasticity in cyprinids that prefer different habitats [J]. The Journal of Experimental Biology, 2014, 217(4): 590—597
[20]Yeager D P, Ultsch G R. Physiological regulation and conformation: a basic program for the determination of critical points [J]. Physiological Zoology, 1989, 888—907
[21]Casselman J M. Effects of temperature, global extremes, and climate change on year-class production of warmwater, coolwater, and coldwater fishes in the Great Lakes basin [C]. American Fisheries Society Symposium. American Fisheries Society, 2002, 39—60
[22]Kelly N I, Burness G, McDermid J L, et al. Ice age fish in a warming world: minimal variation in thermal acclimation capacity among lake trout (Salvelinus namaycush) populations [J]. Conservation Physiology, 2014, 2(1): 25
[23]He W, Chen B J, Cao Z D, et al. The effect of acclimation temperature on the activity of carbohydrate-metabolizing enzymes in five cyprinids [J]. Acta Hydrobiologica Sinica, 2015, 39(1): 203—208 [何伟, 陈波见, 曹振东,等. 温度驯化对5种鲤科鱼类糖代谢酶活性的影响. 水生生物学报, 2015, 39(1): 203—208]
[24]Eliason E J, Clark T D, Hinch S G, et al. Cardiorespiratory collapse at high temperature in swimming adult sockeye salmon [J]. Conservation Physiology, 2013, 1(1): 8
[25]Chen B J, Cao Z D, Fu S J, et al. Temperature effect on rest metabolic rate and hypoxia tolerance in Chinese bream (Parabramis pekinensis) [J]. Chinese Journal of Zoology, 2010, 45(5): 1—8 [陈波见, 曹振东, 付世建, 等.温度对鳊鱼静止代谢和耐低氧能力的影响. 动物学杂志, 2010, 45(5): 1—8]
[26]Remen M, Oppedal F, Imsland A K, et al. Hypoxia tolerance thresholds for post-smolt Atlantic salmon: Dependency of temperature and hypoxia acclimation [J]. Aquaculture, 2013, 416—417: 41—47
[27]Mandic M, Todgham A E, Richards J G. Mechanisms and evolution of hypoxia tolerance in fish [J]. Proceedings of the Royal Society of London B: Biological Sciences, 2009, 276(1657): 735—744
[28]Dhillon R S, Yao L, Matey V, et al. Interspecific differences in hypoxia-induced gill remodeling in carp [J]. Physiological and Biochemical Zoology, 2013, 86(6): 727—739
[29]Barrionuevo W R, Burggren W W. O2consumption and heart rate in developing zebrafish (Danio rerio): influence of temperature and ambient O2[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 1999, 276(2): R505—R513
THE METABOLISM AND HYPOXIA TOLERANCE OF BRACHYMYSTAX LENOK TSINLINGENSIS IN RELATION TO TEMPERATURE ACCLIMATION
XIA Ji-Gang, CHEN Mei, XIAO Jing and FU Shi-Jian
(Laboratory of Evolutionary Physiology and Behavior, Chongqing Key Laboratory of Animal Biology, Chongqing Normal University, Chongqing 401331, China)
Brachymystax lenok tsinlingensis, a second-class state-protected wild animal in the China Red Data Book of Endangered Animals, is generally regarded as one of the southernmost-distributed Salmonidae fish. Although temperature is critical for the survival and distribution of this species, information on its thermal physiology is extremely limited. In order to investigate the metabolism and hypoxia tolerance of B. lenok tsinlingensis in relation to temperature acclimation, fish were acclimated to the experimental temperature (6℃, 12℃, and 18℃) for 4 weeks, and sealed respirometers were used to determine the physiological parameters [e.g., resting metabolic rate (RMR) and critical oxygen press (Pcrit)]. Our results showed that the RMR increased with an increase in the acclimation temperature. The Q10of RMR at 6—12℃ and 12—18℃ were 2.59 and 2.77, respectively, suggesting that B. lenok tsinlingensis was of high sensitivity to temperature changes. The Pcritincreased with an increase in the acclimation temperature, and the values of Pcritincreased by 76.2% over the acclimation temperature range (6—18℃). Furthermore, significantly positive correlations were found between the Pcritand the RMR. Our findings indicate that B. lenok tsinlingensis evolves poor physiological plasticity in response to hypoxic environment, and that increasing RMR at high temperatures may have contributed to the decreased hypoxia tolerance in B. lenok tsinlingensis.
Brachymystax lenok tsinlingensis; Temperature acclimation; Resting metabolic rate (RMR); Hypoxia tolerance; Temperature coefficient (Q10)
Q175
A
1000-3207(2017)01-0201-05
10.7541/2017.25
2016-01-12;
2016-06-17
国家自然科学基金(31300340); 重庆师范大学青年拔尖人才培育计划(14CSBJ08)资助 [Supported by the National Natural Science Foundation of China (31300340); Youth Top-notch Talent Cultivation Program of Chongqing Normal University (14CSB J08)]
夏继刚(1980—), 男, 河南固始人; 博士, 副教授, 硕士生导师; 主要从事鱼类环境生理与保护生态学研究。E-mail: jigang xia@163.com
付世建, E-mail: shijianfu9@hotmail.com
