油菜秸秆60Co–γ辐照降解产物分析
2017-02-15张春艳谭兴和熊兴耀苏小军李清明王克勤
张春艳,谭兴和*,熊兴耀,苏小军,2,李清明,王克勤
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.湖南省作物种质创新与资源利用重点实验室,湖南 长沙 410128;3.中国农业科学院蔬菜与花卉研究所,北京 100081;4.湖南省农业科学院核农学与航天育种研究院,湖南 长沙 410125)
油菜秸秆60Co–γ辐照降解产物分析
张春艳1,谭兴和1*,熊兴耀2,3,苏小军1,2,李清明1,王克勤4
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.湖南省作物种质创新与资源利用重点实验室,湖南 长沙 410128;3.中国农业科学院蔬菜与花卉研究所,北京 100081;4.湖南省农业科学院核农学与航天育种研究院,湖南 长沙 410125)
以油菜秸秆为材料,采用60Co–γ辐照,设6个辐照剂量处理,分别为 0(CK)、400、600、800、1 000、1 200 kGy,考察不同剂量辐照处理后油菜秸秆3大主要组分降解率的变化,并采用气质联用法对辐照后全产物进行分析。结果表明:随着剂量的增大,纤维素、半纤维素和木质素降解率都有不同程度的提高;当辐照剂量为1 200 kGy时,纤维素、半纤维素和木质素降解率分别达到69.06%、42.57%和4.99%;未辐照油菜秸秆水提液乙酸乙酯萃取物中分别检测到脂肪酸类物质22种、芳香类物质5种,未检测到呋喃类物质,而从不同剂量辐照后样品中分别检测到脂肪酸类物质25种、芳香类物质17种,呋喃类物质5种,且各类产物的种类与含量变化呈现出不同规律。
油菜秸秆;60Co–γ辐照;降解产物
在众多的可再生能源中,木质纤维素原料等生物质能源因其具有来源丰富、价格低廉等独特优势而成为新能源领域的研究热点之一[1–2]。由于秸秆等木质纤维素原料的结构致密复杂,因此如何采取有效的预处理方法,改变其结构,以增加其反应性能[3]是当前亟待解决的问题。目前,已有很多方法被应用于木质纤维素原料的预处理,如酸碱法,蒸气爆破法、高压液态水法、离子液体法等,这些方法都或多或少有一定的局限性,例如成本居高不下或者会产生对后续酶解发酵有抑制作用的副产物等[4]。而辐照预处理,可使木质纤维素原料分子内部产生自由基,这些自由基又可以通过一定的链剪切或交联反应诱发木质纤维素的降解[5]。
中国每年有大量的油菜秸秆被废弃,造成极大的资源浪费,还会对环境造成污染。笔者研究经不同剂量辐照后油菜秸秆中的纤维素、半纤维素和木质素的降解情况,并采用气质联用技术检测辐照后降解产物的种类与含量,以期为木质纤维素原料的辐照降解机理提供一定的参考。
1 材料与方法
1.1 材料
油菜秸秆采自湖南农业大学油料作物研究所试验基地。
仪器:Agilent 7200 QTOF气相色谱–质谱联用仪,美国安捷伦公司生产;FIWE3/6纤维素测定仪,北京盈盛恒泰科技有限责任公司生产;XS型中草药粉碎机,广州华凯机电设备有限公司生产。
试剂:吡啶、N,O–双三甲基硅三氟乙酰胺等试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 油菜秸秆辐照预处理
油菜秸秆采回后清洗,烘干至恒重(60 ℃,5 d),粉碎过孔径为0.425 mm的筛。取一定量的油菜秸秆粉末装入1 000 mL广口瓶中,在自然室温条件下照射。共设6个辐照剂量处理,分别为 0(CK)、400、600、800、1 000、1 200 kGy,剂量率为2.0 kGy/h。辐照处理在湖南省农业科学院核农学与航天育种研究所进行。辐射钴源强度为9.99×1015Bq。处理后的样品在自然室温条件下贮藏,备用。
1.2.2 油菜秸秆基本成分分析
水分测定参照GB 5009.3—2010;灰分测定参照GB 5009.4—2010;纤维素含量测定采用硝酸乙醇法[6];综纤维素含量测定参照GB/T 2677.10—1995,木质素含量的测定参照GB/T 2677.8—94。半纤维素含量为综纤维素含量减去纤维素含量。纤维素、半纤维素和木质素降解率分别为经过辐照处理后被降解掉的纤维素、半纤维素和木质素含量与未经处理的原料中纤维素、半纤维素和木质素含量的百分比。
1.2.3 气质联用样品前处理及条件
样品前处理参照文献[7]的方法进行:分别称取一定量经不同剂量辐照处理后的油菜秸秆样品,放入150 mL 三角瓶中,按固(质量,g)液(体积,mL)比1∶10加入蒸馏水,沸水浴处理30 min,收集滤液并用乙酸乙酯萃取3次;将收集的有机相混合后用饱和氯化钠溶液洗涤,加入无水硫酸镁脱水,后置于旋转蒸发仪中浓缩至干物质;取500 μL浓缩后产物用少许乙酸乙酯溶解,加入100 μL吡啶和400 μL N,O–双三甲基硅三氟乙酰胺(BSTFA),充分混匀,放置于70 ℃恒温干燥箱中反应30 min,衍生化后的产物即可用于气质联用分析。
气质联用条件:DB–5弹性石英毛细管色谱柱,进样量1 μL,进样口温度为250 ℃,载气为1 mL/min氦气;升温程序为初始温度50 ℃,保持2 min,以5℃/ min 升至150 ℃,保持2 min,然后以5 ℃/ min升至250 ℃,保持20 min。质谱采用250 ℃ EI离子源,扫描范围(m/z)50~500。
1.3 数据处理
产物的定性分析以标准化合物谱库检索为依据。
2 结果与分析
2.1 不同剂量辐照处理对油菜秸秆主要组分的影响
测得油菜秸秆中纤维素、半纤维素和木质素含量分别为41.37%、23.63%和13.03%,灰分为8.75%,水分为8%,表明油菜秸秆是典型的木质纤维素原料。
经不同剂量辐照后油菜秸秆纤维素、半纤维素和木质素降解率变化如图1所示。辐照后油菜秸秆中的纤维素、半纤维素和木质素发生不同程度的降解,并且随着辐照剂量的增加,降解率增大。半纤维素对辐照较为敏感,当剂量从400 kGy增大到1 200 kGy时,降解率相应的从9.73%增大到69.06%;纤维素敏感性稍低,降解率从15.47%(400 kGy)增大到42.57%(1 200 kGy);木质素对辐照最不敏感,仅由3.91%(400 kGy)增大到4.99%(1 200 kGy)。

图1 不同剂量辐照后油菜秸秆主要组分的降解率Fig.1 The main component degradation rate of rape straw after irradiation with different doses
2.2 油菜秸秆经辐照后的降解副产物分析
2.2.1 辐照后油菜秸秆乙酸乙酯萃取液中脂肪酸类化合物分析
经不同剂量辐照处理后油菜秸秆乙酸乙酯萃取液中含有大量的脂肪酸类化合物,结果见表1。从各辐照处理样品中共鉴定出32种脂肪酸化合物。这些物质主要来源于提取物、木质纤维素的降解及某些降解产物如糖类化合物的进一步降解。一些长链脂肪酸如十四酸、壬酸等可能来源于纤维素的降解或者未改性的提取物。短链脂肪酸如2–丙烯酸、3–丙烯酸等可能来源于提取物或者碳水化合物的降解。

表1 不同剂量辐照处理的油菜秸秆乙酸乙酯萃取液中的脂肪酸类化合物及其含量Table 1 Aliphatic acids in ethyl acetate extractives of untreated and irradiation–pretreated rapeseed straw
在不同剂量辐照处理下,发生的反应不尽相同,因此脂肪酸类物质的种类和含量差别也较大。在所列出的脂肪酸类化合物中,有辛二酸、2–戊烯酸、3–丙烯酸、软脂酸、乙二酸、辛酸、肉桂酸等7种仅在未辐照的样品中检测到,而辐照处理的样品中均未检测到,表明经辐照后,这些物质全部发生了反应,转变成为其他物质。这7种物质中除辛二酸、3–丙烯酸含量稍高,其他几种物质含量都很低。从未辐照样品中一共检测到脂肪酸类物质 22种,总相对含量为19.99%,当辐照剂量在400~1 000 kGy时,脂肪酸种类与含量变化不大,数量保持在18~22种,含量为14.99%~19.52%,而当辐照剂量达到1 200 kGy时,脂肪酸种类减少至14种,含量则明显降低,仅为6.23%。表明在这一辐照条件下,大部分的脂肪酸类物质都发生了进一步的反应,降解明显。
在辐照前后样品中都可以检测到的有丙二酸、正己酸、乙酸、戊二酸、己二酸、(Z,Z)–9,12–十八烷二烯酸、壬二酸、DL–苹果酸等8种脂肪酸类,其中DL–苹果酸在未辐照样品中含量为14%,随着辐照剂量的增加,含量减少至 1.92%,降解率达86%。丙二酸也呈同样的变化趋势,降解率达95%。正己酸含量无明显变化。乙酸和戊二酸变化趋势相似,分别在600 kGy和800 kGy时含量达到最高值,随后又减少,可能在剂量增大的过程中,发生了某种反应生成乙酸和戊二酸,而当剂量进一步增大时,这2种物质又发生反应,转变成为其他物质,使其含量相应减少。而3–羟基丁酸、反–2–戊烯酸、(R*,S*)–3,4–二羟丁酸和反式–3–己烯二酸等性质不稳定,只是反应过程中的中间产物,即辐照达到一定剂量时产生,随着辐照剂量增加又发生反应而消失。而2–羟基异己酸只有当辐照剂量达到600 kGy时才产生,并且随着剂量增大,含量也逐渐增大。总之,降解过程中所发生的反应复杂,脂肪酸类物质的种类、含量和变化趋势也相当复杂。
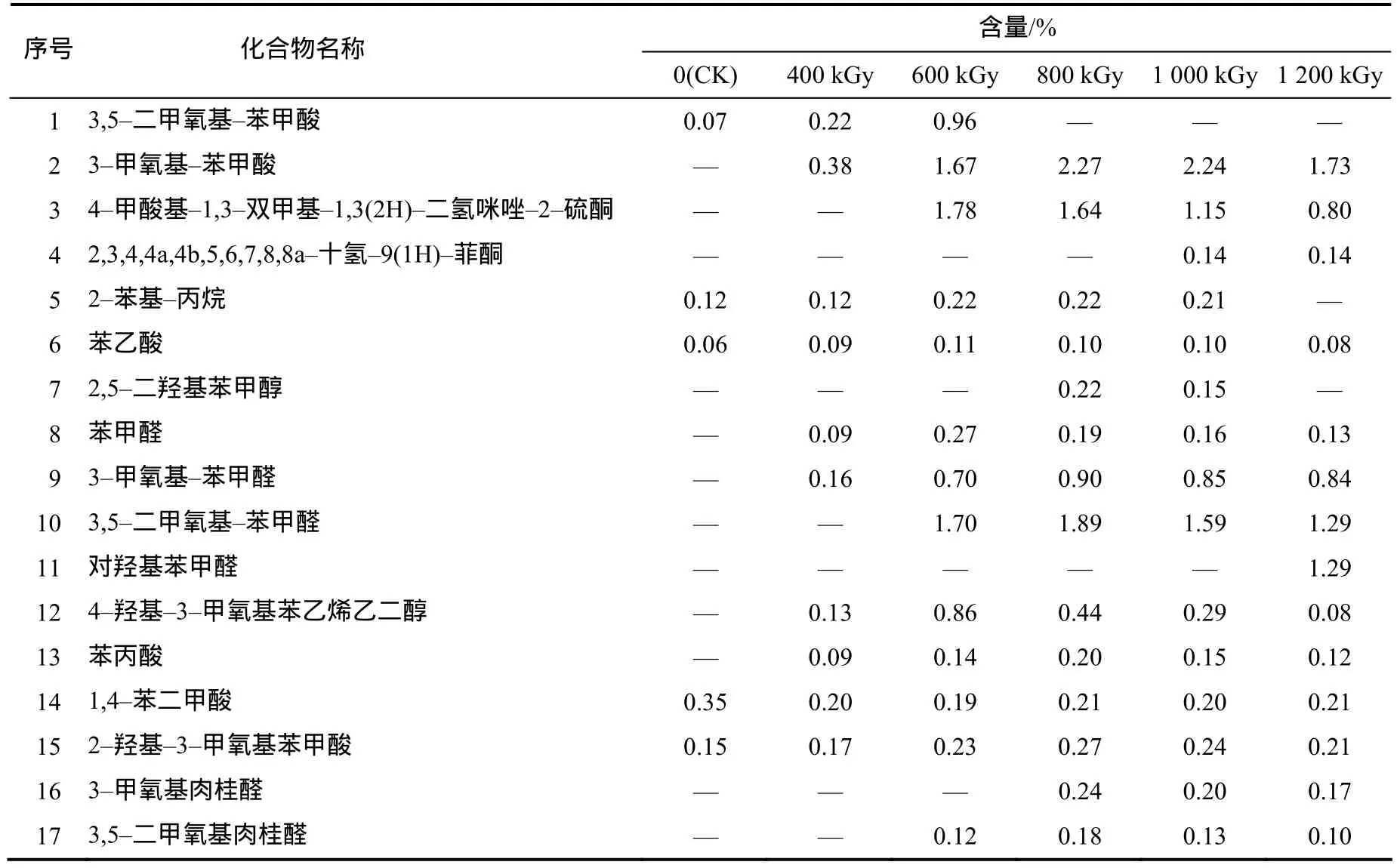
表2 不同剂量辐照处理的油菜秸秆乙酸乙酯萃取物中的芳香类化合物及其含量Table 2 Aromatic compounds in ethyl acetate extractives of untreated and irradiation–pretreated rapeseed straw
2.2.2 辐照对油菜秸秆水提液中芳香类化合物的影响
经不同剂量辐照处理后的油菜秸秆乙酸乙酯萃取液中,共检测到17种芳香类化合物,详见表2。其中酸类化合物6种,酮类化合物2种,烷基类化合物1种,醇类化合物2种,醛类化合物6种。未辐照样品中仅检测出5种芳香类物质,并且总含量仅为0.75%。辐照后样品中的芳香类物质种类与含量明显增加,种类保持在 10~15种,总含量保持在1.65%~8.97%,其中1 000 kGy辐照样品中的种类最多,达到15种;400 kGy辐照样品中总含量最少,仅为1.65%;800 kGy辐照样品中总含量最高,为8.97%。这些物质主要来源于木质纤维素的降解或者其他芳香类提取物的降解和分解。
2.2.3 辐照对油菜秸秆水提液中呋喃类化合物的影响
从辐照处理后的油菜秸秆乙酸乙酯萃取液中共检测到5种呋喃类化合物,详见表3。在CK、400 kGy和 600 kGy辐照样品中均未检出呋喃类化合物,只有当剂量达到800 kGy以上时才有呋喃类物质产生,且不同剂量辐照时所产生的呋喃类物质的种类差异较大。在辐照条件下,纤维素可以直接降解为葡萄糖后发生分子内脱水,闭环生成5–羟甲基糠醛,羟甲基进一步断裂后可生成糠醛和甲醛。但在GC–MS分析中并未检测到糠醛和甲醛,可能是由于糠醛上醛基被氧化生成了呋喃酮或呋喃酸类物质,而甲醛则发生其他反应生成了苯甲醛类物质;其次,半纤维素的组分木聚糖也可以发生分子内脱水环化生成糠醛,糠醛进一步生成呋喃类和呋喃酮类物质。
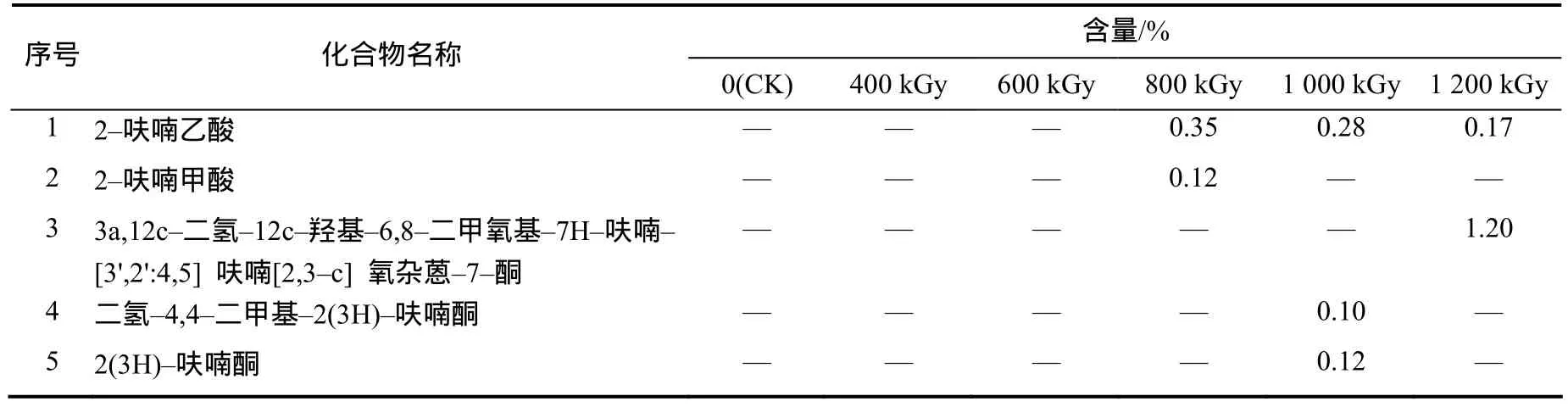
表3 不同剂量辐照处理的油菜秸秆乙酸乙酯萃取物中的呋喃类化合物及其含量Table 3 Furan compounds in ethyl acetate extractives of untreated and irradiation–pretreated rapeseed straw
3 结论与讨论
在辐照条件下,纤维素会发生链剪切和交联反应,当辐照剂量较高时,降解作用占主导,使得糖苷键更易于断裂,木质纤维素之间的交联结构被破坏,部分纤维素、半纤维素被直接降解[8–10]。经一定剂量辐照后,木质纤维素分子内形成自由基,而自由基又通过一定的反应诱发木质纤维素的降解。可能由于组成结构的差异,三大组分对辐照敏感性有差异,木质素较纤维素受辐照的敏感性要小得多,但随着剂量的增加,木质素仍会受到一定程度的降解和分解[9,11]。
利用气质联用(GC–MS)技术从未经辐照的油菜秸秆乙酸乙酯萃取物中分别检测到脂肪酸类物质22种、芳香类物质5种,未检测到呋喃类物质,而从辐照处理后的样品中分别检测到脂肪酸类物质25种、芳香类物质17种,呋喃类物质5种,并且经不同剂量辐照后,产物的种类与含量变化呈现出不同规律。Chen等[12]采用HPLC法分析稀酸水解玉米秸秆产物,除了检测到甲酸、乙酸和乙酰丙酸外,还得到 10种脂肪酸类化合物。Luo等[13]利用乙酸乙酯萃取杨树稀酸水解液,得到 17种脂肪酸类化合物,其变化趋势也各有差异。
经不同剂量辐照处理后,油菜秸秆中的纤维素、半纤维素和木质素与提取物发生降解,降解产物又可以进一步发生分解、缩聚等反应而降解为一系列结构复杂的其他物质,包括一些含羟基、甲氧基、甲基、乙基等官能团的酮类、酸类、酚类、芳香类、醛类化合物等,如乙酸主要由半纤维素乙酰基的降解而来,木质素主要通过降解作用,或者降解产物进一步的缩聚作用生成酚类化合物等[14],这些降解产物的存在不利于后续酶解和乙醇发酵过程。Zaldivar等[15–16]研究了纤维素、半纤维素降解产物,如醛类、有机酸类等物质对发酵产乙醇的基因工程菌Escherichia coli LY01的生长情况和发酵效果,发现由于不同的醛类和有机酸类疏水性有差异,对酵母的生长情况和发酵效果的抑制作用也不同,因此,开展对木质纤维素原料辐照降解产物的定性定量分析,可为后续的水解液脱毒工艺提供一定的参考依据。
[1]张薇,王明远,苏小军,等.离子色谱法测定水稻秸秆木质纤维素水解物单糖[J].湖南农业大学学报(自然科学版),2011,37(2):206–210.DOI:10.3724/SP.J.1238.2011.00206.
[2]SHI J,PU Y Q,YANG B,et al.Comparision of microwaves to fluidized sand baths for heating tubular reactors for hydrothermal and dilute acid batch pretreatment of corn stover[J].Bioresource Technology,2011,102(10):5952–5961.DOI:10.1016/j.biortech.2011.03.027.
[3]WANG K Q,XIONG X Y,CHEN J P.Comparison of gamma irradiation and steam explosion pretreatment for ethanol production from agricultural residues[J].Biomass and Bioenergy,2012,46(1):301–308.DOI:10.1016/j.biombioe.2012.08.013.
[4]SARKAR N,GHOSH S K,BANNERJEE S,et al.Bioethanol production from agricultural wastes:an overview[J].Renewable Energy,2012,37(1):19–27.DOI:10.1021/ bm060168y.
[5]KHAN F,AHMAD S R,KRONFLI E.γ–radiation induced changes in the physical and chemical properties of lignocellulose[J].Biomacromolecules,2006,7(8):2303– 2309.DOI:10.1021/bm060168y.
[6]王林风,程远超.硝酸乙醇法测定纤维素含量[J].化学研究,2011,22(4):52–55.DOI:10.3969/j.issn.1008–1011.2011.04.013.
[7]蒋怡乐,李清明,苏小军,等.芦苇60Co–γ辐照降解副产物的分析[J].激光生物学报,2013,22(4):322–328.DOI:10.3969/j.issn.1007–7146.2013.04.007.
[8]YANG G S,ZHANG Y P,WEI M Y,et al.Influence of γ–ray radiation on the structure and properties of paper grade bamboo pulp[J].Carbohyd Polym 2010,81(1):114–119.DOI:10.1016/j.carbpol.2010.02.003.
[9]CHARLESBY A.Crosslinking and degradation of polymers [J].Radiation Physics and Chemistry,1981,18(18),59.DOI:10.1016/0146–5724(81)90064–9.
[10]FARHATAZIZ,ROGERS M A J.Radiation Chemistry,Principles and Applications[M].New York:VCH Publishers,1987.
[11]张文辉,陈琼.γ射线辐照后木荷粉自由基的ESR和XPS分析[J].辐射研究与辐射工艺学报,2012,30(5):280–285.DOI:10.1016/0146–5724(81)90064–9.
[12]CHEN S F,MOWERY R A,CASTLEBERRY V A,et al.High–performance liquid chromatography method for simultaneous determination of aliphatic acid,aromatic acid and neutral degradation products in biomass pretreatment hydrolysates[J].Journal of Chromatography A,2006(1104):54–61.DOI:10.1016/j.chroma.2005.11.136.
[13]LUO C D,BRINK D L,BLANCH H W.Identification of potential fermentation inhibitors in conversion of hybrid poplar hydrolyzate to ethanol[J].Biomass and Bioenergy,2002,22(2):125–138.DOI:10.1016/s0961–9534(01) 00061–7.
[14]OLSSON L,HAHA–HAGERDAL B.Fermentation of lignocellulosic hydrolysates for ethanol production[J].Enzyme and Microbial Technology,1996,18(5):312–331.DOI:10.3109/07388551003757816.
[15]ZALDIVAR J,MARTINEZ A,INGRAM L O.Effect of selected aldehydes on the growth and fermetation of ethanol genic Escherichia coli LY01[J].Biotechnology Bioenergy,1999,65(1):24–33.DOI:10.1002/(sici)1097–0290(199910 05)65:1<24::aid–bit4>3.0.co;2–2.
[16]ZALDIVAR J,INGRAM L O.Effect of organic acids on the growth and fermentation of ethanol genic Escherichia coli LY01[J].Biotechnology Bioenergy,2010,66(4):203–210.DOI:10.1002/(sici)1097–0290(1999)66:4<203:: aid–bit1>3.3.co;2–r.
责任编辑:尹小红
英文编辑:梁 和
Analysis of degradation products of rapeseed straw irradiated with60Co–γ
ZHANG Chunyan1, TAN Xinghe1*, XIONG Xingyao2,3, SU Xiaojun1,2, LI Qingming1, WANG Keqin4
(1.College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2.Key Laboratory of Corp Germplasm Innovation and Resource Utilization of Hunan Province, Changsha 410128, China; 3.The Institute of Vegetables and Flowers Chinese Academy of Agricultural Sciences, Beijing 100081, China; 4.Hunan Academy of Agricultural Sciences, Institute of nuclear and space breeding, Changsha 410125, China)
In this experiment, rapeseed straw was used as material, six irradiation doses of60Co–γ(0, 400, 600, 800, 1 000, 1 200 kGy) were designed to analyse the degradation products of cellulose, hemicellulose and lignin by GC–MS.The results showed that the degradation rates of cellulose, hemicellulose and lignin were all improved in different degrees with the increasing of dose.With the dose of 1 200 kGy, the degradation of cellulose, hemicellulose and lignin was 69.06%, 42.57% and 4.99%, respectively.22 fatty acids, 5 aromatics and no furans were detected from the water extracts of untreated straws, while 25 fatty acids,17 aromatics and 5 furans were detected from the water extracts of treated straws.The variety and content of the products showed different with different dose treatment.
rapeseed straw; irradiation with60Co–γ ; degradation products
S565.4
:A
:1007-1032(2017)01-0092-06
2016–05–04
2016–12–12
国家“863计划”项目(2012AA101804 );湖南省科学技术厅项目(2015NK3009)
张春艳(1981—),女,湖南浏阳人,博士,高级实验师,主要从事生物质能源研究,zhangchy95@163.com;*通信作者,谭兴和,教授,主要从事生物质能源研究,xinghetan@163.com
