低温保存对Hep⁃G2细胞凋亡的影响
2017-02-15梁玮姚岚刘宝林
梁玮 姚岚 刘宝林
(上海理工大学生物系统热科学研究所 上海 200093)
低温保存对Hep⁃G2细胞凋亡的影响
梁玮 姚岚 刘宝林
(上海理工大学生物系统热科学研究所 上海 200093)
样本质量是体现生物样本库价值的关键,但是低温保存可能导致细胞凋亡及基因表达量的变化,影响样本质量。本文采用流式细胞术与实时荧光定量PCR(qPCR)的方法,研究了Hep⁃G2细胞在不同条件下冻存后凋亡及相关基因表达量。结果表明:低温保存影响Hep⁃G2细胞的成活率、凋亡情况及某些凋亡基因表达量。无论冻存过程中是否添加低温保护剂,低温保存都会对细胞的凋亡相关基因表达带来不同程度的影响。不添加保护剂冻存会导致细胞死亡,添加10%DMSO冻存会导致细胞凋亡,复苏培养24 h后细胞的成活率、凋亡情况与相关基因表达量基本与对照组水平一致。
低温保存;细胞凋亡;流式细胞术;实时荧光定量PCR

表1实验设计Tab.1 Design of the experiment
1 实验材料与方法
1.1实验材料
1.1.1材料与试剂
Hep⁃G2细胞(中科院上海生命科学研究院),胎牛血清,DMEM培养基,台盼蓝染色液(2X),二甲亚砜(DMSO),Annexin V⁃FITC细胞凋亡检测试剂盒,RNAiso Plus,反转录试剂盒PrimeScriptRRT reagent Kit,实时荧光定量 PCR试剂盒 SYBR Premix Ex TaqTM(Perfect Real Time),Sample Protector for RNA/DNA。
1.1.2仪器与设备
HH.CP⁃01W 细胞培养箱,低速台式离心机,FACS CaliburTM流式细胞仪,7900HT实时荧光定量PCR仪。
1.2实验方法
1.2.1实验分组
表1所示为实验分组及各组的冻存液选用、冻存条件等情况。实验所用细胞均取于同一批次培养后的细胞,冻结并复温后,立即用离心法收集细胞,用于后续检测。
1.2.2细胞培养及冻存
Hep⁃G2细胞用含10%胎牛血清的DMEM培养液培养,细胞培养箱条件为 5%CO2、饱和湿度、37℃,细胞覆盖率达到90%时传代,传代4~5次后取处于对数生长期的细胞用于实验。细胞收集后加入冷冻保护液重悬,4℃平衡5 min后,以1℃/min的速度降温至 -80℃,稳定4 h后长期储存在-80℃冰箱或液氮中。
1.2.3细胞成活率[6]
取重悬细胞100 μL于1.5 mL离心管中,再加入100 μL台盼蓝染液染色,混匀后静止3~5 min,吸取10 μL于血球计数板计数,分别记录活细胞和死细胞数量。按公式(1)计算细胞存活率,每组实验均重复三次。

1.2.4细胞凋亡检测
收集各组细胞,D⁃hank′s重悬,按照Annexin V⁃FITC细胞凋亡检测试剂盒的说明进行染色,然后上机测定。
1.2.5 qPCR检测[7]
细胞收集后加入Sample Protector for RNA/DNA,于-20℃保存。用 RNAiso Plus提取各实验组的RNA,然后参照反转录试剂盒的说明书除去其中混有的DNA,随后以去除了DNA的RNA为模板,做反转录,制备出单链cDNA,保存于-20℃。
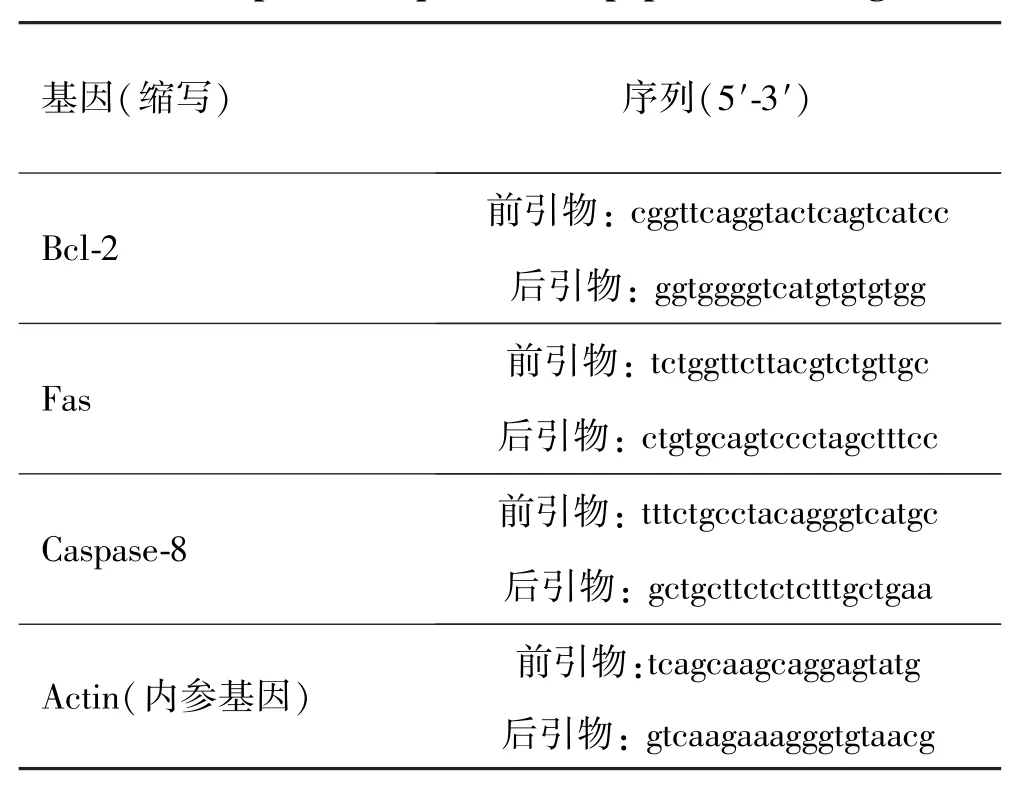
表2细胞凋亡相关基因引物序列Tab.2 The primer sequences of apoptosis⁃related genes
根据Genebank检索凋亡相关基因,选取Bcl⁃2,Fas,Caspase⁃8为研究对象,利用Primer Premier 5.0软件设计引物(见表2),引物长度20~0 bp,扩增的产物在100~200 bp左右,所有引物由生工生物工程(上海)有限公司合成。
以Actin为内参基因,按照实时荧光定量PCR试剂盒SYBR Premix Ex TaqTM(Perfect Real Time)的说明书配置PCR反应液20 uL,并振荡摇匀,使其充分混合。随后放入PCR仪器中,设置首先在50℃作用2 min、95℃作用2 min,然后95℃作用15 s、53℃作用20 s、72℃作用20 s,重复40个循环,最后95℃作用2 min终止反应。用2-ΔΔC(t)方法对qPCR结果进行分析,其中正常对照组的结果均为1,所有实验均重复3次。
1.2.6统计分析
采用统计分析软件SPSS11.0对细胞成活率数据及qPCR数据进行配对t检验,各处理组与正常对照组进行比较,P<0.05即认为差异显著,P<0.01认为差异非常显著。
2 实验结果
2.1 成活率
台盼蓝染色计算成活率的结果如图1所示,实验2和实验3组细胞冻存时未添加保护剂,全部死亡,实验4组添加DMSO后在常温下放置30 min也会造成一部分细胞死亡,经过冻存后,细胞成活率均有所下降,并且-80℃冻存9 d的成活率(实验5组)比液氮中冻存30 d(实验6组)成活率低。复苏培养24 h后(实验7组)成活率又恢复至对照组水平。
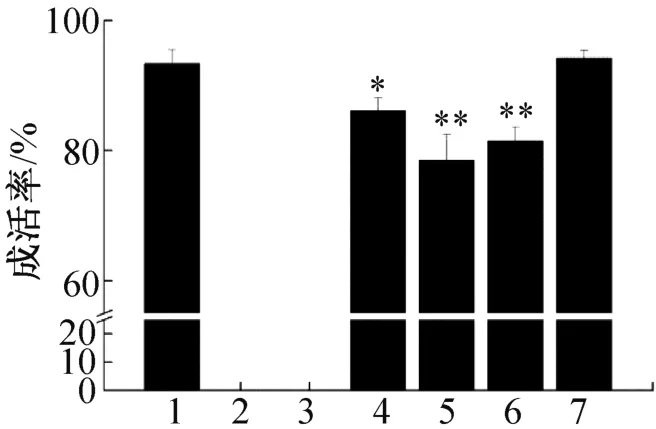
图1 Hep⁃G2的成活率Fig.1 The survival rate of Hep⁃G2
2.2 细胞凋亡结果
流式细胞仪检测细胞凋亡率的结果如图2所示,各个时期细胞占比见表3。对照组有94.32%的细胞为正常细胞,实验2和实验3组细胞全部死亡,几乎检测不到正常大小的细胞,超大细胞及碎片率分别达到99.87%及97.14%,其各个时期细胞所占百分比并无实际意义。实验4组细胞在DMSO保护液中室温放置30 min后,凋亡早期细胞由2.34%增加到27.83%。冷冻后凋亡早期细胞减少,而凋亡晚期和坏死的细胞增多。但是在液氮中冷冻保存的细胞正常细胞所占比率更高一些。实验7组细胞复苏后培养24 h细胞凋亡率明显降低,达到对照组的水平。
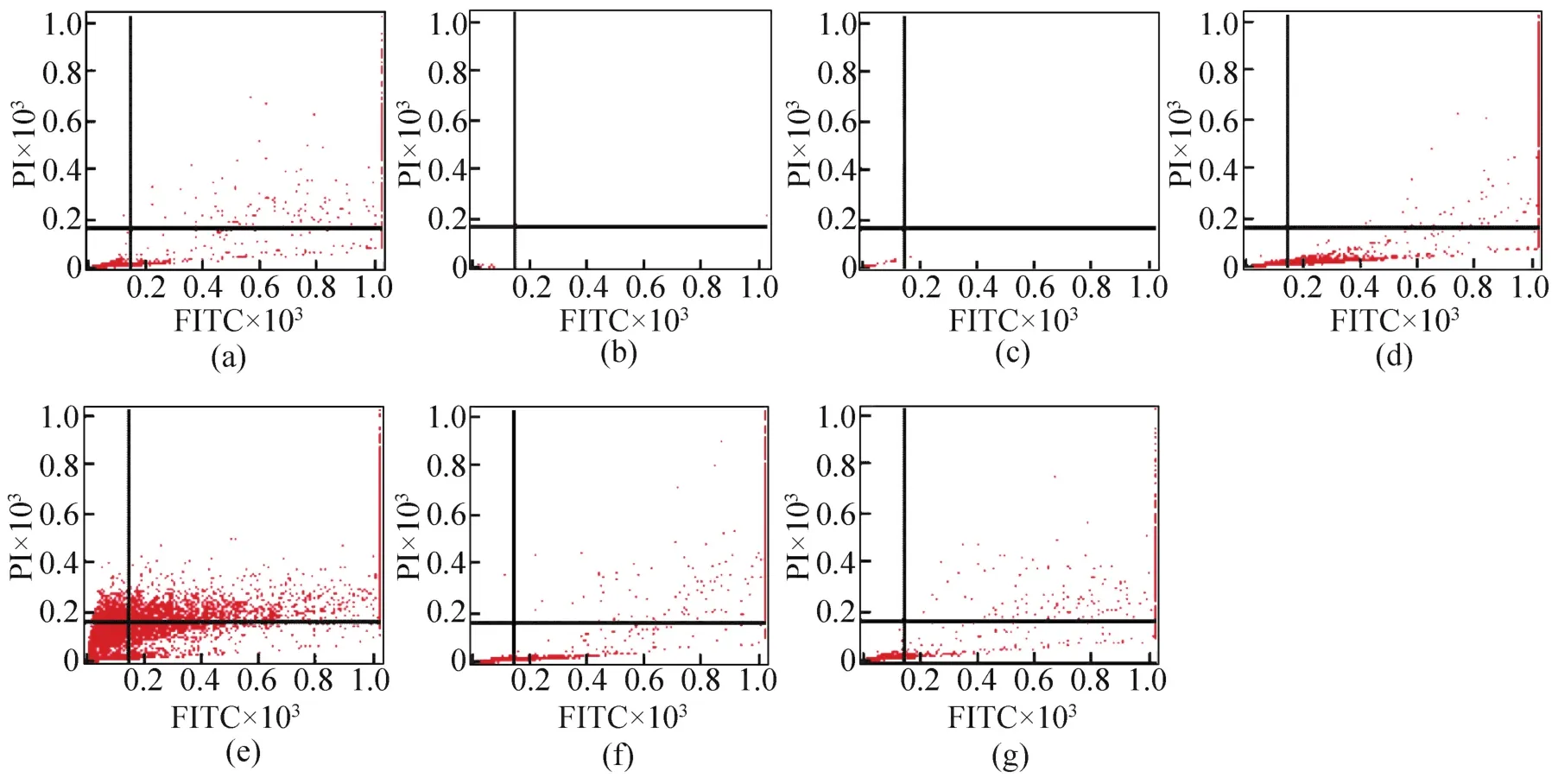
图2流式细胞仪检测冻存前后细胞凋亡率的结果((a)~(g)分别为实验1~7组细胞检测结果。右上象限为凋亡晚期及坏死细胞,右下象限为凋亡早期细胞,左下象限为正常细胞)Fig.2 The apoptosis of cells before and after cryopreservation(The results of No.1⁃7 are shown from a to g respectively,the upper right,lower right and lower left quadrants indicate the late⁃stage apoptotic and necrotic cells,early⁃stage apoptotic cells and the normal cells respectively)
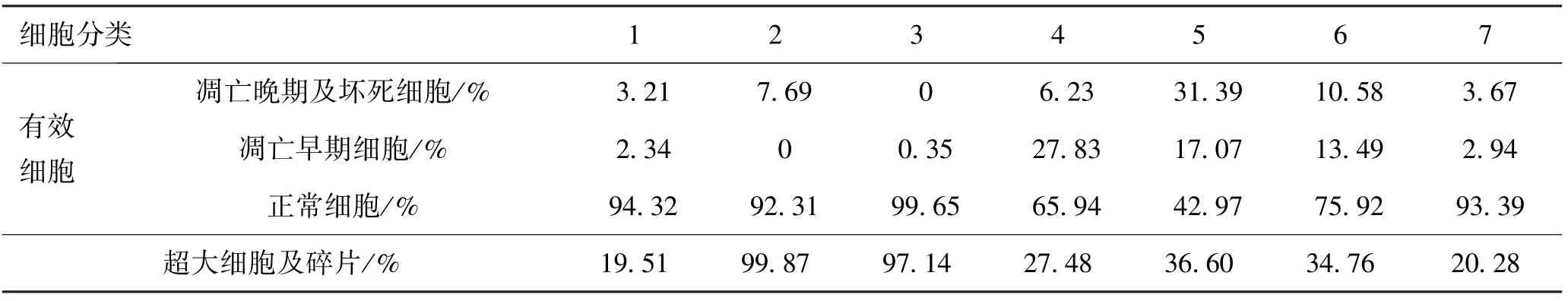
表3 冻存前后细胞凋亡情况Tab.3 The apoptosis of cells in different stage before and after cryopreservation
2.3 qPCR检测结果
如表4所示,实验2和实验3组细胞不添加任何保护剂冻存,抑制凋亡的基因Bcl⁃2表达量没有显著变化,而促进凋亡的基因Caspase⁃8与Fas在-80℃冻存9 d后表达量略有下降,液氮冻存30 d后表达量显著增加。
表4 qPCR检测Hep⁃G2细胞目的基因的2-ΔΔC(t)值(±s,n=3)Tab.4 2-ΔΔC(t)value of the genes in Hep⁃G2 by qPCR(±s,n=3)
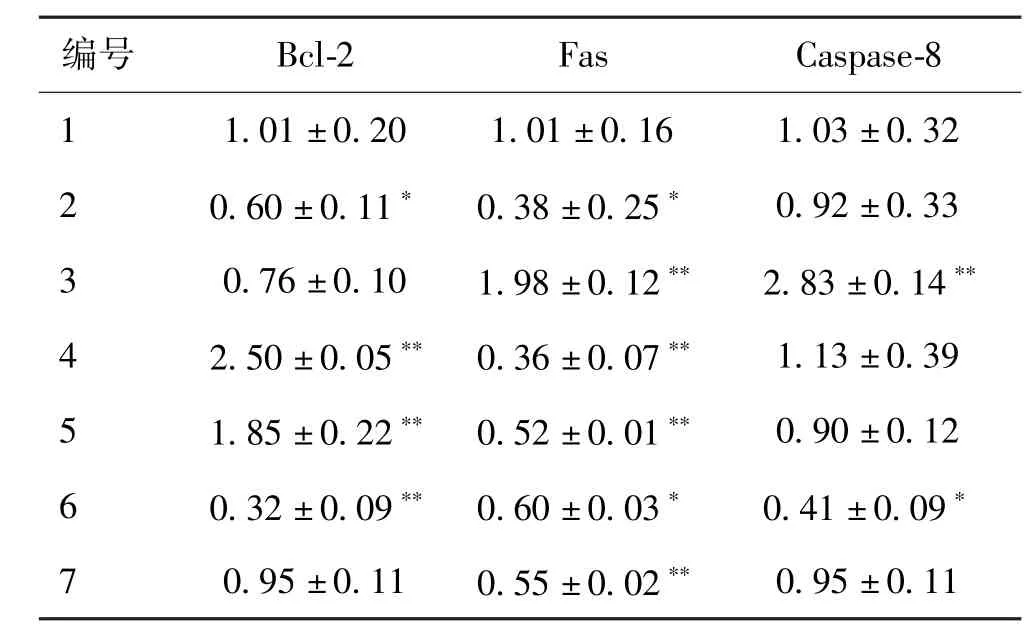
表4 qPCR检测Hep⁃G2细胞目的基因的2-ΔΔC(t)值(±s,n=3)Tab.4 2-ΔΔC(t)value of the genes in Hep⁃G2 by qPCR(±s,n=3)
注:∗:P<0.05,∗∗:P<0.01,n=3。
编号 Bcl⁃2 Fas Caspase⁃8 1 1.01±0.20 1.01±0.16 1.03±0.32 2 0.60±0.11∗0.38±0.25∗0.92±0.33 3 0.76±0.10 1.98±0.12∗∗2.83±0.14∗∗4 2.50±0.05∗∗0.36±0.07∗∗1.13±0.39 5 1.85±0.22∗∗0.52±0.01∗∗0.90±0.12 6 0.32±0.09∗∗0.60±0.03∗0.41±0.09∗7 0.95±0.11 0.55±0.02∗∗0.95±0.11
实验4组细胞在室温下DMSO处理30 min,Bcl⁃2表达量增加。实验5组细胞-80℃冻存9 d后Bcl⁃2依旧保持较高的表达量。实验6组细胞在液氮冻存30 d后Bcl⁃2、Caspase⁃8与Fas表达量有显著降低。复苏后培养24 h表达量有所恢复。
3 讨论
细胞凋亡是医学基础研究的重要内容。生物样本库低温保存的样本主要服务于转化医学研究,用于新药开发的实验,这需要在样本保存后不发生凋亡特性的改变,并且凋亡相关的基因表达水平也不能发生改变。添加冷冻保护剂保存样本可以使冻存的样本具有活性,应用于样本扩大化或PDX模型的建立。细胞凋亡也是器官组织深低温保存后丧失功能的重要原因[8]。因此研究冷冻对细胞凋亡的影响具有重要意义。本文以Hep⁃G2细胞为模型,对低温保存后细胞的成活率、凋亡率及几个凋亡相关基因表达量三个方面进行了研究。
3.1 细胞成活率、凋亡率及凋亡相关基因表达量之间的关系
实验中得到的细胞的成活率与细胞凋亡的结果一致。用台盼蓝染色法测定细胞成活率时,正常细胞及凋亡早期细胞均检测为活细胞,而凋亡晚期及坏死细胞则检测为死细胞。不加保护剂冻存后的细胞全部死亡,成为细胞碎片,在流式细胞仪上检测为非正常大小细胞,不会被计入有效细胞进行凋亡统计。因此,检测细胞凋亡是一项更准确判断细胞状态的方法。在进行组织器官保存研究时,要尽可能采取检测细胞凋亡的方法对保存效果进行判断。
实验6组(75.92%)比实验4组(65.94%)正常细胞的比例高,这是因为DMSO的毒性随着温度和时间的增加而增加[9]。实验4组在室温暴露于DM⁃SO溶液30 min,而实验6组仅仅在4℃平衡5 min后就开始程序降温,因此实验6组中DMSO的毒性带来的损伤更小,凋亡细胞的比例也小一些。
现阶段生物样本库保存的样本主要用于提取生物大分子(DNA、RNA和蛋白质等),此时保存的目标是凋亡基因表达量不发生改变,并不需要保证样本存活,本文的研究也说明细胞凋亡基因表达量的变化与成活率没有明显的联系。
3.2 细胞凋亡机制及相关基因表达量的变化
关于冷冻后细胞发生凋亡机制的研究已有很多,J.M.Baust等[10]和U.Rauen等[11]的研究结果发现,细胞在冷冻过程中受到外界环境的刺激,如氧化应激反应,渗透压损伤、冰晶形成、Na+/K+⁃ATP酶抑制使离子内环境紊乱等,均会发生凋亡,此时细胞内发生一系列的级联反应,导致细胞凋亡相关的酶活化,促使细胞发生凋亡反应。本实验还对凋亡过程中若干关键的基因表达水平进行了研究,为抑制冷冻保存过程中凋亡发生的研究提供参考。
Caspase⁃8主要出现在凋亡的早期,是细胞凋亡的启动者,有研究表明冷冻损伤造成的凋亡是由Caspase死亡受体依赖的线粒体途径介导,而不涉及非Caspase蛋白酶[12⁃13]。Fas是诱导多种细胞凋亡的最主要的死亡受体之一,在Fas诱导的细胞凋亡体系中,Fas通过激活 Caspase⁃8传导凋亡信号[14⁃15]。不加任何保护剂冻存时,细胞在降温过程中承受冷冻刺激带来的冰晶与渗透压损伤,自身会发生调节作用,此时一些基因表达量也可能发生变化。如Caspase⁃8 与Fas在液氮中冻存30 d后表达量都显著增高,这说明细胞在无保护剂冻存时,虽然细胞全部死亡,但是在这个过程中也发生了细胞凋亡。而DMSO虽然本身具有一定的毒性,但是却可以抑制Caspase⁃8的表达,本实验与丁丽等[16]的研究都证明了这个结果。
Bcl⁃2是目前研究较多的凋亡抑制基因[17],研究表明:Bcl⁃2通过抑制细胞色素 C的释放,阻断Caspase的激活来抑制凋亡,同时Bcl⁃2表达产物可阻止许多刺激物诱发的细胞凋亡[18]。DMSO能够诱导凋亡的发生[19-20],常温下细胞受到DMSO刺激,Bcl⁃2过量表达,原因可能是细胞的自我保护机制抑制了凋亡的发生。但是在冻存过程中,DMSO不仅可以保护细胞免于冰晶与渗透压的损伤,提高细胞的存活率,其对细胞的刺激作用也有所减小,这点可以从Bcl⁃2的表达量在冻存后有所降低体现。
3.3 复苏及再培养对细胞凋亡的影响
-80℃冰箱与液氮罐是样本库保存样本常用的两种保存条件,一般认为在液氮中样本能得到更好的保存[21],因为此时细胞的生命活动几乎完全停止,可以长久保存并且不会引起基因蛋白等表达量的变化。但是细胞在降温与储存过程中通常可以保存完好,却极可能在复温过程中遭受损伤而死亡[22]。复温时活细胞会再次经历渗透压的变化,胞内冰也可能发生重结晶。这些物理因素的改变也极有可能再次导致某些基因表达量的变化,因此冻存与复温过程共同影响着凋亡基因的表达。由于技术条件限制,本实验无法在细胞复温前的冷冻状态检测其成活率、凋亡情况和基因表达水平,因此也无法判断这些损伤是在哪个阶段造成的。但是从应用的角度讲,复温是必经过程,研究复温后的细胞凋亡情况也具有实际意义。关于如何减少冷冻保存带来的细胞凋亡,C.Stroch等[23]的研究表明,无论在冷冻还是复温过程中加入Caspase抑制剂,都可以阻止Caspase的激活,提高冷冻后细胞的复苏率。
冻存是目前保存细胞与组织常用的方法,但是细胞在冷冻及复苏过程中会发生一些变化,那么再培养就是细胞恢复正常所必经的过程,细胞进行自我修复和生长,可达到最佳生长状态。但是复苏培养24 h 后Fas基因表达量依然很低,这可能是因为不同基因表达量的恢复时间不同,可延长培养时间进一步观察。然而复苏培养后的细胞已与冻存前的细胞完全不同,其基因表达水平是否能真正代表冻存前的状态,复苏培养技术能否应用于生物样本库还需要斟酌。因此目前可行的办法是通过添加凋亡抑制剂或改进保护剂配方以稳定RNA的表达。
4 结论
本文通过用流式细胞术与实时荧光定量PCR对Hep⁃G2细胞进行凋亡情况的研究,得到如下结论:
1)无论冻存过程中是否添加低温保护剂,低温保存都会对细胞的凋亡相关基因表达带来不同程度的影响。
2)不加保护剂冻存会导致细胞死亡,添加10% DMSO冻存会导致细胞凋亡,复苏培养24 h后细胞的成活率和凋亡情况与相关基因表达量基本与对照组水平一致。
3)本文仅对一种细胞冻存后的凋亡情况和几个凋亡相关基因表达量进行了研究,还有许多凋亡通路中的相关基因需要进一步研究。
4)实验中所选的保护剂DMSO会对细胞凋亡带来较大影响,可通过添加凋亡抑制剂或更换保护剂以减少细胞凋亡,稳定凋亡相关基因表达。
本文受上海东方学者跟踪计划项目资助。(The project was supported by the Project Tracing Program of Oriental Schol⁃ars.)
[1] 王庆宝.生物样本库——转化医学与第六次科技革命[J].泰山医学院学报,2012,33(1):1⁃3.(WANG Qingbao.Biobank——translational medicine and the sixth technological revolation[J].Journal of Taishan Medical College,2012,33(1):1⁃3.)
[2] 陆怡.转化医学与生物样本库现状[J].生命的化学,2012,32(3):287⁃293.(LU Yi.Translational medicine and biobank[J].Chemistry of Life,2012,32(3):287⁃293.)
[3] 胡颖,张连海,宋丽洁,等.生物样本质量的影响因素与评估[J].中国医药生物技术,2013,8(1):69⁃72. (HU Ying,ZHANG Lianhai,SONG Lijie,et al.Factors and evaluation on biospecimens′quality[J].Chinese Me⁃dicinal Biotechnology Affecting,2013,8(1):69⁃72.)
[4] Shankar S K,Mahadevan A.Biobanking for cancer re⁃search:preservation of tissue integrity⁃some technical con⁃siderations[J].Indian Journal of Neurosurgery,2012,1 (2):130⁃138.
[5] 张佳年,于颖彦,计骏,等.低温冻存时间对肿瘤组织生物大分子的影响[J].诊断学理论与实践,2009,8 (1):38⁃42.(ZHANG Jianian,YU Yingyan,JI Jun,et al.Effect of time of freeze⁃preserving on biological macro⁃molecules of tumor tissue[J].Journal of Diagnostics Con⁃cepts&Practice,2009,8(1):38⁃42.)
[6] 姚岚,梁玮,刘宝林.人肝癌细胞Hep⁃G2的低温保存研究[J].制冷学报,2015,36(2):95⁃100.(YAO Lan,LIANG Wei,LIU Baolin.Study on cryopreservation of human hepatoma Hep⁃G2 cell[J].Journal of Refrigera⁃tion,2015,36(2):95⁃100.)
[7] 欧阳松应,杨冬,欧阳红生,等.实时荧光定量PCR技术及其应用[J].生命的化学,2004,24(1):74⁃76. (OUYANG Songying,YANG Dong,OUYANG Hongsh⁃eng,et al.The specification and application of real⁃time fluorescent quantitative PCR[J].Chemistry of Life,2004,24(1):74⁃76.)
[8] 马路生,高波,杨朝忠,等.胎儿角膜深低温保存对FAS/FASL蛋白表达的影响[J].国际眼科杂志,2008,8(5):907⁃908.(MA Lusheng,GAO Bo,YANG Cha⁃ozhong,et al.Effect of deep cryopreservation of fetal cor⁃nea on expression of Fas/FasL[J].International Journal of Ophthalmology,2008,8(5):907⁃908.)
[9] Taylor M J,Baicu S.Review of vitreous islet cryopreserva⁃tion:some practical issues and their resolution[J].Orga⁃nogenesis,2009,5(3):155⁃166.
[10]Baust J M,Vogel M J,Van B R,et al.A molecular basis of cryopreservation failure and its modulation to improve cell survival[J].Cell Transplantation,2001,10(7):561⁃571.
[11]Rauen U,Polzar B,Stephan H,et al.Cold⁃induced apop⁃tosis in cultured hepatocytes and liver endothelial cells:mediation by reactive oxygen species[J].The FASEB Journal,1999,13(1):155⁃168.
[12]Fan T J,Han L H,Cong R S,et al.Caspase family prote⁃ases and apoptosis[J].Acta Biochimica et Biophysica Sin⁃ica,2005,37(11):719⁃727.
[13]Boatright K M,Salvesen G S.Mechanisms of caspase acti⁃vation[J].Current Opinion in Cell Biology,2003,15 (6):725⁃731.
[14]Yonehara S,Ishii A,Yonehara M.A cell⁃killing mono⁃clonal antibody(anti⁃Fas)to a cell surface antigen co⁃downregulated with the receptor of tumor necrosis factor [J].Journal of Experimental Medicine,1989,169(5):1747⁃1756.
[15]梁晓阳.Fas与Caspase⁃8在胶质瘤中的表达及意义[D].泸州:泸州医学院,2014.(LIANG Xiaoyang.The expression and significance of Fas and Caspase⁃8 in glioma [D].Luzhou:Luzhou Medicine School,2014.)
[16]丁丽,方东辉,何莲,等.细胞凋亡相关Caspases在猪精子冷冻过程中的表达谱研究[J].四川农业大学学报,2014,32(1):68⁃75.(DING Li,FANG Donghui,HE Lian,et al.Expression prolifes of apoptotic⁃related caspases during boar spermatozoa cryopreservation[J]. Journal of Sichuan Agricultural University,2014,32(1):68⁃75.)
[17]丁丽.甘油对猪冷冻精子细胞凋亡信号通路相关基因表达的影响[D].雅安:四川农业大学,2014.(DING Li.Effects of glycerol on apoptotic signaling pathways re⁃lated genes during boar spermatozoa cryopreservation[D]. Ya′an:Sichuan Agricultural University,2014.)
[18]刘彦信,杨学辉.Bcl⁃2抑制CD3ε分子介导的T淋巴细胞凋亡[J].中国医学科学院学报,1999,21(6):421⁃424.(LIU Yanxin,YANG Xuehui.Verexpression of Bcl⁃2 inhibited T lymphocyte spoptosis mediated by CD3ε molecule[J].ACTA Academiae Medicinae Sinicae,1999,21(6):421⁃424.)
[19]韩利波,梁蒙,李佳雯,等.DMSO诱导烟草BY⁃2悬浮细胞的凋亡[J].首都师范大学学报(自然科学版),2009,30(3):30⁃37.(HAN Libo,LIANG Meng,LI Jia⁃wen,et al.DMSO induces apoptosis of tobacco suspension BY⁃2 cells[J].Journal of Capital Normal University(Nat⁃ural Sciences Edition),2009,30(3):30⁃37.)
[20]苗俊英,张捷,张尚立,等.二甲基亚砜诱导人肝癌细胞BEL⁃7402凋亡的研究[J].山东大学学报(医学版),2002,40(2):103⁃105.(MIAO Junying,ZHANG Jie,ZHANG Shangli,et al.Study on apoptosis induced by DMSO in human hepatocellular cancer cells[J].Journal of Shandong University(Health Sciences),2002,40(2):103⁃105.)
[21]于颖彦,刘炳亚,朱正纲.肿瘤组织库建立的进展及意义[J].诊断学理论与实践,2009,8(1):9⁃11.(YU Yingyan,LIU Bingya,ZHU Zhenggang.Advances in the establishment of tumor tissue bank and its significance[J]. Journal of Diagnostics Concepts&Practice,2009,8(1):9⁃11.)
[22]华泽钊,任禾盛.低温生物医学技术[M].北京:科学出版社,1994:39⁃41.(HUA Zezhao,REN Hesheng. Technology of cryobiology and medical[M].Beijing:Sci⁃ence Press,1994:39⁃41.)
[23]Stroh C,Cassens U,Samraj A,et al.The role of caspases in cryoinjury:caspase inhibition strongly improves the re⁃covery of cryopreserved hematopoietic and other cells[J]. The FASEB Journal,2002,16(12):1651⁃1653.
Effects of Cryopreservation on Apoptosis in Hep⁃G2 Cells
Liang Wei Yao Lan Liu Baolin
(Institute of Biothermal and Technology,University of Shanghai for Science and Technology,Shanghai,200093,China)
The quality of biospecimens is a very important factor of evaluating a biobank.Cryopreservation may induce apoptosis and changes of gene expression in cells.In this research the apoptosis profiles were assessed by flow cytometry and the expression of RNAs re⁃lated to apoptosis were estimated by real⁃time fluorescent quantitative PCR(qPCR)in Hep⁃G2 cells after cryopreservation.The results showed that with the addition of 10%DMSO or no cryoprotectant during cryopreservation,the cryopreservation progress made some impact on apoptosis and the expression of RNAs related to apoptosis in Hep⁃G2 cells.During cryopreservation,the cells were all dead with no cryoprotectant,but more cells apoptosis occurred with 10%DMSO.The cells could be recovered to normal level when the cells were re⁃cultured for 24 hours after cryopreservation.
cryopreservation;apoptosis;flow cytometry;real⁃time fluorescent quantitative PCR
TB61+1;R318.52;R73⁃3
A
0253-4339(2017)01-0113-06
10.3969/j.issn.0253-4339.2017.01.113
2016年4月29日研究了其在不同条件下冻存前后的凋亡情况及其几 个凋亡相关基因冻存前后表达量的变化。
国家自然科学基金(51076108)资助项目。(The project was supported by the National Natural Science Foundation of China(No. 51076108).)
生物样本库(biobank)也叫生物银行,是指标准化收集、处理、储存和应用健康和疾病生物体的生物大分子、细胞、组织和器官等样本(包括人体器官组织、全血、血浆、血清、生物体液或经处理过的生物样本(DNA、RNA、蛋白等)以及与这些生物样本相关的临床、病理、治疗、随访、知情同意等资料及其质量控制、信息管理与应用系统[1]。生物样本库是转化医学研究的战略资源[2],一个高质量的生物样本库不仅要有种类丰富的大量样本,更重要的是能够保证这些样本的质量[3]。基于生物样本库的研究都要以其中保存样本的质量未发生改变为前提,只有彻底排除在保存过程中发生的基因、蛋白质等变化,才能准确判断患病前后或治疗前后基因表达之间真正的关联[4]。因此为了研究结果的可靠性,需要迫切了解在低温保存过程中样本质量是否发生改变。目前已有学者针对样本库中保存样本的RNA质量进行了研究[5],但是少有对比样本冻存前后质量变化的结果。此外,对细胞在不同冻存条件下冻存前后RNA质量的变化进行研究,也可以为改进组织和血液的冻存方法提供参考。
凋亡是肿瘤基础研究中非常重要的特性,Bcl⁃2、Fas、Caspase⁃8是研究细胞凋亡的重要基因,由于组织的结构和成分比较复杂,一般在研究前先选取简易的细胞系模型进行初步研究。肝癌是一种常见的肿瘤疾病,很多样本库都保存有肝癌样本。因此本文选取了常用的细胞模型——人肝癌上皮细胞Hep⁃G2,
刘宝林,男,教授,博士,上海理工大学医疗器械与食品学院,(021)55277768,E⁃mail:blliuk@163.com。研究方向:生物材料的低温保存。
About the corresponding author
Liu Baolin,male,Ph.D./professor,School of Medical Instru⁃ment and Food Engineering,University of Shanghai for Science and Technology,+86 21⁃55277768,E⁃mail:blliuk@163.com. Research fields:cryopreservation of biomaterials.
