藿芪灌注液中淫羊藿苷和黄芪甲苷稳定性试验研究
2017-02-15杨洪早苗小楼张世栋董书伟闫宝琪桑梦琪那立冬王东升严作廷
杨洪早,苗小楼,张世栋,董书伟,闫宝琪,桑梦琪, 那立冬,王东升*,严作廷*
(1.中国农业科学院兰州畜牧与兽药研究所,农业部兽用药物创制重点实验室,兰州 730050) (2.甘肃农业大学动物医学院,兰州 730070)
藿芪灌注液中淫羊藿苷和黄芪甲苷稳定性试验研究
杨洪早1,2,苗小楼1,张世栋1,董书伟1,闫宝琪1,桑梦琪1, 那立冬1,2,王东升1*,严作廷1*
(1.中国农业科学院兰州畜牧与兽药研究所,农业部兽用药物创制重点实验室,兰州 730050) (2.甘肃农业大学动物医学院,兰州 730070)
为了研究藿芪灌注液的稳定性,采用HPLC法测定藿芪灌注液中淫羊藿苷与黄芪甲苷含量,使用WondaSil C18柱(4.6 mm×250 mm,5 μm),流动相:乙腈-水28∶72,柱温40 ℃,检测波长270 nm,进样量10 μL,流速1.0 mL/min测定淫羊藿苷的含量;使用ZORBAX SB-C18柱(4.6 mm×150 mm,5 μm),漂移管温度为90 ℃,载气流速为2.5 L/min,流动相:甲醇-水65∶35,柱温:40 ℃,流速:1 mL/min,用蒸发光散射检测器检测测定黄芪甲苷的含量。藿芪灌注液于高温60 ℃放置10 d,高湿度90%±5%放置10 d,经强光照射4500±500LX放置10 d,加速试验在温度40 ℃±2 ℃、相对湿度75%±5%的条件下放置6个月,长期试验在温度25 ℃±2 ℃、相对湿度60%±10%的条件下放置12个月,考察藿芪灌注液在不同条件存放后的性状、鉴别、pH、淫羊藿苷含量、黄芪甲苷含量以及无菌检查等项目的变化。结果表明,藿芪灌注液性质稳定,在不同条件存放后所有指标均未有明显变化,符合质量标准要求。
藿芪灌注液;稳定性试验;高效液相色谱法;淫羊藿苷;黄芪甲苷
藿芪灌注液,又名催情助孕液,是由淫羊藿、黄芪、丹参等中药组成的子宫灌注剂,以中医药学理论为基础,运用现代中药制剂技术,其成分明确,具有益气壮阳、催情助孕、补血养阴之功,临床主治于奶牛卵巢静止和持久性黄体不孕症[1]。目前,已有对本品的制备工艺、质量标准及药效学进行的相关研究报道[2-4]。为保证该制剂的质量及疗效,为其生产、包装、贮存、运输和有效期的确定建立科学依据,依据《中国药典》(2015年版一部)、《中国兽药典》(2010年版二部)、《兽用中药、天然药物稳定性试验技术指导原则》规定[5-7],在拟市售包装(钠钙玻璃模制注射剂瓶,强光照条件下除外)的基础上对藿芪灌注液进行影响因素试验、加速试验和长期试验研究,考察性状、pH、有效成分的含量变化以及无菌检查等来评价制剂稳定性。
1 仪器与药品
1.1 仪器设备 DL-101-2BS电热恒温鼓风干燥箱,GH4500型隔水式培养箱,PYX-DHS-40×50-BS隔水式电热恒温培养箱,HH.BII420 S型电热恒温培养箱,MT-250B药品稳定性试验箱,PHS-3C型pH计。岛津LC 20AD高效液相色谱仪,SPD-20A紫外检测器:一元泵,LabSolutions工作站,柱温箱,WondaSil C18柱(4.6 mm×250 mm,5 μm);Agilent 1260 高效液相色谱仪,Alltech ELSD2000ES检测器:在线脱气机,四元泵,ChemStation工作站,CSChrom Plus工作站,柱温箱,ZORBAX SB-C18柱(4.6 mm×150 mm,5 μm)。1.2 药品 藿芪灌注液,中国农业科学院兰州畜牧与兽药研究所研制,含量测定批号20120801、20120802、20120803、20120804、20120805、20120901、20120902、20120903、20120904、20120905;稳定性试验批号20121001、20121002、20121003,模拟市售包装(钠钙玻璃模制注射剂瓶);淫羊藿苷(批号110737-200415,中国药品生物制品检定所);黄芪甲苷(批号110781-200613,中国药品生物制品检定所);乙腈、甲醇均为色谱纯,水为超纯水。
2 方法与结果
2.1 性状、pH、相对密度测定、无菌检查 参照《中华人民共和国兽药典》 2010 年版二部附录Ⅶ,在自然光条件下白色背景中通过肉眼直接观察灌注液性状; 使用酸度计测量灌注液pH;使用薄膜过滤法检查无菌试验。
2.2 含量测定
2.2.1 淫羊藿苷含量测定
2.2.1.1 色谱条件 固定相:WondaSil C18柱(4.6 mm×250 mm,5 μm),流动相:乙腈-水28∶72,检测波长270 nm,柱温40℃,进样量10 μL,流速1.0 mL/min,理论塔板数以淫羊藿苷计不低于1500。
2.2.1.2 样品溶液的制备 对照品溶液的制备:精密称取淫羊藿苷对照品11.68 mg,置50 mL量瓶中,加甲醇定容至刻度,摇匀,制成233.6 μg/mL的对照品储备溶液。精密移取储备液5 mL,置10 mL量瓶中,加甲醇定容至刻度,制成116.8 μg/mL的对照品溶液①,吸取对照品溶液①1 mL,置10 mL量瓶中,甲醇定容至刻度,即得浓度为11.68 μg/mL的对照品溶液②。
供试品溶液的制备:精密量取藿芪灌注液1 mL,置25 mL量瓶中,加水定容至刻度,摇匀,滤过,取续滤液,即得供试品溶液。
阴性对照溶液的制备:取按处方比例并以相同工艺制备的缺淫羊藿的阴性对照供试品,按供试品溶液制备法制得阴性对照溶液。
2.2.1.3 样品含量测定 精密量取10批藿芪灌注液,按2.1.2.2项下供试液样品的制备方法处理样品,按以上色谱条件测定淫羊藿苷含量。结果得平均含量为0.242 mg/mL,RSD为7.49%。考虑到大规模生产中的各种损失和测量误差,取其平均值的80%作为其含量限度,即得0.1936 mg/mL,故暂定本品含淫羊藿按淫羊藿苷计不少于0.20 mg/mL。
照影响因素试验条件下测其含量,按2.1.2.2项下供试液样品制备方法处理同批次两份样品,同以上色谱条件进样10 μL,按外标法测定淫羊藿苷含量,详见影响因素试验结果表。
2.2.2 黄芪甲苷含量测定
2.2.2.1 色谱条件 固定相:ZORBAX SB-C18柱(4.6 mm×150 mm,5 μm),漂移管温度为90 ℃,载气流速为2.5L/min,流动相:甲醇-水65∶35,流速:1 mL/min,柱温:40 ℃,进样量10 μL用蒸发光散射检测器检测。理论板数按黄芪甲苷峰计算应不低于3000。
2.2.2.2 样品溶液的制备 对照品溶液的制备:精密称取黄芪甲苷对照品11.95 mg,置10 mL量瓶中,加甲醇溶解并定容至刻度,摇匀,制成1.195 mg/mL的对照品储备液,精密量取对照品储备液1 mL,置5 mL量瓶中,加甲醇定容至刻度,摇匀,制成浓度0.239 mg/mL的对照品溶液。
供试品溶液的制备:精密量取藿芪灌注液25 mL,用水饱和的正丁醇振摇提取4次,每次40 mL,合并正丁醇提取液,用氨试液洗涤2次,每次25 mL,弃去氨液,取正丁醇液,挥干溶剂,残渣加甲醇溶解并移至5 mL量瓶中,加甲醇稀定容至刻度,摇匀,滤过,取续滤液,即得。
阴性对照溶液的制备:取按处方比例并以相同工艺制备的缺黄芪的阴性对照供试品,按供试品溶液制备法制得阴性对照溶液。
2.2.2.3 样品含量测定 精密量取10批藿芪灌注液样品25 mL,按2.2.2.2项下供试品溶液的制备方法制备样品,按以上色谱条件测定黄芪甲苷含量。结果10批藿芪灌注液样品中黄芪甲苷的的平均含量为64.653 μg/mL,考虑到大规模生产中的各种损失,取其平均值的80%作为其含量限度,即得45.55 μg/mL,故暂定本品黄芪按黄芪甲苷计不少于45.0 μg/mL。
照影响因素试验条件下测其含量,按2.2.2.2项下供试液样品制备方法处理同批次两份样品,同以上色谱条件进样10 μL,按外标法测定黄芪甲苷含量,详见影响因素试验结果表。
2.3 影响因素试验
2.3.1 高温试验 将三批样品(批号20121001、20121002、20121003)置于DL-101-2BS电热恒温鼓风干燥箱(控制温度:室温~300 ℃),在温度60 ℃的条件下放置10 d。依据质量标准草案在0、5、10 d各取样品,考察其性状、鉴别、含量、相对密度、pH值及无菌。结果见表1。
2.3.2 高湿试验 将三批样品置于GH4500型隔水式培养箱,在温度25℃,相对湿度90%±5%的条件下放置10 d。在0、5、10 d各取样品,依据质量标准草案考察其性状、鉴别、含量、pH值及无菌。结果见表1。
2.3.3 强光照射试验 将三批样品置于MT-250B药品稳定性试验箱,在温度20 ℃,暴露于4500±500LX的条件下放置10 d。依据质量标准草案在0、5、10 d各取样品,考察其性状、鉴别、含量、pH值及无菌。结果见表1。
藿芪灌注液影响因素试验结果表明高温和高湿及强光照射条件条件下,其考察项性状、鉴别、无菌检查项目无异常,pH和淫羊藿苷含量变化不显著,黄芪甲苷含量变化差异极显著(P<0.01),但未低于最低含量限制(45.0 μg/mL),故从此变化得出该制剂应在室温下密闭贮存,在生产中要严格控制生产与贮存环境的湿度与温度,这样可以保证该制剂全、稳定、有效。该试验为藿芪灌注液大生产中控制车间生产条件与储存条件提供了理论依据。
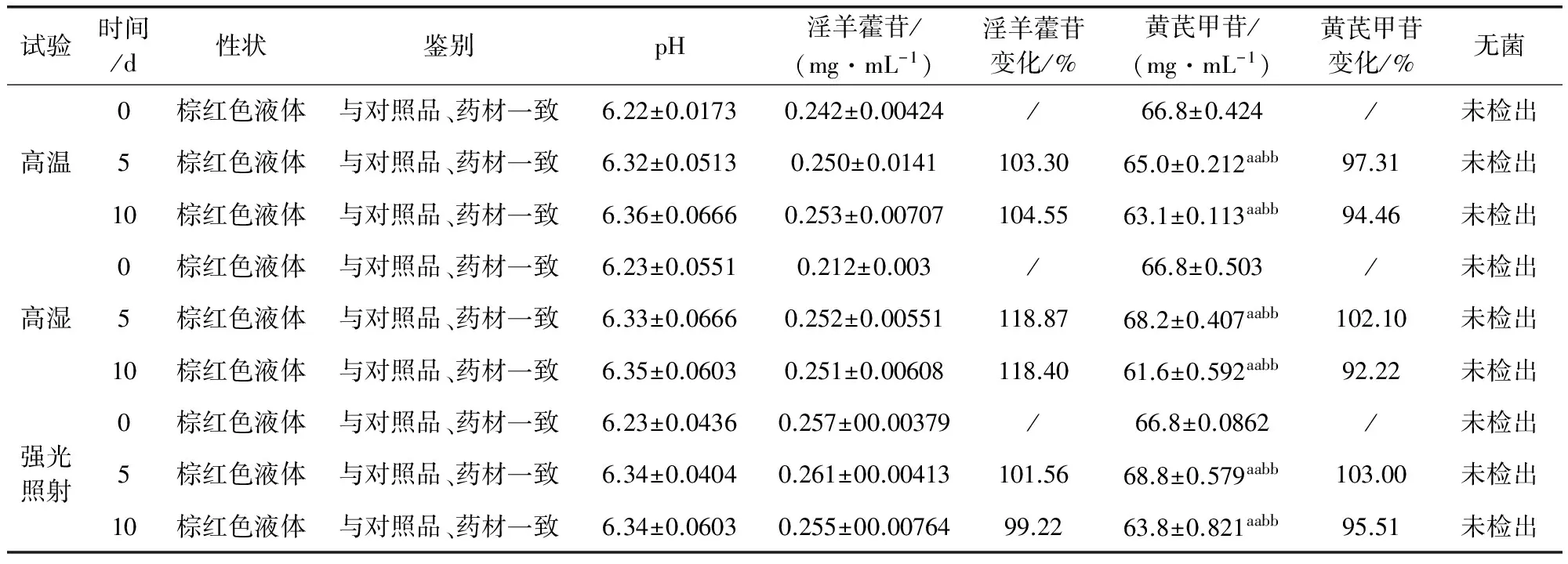
表1 藿芪灌注液影响因素试验(n=3)
与初始值相比,标注(a)表示P<0.05显著;(aa)表示P<0.01极显著;同组间相比,标注(b)表示P<0.05显著;(bb)表示P<0.01极显著;下同。除含量变化百分比外,其余结果均保留三位有效数字。淫羊藿苷、黄芪甲苷其含量变化百分比(%)=所测得含量/初始含量,下同。
2.4 加速试验 将三批样品(批号20121001、20121002、20121003)置于PYX-DHS-40×50-BS隔水式电热恒温培养箱,在温度40±2℃,相对湿度75%±5%的条件下放置6个月。在0、1、2、3、6个月各取样品,依据质量标准草案考察其性状、鉴别、含量、pH值及无菌,结果显示:其考察项性状、鉴别、无菌检查项目无异常,pH和淫羊藿苷含量变化不显著,其中黄芪甲苷含量20121002批变化无显著性,而20121001批和20121003批差异显著(P<0.05),但未低于最低含量限制(45.0 μg/mL),综合其考察项在6个月内变化不明显,样品较稳定,符合规定。结果见表2。
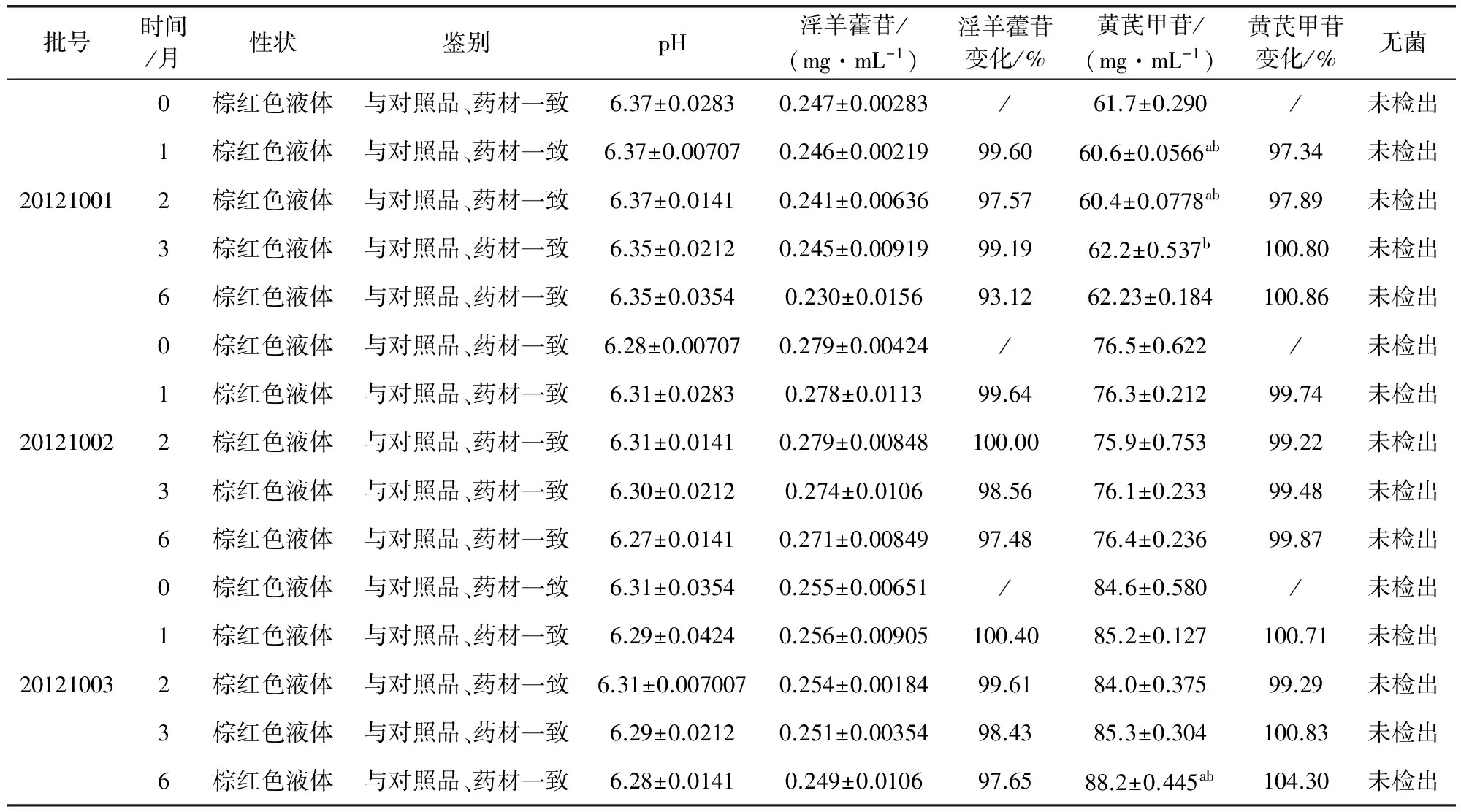
表2 藿芪灌注液加速试验(n=2)
2.5 长期试验 将三批样品置于HH.BII420 S型电热恒温培养箱,在温度25℃±2℃,相对湿度60%±10%的条件下放置24个月。依据质量标准草案在0、3、6、9、12、18、24个月月末取样,考察其性状、鉴别、含量、pH值及无菌,结果表明:其考察项性状、鉴别及无菌无异常现象,淫羊藿苷和黄芪甲苷含量在放置24个月均有显著差异变化,但都未低于最低含量(淫羊藿苷不少于0.20 mg/mL,黄芪甲苷不少于45.0 μg/mL),样品较稳定,符合规定,结果见表3。
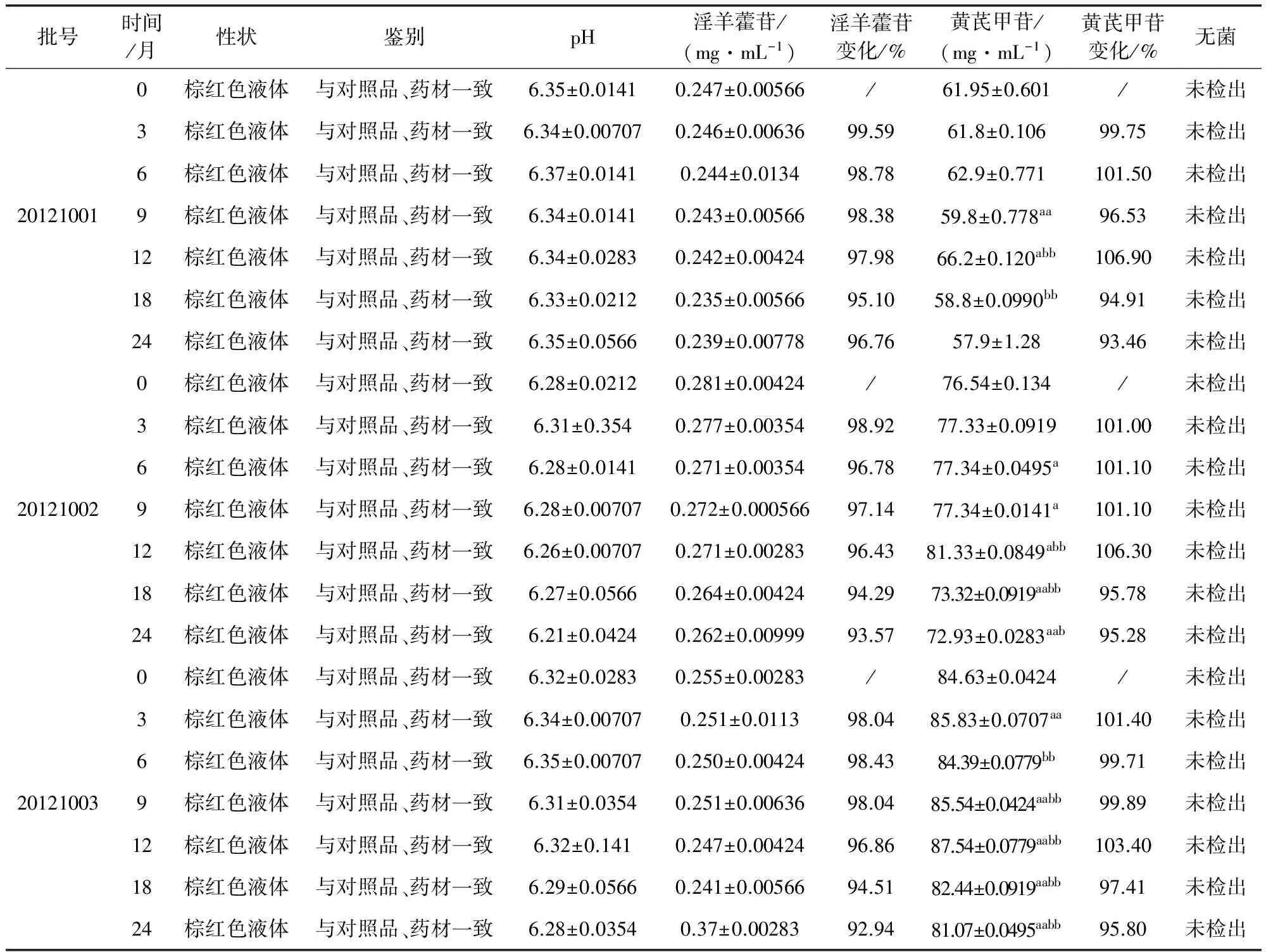
表3 藿芪灌注液长期试验结果(n=2)
3 讨 论
淫羊藿和黄芪作为该制剂中的君药,也是发挥主要药理活性作用,对其药材中主要成分淫羊藿苷和黄芪甲苷进行含量测定研究,对完善本品的质量标准具有十分重要的作用,同时也能有效控制该制剂的内在质量,对发挥临床药效具有重要的意义[8-9]。本制剂参考《中国药典》淫羊藿苷含量测定方法进行研究,对其柱温、流速、流动相比例进行系统适用性试验以及波长的选择,试验证明以流动相乙腈-水28∶72、检测波长270 nm、柱温40 ℃、流速1.0 mL/min的色谱条件对淫羊藿苷的测定具有较强的专属性,能达到基线平衡、与其他组分离度较高、峰形对称、阴性对照无干扰、也缩短了分析时间,便于作为该制剂的含量测定研究[10-11]。其黄芪甲苷含量测定参考《中国药典》方法,考察了流动相比例、流速及温度的变化,最终确定色谱条件为:漂移管温度为90 ℃,载气流速为2.5 L/min,流动相:甲醇-水65∶35,流速:1mL/min,柱温:40 ℃,其所测得结果灵敏度高、分离度好、前处理简便、重现性好[12-13]。其含量测定方法学研究在此前已进行试验,在此不做研究说明。
藿芪灌注液采用经典的水提醇沉工艺制备[2],可保留较全的有效成分,灌注液性状棕红色澄清液体,并通过淫羊藿苷、黄芪甲苷含量以控制灌注液的质量。该制剂进行影响因素试验和加速试验的目的是考察制剂处方与生产工艺及包装条件的合理性。在影响因素试验中淫羊藿苷、黄芪甲苷含量都有不同程度下降,此两种成分在强光和高温条件下容易分解[14-15],说明高温和强光是影响本品稳定性的一个主要因素。因此在提取、浓缩灭菌等生产环节需注意对温度和时间的控制,以及运输、存放时需注意强光和高温对本品的稳定性影响[16]。而且药液pH也是影响其稳定性的一个重要因素,在酸性、弱碱性和中性条件下其结构稳定,但在强酸性和强碱性条件下淫羊藿苷、黄芪甲苷稳定性差,结构易改变[17],故在进行批量生产时应慎重处理或进一步研究是否调整药液pH值。
4 结 论
综上所述,根据本试验的稳定性考察结果,建议可将藿芪灌注液的有效期暂定为2年,使用棕色无菌聚酯瓶,贮藏条件为密闭,室温保存。试验通过对该制剂的稳定性研究,进一步为其质量标准的建立提供理论依据,也为该新药的申报资料提供试验方法和数据,对该药物的进一步深入研究和有效开发利用奠定理论基础。
[1] 李世宏,严作廷,王东升,等. 纯中药催情助孕液治疗奶牛卵巢性不孕症试验[J]. 中兽医医药杂志, 2010(06): 52-53.
[2] 王东升,张世栋,李世宏,等. 正交试验法优化催情助孕液制备工艺[J]. 中国农学通报, 2012(29): 75-78.
[3] 张世栋,王旭荣,杨峰,等. 催情助孕液对小鼠雌、孕激素水平及其受体mRNA表达的影响[J]. 中国兽医学报, 2013(07): 1127-1131.
[4] 王东升,张世栋,苗小楼,等. 藿芪灌注液局部刺激性试验[J]. 江苏农业科学, 2016(04): 303-305.
[5] 农业部兽药审评中心. 兽药研究技术指导原则[M]. 化学工业出版社, 2010: 151.
[6] 中国兽药典委员会. 中国兽药典2010版二部[M]. 北京: 中国农业出版社, 2010.
[7] 国家药典委员会. 中国药典2015版一部[M]. 北京: 中国医药科技出版社, 2015: 45.
[8] Huang D, Jie Y, Lu X,etal. An integrated plasma and urinary metabonomic study using UHPLC-MS: Intervention effects of Epimedium koreanum on kidney-yang deficiency syndrome’rats[J]. Journal of Pharmaceutical & Biomedical Analysis, 2013, 76: 200-206.
[9] Chen W W. Effects of astragalosides from radix astragali on high glucoseinduced proliferation and extracellular matrix accumulation in glomerular mesangial cells[J]. Experimental & Therapeutic Medicine, 2016.
[10]徐作刚,段萍,茅向军,等. 金乌骨通胶囊HPLC指纹图谱研究[J]. 中国民族民间医药, 2014(22): 8-10.
[11]Han S, Xie Y Y, Wang Y M,etal. Comparative study on chemical quality of main species of epimedium.[J]. Acta pharmaceutica Sinica. 2012, 47(4): 502-507.
[12]Su B R, Deng H M, Ma H L,etal. Quality evaluation of astragali radix through chemical pattern recognition of fingerprint by HPLC-dAD-ELSD[J]. China journal of Chinese materia medica, 2013, 38(19): 3319-3323.
[13]Chen H, Zhou X, Zhao Y,etal. HPLC-DAD-ELSD combined pharmacodynamics and serum medicinal chemistry for quality assessment of huangqi granule.[J]. Plos One, 2015, 10(4).
[14]陈毅平,陈双英,陈文财,等. 淫羊藿苷的稳定性及其影响因素[J]. 中国实验方剂学杂志. 2014(05): 78-81.
[15]陈祖云,石凌云,黄勇,等. HPLC-ELSD法测定脑通颗粒中黄芪甲苷和人参皂苷Rb_1的含量及稳定性[J]. 中国药房. 2011(23): 2164-2166.
[16]刘泽干,黄良永,朱海涛,等. 金茵清热口服液稳定性考察[J]. 医药导报. 2014(11): 1502-1505.
[17]陈毅平,陈双英,陈文财,等. 淫羊藿苷的稳定性及其影响因素[J]. 中国实验方剂学杂志. 2014(05): 78-81.
(编辑:陈希)
Study on Stability of Icariin and Astragaloside in Huoqi Perfusion
YANG Hong-zao1,2, MIAO Xiao-lou1,ZHANG Shi-dong1,DONG Shu-wei1,YAN Bao-qi1, SANG Meng-qi1,NA Li-dong1,2,WANG Dong-sheng1*,YAN Zuo-ting1*
(1.LanzhouInstituteofAnimalHusbandryandPharmaceuticalSciences,ChineseAcademyofAgriculturalSciences,KeyLaboratoryofVeterinaryPharmaceuticalDiscovery,MinistryofAgriculture,Lanzhou730050 ,China) (2.CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China)
To investigate the stability of Huoqi perfusion, the contents oficariin and astragaloside were determined by HPLC.The separation of the icariin was achieved by a WondaSil-C18(4.6 mm×250 mm,5 μm) and mobile phase composed of acetonitrile-water(28∶72),the detection wavelength was 270 nm,the column temperature was 40 ℃,the injection volume of 10 μL,the flow rate was 1.0 mL/min;The separation of the astragaloside was achieved by a ZORBAX SB-C18(4.6 mm×150 mm,5 μm),The drift tube temperature is 90 ℃,The carrier gas flow rate is 2.5 L/min and mobile phase composed of methanol-water(65∶35) , the flow rate was 1.0 mL/min;the injection volume of 10 μL; the column temperature was 40 ℃,with evaporative light scattering detector. Huoqi Perfusionwas treated respectively with high temperature(60 ℃)for 10 d, high wet(RH95%±5%)for 10 days,high light(4500±500LX )for 10 days,accelerating testing (40 ℃±2 ℃,RH75%±5%)for six months,and a long-term testing (25 ℃±2 ℃,RH60%±10%) for twelve months,and then the changes of characters,identification, pH,icariin,astragaloside and sterility test under different storage conditions were observed. All of the tested indexes of Huoqi Perfusion were consistent with the quality standards. The tested of Huoqi perfusion is stable and reliable.
Huoqi perfusion;stability test;HPLC;icariin;astragaloside;
中国农业科学院科技创新工程项目(CAAS-ASTIP-2014-LIHPS-03);"十二五"国家科技支撑计划重点课题(2012BAD12B03)
杨洪早,硕士研究生,从事中兽药研发方面研究。
严作廷,E-mail:yanzuoting@caas.cn;王东升,E-mail:lzmyswdsh@126.com
2016-08-04
A
1002-1280 (2017) 01-0019-06
S853.74
