不同剂量燕麦β-葡聚糖对高脂饮食诱导的大鼠血糖和血脂水平的影响*
2017-02-14
不同剂量燕麦β-葡聚糖对高脂饮食诱导的大鼠血糖和血脂水平的影响*
孙娟①张美芳①葛声②*刘海丽②唐雯①张海峰①

目的:研究不同剂量燕麦β-葡聚糖对高脂饮食诱导的大鼠血糖和血脂水平的影响及其相关作用机制。方法:选择50只雄性SD大鼠,按体重分层随机将其分为5组,每组10只,分别为正常对照组、高脂对照组、燕麦β-葡聚糖低剂量组、燕麦β-葡聚糖中剂量组以及燕麦β-葡聚糖高剂量组。50只雄性SD大鼠连续喂养14周后做葡萄糖耐量测试(GTT),计算血糖曲线下面积(AUC)。GTT后再连续喂养一周,将大鼠空腹处死,测定空腹血糖(FBG)、血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、游离脂肪酸(FFA)、空腹血清胰岛素(FINS)、脂联素以及胰高血糖素样肽1(GLP-1),并计算胰岛素抵抗指数(HOMA-IR)。结果:燕麦β-葡聚糖低剂量组大鼠GTT实验30 min末梢血糖高于正常对照组与高脂对照组,差异有统计学意义(95%CI分别为0.00~2.23和0.25~2.25;P<0.05);燕麦β-葡聚糖低剂量组、燕麦β-葡聚糖中剂量组大鼠GTT实验120 min末梢血糖高于正常对照组,差异有统计学意义(95%CI分别为0.82~3.57和0.28~2.90;P<0.05);燕麦β-葡聚糖高剂量组大鼠GTT检测与正常对照组和高脂对照组比较均无差异。燕麦β-葡聚糖低剂量组AUC显著高于高脂对照组,差异有统计学意义(95%CI为0.56~4.40;P<0.05),且燕麦β-葡聚糖低剂量组TC高于正常对照组与高脂对照组,差异有统计学意义(95%CI分别为0.10~0.80和0.01~0.64;P<0.05);LDL-C显著高于正常对照组与高脂对照组,差异有统计学意义(95% CI分别为0.03~0.13和0.01~0.10;P<0.05);各实验组大鼠空腹血清GLP-1与正常对照组及高脂对照组之间差异均无统计学意义。结论:低剂量的燕麦β-葡聚糖降低了实验大鼠机体对血糖的调节能力,并且增加了空腹血清TC和LDL-C水平。
燕麦β-葡聚糖;血脂;血糖;葡萄糖耐量测试;胰高血糖素样肽1
[First-author’s address] Department of Nutrition, Shanghai Ninth People’s Hospital, Shanghai JiaoTong University School of Medicine, Shanghai200011, China.
燕麦是主要的谷类作物之一,在燕麦籽粒的糊粉层和亚糊粉层细胞壁中含有一种非淀粉类水溶性植物多糖—燕麦β-葡聚糖,其基本结构是由β(1→3)和 β(1→4)糖苷键连接β-D-吡喃葡萄糖单位而形成的一种高分子无分支线性黏多糖,是一种低聚糖,属于可溶性膳食纤维[1-2]。大量的动物实验表明,燕麦-β葡聚糖具有改善胰岛素抵抗和血液总胆固醇水平,降低血压、调节机体免疫功能以及抗疲劳等作用[3-8]。另有研究表明,燕麦β-葡聚糖可影响肠道菌群,增加实验动物肠道中乳酸杆菌数量[9]。
以往研究多集中在有关燕麦β-葡聚糖的治疗作用,其在预防代谢性疾病中的作用,以及合理剂量的相关研究甚少,因此,缺少不同剂量燕麦β-葡聚糖在预防代谢性疾病中作用效果的相关研究。为此,本研究通过探讨不同剂量燕麦β-葡聚糖对高脂饮食诱导大鼠血糖和血脂水平的影响,并在此基础上进一步研究燕麦β-葡聚糖对血糖和血脂水平的影响与肠肽激素GLP-1的关系,以期为我国保健食品的研发,利用燕麦开发出新的功能性谷物食品,或定向扩大其应用范围提供一定的理论基础。
1 资料与方法
1.1实验动物
选取清洁级SD大鼠50只,均为雄性,体重(228±9)g,由上海西普尔-必凯实验动物公司提供(生产许可证号:SCXK(沪)2013-0016;使用许可证号:SYXK(沪)2011-0128)。所有实验大鼠均适应性喂养1周,以空腹体重为基础,按体重分层随机将其分为5组:①正常对照组(10只),采用普通饲料+生理盐水灌胃;②高脂对照组(10只),采用高脂高糖饲料+生理盐水灌胃;③燕麦β-葡聚糖低剂量组(10只),采用高脂高糖饲料+燕麦β-葡聚糖148 mg/(kg·d)灌胃;④燕麦β-葡聚糖中剂量组(10只),采用高脂高糖饲料+燕麦β-葡聚糖296 mg/(kg·d)灌胃;⑤燕麦β-葡聚糖高剂量组(10只),采用高脂高糖饲料+燕麦β-葡聚糖591 mg/ (kg·d)灌胃。其中燕麦β-葡聚糖各剂量组设计参考相关文献,并根据本研究实验使用燕麦-β葡聚糖浓度做相应调整和相关预实验研究[10]。燕麦β-葡聚糖由西安天瑞技术有限公司提供,浓度水平为90%。
1.2仪器与试剂
采用advia2400大型生化仪(西门子);FA2004N电子天平(上海精密科学仪器有限公司);离心机(德国Eppendorf公司);酶标仪318C+(上海市沛欧分析仪器有限公司);MH-1迷你水平摇床(海门市其林贝尔仪器制造有限公司);DK-420电热恒温水槽(上海精宏实验设备有限公司)。
大鼠血糖、血脂、游离脂肪酸试剂盒(德国罗氏公司);大鼠脂联素酶联免疫(ELISA)试剂盒、大鼠GLP-1酶联免疫(ELISA)试剂盒(美国Crystalchem公司);大鼠胰岛素酶联免疫(ELISA)试剂盒(日本Shibayagi公司);二肽基肽酶-Ⅳ(Dipeptidyl peptidase-4,DPP-4)抑制剂(美国Millipore公司)。
1.3实验方法
实验期间正常对照组继续给予普通饲料,其配方为:100 g普通饲料中含有碳水化合物52.0 g(占总热量60.5%)、脂肪5.28 g(占总热量13.8%)、蛋白质22.10 g(占总热量25.7%),供能343.92 kcal/100 g;高脂对照组和燕麦β-葡聚糖各剂量组喂40%高脂高糖饲料,其配方为:100 g高脂饲料中含有碳水化合物44.6 g(占总热量40%)、脂肪19.8 g(占总热量40%)、蛋白质22.3 g(占总热量20%),供能445.8 kcal/100 g。
实验大鼠自由进食和饮水,每日早8:00给予灌胃,灌胃剂量5 ml/(kg·BW·d)。动物饲养环境温度为(25±2)℃,相对湿度为50%~70%,每12 h进行一次昼夜交替循环。
1.4检测指标
采用葡萄糖氧化酶终点法测定大鼠空腹血糖(fasting blood glucose,FBG)、采用胆固醇氧化酶法测定血清总胆固醇(total cholesterol,TC)、采用酶法终点法测定甘油三酯(triglyceride,TG)、采用直接测量法测定低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、采用酶法终点法测定游离脂肪酸(free fatty acid,FFA)、采用ELISA双抗体夹心法测定空腹血清胰岛素(fasting serum insulin,FINS)、脂联素及胰高血糖素样肽1(glucagon-like peptide 1,GLP-1),并计算胰岛素抵抗指数(homeostasis model assessment of insulin resistance index,HOMA-IR)。
(1)实验大鼠葡萄糖耐量测试(glucose tolerance test,GTT)的测定及血糖曲线下面积(area under the curve,AUC)的计算。5组大鼠连续喂养14周后进行GTT实验,评价实验大鼠胰岛β细胞功能和机体对血糖的调节能力。空腹12 h后,各组大鼠给予20%葡萄糖2 g/(kg·bw)腹腔内注射。在葡萄糖注射前(0 min)及注射后30 min、60 min及120 min的4个时间点检测大鼠尾静脉末梢血糖。葡萄糖AUC[11]计算为公式1:
AUC=(0 min血糖值+30 min血糖值)×0.5÷2+(30 min血糖值+60 min血糖值)×0.5÷2+(60 min血糖值+120 min血糖值)×1÷2 (1)
(2)经GTT后再连续喂养一周,处死实验大鼠。采血前禁食、不禁水12 h,于次日晨采血。测定大鼠FBG、TC、TG、LDL-C、HDL-C和FFA以及FINS和脂联素。将HOMA-IR计算作为评价胰岛素抵抗的指标,HOMA-IR计算为公式2:
HOMA-IR=[FBG(mmol/L)×FINS(mU/L)]÷22.5 (2)
(3)空腹GLP-1的测定。GLP-1释放到血液中,会迅速被以DPP-4为主的酶降解而失去活性,并从肾脏清除,其在血液中的半衰期<2 min[12]。采集血液样本1 ml后立即加入DPP-4抑制剂10 μl,防止蛋白降解。
1.5统计学方法
采用SPSS17.0软件对数据进行统计学处理,GraphPad Prism绘图软件绘制相关线形图及直方图。各计量数据资料以均数±标准差(x-±s)表示,各组间比较采用方差分析(One-way ANOVA),Duunet t(2-sided)a检验,以P<0.05为差异有统计学意义。95%置信区间(95% confidence interval,95%CI)。
2 结果
实验进行到第1周和第3周,因灌胃时SD大鼠挣扎造成损伤,分别导致燕麦β-葡聚糖低剂量组和高剂量组实验SD大鼠各死亡1只,其余均健康存活,直至实验结束。
2.1各组GTT及AUC检测结果比较
GTT检测结果显示:燕麦β-葡聚糖低剂量组大鼠30 min末梢血糖为(6.81±0.91)mmol/L,高于正常对照组(5.70±0.66)mmol/L和高脂对照组(5.56±0.56) mmol/L,差异有统计学意义(95%CI分别为0.00~2.23和0.25~2.25;P<0.05)。燕麦β-葡聚糖低剂量组大鼠120 min末梢血糖为(7.27±1.12)mmol/L,显著高于正常对照组(5.08±0.84)mmol/L,差异有统计学意义(95%CI为0.82~3.57;P<0.05),且燕麦β-葡聚糖中剂量组大鼠120 min末梢血糖为(6.67±0.98)mmol/L,高于正常对照组(5.08±0.84)mmol/L,差异有统计学意义(95%CI为0.28~2.90;P<0.05),燕麦β-葡聚糖高剂量组大鼠GTT检测与正常对照组和高脂对照组比较均无差异,见表1,表2。
AUC分析统计结果与GTT结果变化趋势相似,燕麦β-葡聚糖低剂量组大鼠的血糖曲线下面积(14.25±2.09)>中剂量组(13.17±0.79)>高剂量组(12.89±1.37)>正常对照组(12.14±1.80)>高脂对照组(11.77±1.07),且燕麦β-葡聚糖低剂量组AUC显著高于高脂对照组,差异具有统计学意义(95%CI 0.56~4.40;P<0.05),如图1所示。
2.2各组空腹血糖、胰岛素及HOMA-IR结果比较
对采集的实验SD大鼠空腹血糖及胰岛素进行检测,并计算HOMA-IR作为评价胰岛素抵抗的指标。分析结果显示:实验各组的空腹血糖、胰岛素以及HOMA-IR与正常对照组及高脂对照组相比,差异均无统计学意义,见表3,表4。
表1 正常对照组与各组间GTT实验血糖结果比较(±s,mmol/L)
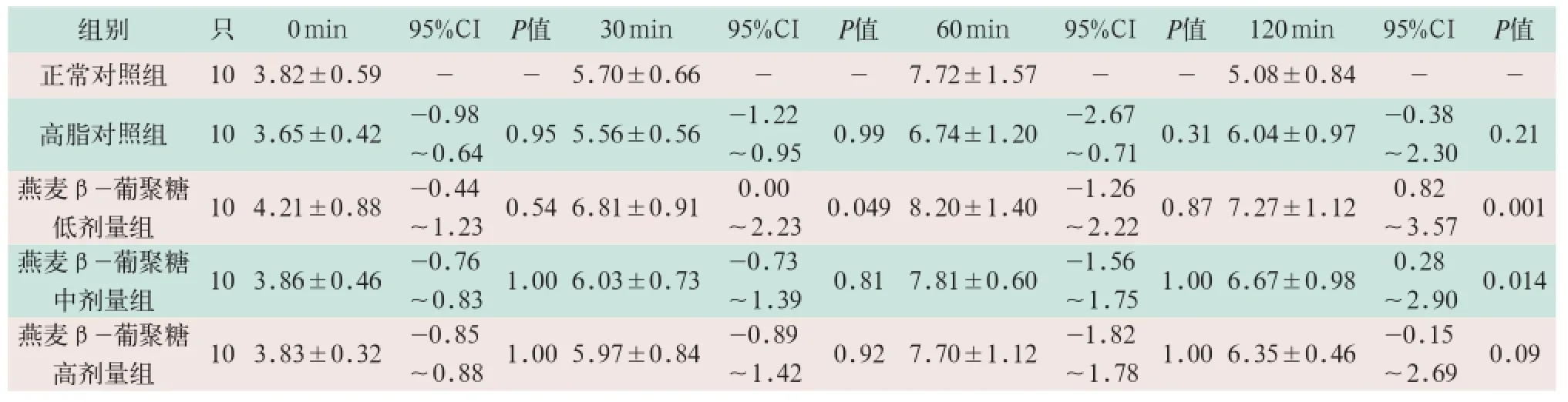
表1 正常对照组与各组间GTT实验血糖结果比较(±s,mmol/L)
组别 只0 m i n 9 5 % C I P值3 0 m i n 9 5 % C I P值6 0 m i n 9 5 % C I P值1 2 0 m i n 9 5 % C I P值正常对照组1 0 3 . 8 2 ± 0 . 5 9 --5 . 7 0 ± 0 . 6 6 --7 . 7 2 ± 1 . 5 7 --5 . 0 8 ± 0 . 8 4 --高脂对照组1 0 3 . 6 5 ± 0 . 4 2 -0 . 9 8~0 . 6 4 0 . 9 5 5 . 5 6 ± 0 . 5 6 -1 . 2 2~0 . 9 5 0 . 9 9 6 . 7 4 ± 1 . 2 0 -2 . 6 7~0 . 7 1 0 . 3 1 6 . 0 4 ± 0 . 9 7 -0 . 3 8~2 . 3 0 0 . 2 1燕麦β -葡聚糖低剂量组1 0 4 . 2 1 ± 0 . 8 8 -0 . 4 4~1 . 2 3 0 . 5 4 6 . 8 1 ± 0 . 9 1 0 . 0 0~2 . 2 3 0 . 0 4 9 8 . 2 0 ± 1 . 4 0 -1 . 2 6~2 . 2 2 0 . 8 7 7 . 2 7 ± 1 . 1 2 0 . 8 2~3 . 5 7 0 . 0 0 1燕麦β -葡聚糖中剂量组1 0 3 . 8 6 ± 0 . 4 6 -0 . 7 6~0 . 8 3 1 . 0 0 6 . 0 3 ± 0 . 7 3 -0 . 7 3~1 . 3 9 0 . 8 1 7 . 8 1 ± 0 . 6 0 -1 . 5 6~1 . 7 5 1 . 0 0 6 . 6 7 ± 0 . 9 8 0 . 2 8~2 . 9 0 0 . 0 1 4燕麦β -葡聚糖高剂量组1 0 3 . 8 3 ± 0 . 3 2 -0 . 8 5~0 . 8 8 1 . 0 0 5 . 9 7 ± 0 . 8 4 -0 . 8 9~1 . 4 2 0 . 9 2 7 . 7 0 ± 1 . 1 2 -1 . 8 2~1 . 7 8 1 . 0 0 6 . 3 5 ± 0 . 4 6 -0 . 1 5~2 . 6 9 0 . 0 9
表2 高脂对照组与各组间GTT实验血糖结果比较(±s,mmol/L)
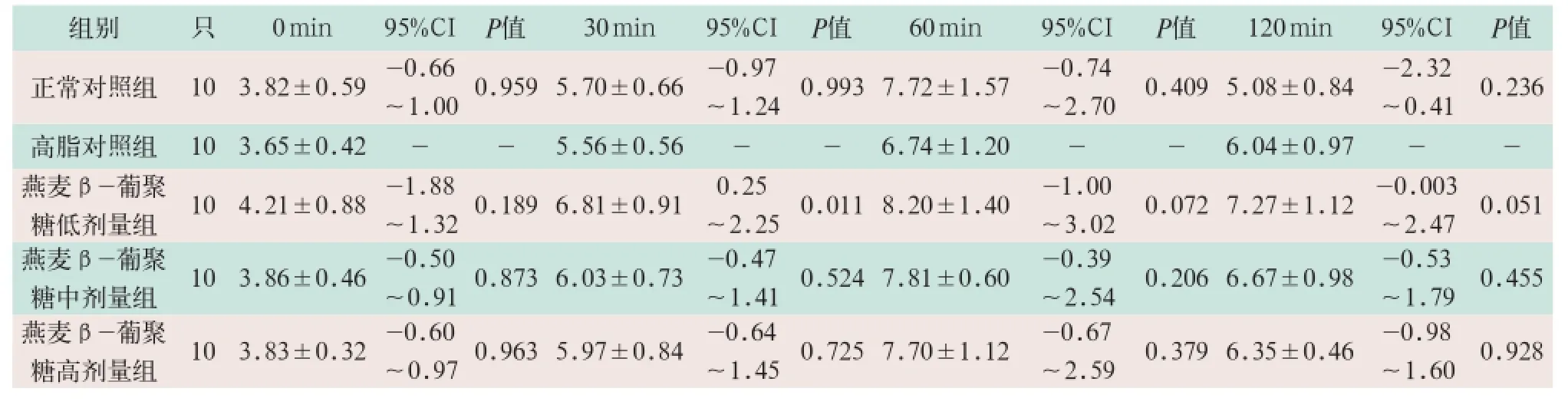
表2 高脂对照组与各组间GTT实验血糖结果比较(±s,mmol/L)
组别 只0 m i n 9 5 % C I P值3 0 m i n 9 5 % C I P值6 0 m i n 9 5 % C I P值1 2 0 m i n 9 5 % C I P值正常对照组 1 0 3 . 8 2 ± 0 . 5 9 -0 . 6 6~1 . 0 0 0 . 9 5 9 5 . 7 0 ± 0 . 6 6 -0 . 9 7~1 . 2 4 0 . 9 9 3 7 . 7 2 ± 1 . 5 7 -0 . 7 4~2 . 7 0 0 . 4 0 9 5 . 0 8 ± 0 . 8 4 -2 . 3 2~0 . 4 1 0 . 2 3 6高脂对照组 1 0 3 . 6 5 ± 0 . 4 2 --5 . 5 6 ± 0 . 5 6 --6 . 7 4 ± 1 . 2 0 --6 . 0 4 ± 0 . 9 7 --燕麦β -葡聚糖低剂量组 1 0 4 . 2 1 ± 0 . 8 8 -1 . 8 8~1 . 3 2 0 . 1 8 9 6 . 8 1 ± 0 . 9 1 0 . 2 5~2 . 2 5 0 . 0 1 1 8 . 2 0 ± 1 . 4 0 -1 . 0 0~3 . 0 2 0 . 0 7 2 7 . 2 7 ± 1 . 1 2 -0 . 0 0 3~2 . 4 7 0 . 0 5 1燕麦β -葡聚糖中剂量组 1 0 3 . 8 6 ± 0 . 4 6 -0 . 5 0~0 . 9 1 0 . 8 7 3 6 . 0 3 ± 0 . 7 3 -0 . 4 7~1 . 4 1 0 . 5 2 4 7 . 8 1 ± 0 . 6 0 -0 . 3 9~2 . 5 4 0 . 2 0 6 6 . 6 7 ± 0 . 9 8 -0 . 5 3~1 . 7 9 0 . 4 5 5燕麦β -葡聚糖高剂量组 1 0 3 . 8 3 ± 0 . 3 2 -0 . 6 0~0 . 9 7 0 . 9 6 3 5 . 9 7 ± 0 . 8 4 -0 . 6 4~1 . 4 5 0 . 7 2 5 7 . 7 0 ± 1 . 1 2 -0 . 6 7~2 . 5 9 0 . 3 7 9 6 . 3 5 ± 0 . 4 6 -0 . 9 8~1 . 6 0 0 . 9 2 8
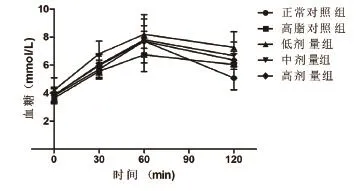
图1 各组实验大鼠血糖曲线下面积曲线图
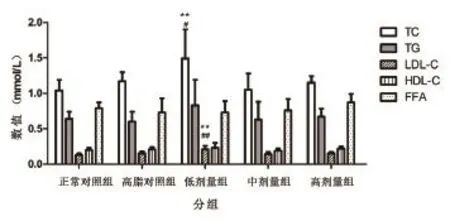
图 2 各组实验大鼠空腹血清血脂水平示图
2.3各组血脂指标结果比较
实验结束后,燕麦β-葡聚糖低剂量组大鼠的血清TC为(1.486±0.413)mmol/L,高于正常对照组(1.038±0.150)mmol/L和高脂对照组(1.165±0.132) mmol/L,且差异有统计学意义(95%CI分别为0.10~0.80和0.01~0.64;P<0.05)。燕麦β-葡聚糖低剂量组大鼠的血清LDL-C为(0.209±0.054) mmol/L,显著高于正常对照组(0.126±0.021) mmol/L和与高脂对照组(0.150±0.032)mmol/L,且差异有显著统计学意义(95%CI分别为0.03~0.13和0.01~0.10;P<0.05)。各实验组大鼠与正常对照组及高脂对照组相比,血清TG、HDL-C及FFA之间差异均无统计学意义,如图2所示。
2.4各组空腹脂联素及GLP-1结果比较
燕麦β-葡聚糖高剂量组空腹血清脂联素水平最高,但与正常对照组以及高脂对照组之间差异无统计学意义(95%CI分别为-2099.52~4895.06和-2688.55~3599.51;P>0.05)。各实验组大鼠空腹血清GLP-1与正常对照组及高脂对照组之间差异均无统计学意义,见表5,表6。
3 讨论
表3 正常对照组与各组实验大鼠FBG、FINS及HOMA-IR指数结果比较(±s)
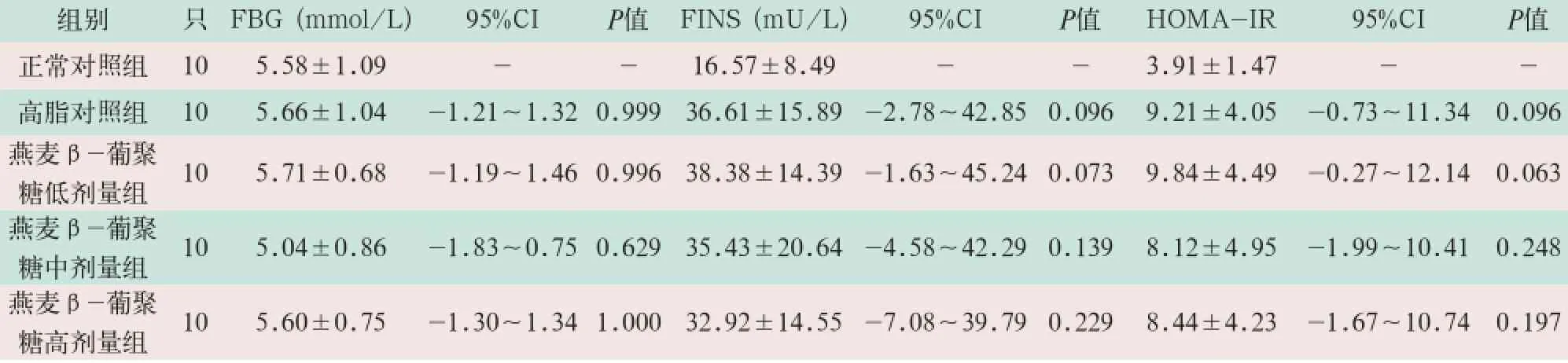
表3 正常对照组与各组实验大鼠FBG、FINS及HOMA-IR指数结果比较(±s)
组别只FBG (mmol/L) 95%CI P值FINS (mU/L) 95%CIP值HOMA-IR 95%CI P值正常对照组105.58±1.09 --16.57±8.49--3.91±1.47 --高脂对照组105.66±1.04-1.21~1.32 0.99936.61±15.89-2.78~42.850.0969.21±4.05 -0.73~11.340.096燕麦β-葡聚糖低剂量组105.71±0.68-1.19~1.46 0.99638.38±14.39-1.63~45.240.0739.84±4.49 -0.27~12.140.063燕麦β-葡聚糖中剂量组105.04±0.86-1.83~0.75 0.62935.43±20.64-4.58~42.290.1398.12±4.95 -1.99~10.410.248燕麦β-葡聚糖高剂量组105.60±0.75-1.30~1.34 1.00032.92±14.55-7.08~39.790.2298.44±4.23 -1.67~10.740.197
表4 高脂对照组与各组实验大鼠FBG、FINS及HOMA-IR指数结果比较(±s)

表4 高脂对照组与各组实验大鼠FBG、FINS及HOMA-IR指数结果比较(±s)
组别只FBG (mmol/L) 95%CIP值FINS (mU/L) 95%CIP值HOMA-IR95%CIP值正常对照组105.58±1.09-1.39~1.23 0.98716.57±8.49-43.24~3.170.107 3.91±1.47-11.45~0.84 0.107高脂对照组105.66±1.04-36.61±15.89--9.21±4.05--燕麦β-葡聚糖低剂量组105.71±0.68-1.14~1.24 0.88338.38±14.39-19.29~22.84 0.9989.84±4.49-4.95~6.200.995燕麦β-葡聚糖中剂量组105.04±0.86-1.77~0.52 0.80635.43±20.64-22.24~19.891.008.12±4.95-6.67~4.480.965燕麦β-葡聚糖高剂量组105.60±0.75-1.25~1.13 0.97432.92±14.55-24.75~17.39 0.9768.44±4.23-6.35~4.800.990
本研究结果显示,燕麦β-葡聚糖低剂量组大鼠的30 min末梢血糖高于正常对照组与高脂对照组,差异均具有统计学意义。燕麦β-葡聚糖低剂量组、中剂量组大鼠的120 min末梢血糖显著高于正常对照组,差异均具有统计学意义。AUC分析统计结果与GTT结果变化趋势相似,燕麦β-葡聚糖低剂量组血糖曲线下面积显著高于高脂对照组,差异具有统计学意义。实验结束后各实验组大鼠的空腹血糖、空腹胰岛素以及HOMA-IR与正常对照组及高脂对照组之间差异均无统计学意义。燕麦β-葡聚糖低剂量组大鼠的空腹血清TC、LDL-C均高于正常对照组与高脂对照组,差异具有统计学意义。燕麦β-葡聚糖高剂量组空腹血清脂联素水平最高,但与正常对照组以及高脂对照组之间差异无统计学意义。各实验组大鼠空腹血清GLP-1与正常对照组及高脂对照组之间差异均无统计学意义。
肠促胰岛素具有抑制食欲、延缓胃排空以及有效降低体重,促进胰岛素的合成和分泌,保护胰岛β细胞功能,抑制胰岛β细胞凋亡等作用。目前常见的肠道激素有胃分泌的胃泌素和胃促生长素;胰腺分泌的胰岛素、胰升血糖素、胰多肽和胰淀素;小肠分泌的缩胆囊素(cholecystokinin,CCK)、胃动素、促胰液素及抑胃肽(gastric inhibitory peptide,GIP);大肠分泌的GLP-1和酪酪肽(peptide YY,PYY)等。上述肠道激素多数与糖脂代谢密切相关,肠道激素水平及其作用的改变可能在糖尿病以及肥胖等代谢性疾病中发挥重要的作用,其作用效果越来越受到人们的关注。
GLP-1主要是由回肠和结肠的L细胞分泌的肠肽类激素,其含有30个氨基酸,半衰期<2 min,主要由DPP-4为主的酶将其降解为无活性的GLP-1(9-36)。GLP-1以分泌颗粒的形式贮存,其通过感受细胞液中Ca2+和环腺苷酸(Cyclic adenosine monophosphate,cAMP)的水平,以胞吐的方式释放[13]。GLP-1可作用于多个靶器官,主要作用是增强葡萄糖介导的胰岛素分泌,同时有效抑制胰升血糖素的分泌,调节血糖稳态,改善胰岛β细胞的功能,减轻体重[14]。
已有相关研究表明,β-葡聚糖可促进或抑制一些胃肠激素的分泌,健康和超重人群在进食富含β-葡聚糖的面包或谷物后,餐后血液中PYY的水平显著升高,β-葡聚糖有促进PYY分泌的作用,PYY与下丘脑的Y2受体结合,该受体通过抑制食欲刺激因子神经肽YY的释放抑制食欲[15-17]。
表5 正常对照组与各组实验大鼠空腹血清脂联素及GLP-1结果比较(±s)

表5 正常对照组与各组实验大鼠空腹血清脂联素及GLP-1结果比较(±s)
组别只脂联素(ng/ml)95%CIP值GLP-1(PM)95%CIP值正常对照组108682.43±1725.05--3.46±0.82--高脂对照组109624.72±3604.43-2462.70~4347.280.8695.33±1.84-1.35~5.090.373燕麦β-葡聚糖低剂量组108928.57±1621.35-3251.15~3743.400.9996.19±1.62-0.85~6.300.171燕麦β-葡聚糖中剂量组108983.88±1369.44-3195.83~3798.740.9984.11±3.56-2.78~4.060.963燕麦β-葡聚糖高剂量组1010080.20±2191.48-2099.52~4895.060.6695.05±1.93-1.84~5.010.560
表6 高脂对照组与各组实验大鼠空腹血清脂联素及GLP-1结果比较(±s)

表6 高脂对照组与各组实验大鼠空腹血清脂联素及GLP-1结果比较(±s)
组别只脂联素(ng/ml)95%CIP值GLP-1(PM)95%CIP值正常对照组108682.43±1725.05-4405.48~2520.900.8963.46±0.82-5.14~1.400.408高脂对照组109624.72±3604.43--5.33±1.84--燕麦β-葡聚糖低剂量组108928.57±1621.35-3840.18~2447.880.9476.19±1.62-2.42~4.130.909燕麦β-葡聚糖中剂量组108983.88±1369.44-3784.86~2503.200.9604.11±3.56-4.32~1.880.713燕麦β-葡聚糖高剂量组1010080.20±2191.48-2688.55~3599.510.9885.05±1.93-3.38~2.820.998
已有大量的动物实验研究表明,燕麦-β葡聚糖具有治疗糖尿病、缓解糖尿病并发症以及改善胰岛素抵抗和血液总胆固醇水平[3-5]的作用。相关人群研究也表明,燕麦β-葡聚糖对高胆固醇血症和肥胖人群确实有显著降脂和减肥功效,但对健康人群血脂调节以及减肥作用仍存在一定争议[18-21]。
GLP-1和PYY均主要来自于肠道的分泌,但本研究通过不同剂量燕麦β-葡聚糖的干预实验,并未发其对实验大鼠空腹血清GLP-1含量有明显的影响。本研究发现燕麦-β葡聚糖低剂量组降低了实验大鼠机体对血糖的调节能力,并且增加了血清TC和LDL-C水平,这可能与本研究从预防保健的作用进行研究有一定关系。在本研究中所有实验大鼠均为正常健康大鼠,自身机体调节能力比较完善,且燕麦-β葡聚糖是一种黏多糖,但也是一种可溶性膳食纤维,可溶解于水又可吸水膨胀,并能被大肠中微生物酵解,具有调节肠道功能,刺激肠道蠕动的作用,低剂量的燕麦β-葡聚糖对实验大鼠的作用结果可能是以这种促进作用占主要地位,进而可通过促进食欲、增加体重等作用降低了实验大鼠机体对血糖的调节能力,并且增加了空腹血清TC和LDL-C水平;此外有研究发现,燕麦β葡聚糖具有益生元的作用,能够改善肠道环境、调节肠道系统中微生物群落组成等诸多生理功效[22-24]。不同剂量的燕麦β-葡聚糖可能对机体肠道菌群也产生不同的作用效果,引起肠道菌群发生不同方向的变化,这种作用可能也会呈现出剂量依赖性,进而引起最终的不同作用。
本研究GLP-1的检测采用的空腹血清,这与PYY的研究标本存在一定的差异,并且本研究为动物实验研究,与大样本人群研究可能会存在一定的差异,其相关作用及作用机制有待于大样本临床研究予以进一步证实。
[1]Andersson AAM,Börjesdotter D.Effects of environment and variety on content and molecular weight of β-glucan in oats[J].Journal of Cereal Science,2011,54(1):122-128.
[2]申瑞玲,程珊珊.燕麦β-葡聚糖生理功能研究进展[J].食品与机械,2007,23(6):126-129.
[3]Andon MB,Anderson JW.State of the Art Reviews:The Oatmeal-Cholesterol Connection:10 Years Later[J].American Journal of Lifestyle Medicine,2008,2(1):51-57.
[4]王双慧,沈南辉,何勇,等.燕麦β-葡聚糖对高胆固醇小鼠血脂和游离脂肪酸的影响研究[J].食品工业科技,2014,35(2):324-327.
[5]汪海波,刘大川,汪海婴,等.燕麦β-葡聚糖对糖尿病大鼠的血糖及糖代谢功能的影响研究[J].食品科学,2005,26(8):387-391.
[6]Tappy L,Gügolz E,Würsch P.Effects of breakfast cereals containing various amounts of beta-glucan fibers on plasma glucose and insulin responses in NIDDM subjects[J].Diabetes Care,1996,19(8):831-834.
[7]Brennan CS,Cleary LJ.The potential use of cereal (1→3,1→4)-β-d-glucans as functional food ingredients[J].Journal of Cereal Science,2005,42(1):1-13.
[8]徐超,胡新中,罗勤贵,等.燕麦对小鼠抗疲劳作用的研究[J].中国粮油学报,2009,24(9):36-39.
[9]Murphy P,Dal Bello F,O'Doherty J,et al.Analysis of bacterial community shifts in the gastrointestinal tract of pigs fed diets supplemented with β-glucan from Laminaria digitata,Laminaria hyperborea and Saccharomyces cerevisiae[J]. Animal,2013,7(7):1079-1087.
[10]裴素萍,蔡东联,朱昱,等.燕麦β-葡聚糖治疗大鼠高脂血症[J].第二军医大学学报,2006,27(5):510-513.
[11]魏占英,沈丽,冯晓慧,等.高脂饲料喂养时间和STZ剂量对建立2型糖尿病大鼠模型的影响[J].医学研究杂志,2014,43(2):42-46.
[12]顿新鹏,陈正望.胰高血糖素样肽1及其修饰物的生理作用与临床应用[J].中华内分泌代谢杂志,2005,21(3):288-291.
[13]Wadden D,Cahill F,Amini P,et al.Circulating glucagon-like peptide-1 increases in response to short-term overfeeding in men[J].Nutr Metab(Lond),2013,10(1):33.
[14]Adamska E,Ostrowska L,Górska M,et al. The role of gastrointestinal hormones in the pathogenesis of obesity and type 2 diabetes[J]. Prz Gastroenterol,2014,9(2):69-76.
[15]Liatis S,Tsapogas P,Chala E,et al.The consumption of bread enriched with betaglucan reduces LDL-cholesterol and improves insulin resistance in patients with type2 diabetes[J]. Diabetes Metab,2009,35(2):115-120.
[16]Beck EJ,Tapsell LC,Batterham MJ,et al.Increases in peptide Y-Y levels following oat beta-glucan ingestion are dose-dependent in overweight adults[J].Nutr Res,2009,29(10):705-709.
[17]Vitaglione P,Lumaga RB,Stanzione A,et al. β-Glucan-enriched bread reduces energy intake and modifies plasma ghrelin and peptide YY concentrations in the short term[J]. Appetite,2009,53(3):338-344.
[18]Rui X.Oat fibre:Overview on their main biological properties[J].European Food Research and Technology,2012,234(4):563-569.
[19]Shimizu C,Kihara M,Aoe S,et al.Effect of high beta-glucan barley on serum cholesterol concentrations and visceral fat area in Japanese men--a randomized,double-blinded,placebocontrolled trial[J].Plant Foods Hum Nutr,2008,63(1):21-25.
[20]Othman RA,Moghadasian MH,Jones PJ.Cholesterol-lowering effects of oat β-glucan[J].Nutr Rev,2011,69(6):299-309.
[21]Chen J,He J,Wildman RP,et al.A randomized controlled trial of dietary fiber intake on serum lipids[J].Eur J Clin Nutr,2006,60(1):62-68.
[22]吉布森(英).益生元开发与应用[M].北京:化学工业出版社,2008:10.
[23]Laine R,Salminen S,Benno Y,et al.Performance of bifidobacteria in oat-based media[J].Int J Food Microbiol,2003,83(1):105-109.
[24]Kedia G,Vázquez JA,Charalampopoulos D,et al. In vitro fermentation of oat bran obtained by debranning with a mixed culture of human fecal bacteria[J].Curr Microbiol,2009,58(4):338-342.
The effect of different doses of oat β-glucan on serum blood glucose and lipid of high fat induced rats
/SUN Juan, ZHANG Mei-fang, GE Sheng, et al//China Medical Equipment,2017,14(1):111-116.
Objective: To investigate the effect of different doses of oat β-glucan on serum blood glucose and lipid of high fat induced rats, and find out its related mechanism. Methods: The 50 male SD rats were divided into 5 groups: Normal control group, High fat feed group, β-glucan (low dosage) LD group, β-glucan (moderate dosage) MD group and β-glucan (high dosage) HD group. With continuous feed for 14 weeks, the glucose tolerance of the rats were detected by glucose tolerance test (GTT), and the blood glucose area under curve (AUC) were calculated. After GTT, the rats were continuously feed for 1 week and then were euthanized. The fasting blood glucose (FBG), serum total cholesterol (TC), triglyceride (TG), low density lipoprotein cholesterol (LDL-C), high density lipoprotein cholesterol (HDL-C), free fatty acid (FFA), fasting serum insulin (FINS), Adiponectin and Glucagon-like peptide 1(GLP-1) were detected, and the homeostasis model assessment of insulin resistance index (HOMA-IR) were counted. Results: The results showed that the 30 min peripheral blood glucose of β-glucan LD group was significantly higher than normal control group and high fat feed group (95% CI were 0.00~2.23 and 0.25~2.25, respectively; P<0.05); the 120 min peripheral blood glucose of β-glucan LD and MD groups were significantly higher than the normal control group (95% CI were 0.82~3.57 and 0.28~2.90, respectively; P<0.05); both of the GTT detection results between β-glucan HD group and normal control group and between HG group and high fat feed group were no significant difference (P>0.05), respectively. The AUC of β-glucan LD group was significantly higher than high fat feed group (95% CI was 0.56~4.40; P<0.05); the TC of the β-glucan LD group was higher than normal control group and high fat feed group (95%CI was 0.10~0.80 and 0.01~0.64, respectively; P<0.05); the LDL-C of β-glucan LD group was significantly higher than normal control group and high fat feed group (95% CI was 0.03~0.13,0.01~0.10; P<0.05); the serum GLP-1 of other groups were no differences with normal control group and high fat feed group(P>0.05). Conclusion: The low dosage of oat β-glucan can reduce the ability of blood glucose regulation function of experiment rats and increase the level of TC and LDL-C in fasting serum.
Oat β-glucan; Serum lipid; Fasting blood glucose; GTT; GLP-1
10.3969/J.ISSN.1672-8270.2017.01.034
1672-8270(2017)01-0111-06
R587.1
A
2016-08-07
上海高校青年教师培养资助计划(ZZjdyx13113)“β-葡聚糖对糖尿病大鼠体内GLP-1及DPP-4作用的研究”
①上海交通大学医学院附属第九人民医院营养科 上海 200011
②上海交通大学附属第六人民医院临床营养科 上海 200233
*通讯作者:xjwan1107@163.com
孙娟,女,(1984- ),硕士,营养师。上海交通大学医学院附属第九人民医院营养科,从事营养与代谢性疾病研究工作。
