Ento-Ia涂膜剂经皮给药对小鼠急性不完全性脑缺血的保护作用
2017-02-14杨自忠赵海荣张成桂
朱 凤 胡 园 刘 衡,3 肖 怀,3 杨自忠,3 赵海荣,3 张成桂,3 何 苗,3*
1.昆虫生物医药研究院云南省昆虫生物医药研发重点实验室,大理大学,云南 大理 671000;2.药用特种昆虫开发国家地方联合工程研究中心,云南 大理 671000;3.中国西南药用昆虫及蛛形类资源开发利用2011协同创新中心,大理大学,云南 大理 671000
Ento-Ia涂膜剂经皮给药对小鼠急性不完全性脑缺血的保护作用
朱 凤1,2胡 园1,2刘 衡1,2,3肖 怀1,2,3杨自忠1,2,3赵海荣1,2,3张成桂1,2,3何 苗1,2,3*
1.昆虫生物医药研究院云南省昆虫生物医药研发重点实验室,大理大学,云南 大理 671000;2.药用特种昆虫开发国家地方联合工程研究中心,云南 大理 671000;3.中国西南药用昆虫及蛛形类资源开发利用2011协同创新中心,大理大学,云南 大理 671000
目的:通过复制小鼠急性不完全性脑缺血模型,研究Ento-Ⅰa涂膜剂对脑缺血的保护作用。 方法:140只小鼠分为2批进行实验,每批70只。将70只小鼠随机分为7组,每组10只,分别为假手术组、Ento-Ⅰa涂膜剂组(37.50mg·kg-1、18.75mg·kg-1、9.38mg·kg-1)、生理盐水模型组、基质模型组、尼莫地平组(18mg·kg-1,ig)。Ento-Ⅰa涂膜剂预防给药7 d后,测定小鼠结扎双侧颈总动脉带迷走神经后的存活时间及其脑组织SOD活性、MDA含量、EB含量。 结果:Ento-Ⅰa涂膜剂在剂量为18.75 mg·kg-1时,可以明显延长小鼠结扎双侧颈总动脉带迷走神经后的存活时间(P<0.05),延长率为39.55%;在剂量为37.50mg·kg-1时效果最佳(P<0.01),小鼠存活时间的延长率为45.15%,与阳性药尼莫地平(18 mg·kg-1,延长率43.96%)相当。与基质模型组比较,Ento-Ia涂膜剂18.75、37.50 mg·kg-1剂量组均可提高脑组织内SOD活性并能减少MDA含量(中剂量组,P<0.05;高剂量组P<0.01);同时,Ento-Ia涂膜剂能显著降低小鼠急性不全性脑缺血小鼠脑组织EB含量(P<0.05)。结论:Ento-Ia涂膜剂经皮给药可对小鼠急性不完全性脑缺血诱发的脑损伤有明显的保护作用,其机制可能通过干预脑缺血后脑组织的氧化应激及其保护血脑屏障有关。
Ento-Ia涂膜剂;经皮给药;急性不完全性脑缺血;存活时间;脑保护
卒中是人类致死和致残的主要原因之一[1],急性缺血性卒中(Acute Ischemic Stroke,AIS)约占全部卒中的80%。然而大多数情况下是非致死性卒中,长期残疾构成人类的重大负担[2]。AIS治疗的关键在于尽早开通阻塞血管、挽救缺血半暗带,然而,基于脑缺血的病理过程涉及复杂的时间和空间级联反应[3],目前有关缺血性脑血管疾病的临床治疗依然存在很多问题,因此开发保护缺血性脑损伤的药物也同样具有重要的理论意义和临床价值[4]。同时,在急性脑卒中过程中的脑保护及神经保护作用对于发病机制的研究是一项重大挑战[5-7]。Ento-Ia是Ento-Ⅰ的同源性物质,在现代应用中可治疗中风偏瘫后遗症患者[8],前期研究发现Ento-I具有防治脑血栓生成、恢复脑瘫动物活动能力[9]、抗血小板聚集、减轻脑梗死面积[10]等作用,可用于制备防治心脑血管疾病创新生化药物,用以预防和治疗缺血性心脑血管等疾病,例如心梗、心血管血栓、脑血栓、脑梗、急/慢性脑卒中。本文通过采用小鼠双侧颈总动脉带迷走神经结扎法观察小鼠存活时间、小鼠脑组织超氧化物歧化酶(Superoxide Dismutase,SOD)活性、丙二醛(Malondialdehyde,MDA)含量的变化及通过测定脑组织伊文思蓝(EB)含量,检测小鼠的脑毛细血管通透性,以此初步评价Ento-Ia涂膜剂对小鼠急性不完全性脑缺血的保护作用,为临床应用和新药研发提供科学依据。
1 材料与方法
1.1 实验动物与试剂 动物:雄性昆明种小鼠140只(由昆明医科大学实验动物中心提供,动物许可证编号:SCKX(滇)2011-0004),体重18~22 g。
试剂:尼莫地平组(拜耳医药保健有限公司,批号:BJ22848);川芎嗪(针剂,哈尔滨三联药业有限公司,批号:121101A3);Ento-Ⅰa涂膜剂(大理大学昆研院自制);超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所,批号:20141011)、丙二醛(MDA)试剂盒(南京建成生物工程研究所,批号:20140422)。
1.2 实验方法
1.2.1 实验分组及给药 实验分为2批,每批70只小鼠,共140只。第一批用于测定Ento-Ia涂膜剂对小鼠急性不完全性脑缺血后的存活时间及脑缺血后小鼠脑组织中SOD、MDA含量的变化,第2批用于测定Ento-Ⅰa涂膜剂对急性不完全性脑缺血小鼠脑毛细血管通透性的影响。将70只小鼠平均分为7组,每组10只,分别是假手术组、生理盐水模型组、基质模型组、尼莫地平组(18mg·kg-1,ig);Ento-Ⅰa涂膜剂37.50、18.75、9.38mg·kg-1剂量组。实验前将Ento-Ⅰa涂膜剂组及基质涂膜剂组用人用脱毛膏在小鼠太阳穴两侧部位进行脱毛,7组小鼠分别按照实验分组及各组相应的给药剂量预防给药7d,其中生理盐水对照组及尼莫地平组灌胃给药;Ento-Ⅰa涂膜剂高、中、低剂量组及基质组按照相应的含药量太阳穴涂抹给药,30μL/只。
1.2.2 Ento-Ia涂膜剂经皮给药小鼠急性不完全性脑缺血后存活时间及小鼠脑组织中SOD、MDA含量的影响 造模方法:将小鼠用乙醚在密闭的玻璃缸中进行浅麻醉,用小动物手术器械仔细分离出双侧颈总动脉,并在左侧及右侧颈总动脉带迷走神经下穿过1根5-0号手术线,结扎两侧颈总动脉带迷走神经造成小鼠急性不完全性脑缺血[11-12]。假手术组只分离双侧颈总动脉,不结扎。
记录结扎双侧颈总动脉后各组小鼠的存活时间。待小鼠死亡后开颅取脑,去除嗅球、小脑和延髓,脑组织匀浆后离心取上清,置于-80℃保存,按照试剂盒说明书分别测定脑组织中MDA含量和SOD活性。MDA含量测定采用硫代巴比妥酸法按操作步骤进行,于532nm处测定吸光度;SOD活性采用黄嘌呤氧化酶法测定,于550nm处测定吸光度,考马斯亮蓝法测定蛋白含量[13]。
1.2.3 Ento-Ia涂膜剂经皮给药急性不完全性脑缺血对小鼠脑毛细血管通透性的影响 绘制标准曲线:将伊文思蓝配制成系列浓度(0.39、0.78、1.56、3.12、6.24、12.48、24.96μg/mL),在分光光度计620 nm处测定吸光度(A)值。以浓度为横坐标、吸光度(A)值为纵坐标,得回归直线方程:Y=0.0892X-0.005,R2=0.9975。
1.2.4 小鼠脑缺血后脑中伊文思蓝含量的测定 分组及给药方法同上,并按“1.2.2”项方法进行造模。末次给药后1h,假手术组小鼠尾静脉注射伊文思蓝(50mg·kg-1),5min后分离双侧颈总动脉带迷走神经,但不结扎,其余各组小鼠在结扎两侧颈总动脉带迷走神经前5min尾静脉注射伊文思蓝(50mg·kg-1),2h后断头,小心剥取两侧大脑半球,称湿重(去小脑、延髓),加入0.5%硫酸钠溶液3mL与丙酮7mL匀浆,密封放置1h,3000rpm离心10min,取上清液,以丙酮︰0.5%硫酸(7:3)混合液调零,620nm处测定吸光度。根据标准曲线计算出脑内伊文思蓝的含量(μg/g脑湿重)。
2 统计方法
3 实验结果
3.1 Ento-Ia涂膜剂经皮给药对小鼠结扎双侧颈总动脉带迷走神经后存活时间的影响 生理盐水模型组与基质模型组比较,小鼠存活时间无统计学差异(P>0.05);假手术组小鼠剥离颈总动脉和迷走神经,小鼠正常存活,说明手术操作对小鼠的存活无影响。与生理盐水组比较,尼莫地平组(18 mg·kg-1)可以显著延长小鼠急性不完全性缺血后的存活时间,其延长率为43.96%;与基质模型组比较,Ento-Ⅰ涂膜剂不同剂量组均可以延长脑缺血小鼠的存活时间,Ento-Ia涂膜剂低剂量组延长率为21.64%,中剂量组为39.55%,高剂量组为45.15%,药效呈现一定的剂量关系。提示Ento-Ia通过经皮给药途径可以明显延长小鼠急性不完全性缺血存活时间。见表1。

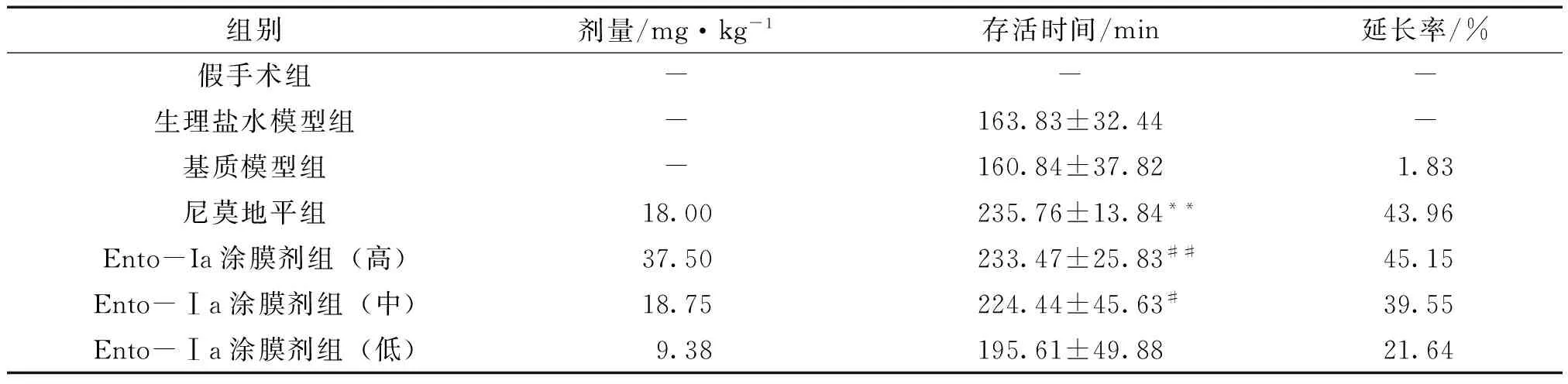
组别剂量/mg·kg-1存活时间/min延长率/%假手术组---生理盐水模型组-163.83±32.44-基质模型组-160.84±37.821.83尼莫地平组18.00235.76±13.84**43.96Ento-Ia涂膜剂组(高)37.50233.47±25.83##45.15Ento-Ⅰa涂膜剂组(中)18.75224.44±45.63#39.55Ento-Ⅰa涂膜剂组(低)9.38195.61±49.8821.64
注:与生理盐水模型组组比较,**P<0.01,#P<0.05;与基质模型组比较,##P<0.01。
3.2 Ento-Ia涂膜剂对脑缺血小鼠脑组织SOD活力、MDA含量的影响 生理盐水模型组与基质模型组比较,小鼠脑内SOD和MDA含量变化无统计学差异(P>0.05);两组模型组与假手术组相比,SOD活力均显著性下降、MDA含量均显著性升高(P<0.01),证明小鼠结扎颈总动脉造模形成的急性脑缺血,引发了机体SOD活力的迅速降低及MDA含量的迅速升高。与生理盐水组比较,尼莫地平组可以显著提高脑组织SOD活力、降低MDA含量(P<0.01);与基质模型组比较,Ento-Ia涂膜剂37.50、18.75、9.38 mg·kg-1剂量组能升高SOD的活力、降低MDA的含量,结果呈现一定的剂量依赖性,其中Ento-Ia涂膜剂高剂量组最明显(P<0.01),且与假手术组差异无统计学意义。见表2。

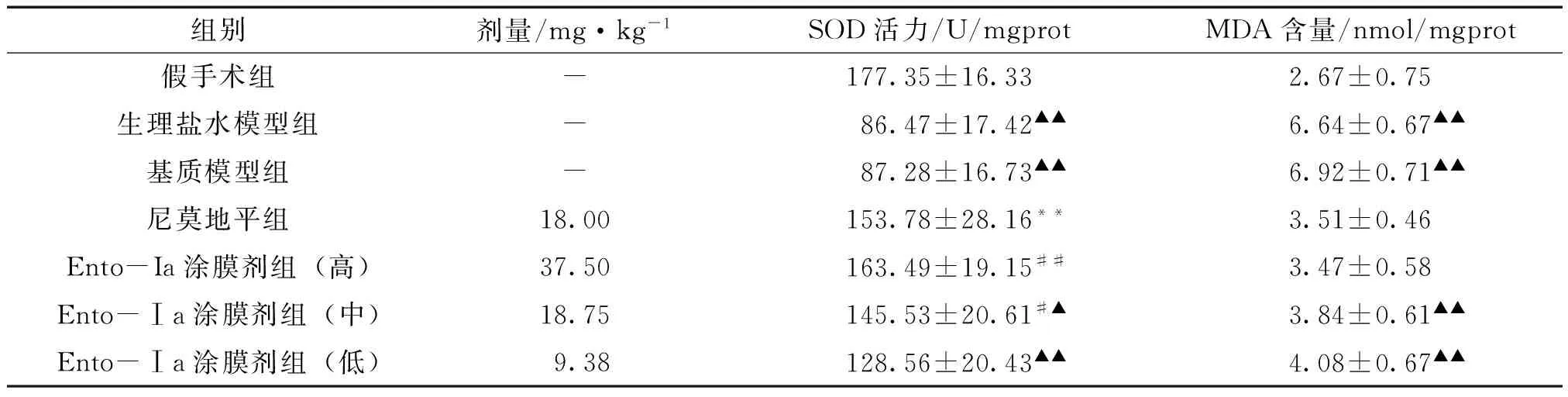
组别剂量/mg·kg-1SOD活力/U/mgprotMDA含量/nmol/mgprot假手术组-177.35±16.332.67±0.75生理盐水模型组-86.47±17.42▲▲6.64±0.67▲▲基质模型组-87.28±16.73▲▲6.92±0.71▲▲尼莫地平组18.00153.78±28.16**3.51±0.46Ento-Ia涂膜剂组(高)37.50163.49±19.15##3.47±0.58Ento-Ⅰa涂膜剂组(中)18.75145.53±20.61#▲3.84±0.61▲▲Ento-Ⅰa涂膜剂组(低)9.38128.56±20.43▲▲4.08±0.67▲▲
注:与生理盐水模型组组比较,**P<0.01;与基质模型组比较,#P<0.05,##P<0.01;与假手术组比较,▲P<0.05,▲▲P<0.01。
3.3 Ento-Ia涂膜剂对脑缺血小鼠脑毛细血管通透性的影响 小鼠脑缺血后脑中伊文思蓝的含量可表示脑毛细血管的通透性。与假手术组相比,模型组小鼠脑缺血后脑中伊文思蓝含量明显增高(P<0.01),说明小鼠急性非完全性脑缺血模型造模成功;与模型组比较,Ento-Ⅰa涂膜剂太阳穴给药能显著降低小鼠脑缺血后脑中伊文思蓝含量(P<0.05)。实验结果提示,Ento-Ⅰa涂膜剂太阳穴给药可以显著降低小鼠脑缺血后的脑毛细血管的通透性,从而具有强效的脑缺血保护作用。见表3。


组别剂量/mg·kg-1小鼠大脑EB含量/μg/g假手术组-7.58±0.33生理盐水模型组-11.27±0.88▲▲基质模型组-11.46±0.71▲▲尼莫地平组18.008.56±2.23**Ento-Ⅰa涂膜剂组(高)37.508.78±2.41#Ento-Ⅰa涂膜剂组(中)18.759.58±1.82#▲Ento-Ⅰa涂膜剂组(低)9.3810.43±1.78▲▲
注:与生理盐水模型组组比较,*P<0.05;与基质模型组比较,#P<0.05;与假手术组比较,▲P<0.05,▲▲P<0.01。
4 讨论
4.1 脑缺血的发病机制 缺血性脑血管病属于中医“中风”范畴,多起病较缓,静态发病,大多清醒,无头痛呕吐等症状。中风主要是由脉络闭阻、气血逆乱和脏腑气机失调等引起[14]。缺血性脑血管疾病的病因和缺血后脑损伤机制至今尚未完全阐明,而治疗上又存在着临床疗效有限、时间窗窄及治疗副作用大等一系列难题,针对这些难题寻找新的、更有效的治疗方法就成为了亟待解决的科学问题[15]。而大脑对缺血极为敏感,短期脑缺血即能导致一系列的功能及代谢紊乱。脑缺血导致脑梗死后可能引发能量损耗[16]、酸中毒[17]、细胞内Ca2+超载[18]、兴奋性氨基酸毒性作用[19]、氧化应激[19-20]和自由基损伤[25]、炎症[21]和细胞凋亡[22]等继发性脑损伤,这几种因素之间相互作用、相互影响,构成复杂的调控网络,形成恶性循环,造成一系列病理级联反应,继而导致病情加重[23]。
4.2 脑缺血模型的制作及缺血后自由基的生成 本实验复制小鼠急性不完全性脑缺血损伤模型[10],由于血流的突然阻断,组织严重缺氧,微循环血流障碍,最终导致供血区脑组织异常、坏死,以此来模拟临床急性脑缺血患病的过程。小鼠急性脑缺血后存活时间不符合正态分布,在结果处理中采用非参数检验的方式对其进行统计分析[24]。
另有研究表明,氧化应激是脑缺血再灌注后最早出现和最重要的损伤机制[25-27]。正常情况下,机体所产生的少量氧自由基,很快就会被体内的自由基清除系统迅速清除,不会造成细胞、组织及机体损伤。脑缺血再灌注时所产生的大量自由基,如果体内SOD等抗氧化酶的清除能力下降,将会导致氧自由基大量堆积,引发细胞膜的脂质过氧化,从而破坏膜的结构和功能。MDA是脂质过氧化终产物,可间接反映出机体受自由基攻击的严重程度。本研究表明,Ento-Ⅰa可升高脑缺血后脑组织内SOD活力及明显降低脑组织内MDA含量,即Ento-Ia可减轻脑缺血引起的脂质过氧化损伤。另外,实验亦表明,Ento-Ia涂膜剂可显著延长小鼠急性不完全性脑缺血的存活时间。
4.3 血脑屏障对脑组织的保护作用 Ento-Ia涂膜剂对脑缺血后脑组织的保护作用可能和其减轻血脑屏障(BBB)的损伤有关[10]。BBB是存在于血液和脑组织之间的一道屏障,对维持中枢神经系统内环境的稳定起重要作用。伊文思蓝为脑血管通透性指示剂,正常情况下不易通过血脑屏障,但血脑屏障受到破坏时,伊文思蓝易于进入脑组织。本实验应用伊文思蓝为示踪剂,通过测定各组小鼠脑缺血后脑中伊文思蓝含量,观察药物对急性不完全性脑缺血小鼠断头后脑毛细血管通透的影响,进而评价其对脑缺氧动物的脑保护功效。
综上所述,Ento-Ia涂膜剂可以有效延长小鼠双侧颈总动脉结扎后小鼠存活时间、升高SOD活性及降低MDA含量,并具有降低脑缺血损伤小鼠脑毛细血管通透性的作用。但是,本实验只是通过小鼠急性不完全性脑缺血这一种模型来验证Ento-Ia涂膜剂的药效,并不能完全涵盖脑缺血的临床病因,关于Ento-Ia对不同原因所致脑缺血的保护作用及相应的作用机制,我们会在后期研究中继续深入探讨。
目前由Ento-Ia毒素制备的透皮吸收制剂治疗脑缺血的药效研究工作正在开展,前期研究表明Ento-Ia毒素可减少MCAO-I/R大鼠脑梗死面积,可能是恢复大鼠大脑皮质区血流。提示其可用于临床治愈瘫痪、失语的中风病人,其机制可能与Ento-Ia毒素的抗凝、溶栓及其透过血脑屏障有关。因此下一步的工作是确定抗脑缺血的Ento-Ia毒素的组分及其抗脑缺血的机制。
致谢:云南省昆虫及蛛形类资源开发利用工程实验室长期致力于昆虫生物药物的研发,在昆虫药物治疗心脑血管疾病的研究方面拥有丰富的经验,本实验的条件由工程实验室药理药效学研究平台提供,非常感谢实验室老师对于本实验的指导、同学对于本实验的帮助。
[1] Murray C J L, Lopez A D.Measuring the global burden of disease.[J].New England Journal of Medicine, 2013, 369(5): 448-457.
[2] Who B.The Global Burden of Disease: 2004 Update[J].Global Burden of Disease Update, 2010, 13(12):1-146.
[3] Rosso C, Samson Y.The ischemic penumbra: the location rather than the volume of recovery determines outcome.[J].Current Opinion in Neurology, 2014, 27(1):35-41.
[4] 伍文彬,谢淑玲,杨昆,等.芪红脑苏汤对急性不完全性脑缺血模型大鼠的脑保护作用[J].实用医院临床杂志,2015,12(2):24-26.
[5] Bouchard H, Bourzat JD, Commeron A.Methods of treating cell lines expressing multidrug resistance P-glyco-protein: US, 6372780[P].2002-04-06.
[6] Oudard S.TROPIC: Phase III trial of cabazitaxel for the treatment of metastatic castration-resistant prostate cancer[J].Future Oncology, 2011, 7(4):497-506.
[7] 王志宏,钟旭丽.抗前列腺癌新药卡巴他赛的药理与临床评价[J].中国新药杂志,2011,20(9):763-765.
[8] 李全良,唐菊芬.蜂针治疗中风后遗症多组穴位交替临床观察[C].// 首届全国中医蜂疗临床技术推广暨学术研讨会论文集.2009.
[9] 冯锐,王音,朱凤,等.Ento-Ⅰ涂膜剂的镇痛及其抗凝抗血栓形成作用[J].国际药学研究杂志,2016,43(3):509-513.
[10]金凡茂,张枝雪,王音,等.Ento-Ⅰ涂膜剂对大鼠脑缺血再灌注损伤的保护作用[J].国际药学研究杂志,2016,43(3):504-508,528.
[11] 徐丽星,尹竹君,张国清,等.心脑欣胶囊对小鼠脑缺血的保护作用[J].中国新药杂志,2014,23(15):1801-1805,1785.
[12] 李晓宇,涂长春,邱常青,等.己酮可可碱对小鼠急性脑缺血的保护作用研究[J].江西医学院学报,2003,43(6):37-39.
[13] 马昂,周宇,杨立朝,等.非诺贝特对小鼠急性局灶性脑缺血再灌注损伤的保护作用[J].中国药学杂志,2012,47(13):1042-1047.
[14] 黄真,张纬萍,魏佳平,等.归芪饮对小鼠急性脑缺血的保护作用[J].中国现代应用药学,2004,21(2):110-114.
[15] 董贝贝.血红素结合蛋白对大鼠局灶性脑缺血再灌注损伤的保护作用研究[D].西安:第四军医大,2013.
[16]Matsuo Y,Aoki M,Kawagoe J,et al.Pathophysiology of cerebral ischemia[J].Tanpakushitsu Kakusan Koso, 1992, 37(8):1382-1393.
[17]Obrenovitch T P, Scheller D, Matsumoto T, et al.A rapid redistribution of hydrogen ions is associated with depolarization and repolarization subsequent to cerebral ischemia reperfusion[J].Journal of Neurophysiology, 1990, 64(4):1125-33.
[18] 杨惠玲.高级病理生理学[M].北京:科学出版社,2006:24-38.
[19] Cherubini A, Polidori M C, Bregnocchi M, et al.Antioxidant profile and early outcome in stroke patients[J].Stroke, 2000, 31(10):2295-300.
[20] Chang C Y, Chen J Y, Ke D, et al.Plasma levels of lipophilic antioxidant vitamins in acute ischemic stroke patients: correlation to inflammation markers and neurological deficits[J].Nutrition, 2005, 21(10):987-992.
[21] Albent l.,Ranliang Hu, Reza Hakimelahi, et al.CT Angiography Source Images Acquired with a Fast-Acquisition Protocol Overestimate Infarct Core on Diffusion Weighted Images in Acute Ischemic Stroke[J].Journal of Neuroimaging Official Journal of the American Society of Neuroimaging, 2011, 22(4):329-335.
[22] Kaushal V, Schlichter L C.Mechanisms of microglia-mediated neurotoxicity in a new model of the stroke penumbra.[J].Journal of Neuroscience the Official Journal of the Society for Neuroscience, 2008, 28(9):2221-30.
[23] 许莉.KZF(抗中风胶囊)对缺血性脑中风鼠的治疗作用及机制[D].苏州:苏州大学,2012.
[24] 王音,何苗,李秀芳,等.非参数统计方法在抗脑缺血药物药效学评价中的应用探讨[J].中国生化药物杂志,2016,36(7):170-172.
[25] Nita D A, Nita V, Spulber S, et al.Oxidative damage following cerebral ischemia depends on reperfusion-a biochemical study in rat.[J].Journal of Cellular & Molecular Medicine, 2001, 5(2):163-170.
[26] Chrissobolis S, Miller A A, Drummond G R, et al.Oxidative stress and endothelial dysfunction in cerebrovascular disease[J].Frontiers in Bioscience, 2011, 16(5):1733-1745.
[27] Mei G, Shi L L, Zhang H A, et al.Therapeutic Effect of Edaravone in Transient Global Brain Ischemia/Reperfusion Rats[J].Journal of Chinese Pharmaceutical Sciences, 2011, 46(12):932-936.
(编辑:梁志庆)
The Protect of Ento-Ⅰa Plastic on Acute Incomplete Cerebral Ischemia by Mice
ZHU Feng1,2HU Yuan1,2LIU Heng1,2,3XIAO Huai1,2,3YANG Zizhong1,2,3ZHAO Hairong1,2,3ZHANG Chenggui1,2,3HE Miao1,2,3*
1.Yunnan Provincial Key Laboratory of Entomological Biopharmaceutical R&D, Institute of Entomoceutics Research, Dali University, Dali 671000, China;2.National-Local Joint Engineering Research Center of Entomoceutics, Dali 671000, China;3.Yunnan Provincial 2011 Collaborative Innovation Center for Entomoceutics, Dali University, Dali 671000, China
Objective To investigote the protective effect of Ento-Ⅰa Plaster on acute mice incomplete cerebral ischemia.Methods 140 mice were divided into two batches to carry on the experiment, each batch 70.70 rats were randomly divided into 7 groups, 10 in each group, the sham operation group, the Ento-Ⅰa coating group (37.50mg·kg-1、18.75mg·kg-1、9.38mg·kg-1), the saline model group, the matrix model group, the nimodipine group (18 mg·kg-1, ig).Ento-Ia plastic was given prophylactically for 5 days, establishment mice acute incomplete cerebral ischemia model by total bilateral carotid artery ligation in mice with vagus nerve, record survival time of mice after ischemia and the determination of mouse brain tissue SOD activity, MDA content and the content of Evans blue.Results This research shows that Compared with the model group matrix, Ento-Ia plastic can significantly prolong the survival time of mice after ligation of bilateral common carotid artery with vagus nerve at a dose of 18.75 mg·kg-1(P<0.05), the extension rate was 39.55%; At a dose of 137.50 mg·kg-1, the effect was the best(P<0.01), prolonged survival time of mice was 45.15%, compared with the positive drug nimodipine (18mg·kg-1, the elongation rate of 43.96%).Compared with the matrix model group, Ento-Ia plastic at the dose of 18.75 and 37.50mg·kg-1dose group could increase the brain tissue SOD activity and reduce MDA content (middle dose group,P<0.05; high dose groupP<0.01).At the same time, Ento-Ia plastic can significantly reduce the cerebral capillary permeability (P<0.05), which is equivalent to the nimodipine group (P>0.05).Conclusion Ento-Ⅰa plastic has obvious protective effect for transdermal delivery of mice with acute incomplete cerebral ischemia induced brain injury, its mechanism may be through the intervention of brain tissue of cerebral ischemia oxidative stress and protection of BBB.
Ento-Ia Plastic; Transdermal Drug Delivery; Acute Incomplete Cerebral Ischemia; Survival Time; Cerebral Protection
2016-11-30
云南省科技厅、云南省应用基础研究计划重点项目(2014FA007);国家自然科学基金(81260475);国家自然科学基金(81360679)。
朱凤(1993-),女,汉族,硕士研究生,研究方向为药剂学。E-mail:18255380707@163.com
何苗(1983-),女,白族,研究实习员,研究方向为天然药物研究与开发。E-mail:mio_h@163.com
R743.31
A
1007-8517(2017)02-0047-05
