乳化-溶剂挥发法制备乙基纤维素/萘普生复合微球
2017-02-11孙佩佩陈金伟2商士斌张开涛2
孙佩佩,陈金伟2,商士斌,王 丹∗,张开涛2
(1.中国林业科学研究院 林业新技术研究所,北京 100091;2.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,江苏 南京 210042)
乳化-溶剂挥发法制备乙基纤维素/萘普生复合微球
孙佩佩1,2,陈金伟2,商士斌1,2,王 丹1,2∗,张开涛2
(1.中国林业科学研究院 林业新技术研究所,北京 100091;2.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,江苏 南京 210042)
以乙基纤维素(EC)为载体材料,萘普生为包埋药物,采用O/W型乳化-溶剂挥发法制备了包封率较高的EC/萘普生复合载药微球,利用正交试验优化制备工艺,得出当EC与萘普生的质量比为3∶1,EC用量2.5%,聚乙烯醇用量0.8%,吐温-80用量0.4%时是复合微球的最佳制备工艺,在该工艺条件下药物包封率达到88.97%。通过扫描电子显微镜(SEM)、激光粒度分析、傅里叶变换红外光谱(FT-IR)对复合微球的形态和结构进行了分析表征。SEM显示复合微球的形态顺滑,激光粒度分析表明复合微球平均粒径为14.014μm,复合微球的FT-IR谱图中既有EC的特征峰,又有萘普生的特征峰,但没有新基团产生,表明EC包覆萘普生过程中未产生新化合物。体外释放实验表明复合微球的累积释药率随溶出介质pH值的增大而增大,在溶出介质pH值为9时,复合微球的累积释药率最大,达到82.5%,缓释性能较好。
乙基纤维素;萘普生;复合微球;包封率;缓释
乙基纤维素(EC)是将纤维素的部分羟基乙基化的烷基醚类产品,属于纤维素衍生物中的非离子型纤维素醚[1],可溶于有机溶剂而一般不溶于水。在工业上,通常利用醚化试剂氯乙烷与碱纤维素反应制备EC,EC的来源十分丰富,同时具有无毒、生物相容性好、可再生、化学性质比较稳定等诸多优点,这些优点使其在药剂中被广泛应用,常被用作药物骨架材料[2-3]、薄膜包衣材料[4-5]、载体[6]、微胶囊囊材[7-8]等。萘普生属于非甾体药物,具有解热、镇痛、抗炎的作用,对于类风湿性关节炎、脊椎炎、骨关节炎等疾病有一定的疗效[9]。萘普生的口服作用比较迅速,见效快,但服用后其浓度在胃中快速达到峰值,阻碍可以保护胃黏膜的内源性前列腺素的合成,进而损坏胃黏膜[10],导致出现胃灼烧等不良反应,对胃的刺激作用非常大。载药微球是备受研究者青睐的一种给药体系,是将药物溶解或分散在合适的高分子材料中,制成包裹药物的微米级球状体[11]。陈莉敏等[12]利用富凝聚法以壳聚糖为载体制备了萘普生微球,在最佳制备工艺下,萘普生的包封率为52.18%。如果利用EC将萘普生包埋制成载药微球,EC对它具有一定的保护和缓释等作用,这样既会降低对胃的刺激作用,又会合理控制萘普生的释放,延长作用时间,具有十分重要的临床意义。载药微球的制备方法一般有乳化-溶剂挥发法[13]、喷雾干燥法[14-15]、超临界流体技术[16]等。本研究以萘普生为芯材、EC为壁材采用水包油(O/W)型乳化-溶剂挥发法制备了EC/萘普生复合微球,通过正交试验优化了制备工艺,并通过扫描电子显微镜(SEM)、激光粒度分析仪、傅里叶变换红外光谱(FT-IR)等对复合微球进行了表征,同时考察了在不同pH值溶出介质中复合微球的缓释性能。
1 材料与方法
1.1 主要原料及仪器
乙基纤维素(EC)、萘普生、二氯甲烷、吐温-80、1799型聚乙烯醇、有机硅消泡剂BYK094、氢氧化钠、盐酸,实验所用水均为去离子水。
3400NI扫描电子显微镜(SEM),日本日立公司;Nicolet iS10傅里叶变换红外光谱(FT-IR)仪,美国赛默飞世尔公司;APA 2000激光粒度分析仪,英国马尔文仪器有限公司;UV-2450紫外光谱(UV)仪,日本岛津公司;冷冻干燥机,宁波新芝生物科技股份有限公司。
1.2 制备方法
1.2.1 EC/萘普生复合微球的制备 准确称取一定量的吐温-80、聚乙烯醇(PVA)用300mL去离子水在90℃下溶解,向其中加入0.45 g有机硅消泡剂BYK094,作为外部水相;室温避光条件下将适量乙基纤维素、萘普生溶于50mL二氯甲烷,作为内部有机相;在9000 r/min下对外部水相进行高剪切,利用注射器将内部有机相于30min内滴加至水相中,滴加结束后继续高剪切5min,然后将混合液于室温、转速500 r/min的条件下避光敞口充分挥发二氯甲烷,制得EC/萘普生微球,用去离子水反复洗涤微球,最后冷冻干燥得到样品。
1.2.2 正交试验优化制备工艺 根据前期的实验,发现EC与萘普生的质量比、EC用量(EC占二氯甲烷的质量分数,下同)、聚乙烯醇用量(聚乙烯醇占水的质量分数,下同)、吐温-80用量(吐温-80占水的质量分数,下同)对复合微球的包封率有影响,故对该4个因素进行考察,每个因素取3个水平,以微球的包封率为考察指标,采用L9(34)正交表,设计正交试验。
1.3 包封率测定
1.3.1 标准曲线的绘制 精密称取适量的萘普生,溶于无水乙醇中,分别配制成质量浓度为0.02、0.04、0.06、0.08、0.10 g/L的萘普生乙醇溶液,采用紫外光谱仪在331nm处测定药物的吸光度,进行线性回归后,得到回归方程Cx=0.1214A+0.0007(Cx为萘普生的质量浓度,单位为g/L;A为吸光度),R=0.9994。
1.3.2 样品包封率测定 包封率指被包裹物质(萘普生)占药物总质量的百分比。精密称取适量EC/萘普生复合微球将其溶于无水乙醇,测定其吸光度,根据标准曲线得到萘普生的质量浓度Cx,进而计算得到复合微球中萘普生的质量。包封率按照如下公式进行计算:

式中:E—样品包封率,%;m0—萘普生的加入质量,g;m1—复合微球中萘普生的质量,g。
1.4 EC/萘普生微球的体外释药
将适量正交试验8条件下制备的复合微球分别分散于盛有去离子水的锥形瓶中,用0.1mol/L的NaOH或HCl调节pH值(pH值分别为3、5、7、9),在37±0.5℃、150 r/min下恒温振荡,定时取样,采用紫外光谱仪在331 nm处测定吸光度,根据回归方程计算不同时刻萘普生的溶出质量浓度,记为Ct(t为时间),计算复合微球的释药率。

式中:R—样品的释药率,%;Ct—t时刻萘普生的溶出质量浓度,g/L;V—缓释液的体积,L;m2—复合微球的加入量,g。
1.5 分析方法
1.5.1 SEM分析 利用SEM对复合微球的表面形貌进行表征。
1.5.2 激光粒度分析 考察复合微球的粒径分布。为避免测量过程中复合微球团聚造成较大误差,在测试前先将复合微球超声分散于去离子水中。
1.5.3 FT-IR分析 利用KBr压片法对EC、萘普生及EC/萘普生复合微球进行FT-IR分析。
2 结果与讨论
2.1 复合微球最佳制备工艺
对影响复合微球包封率的EC与萘普生的质量比、EC用量(EC占二氯甲烷的质量分数)、聚乙烯醇(PVA)用量(聚乙烯醇占水的质量分数)、吐温-80用量(吐温-80占水的质量分数)进行考察,每个因素取3个水平,设计正交试验,优化微球制备工艺,结果见表1。

表1 正交试验结果Table 1 Results of orthogonal experiment
由极差R值分析可知,4个因素对萘普生包封率的影响顺序为A>B>D>C,即对包封率影响最大的是EC与萘普生的质量比,其次是EC用量,接着是吐温-80用量和PVA用量。经计算分析之后,得出萘普生/EC复合微球最佳制备工艺是A3B2C1D1,即m(EC)∶m(萘普生)=3∶1,EC用量2.5%,PVA用量0.8%,吐温-80用量0.4%。研究发现,萘普生作为芯材,EC作为壁材,其相对含量的高低直接影响复合微球的包封率,且影响较大,吐温-80用量及PVA用量也对复合微球的包封率有一定的影响。在最佳制备工艺下进行3次验证实验,得到的复合微球的包封率分别为88.94%、88.97%、89.01%,平均值为88.97%。验证实验所得的包封率均高于正交试验中的包封率,说明该工艺的制备条件重现性较好。后续实验中,均选择正交试验8条件下制备的复合微球进行分析表征,并研究其体外释放性能。
2.2 复合微球的分析表征
2.2.1 SEM分析 在扫描电子显微镜下观察复合微球的表面形貌,结果如图1所示。由图1(a)可见,复合微球球型比较顺滑规整,微球之间稍有粘结,微球粒度分布不是特别均匀,但粒径大部分分布在1~10μm范围内,乙基纤维素对萘普生的包覆较好,微球没有破裂,因此该复合微球的制备工艺可以较好地包埋萘普生,进而实现减小萘普生对胃刺激的目的;此外,由图1(b)可见,微球表面存在轻微的褶皱,这是由于EC存在一定的亲水性,在溶剂挥发过程中,少量水进入乳滴内部,乳滴内部水含量增大导致油膜破损,使得微球固化后出现轻微的褶皱[17]。

图1 EC/萘普生复合微球的SEM图Fig.1 SEM images of EC/naproxen compositem icrospheres
2.2.2 粒径分析 微球的粒度分布利用激光粒度分析仪进行测定。图2为EC/萘普生复合微球的粒度分布及累积体积分数图。通过激光粒度分析得知复合微球的平均粒径为14.014μm,由累积曲线可见,粒径分布范围在1~10μm的微球体积分数占74.5%,说明复合微球的粒径主要分布在1~10μm,与SEM分析结果相似,但也有少数粒径较大的复合微球存在。影响复合微球粒径的因素有很多,导致部分微球粒径偏大的原因可能是机械搅拌过程中,有的乳滴偏大,溶剂含量高,溶剂挥发速度较慢且挥发不完全造成的。
2.2.3 FT-IR分析 图3为EC、萘普生及EC/萘普生复合微球的红外光谱图。

图2 乙基纤维素/萘普生复合微球的粒度分布(a)及累积体积分数(b)图Fig.2 The particle size distribution(a)and accumulative volum e fraction(b)of EC/naproxen compositem icrospheres
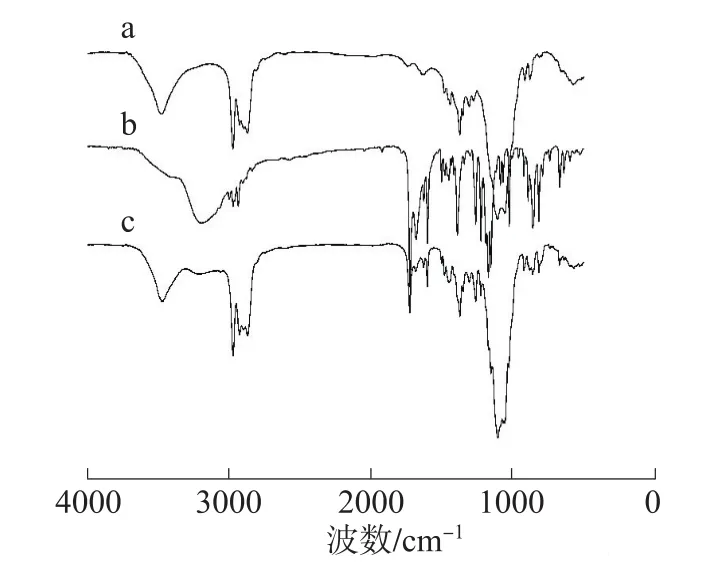
图3 乙基纤维素(a)、萘普生(b)及复合 微球(c)红外光谱图Fig.3 FT-IR spectra of EC(a),naproxen(b) and EC/naproxen com positem icrospheres(c)
在EC结构中,3479 cm-1处为EC中—OH的伸缩振动峰,1377 cm-1处为—CH3的特征吸收峰,同时在2975、2873cm-1处可看到—CH3的反对称、对称伸缩振动峰,1110cm-1处为C—O—C的伸缩振动吸收峰;在萘普生结构中,3195 cm-1处宽峰为—COOH中—OH的伸缩振动吸收峰,1728 cm-1处为—COOH中C=O的伸缩振动吸收峰,1157 cm-1为C—O—C的伸缩振动吸收峰;在EC/萘普生复合微球的FT-IR图谱中,既可看到EC的特征吸收峰,又可看到萘普生的特征吸收峰,但并未看到新基团的产生,所以可以认为EC成功包覆了萘普生,且包覆的过程中未产生新化合物。
2.3 EC/萘普生微球的释放性能研究
图4为以时间(t)为横坐标,累积释药率为纵坐标绘制的EC/萘普生微球的体外释放曲线图。由图可见,随溶出介质pH值升高,复合微球的释药率增大,这是由于在中性或偏碱性条件下,萘普生中的羧基呈离子态,可以加快萘普生的释放,且随着碱性增强更利于羧基的离子化,使得释药速度加快。此外,在前30min内,复合微球存在突释行为,在30~150min内萘普生的释放速度减缓,150min之后,释放量趋于平缓,实验发现,当溶出液pH值为9时,复合微球对萘普生的最大释放量为82.5%,比冯敏等[18]制备的萘普生核壳型共聚物纳米胶束的释药量高,故实验制备的复合微球的缓释性能较好,基本可以达到降低萘普生对胃刺激的目的。
3 结论
3.1 以乙基纤维素(EC)为壁材,萘普生为芯材,通过乳化-溶剂挥发法制备了EC/萘普生复合微球,通过正交试验筛选出较佳制备工艺为:EC与萘普生的质量比为3∶1,EC用量为2.5%,聚乙烯醇用量为0.8%,吐温-80用量为0.4%,经验证实验得出该工艺条件下复合微球的包封率为88.97%。
3.2 对复合微球进行了SEM、激光粒度分析及FT-IR分析,发现制备的复合微球圆滑规整,平均粒径为为14.014μm,EC包覆萘普生过程中未产生新化合物。
3.3 正交试验8条件下制备的复合微球中,EC对萘普生的包封率为88.80%,并考察了其在不同pH值下的体外释放情况,发现复合微球的累积释药率随溶出介质pH值的增大而增大,在溶出介质pH值为9时其累积释药率最大,最大释药率达到82.5%,表明所制备复合微球的缓释性能较好。

图4 EC/萘普生微球的体外释放曲线Fig.4 Drug releasing curves of EC/naproxen com positem icrospheres
[1]郭波红,程怡.乙基纤维素在缓控释药制剂中的应用研究[J].中医药学刊,2002,20(5):601-603.
[2]王秀丽,党晓芳,廖艳,等.乙基纤维素骨架缓释片处方工艺对水溶性药物释放的影响因素研究[J].药学实践杂志,2014,32 (2):116-117.
[3]INDIRAN PS,IRINA R,JAMESA S,etal.Sustained release theophylline tabletsby direct compression:Part1:Formulation and in vitro testing [J].International Journal Pharmaceutics,1998,164(1/2):1-10.
[4]SIEPMANN J,SIEPMANN F.Stability of aqueous polymeric controlled release film coatings[J].International Journal Pharmaceutics,2013,457(2):437-445.
[5]SHIP J,ZUO Y,ZOU Q,et al.Improved properties of incorporated chitosan film with ethyl cellulosemicrospheres for controlled release[J]. International Journal Pharmaceutics,2009,375(1/2):67-74.
[6]金刚,王洁,王涛,等.阿司匹林缓释固体分散体的制备及体外溶出度的研究[J].吉林化工学院学报,2014,31(3):35-37.
[7]SENGEL C T,HASCICEK C,GONUL N.Development and in-vitro evaluation ofmodified release tablets including ethylcellulosemicrospheres loaded with diltiazem hydrochloride[J].Journal of Microencapsulation,2006,23(2):135-152.
[8]DASM K,RAO K R.Evaluation of zidovudine encapsulated ethylcellulose microspheres prepared by water-in-oil-in-oil(w/o/o)double emulsion solvent diffusion technique[J].Acta Poloniae Pharmaceutica,2006,63(2):141-148.
[9]SHARA J,SINGLA A K,DHAWAN S.Zinc-naproxen complex:Synthesis,physicochemical and biological evaluation[J].International Journal of Pharmaceutics,2003,260(2):217-227.
[10]BROGDEN R N,HEEL R C,SPEIGHT TM.Naproxen up to date:A review of its pharmacological properties and therapeutic efficacy and use in rheumatic disease and pain states[J].Drugs,1979,18(4):241-277.
[11]OKADA H,TOGUCHIH.Biodegradablemicrospheres in drug delivery[J].Critical Reviews in Therapeutic Drug Carrier Systems,1995,12 (1):1-99.
[12]陈莉敏,李柱来,王津.萘普生缓释微球制备工艺及性能研究[J].天然产物研究与开发,2007,19(5):878-880,889.
[13]张敏,张丽叶.洛伐他汀聚乳酸缓释微球的制备及其体外释药[J].北京化工大学学报:自然科学版,2011,38(2):94-98.
[14]WANG F J,WANG C H.Sustained release of etanidazole from spray dried microspheres prepared by non-halogenated solvents[J].Journal of Controlled Release,2002,81(3):263-280.
[15]GAVINIE,CHETONIP,COSSU M,et al.PLGA microspheres for the ocular delivery of a peptide drug,vancomycin using emulsification/ spray-drying as the preparation method:In vitro/in vivo studies[J].European Journal of Pharmaceutics and Biopharmaceutics,2004,57 (2):207-212.
[16]张严之,李奎锋,黄婷,等.超临界流体技术制备5-氟尿嘧啶-吲哚美辛-聚乳酸缓释微球[J].复合材料学报,2011,28(1):21-25.
[17]曾烨婧,王连艳,马光辉,等.快速膜乳化法制备紫杉醇聚乳酸类微球[J].过程工程学报,2010,10(3):568-575.
[18]冯敏,吴伟荣,潘仕荣,等.萘普生核壳型共聚物纳米胶束的制备及特性[J].中国药学杂志,2002,37(7):509-512.
Preparation of Ethyl Cellulose/Naproxen Composite Microspheres Through Emulsion-solvent Evaporation Method
SUN Peipei1,2,CHEN Jinwei2,SHANG Shibin1,2,WANG Dan1,2,ZHANG Kaitao2
(1.Research Institute of Forestry New Technology,CAF,Beijing 100091,China;2.Institute of Chemical Industry of Forest Products,CAF;National Engineering Lab.for Biomass Chemical Utilization;Key and Open Lab.of Forest Chemical Engineering,SFA;Key Lab.of Biomass Energy and Material,Jiangsu Province,Nanjing 210042,China)
Ethyl cellulose/naproxen compositemicrospheres with high encapsulation efficiency were prepared by O/W emulsionsolvent evaporation method with ethyl cellulose as the carrier material and naproxen as the entrapped object.Orthogonal experimentwas used to optimize the preparation process.And the results indicated that the optimal conditionswere themass ratio of ethyl cellulose and naproxen 3∶1,ethyl cellulose addition 2.5%,polyvinyl alcohol addition 0.8%,Tween-80 addition 0.4%. Under these conditions,the encapsulation efficiency of naproxen was 88.97%.The morphology and structure of composite microsphereswere investigated by scanning electron microscope(SEM),laser granularity analyzer and Fourier transform infrared spectroscopy(FT-IR).The SEM observation showed that composite microspheres were smooth,and laser granularity analyzer demonstrated that themean diameter of particleswas 14.014μm.The FT-IR showed that the characteristic adsorption peaks of EC and naproxen all appeared in the spectrum ofmicrosphere and there was no new peak.This indicated no new compound generated during EC coating naproxen.The experiment of drug releasing indicated that the accumulative release rate increased with the increase of pH value of dissolutionmedium and reached themaximum of 82.5%at pH 9.And the compositemicrospheres showed better sustained release of drug.
ethyl cellulose;naproxen;compositemicrospheres;encapsulation efficiency;sustained release
TQ352.79
:A
:1673-5854(2017)01-0008-05
10.3969/j.issn.1673-5854.2017.01.002
2016-04-13
中国林科院中央级公益性科研院所基本科研业务费专项基金(CAFINT2015C01)
孙佩佩(1990—),女,山东烟台人,硕士生,研究方向为生物质资源化学与利用
∗通讯作者:王丹,男,研究员,博士,硕士生导师,研究方向为生物质资源化学与利用;E-mail:wgdan@163.com。
