外源酶对湖羊瘤胃微生物区系的影响
2017-02-10陈宇
陈 宇
(1.宁德出入境检验检疫局,福建 宁德 352100)
外源酶对湖羊瘤胃微生物区系的影响
陈 宇
(1.宁德出入境检验检疫局,福建 宁德 352100)
研究添加不同水平的外源酶(木聚糖酶和纤维素酶)对湖羊瘤胃液体外培养及瘤胃微生物体外培养区系的影响,旨在为外源酶作为湖羊饲料添加剂开发提供理论依据。结果表明:添加不同水平外源酶均能改善瘤胃微生物体外培养特性,其中以添加量为10 mg/kg处理组效果最佳,外源酶(10 mg/kg)可以有效提高培养液中细菌浓度(P<0.01),产甲烷菌浓度极显著降低(P<0.01),促进纤维素降解菌生长繁殖。
湖羊;外源酶;瘤胃微生物;体外培养;RT-PCR
由于20世纪80年代生物技术得到快速研究和实际应用,使酶制剂可以实现批量生产,降低成本,并得到广泛应用。在畜禽配合饲料中添加适量酶制剂,可以提高畜禽的采食量和饲料利用率,减少氮、磷排放量,降低畜禽养殖对环境污染程度。饲料中添加外源酶制剂在动物肠道内可以降解多糖,被包被的淀粉和多糖暴露在消化酶中,使不能被内源酶消化的养分可以被消化和利用[1],还会通过降低内源物质的损失而提高日粮营养价值[2]。有学者研究表明:在玉米-豆粕日粮中添加外源复合酶,可以有效提高生长猪生产性能[3];在生长育肥猪饲料中添加木聚糖酶可以有效提高饲料利用率和猪生长性能[4-6]。在绵羊高纤维日粮中添加外源复合酶,能够提高其纤维物质消化率及绵羊日增重[7]。
外源酶制剂在肠道内还可以降解饲料中植酸、酶抑制剂等抗营养物质,减少对内源酶的阻碍作用,提高酶活力,提高饲料消化率和营养物质利用率[8]。
本实验的目的是研究添加外源酶对湖羊瘤胃液微生物体外培养特性的影响,探讨添加不同水平外源酶、在不同培养时间点,体外培养液中微生物发酵水平,为进一步研究瘤胃液微生物的体外培养区系,为外源酶作为湖羊或其他反刍动物饲料添加剂开发提供理论依据。
1 材料与方法
1.1 材料
外源酶为纤维素酶和木聚糖酶,按照4∶1比例混合,均购自上海生物工程有限公司,纤维素酶和木聚糖酶酶活按照该公司的企业标准方法测定,纤维素酶酶活为22 525 IU,木聚糖酶酶活为24 200 IU;质量分数0.1%刃天青溶液。
1 mol/L KCl、2 mol/L MgCl2、1 mol/L葡萄糖、50 mg/ml X-Gal、24 g/L IPTG、100 g/L氨苄青霉素(Amp)、高纯质粒制备试剂盒、琼脂糖凝胶DNA回收试剂盒、UItraPower Pum-T快速克隆试剂盒、DNA DL2000 Marker、SYBR Green I试剂盒、96孔PCR板。
1.2 仪器设备
紫外分光光度计、恒温振荡水浴锅、电子天平、离心机、pHS-3D型酸度计、荧光定量PCR仪、凝胶成像系统、无菌操作台、箱式恒温摇床、平板电泳仪、涡旋混合器。
1.3 方法
1.3.1 瘤胃微生物培养液配制[9]
培养液A的配制:16.0 g FeCl3·6H2O、2.0 g CoCl2·6H2O、20 g MnCl2·4H2O 和26.4 g CaCl2·2H2O充分溶解于120 ml蒸馏水中,再定容至200 ml容量瓶中。
培养液B的配制:4.0 g NH4HCO3和35.0 g NaHCO3充分溶于600 ml蒸馏水,再定容至1 000 ml容量瓶中。
培养液C的配制:5.7 g Na2HPO4、6.2 g K2HPO4和 0.6 g MgSO4·7H2O充分溶解于600 ml蒸馏水中,再定容至1 000 ml容量瓶中。
还原剂培养液的配制:320 ml NaOH 和625 ml Na2S·9H2O加100 ml蒸馏水。使用时临时配制。
培养液配制:取800 ml蒸馏水+0.2 ml培养液A+400 ml培养液B+400 ml培养液C+2 ml刃天青溶液+80 ml还原剂培养液,用玻璃棒充分搅匀,将混合液在39℃水浴锅中预热,直到混合液温度稳定,并向混合液中缓慢冲CO2气体直到饱和(培养液由紫色变成无色,并保持无色状态),备用。
1.3.2 实验动物与饲养管理
购买4只体重30~32 kg公母各半且健康度高的湖羊,每只湖羊都安装永久性瘤胃瘘管,护理15 d后使用。实验动物日粮包括粗饲料1 kg和精饲料0.5 kg两部分,粗饲料为新鲜杂交狼尾草,精饲料包括玉米、豆粕、次粉、氯化钠等(表1)。自由饮水,分早上6:30和下午5:30两次饲喂。

表1 湖羊精饲料组成及营养水平
1.3.3 实验设计
分5个处理组,每个处理组3个重复,对照组记为A0,处理组分别记为A1、A2、A3、A4。对照组A0全混合日粮中不添加外源酶,处理组A1、A2、A3、A4每1 kg全混合日粮中添加外源酶量分别为10、20、30、40 mg。
1.3.4 体外培养操作步骤
湖羊瘤胃微生物体外培养采用自制体外培养设备,如图1所示。

图1 湖羊瘤胃微生物体外培养装置示意图
体外培养设备由注射器(50 ml,最小刻度为1 ml)、三角锥瓶(50 ml)、三通阀、恒温振荡水浴锅(39℃)组成。注射器用于测量微生物产生气体体积,用少量润滑剂均匀涂抹注射器活塞,减小活塞阻力,减少由于阻力带来的实验误差,使气体产量测定结果更准确。三角锥瓶作为瘤胃微生物体外培养主体,瘤胃微生物和发酵底物在三角锥瓶中发酵。三角锥瓶放在水浴锅中,使三角锥瓶中培养液恒温,有规律振荡,模拟湖羊瘤胃的无氧、恒温和胃蠕动环境。
(1)在15个三角锥形瓶中分别加入600 mg全混合日粮底物(稻草∶精料=1∶1)。
(2)在三角锥形瓶中缓慢加入体外培养液30 ml,往培养液中缓慢通入二氧化碳气体(以缓慢冒气泡为准),待完全排出瓶中空气,盖上塞子,在39℃恒温水浴锅中预热备用。
(3)湖羊瘤胃液采集:在湖羊晨饲前,利用真空负压装置从湖羊永久性瘤胃瘘管采取瘤胃液各250 ml,装于事先通满二氧化碳气体的保温瓶中,迅速带回实验室。
(4)瘤胃液预处理:把1 L玻璃烧杯放入39℃恒温水浴锅中加热到恒温。将采回来的新鲜瘤胃液用4层纱布过虑,往滤液中不停缓慢通入二氧化碳气体,39℃恒温水浴备用。
(5)用50 ml注射器缓慢吸取30 ml瘤胃液注入三角锥形瓶中(防止生成气泡),盖上塞子。
(6)在三通阀上插上50 ml注射器,打开三通阀开关,使气体进入注射器。
(7)打开水浴锅振荡开关,开始缓慢振荡。
(8)分别在培养0、6、12、18、24、36、48 h时读取注射器读数并及时对三角锥形瓶中培养液采样。
1.3.5 标准品制备
(1)采用反复冻融CTAB法[10-12]提取湖羊瘤胃微生物DNA。
(2)用QIAamp DNA纯化试剂对培养液微生物总DNA进行纯化。
(3)培养液微生物目标PCR产物制备:根据表2合成通用引物,对提取总DNA扩增细菌16SrDNA。
(4)扩增产物纯化:扩增产物进行电泳,并用胶回收试剂盒回收目标条带。
(5)质粒DNA提取:使用大连宝生物科技公司质粒制备试剂盒提取。
(6)阳性克隆PCR产物检测:质粒DNA进行普通PCR反应,并对PCR产物进行电泳检测。
(7)培养液微生物阳性克隆测序和比对:培养液微生物阳性克隆测序由大连宝生生物技术公司完成。测序结果最后在GENE BANK中BLAST检测。
(8)质粒浓度换算:用紫外分光光度计测定质粒DNAOD260值,并通过公式换算成质粒拷贝数(copies/μl)。

表2 瘤胃细菌、真菌、产琥珀酸丝状杆菌、黄色瘤胃球菌、溶纤维丁酸弧菌、产甲烷菌16SrDNA全序列引物[13]
1.3.6 RT-PCR反应体系和扩增条件
先用1.5 ml无菌管按表3配制n+1倍反应液(n为孔数),使用八连管分装反应液,每个孔20 μl,3个重复。然后按照表4的条件进行扩增。

表3 RT-PCR反应液配制
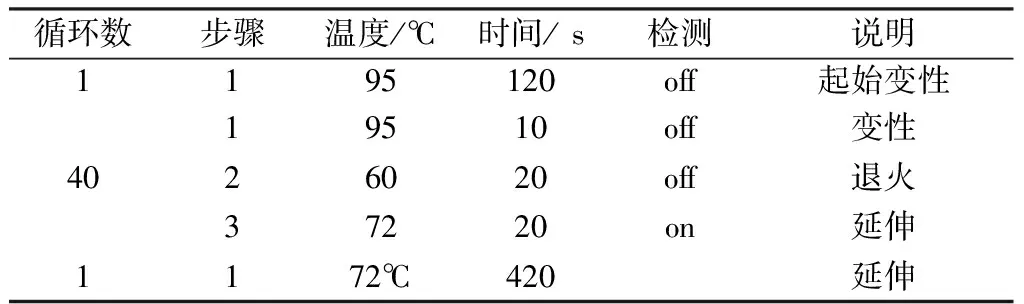
表4 RT-PCR扩增热循环程序
1.3.7 数据处理
实验所得数据用Microsoft EXCEL(2013)初步整理,再利用SPSS(17.0)中One-way ANOVA进行方差分析,并进行多重比较。实验数据处理结果用“平均值±标准差”形式表示。
2 结果与分析
2.1 阳性克隆PCR产物检测
电泳检测结果见图2所示。
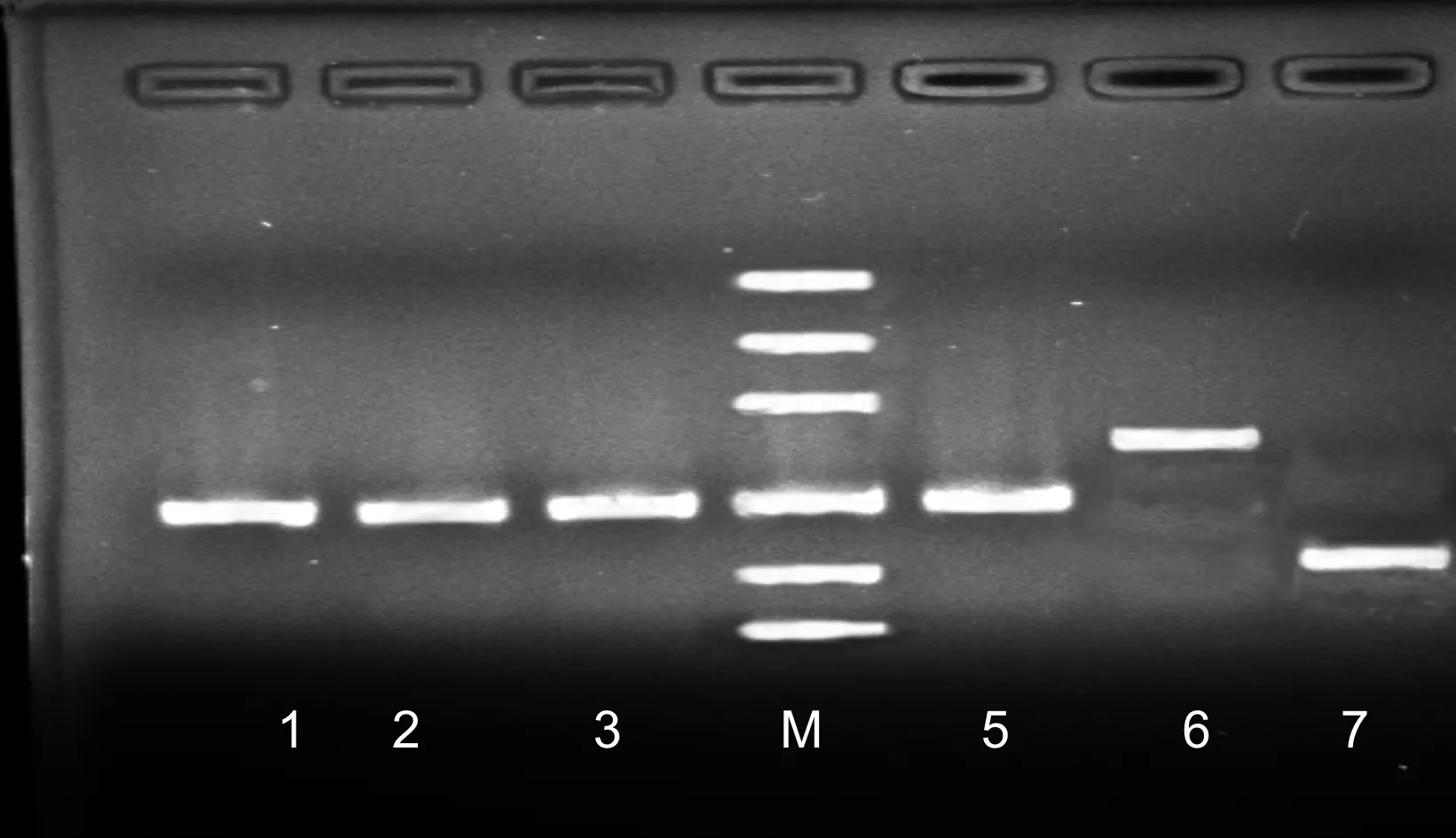
图2 质粒PCR产物凝胶电泳图
图2中1~6分别代表:培养液微生物细菌、真菌、甲烷菌、产琥珀酸丝状杆菌、黄色球菌和溶纤维丁酸弧菌,M代表Mark500。从图中各亮带可知,各菌所提取质粒亮带唯一,分别在200、200、200、200、286、136 bp,与各菌通用引物设计的目的片段大小相符。
2.2 外源酶对体外培养液总细菌影响
外源酶不同添加量处理组培养液总细菌浓度见表5。

表5 不同外源酶添加量处理组培养液总细菌浓度动态变化 1011 CFU/ml
注:表中数据为“平均值±标准差”,同列不同小写字母表示存在显著差异(P<0.05)(n=3);同列不同大写字母表示存在极显著差异(P<0.01)(n=3)。下同。
由表5可得,各处理组培养液总细菌浓度都处于1010~1011,属于正常瘤胃微生物体外培养总细菌浓度。在培养6 h时,处理组A1总细菌浓度比对照组A0极显著提高(P<0.01),由1.13×1011CFU/ml提高到2.63×1011CFU/ml;在培养12 h时,处理组A1、A2总细菌浓度极显著高于对照组A0(P<0.01);在培养18 h时,处理组A1总细菌浓度比对照组A0极显著提高(P<0.01),处理组A2、A3总细菌浓度显著高于对照组A0(P<0.05);在培养24 h时,处理组A1总细菌浓度比对照组A0极显著提高(P<0.01),由1.52×1011CFU/ml提高到3.86×1011CFU/ml。
2.3 外源酶对体外培养液真菌影响
外源酶不同添加量处理组真菌浓度见表6。

表6 不同外源酶添加量处理组培养液真菌浓度动态变化 105 CFU/ml
由表6可知,48 h内瘤胃液体外培养液真菌浓度都在105~107,属于正常瘤胃液体外培养真菌浓度。在培养6 h时,处理组A1真菌浓度比对照组A0极显著提高(P<0.01),由12.43×105CFU/ml提高到17.45×105CFU/ml;在培养12、18 h时,处理组A2显著高于对照组A0(P<0.05);在培养24 h时,处理组A1、A4极显著高于对照组A0(P<0.01),处理组A2、A3显著高于对照组A0(P<0.05);在培养48 h时,处理组A1比对照组A0极显著提高(P<0.01),由1.79×105CFU/ml提高到3.41×105CFU/ml。
2.4 外源酶对体外培养液产甲烷菌影响
外源酶不同添加量处理组产甲烷菌浓度见表7。

表7 不同外源酶添加量处理组培养液产甲烷菌浓度动态变化 107 CFU/ml
由表7可知,48 h内瘤胃液体外培养产甲烷菌浓度都在107~109,属于正常瘤胃液体外培养产甲烷菌浓度。在培养12 h时,处理组A1比对照组A0显著减少(P<0.05),由15.48×107CFU/ml减少到13.52×107CFU/ml;在培养18 h时,处理组A1、A2极显著低于对照组A0(P<0.01);在培养24 h时,处理组A1比对照组A0极显著降低(P<0.01),由10.46×107CFU/ml降低到7.82×107CFU/ml;在培养36 h时,处理组A1显著低于处理组A2;在培养48 h时,处理组A1比A4显著降低(P<0.05)。
2.5 外源酶对体外培养液产琥珀酸丝状杆菌影响
外源酶不同添加量处理组产琥珀酸丝状杆菌浓度见表8。

表8 不同外源酶添加量处理组培养液产琥珀酸丝状杆菌浓度动态变化 108 CFU/ml
由表8可知,48 h内瘤胃液体外培养产琥珀酸丝状杆菌浓度在108~109,属于正常瘤胃液体外培养产琥珀酸丝状杆菌浓度。在培养6 h和12 h时,处理组A1比对照组A0极显著提高 (P<0.01),分别由1.79×108CFU/ml和4.32×108CFU/ml提高到3.35×108CFU/ml和6.39×108CFU/ml;在培养18 h时,处理组A1、A2显著高于对照组A0;在培养24、36、48 h时,处理组A1都显著高于对照组A0(P<0.01)。
2.6 外源酶对体外培养液产黄色瘤胃球菌影响
外源酶不同添加量处理组黄色瘤胃球菌浓度见表9。

表9 不同外源酶添加量处理组培养液黄色瘤胃球菌浓度动态变化 106 CFU/ml
由表9可知,各处理组在培养48h内黄色瘤胃球菌浓度变化趋势一致,在培养6~12 h时呈现快速上升。在培养12 h时,处理组A1显著高于对照组A0(P<0.05);在培养18 h时,各处理组浓度都显著高于对照组A0;在培养24 h时,处理组A1、A2显著高于对照组A0(P<0.05)。
2.7 外源酶对体外培养液产溶纤维丁酸弧菌影响
外源酶不同添加量处理组溶纤维丁酸弧菌浓度见表10。

表10 不同外源酶添加量处理组培养液溶纤维丁酸弧菌浓度动态变化 108 CFU/ml
由表10可知,各组在0~48 h内溶纤维丁酸弧菌浓度变化一致。在培养6 h时,处理组A1极显著高于对照组A0(P<0.05);在培养12 h时,处理组A2显著高于对照组A0(P<0.05);在培养18 h时,处理组A1极显著高于对照组A0(P<0.01);在培养24 h时,处理组A1、A2显著高于对照组A0(P<0.05)。
3 讨论
3.1 外源酶对瘤胃液体外培养总细菌浓度影响
湖羊瘤胃内细菌利用营养物质生成菌体蛋白(MCP)、挥发性脂肪酸(VFA)等被自身吸收利用,细菌是湖羊瘤胃消化饲料和机体吸收营养的重要枢纽,湖羊生长需要的蛋白质有60%~65%由瘤胃细菌提供[16]。瘤胃细菌浓度取决于湖羊摄入饲料总能量。反刍动物在摄入饲料能量水平相同情况下,瘤胃内细菌浓度不会呈现显著差异[17]。瘤胃液体外培养实验中,细菌浓度都处于0.49×1011~5.11×1011CFU/ml,属于瘤胃培养液细菌正常范围1010~1011CFU/ml。
添加外源酶后瘤胃微生物通过对粗纤维依附后分解各类酶,形成降解作用显著的酶系统,提高细菌对植物细胞壁降解能力,提高粗纤维降解率,进而提高饲料营养利用率,促进细菌生长繁殖。可见,外源酶可以提高瘤胃液体外培养总细菌浓度,其中以10 mg/kg添加量为最佳。
3.2 外源酶对瘤胃液体外培养真菌浓度影响
湖羊瘤胃真菌通过合成分泌纤维素酶降解利用粗饲料中纤维素、半纤维素,并生成乙酸、CO2、H2等。纤维素酶的添加促进了纤维素降解,提高了真菌活力和繁殖速度。瘤胃内真菌与产甲烷菌存在协同作用,产甲烷菌利用真菌代谢生成的H2合成甲烷,两者体外混合培养比真菌单独培养降解纤维素能力强,生成乙酸和CO2更多,减少乳酸和乙醇产生,不产生氢气,减少瘤胃酸中毒发生。瘤胃液中真菌合成蛋白质主要氮源是氨态氮,本次体外培养实验中,培养液真菌浓度变化规律与氨态氮浓度变化相近。Denman等[18]通过Real time PCR研究表明瘤胃微生物体外培养过程 ,培养4~8 h为真菌快速繁殖阶段,在培养12 h左右真菌出现最高浓度值。这个研究发现与本实验结果相似。在体外培养初期,培养液细菌充分利用底物,迅速繁殖,在一定程度上抑制真菌繁殖,在培养后期细菌生长繁殖速度降低,对真菌抑制减弱。
3.3 外源酶对瘤胃液体外培养产甲烷菌浓度影响
反刍动物瘤胃内产甲烷菌属于厌氧菌,在体外单独培养定量产甲烷菌条件要求很高,可以通过用现代分子技术手段免培养定量[19]。研究表明定量产甲烷菌可用rRNA片段和荧光探针标记法[20-21]。瘤胃中产甲烷菌利用其它微生物代谢产物氢和乙酸合成甲烷气体,产甲烷菌与原虫存在协同作用,原虫为产甲烷菌提供合成甲烷所需的氢,产甲烷菌使原虫提高营养物质速率;乙酸可通过瘤胃壁进入动物体内进行供能与异生作用等,但是产甲烷菌也能利用乙酸,使动物体降低乙酸利用率,从而使饲料营养利用率降低。体外培养实验中,培养液中产甲烷菌浓度都在107~108,属于正常瘤胃液体外培养产甲烷菌浓度。
3.4 外源酶对瘤胃液体外培养琥珀酸丝状杆菌浓度影响
反刍动物瘤胃内产琥珀酸丝状杆菌定植在植物细胞壁合成并分泌纤维素酶,纤维素和半纤维素被纤维素酶降解为乙酸和琥珀酸等。在瘤胃液体外培养初期,培养液底物营养物质充足,细菌快速生长繁殖,抑制纤维素降解菌活性,待非结构性碳水化合物被细菌消耗殆尽,纤维素降解菌抑制作用解除,生长繁殖加快。添加10 mg/kg外源酶可以提高瘤胃液体外培养产琥珀酸丝状杆菌浓度,提高纤维素利用率。
3.5 外源酶对瘤胃液体外培养黄色瘤胃球菌浓度影响
黄色瘤胃球菌是最重要纤维素降解菌之一,主要通过附着在植物细胞表皮和细胞壁合成分泌木聚糖酶和葡聚糖酶降解晶状纤维素[22]。在瘤胃液体外培养中,黄色瘤胃球菌和产琥珀酸丝状杆菌生长繁殖趋势具有相似性。添加外源酶处理组黄色瘤胃球菌浓度高于对照组,这原因可能跟外源酶作用于产琥珀酸丝状杆菌相同。但是10 mg/kg添加量处理组细菌浓度高于其它各组,可能是由于高浓度外源酶使与黄色瘤胃球菌存在竞争作用的微生物也加快繁殖。这说明添加10 mg/kg外源酶可以提高瘤胃液体外培养黄色瘤胃球菌活性,提高纤维素利用率。
3.6 外源酶对瘤胃液体外培养溶纤维丁酸弧菌浓度影响
溶纤维丁酸弧菌在瘤胃内降解纤维素生成VFA,也可以降解非结构性碳水化合物生成NH3和VFA。因此本次体外培养实验中,外源酶添加量为10 mg/kg处理组在培养6~18 h时都是极显著高于对照组。这主要是由于外源酶提高了溶纤维丁酸弧菌降解纤维素能力,使溶纤维丁酸弧菌可降解底物浓度提高,促进溶纤维丁酸弧菌生长繁殖。因此,添加10 mg/kg外源酶可以显著提高瘤胃液体外培养溶纤维丁酸弧菌浓度,促进底物中纤维素利用。
4 结论
外源酶可以提高培养液中细菌总浓度,抑制产甲烷菌生长繁殖,促进纤维降解菌繁殖。从而提高饲料中营养素利用率,提高纤维素降解率。其中以外源酶添加量为全混日粮的10 mg/kg为最佳。
(1)在体外培养24 h时,处理组A1总细菌浓度比对照组A0显著提高(P<0.05)。
(2)在体外培养48 h时,处理组A1真菌浓度比对照组A0极显著提高(P<0.01)。
(3)在体外培养24 h时,处理组A1产甲烷菌浓度比对照组A0极显著降低(P<0.01)。在培养48 h时,处理组A1产甲烷菌浓度比A4显著降低(P<0.05)。
(4)在体外培养6 h和12 h时,处理组A1产琥珀酸丝状杆菌浓度比对照组A0极显著提高 (P<0.01)。
(5)各处理组在体外培养48 h内,黄色瘤胃球菌浓度变化趋势一致,在培养6~12 h时呈现快速上升。在培养12 h时,处理组A1显著高于对照组A0(P<0.05)。
(6)各组在体外培养0~48 h内,溶纤维丁酸弧菌浓度变化一致。在培养6 h时,处理组A1极显著高于对照组A0(P<0.05);在培养12 h时,处理组A2显著高于对照组A0(P<0.05)。
[1] BEDFORD M R. The effect of enzymes on digestion[J].Journal of Applied Poultry Research, 1996, 5(4):370-378.
[2] DANICKE S, BOTTCHER W, JEROCH H, et al. Replacement of soybean oil with tallow in rye-based diets without xylanase Increases protein synthesis in small intestine of broilers[J].Animal Social Nutrition Science, 2000,130:827-834.
[3] LINDEMANN M D, GENTRY J L, MONEGUE H J, et al. Determination of the contribution of an enzyme combination (Vegpro) to performance in grower finisher pigs[M].Australia: Manipulating pig production VI (Ed. PD Cranwell), 1997.
[4] SCHULZE H, PARTRIDGE G G, CRESWELL D. The effect of feed enzyme supplementation to corn/soya based diets on performance of finisher pigs from 46 to 92 kg[J].Journal of Animal Science,1996, 74(1):197.
[5] SCHULZE H, CAMPBELL R G. Effect of exogenous xylanase on performance of pig fed corn/soya based diets[J]. Journal of Animal Science, 1998, 76(1):179.
[6] PARTRIDGE G G, ALCANTARA P F, CRESWELL D. Effect of xylanase addition to corn/soybean meal/Wheat pollard diets for grower/finisher pigs[J]. Korea: Proceedings of the 8 th World Conference on Animal Production. Seoul, 1998.
[7] 杨永明. 外源纤维复合酶在绵羊饲养中的作用效果及其作用机制的研究[D]. 呼和浩特:内蒙古农业大学硕士学位论文, 2002.
[8] 冯宗慈, 高 民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010 (6): 37-37.
[9] MAKKAR H P S,BECKER K. Purine quantification in digesta from ruminants by spectrophoto-metric and HPLC methods[J].British Journal of Nutrition,1999,81:107-112.
[10] 邓思川.化学处理对真姬菇菌糠营养组分及人工瘤胃发酵的影响[D].福州:福建农林大学,2013
[11] MENKE K H, STEINGASS H. Estimation of energetic feed value obtained from chemical analysis and in vitro g as production using rumen fluid[J]. Anim Feed Science Technol, 1988, 28:91-97.
[12] 淡瑞芳, 用 RealTimePCR 和 DGGE 技术研究放牧藏系绵羊瘤胃微生物季节动态 [D]. 兰州: 甘肃农业大学, 2006.
[13] MURRAY M G, Thompson W F. Rapid isolation of high molecular weight plant DNA[J]. Nucleic acids research, 1980, 8(19): 4 321-4 326.
[14] 郭嫣秋. 瘤胃产甲烷菌定量检测与微生物菌群调控研究[D]. 杭州:浙江大学, 2008.
[15] 王加启. 反刍动物营养学研究方法 [M].北京: 现代教育出版社,2011.
[16] 杨璐玲, 吕永艳, 张杰杰, 等. 啤酒糟对瘤胃发酵参数及纤维素酶活性的影响[J]. 动物营养学报, 2013, 25(10): 2 414-2 421.
[17] LEEDLE J A, BRYANT M P, HESPELL R B. Diurnal variations in bacterial numbers and fluid parameters in ruminal contents of animals fed low-or high-forage diets[J]. Applied and environmental microbiology, 1982, 44(2): 402-412.
[18] DENMAN S E,MESWEENEY C S.Development of a real-time PCR assay for monitoring anarobic fungal and cellulolytic bacterial popolations within the rumen[J].FEMS Microbiology Ecology,2006.58(3):572-582.
[19] TOKURA M, CHAGAN L, USHIDA K, KOJIMA Y . Phylogenetic study of methanogens associated with rumen ciliates [J]. Current Microbiol, 1999,39:123-128.
[20] SHARP R, ZIEMER C J, STEM M D, et al. Taxon-specific associations between protozoal and methanogen populations in the rumen and a model rumen system [J]. FEMS Microbiology and Ecology, 1998,26:71-78.
[21] MACHMULLER A, SOLIVA C R,KREUZER M. Effect of coconut oil and defaunation treatment on methanogenesis in sheep [J]. Reproduction Nutrition and Development, 2003,43:41-55.
[22] DOEMER K C, WHITE B A. A assessment of the endo-1,4-glucanase components of ruminococcus flavefaciens FD-1[J].Appl Environ Microbial, 1990,56: 1 844-1 850.
(责任编辑:苏 幔)
Effects of exogenous enzymes on Hu sheep rumen microbial flora
CHEN Yu
(Ningde Entry-Exit Inspection and Quarantine Bureau, Ningde 352100,China)
The experiment was carried out to study the effects of different levels of exogenous enzymes on Hu sheep rumen fermentation and rumen microbial flora, designed to provide a theoretical basis for exogenous enzymes as feed additives of Hu sheep. The results showed that: adding different levels of exogenous enzymes can improve the in vitro rumen microbial properties, in which dosage of 10 mg/kg treatment group was the best, exogenous enzymes can increase the concentration of bacteria in the culture medium(P<0.01), methanogens concentration signifantly decreased(P<0.01), which promoted the growth and multiplication of cellulose degradation bacteria.
Hu sheep;exogenous enzymes; rumenmicrobes; in vitro culture; RT-PCR
2016-10-15;
2017-12-05
陈 宇(1981-),男,硕士,主要从事畜牧与饲料的研究。
10.7633/j.issn.1003-6202.2017.01.014
S816.32;S816.7
A
1003-6202(2017)01-0057-07
