不同重金属混合液对萼花臂尾轮虫(Brachionus calyciflorus)实验种群增长的影响
2017-02-10徐晓平席贻龙
徐晓平,席贻龙,黄 林
(1.安徽师范大学生命科学学院/ 安徽省皖江城市带退化生态系统的恢复与重建协同创新中心,安徽 芜湖 241000;2.安徽工程大学建筑工程学院,安徽 芜湖 241000)
不同重金属混合液对萼花臂尾轮虫(Brachionus calyciflorus)实验种群增长的影响
徐晓平1,2,席贻龙1①,黄 林1
(1.安徽师范大学生命科学学院/ 安徽省皖江城市带退化生态系统的恢复与重建协同创新中心,安徽 芜湖 241000;2.安徽工程大学建筑工程学院,安徽 芜湖 241000)
为探究重金属复合污染对轮虫种群增长的影响,以萼花臂尾轮虫(Brachionuscalyciflorus)为受试生物,采用析因设计方法设置ρ(Cu2+)为0.001和0.01 mg·L-1、ρ(Zn2+)为0.01和0.1 mg·L-1、ρ(Cd2+)为0.01和0.1 mg·L-1、ρ(Cr6+)为0.01和0.1 mg·L-1和ρ(Mn2+)为0.1和1 mg·L-1不同组合的混合液,利用轮虫群体累积培养方法,研究暴露于不同重金属混合液中的轮虫18 d实验种群增长的变化情况,探讨不同处理组对轮虫种群增长率和轮虫最大种群密度的影响。结果显示,重金属混合液组成成分浓度的变化显著影响其对轮虫的毒性,高浓度重金属混合液均显著降低轮虫种群增长率和轮虫最大种群密度。每种重金属离子和其他4种重金属混合液浓度的交互作用均显著影响轮虫种群增长率;Zn2+和其他4种重金属混合液浓度的交互作用显著影响轮虫最大种群密度。轮虫种群增长率对重金属混合物中各组成成分之间的交互作用更加敏感,适合用来监测重金属复合污染对轮虫种群的长期、慢性毒性影响。
重金属混合液;萼花臂尾轮虫;种群增长率;最大种群密度
重金属广泛存在于水体和土壤中,因其不可降解性和在水体沉积物中的高蓄积性,其对水生生物的毒性一直是人们研究的热点[1]。然而,实际环境中,重金属元素不可能单独存在,更多的是2种以上同时共存于水体中,它们作用于生物体时往往会发生与单一重金属完全不同的联合毒性效应[2]。所以,基于单一重金属毒性测试数据制定的水质基准和废水排放标准很可能“不安全”,会对包括轮虫在内的重要水生生物构成潜在威胁[3],开展重金属联合作用效应的研究显得十分必要。虽然人们很早就开始关注重金属之间的联合作用效应[4],但是由于复合污染机理十分复杂,开展此类研究的方法和技术路线很重要,总体看来此类研究还有较大改进空间,还需要开展大量的基础研究来积累理论数据,为正确评价重金属复合污染提供科学依据[5]。
轮虫是广泛分布于各类水体中的一类浮游动物,其生物量占浮游生物总生物量的30%以上。它们以藻类、细菌等为食物,同时又是鱼类幼苗的开口饵料,在淡水生态系统的结构组成、物质循环和能量流动过程中具有重要作用[6]。同时,由于轮虫具有分布广泛、繁殖迅速、世代时间短以及存活、繁殖和行为等对环境理化因子的变化敏感等优点,在水生态毒理学研究和水环境监测中日益受到研究者的青睐[7]。早在20世纪90年代萼花臂尾轮虫(Brachionuscalyciflorus)和褶皱臂尾轮虫(Brachionusplicatilis)就被分别作为淡水和海水污染的测试生物列入美国国家测试标准[8]。
目前,有关重金属对轮虫的毒性影响的报道主要集中在单一重金属毒性影响上[9-11],二元及以上重金属联合毒性作用的影响则鲜有报道[12]。为探究多元重金属复合污染对轮虫种群增长的影响,以萼花臂尾轮虫为受试生物,研究了Cu2+、Zn2+、Cd2+、Cr6+和Mn2+这5种重金属不同浓度组合混合液对轮虫实验种群增长的影响,旨在为正确评价重金属复合污染对水生态系统的影响提供科学参考。
1 材料与方法
1.1 轮虫的来源与培养
萼花臂尾轮虫(以下称轮虫)采自芜湖市汀棠湖(31°20′ N,119°21′ E),实验室内在(25±1) ℃、自然光照条件下进行“单克隆”培养,即由一个轮虫雌体开始经周期性孤雌生殖形成种群,培养时间为3个月以上;所用轮虫培养液采用EPA配方[13],所用饵料为由HB-4培养基[14]培养的处于指数增长期的斜生栅藻(Scenedesmusobliquus),离心浓缩后使用。实验前将轮虫置于(25±1) ℃、无光照的恒温培养箱内进行1周以上的预培养,预培养时每天投喂密度为1.0×106mL-1斜生栅藻并更换轮虫培养液,同时通过去除一部分个体使得轮虫种群始终处于指数增长期。
1.2 测试液的配制
实验所用CuSO4·5H2O(无锡市亚盛化工有限公司生产)、ZnSO4·7H2O(无锡市亚盛化工有限公司生产)、CdCl2·2.5H2O(国药集团化学试剂有限公司生产)、K2Cr2O7(无锡市展望化工试剂有限公司生产)和MnCl2(国药集团化学试剂有限公司生产)均为分析纯(≥99%)。依据轮虫急性毒性预实验结果,选择小于半数致死浓度(LC50),同时参照GB 3838—2002《地表水环境质量标准》和GB 25466—2010《铝、锌工业污染物排放标准》,最终确定用于联合毒性实验的Cu2+、Zn2+、Cd2+、Cr6+和Mn2+浓度分别是ρ(Cu2+)为0.001和0.01 mg·L-1,ρ(Zn2+)、ρ(Cd2+)和ρ(Cr6+)均为0.01和0.1 mg·L-1,ρ(Mn2+)为0.1和1 mg·L-1。实验前先用蒸馏水配制ρ为1 mg·L-1的母液(均为离子浓度),实验时再用EPA将母液稀释成所需各浓度测试液。母液中的实际金属元素浓度由等离子体发射光谱(ICP-OES,PerkinElmer Optima 2100 DV)[15]测定。实验所用玻璃器皿使用前均用相应浓度的测试液浸泡24 h,实验过程中每24 h更换1次新鲜测试液。
所配制的各母液标称浓度与实测浓度如表1所示。母液标称浓度与实测浓度相差10%以内,测试液浓度按照母液标称浓度进行稀释。
表1 重金属母液标称与实测质量浓度
Table 1 Norminal and measured mass concentrations of the stock solution

重金属标称质量浓度/(mg·L-1)实测质量浓度/(mg·L-1)Cu2+010094±0002Zn2+10960±0079Cd2+10930±0066Cr6+10940±0094Mn2+10950±0027
1.3 实验设计
采用析因设计法(factorial design)将此5种金属混合物处理组视作某一特定金属与其他4种金属组成的混合物,同时将该特定金属X视作主体,其他4种金属组成的混合物视作X所在的背景环境(记作ENV)。X有高(H)和低(L)2种浓度,ENV则有高(H)、低(L)和无(0)3种浓度:ENV(H)意味着其他4种金属均为高浓度,ENV(L)意味着其他4种金属均为低浓度,ENV(0)意味着其他4种重金属浓度均为0。为表述方便,混合液分别记作为X+ENV(L+0)、X+ENV(L+L)、X+ENV(L+H)、X+ENV(H+0)、X+ENV(H+L)、X+ENV(H+H)。实验共包括22个处理(去除高低浓度各4组重复所得)和1个空白对照,每个处理和对照设置4个重复。
实验取6个龄长在3 h以内的轮虫幼体(非混交雌体)置于15 mL玻璃试管中,加入12 mL测试液(内含密度为1.0×106mL-1斜生栅藻),于(25±1) ℃、无光照的恒温培养箱中培养;历时18 d,期间每12 h悬浮1次沉积于试管底部的藻类食物,每24 h对每根试管中存活的轮虫总雌体计数,然后将存活个体转移至新的含有新鲜测试液的试管中,并投喂相应体积的藻。实验早期轮虫密度较小时采用全计数,密度较大时采用抽样计数。
1.4 相关参数的定义和计算方法
计算轮虫种群增长率时,依据DUMONT等[16]所述方法,在轮虫种群处于指数期增长阶段选取4~6 d计数轮虫种群密度,以此计算种群增长率并最终获得每个重复组的平均值。轮虫种群增长率(r)的计算公式为
r=(ln Nt-ln N0)/t。
(1)
式(1)中,N0为实验起始轮虫接种密度,即0.5 mL-1;Nt为实验进行到第t天时的轮虫密度,mL-1;t为实验进行的时间,d。
1.5 数据处理
如前所述,每个处理组由2个部分构成,即某特定重金属和其他4种重金属的混合液,该2个部分又分别包含不同的浓度水平,因此,在分析该2个部分交互作用对实验指标的影响时采用双因素方差分析法;同时,通过单因素方差分析和多重比较(LSD检验)比较各处理组指标与对照组之间的差异显著性(SPSS 16.0)[17]。
2 结果与分析
2.1 暴露于各处理组中的萼花臂尾轮虫种群增长动态
图1为暴露于各重金属混合液中的萼花臂尾轮虫种群增长曲线。在该实验条件下各个处理中高浓度混合物,如L+H和H+H,普遍对轮虫种群增长具有抑制作用。多数种群密度在8~10 d时出现1个明显的下降过程,之后又开始增长直至达到第2个高峰,14~15 d前后密度又开始下降。

ENV为环境浓度,0为浓度为0,L为低浓度,H为高浓度。图1 暴露于不同金属混合液中的萼花臂尾轮虫种群增长曲线Fig.1 Population growth curve of Brachionus calyciflorus exposed to multi-metal solution relative to composition of the solution
图2为暴露于各种不同浓度重金属混合液中的萼花臂尾轮虫种群增长率。与对照相比,Cu2++ENV(L+0、L+H、H+L、H+H)、Zn2++ENV(L+H、H+H)、Cd2++ENV(L+H、H+0、H+L、H+H)、Cr6++ENV(L+H、H+H)和Mn2++ENV(L+0、L+H、H+H)处理均显著或极显著减少轮虫种群增长率(P<0.05或P<0.01),而Cd2++ENV(L+0)处理却显著增加轮虫增长率(P<0.05)。
图3为暴露于各种不同浓度金属混合液中的萼花臂尾轮虫的最大种群密度。与对照相比,Cu2++ENV(L+H、H+0、H+H)、Zn2++ENV(L+H、H+0、H+L、H+H)、Cd2++ENV(L+H、H+0、H+L、H+H)、Cr6++ENV(L+H、H+L、H+H)和Mn2++ENV(L+0、L+H、H+H) 处理显著或极显著减少轮虫的最大种群密度(P<0.05或P<0.01)。

*P<0.05,**P<0.01,表示处理组与对照组(0+0)之间种群增长率差异显著。ENV为环境浓度,0为浓度0,L为低浓度,H为高浓度。图2 暴露于不同金属混合液中萼花臂尾轮虫的种群增长率Fig.2 Population growth rate of Brachionus calyciflorus exposed to multi-metal solution relative to composition of the solution
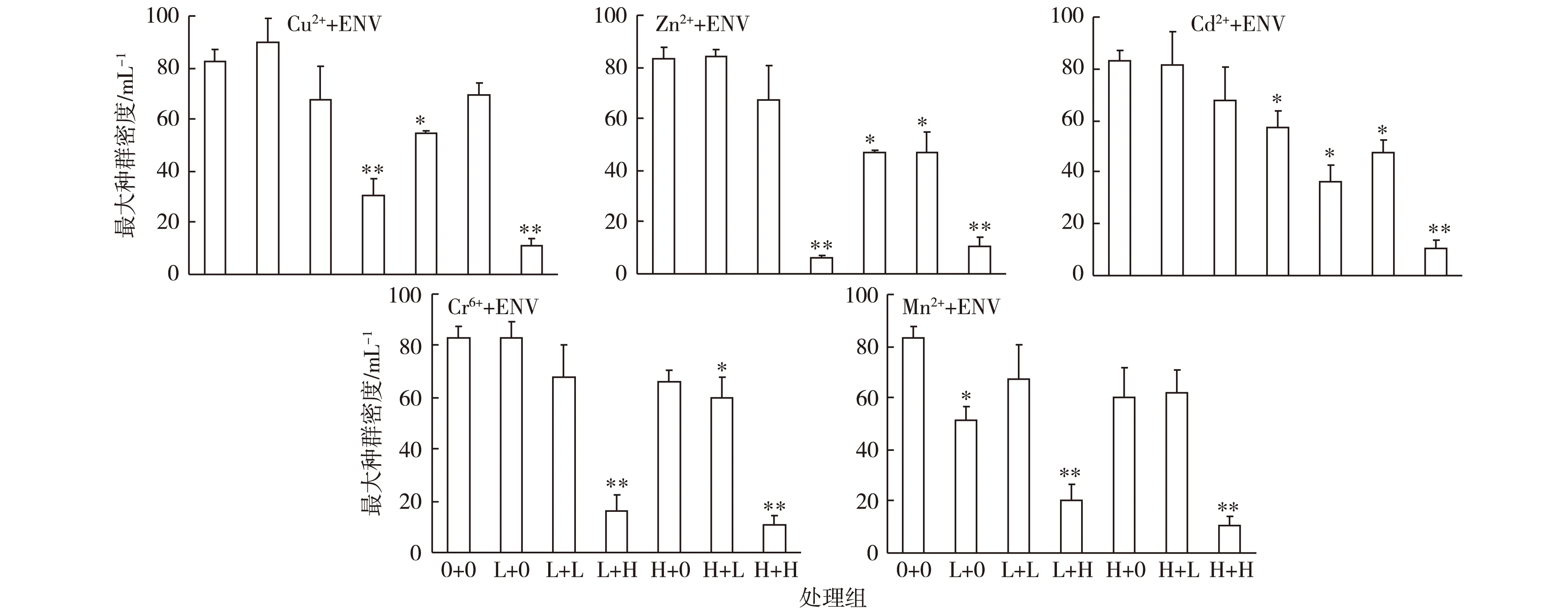
*P<0.05,**P<0.01,表示处理组与对照组(0+0)之间最大种群密度差异显著。ENV为环境浓度,0为浓度0,L为低浓度,H为高浓度。图3 暴露于不同金属混合液中萼花臂尾轮虫的最大种群密度Fig.3 Maximal population density of Brachionus calyciflorus exposed to multi-metal solution relative to composition of the solution
2.2 重金属交互作用双因素方差分析结果
双因素方差分析结果如表2所示,Cu2+浓度×ENV、Zn2+浓度×ENV、Cd2+浓度×ENV、Cr6+浓度×ENV和Mn2+浓度×ENV显著或极显著影响轮虫种群增长率(P<0.05或P<0.01),Zn2+浓度×ENV显著影响轮虫最大种群密度(P<0.05)。
3 讨论与结论
相对于急性实验而言,慢性毒性实验如多世代的种群增长实验更加耗时,但是此类实验的结果对制定保护浮游动物的相关水质标准更具有参考意义[18]。因此,越来越多的研究者采纳此方法开展轮虫毒理学研究[19-21]。种群增长率(r)和最大种群密度(K)是种群增长实验中常用的2个指标,由于该类实验中轮虫种群是长期、多世代暴露于毒物中的,因此,这2个实验指标的变化能更加综合地反映毒物对轮虫种群的毒性影响。但是,SARMA等[19]认为,此类研究中多数实验在轮虫种群到达增长减速期(retardation phase)之前就终止了,这样得到的种群最大密度不能作为实验指标,实验结束时间应至少选择在种群完成1个增长周期后,即多数种群开始下降时。笔者研究中很多处理组种群增长出现2个高峰期(图1),在第1个高峰期前种群呈“S”型增长,符合逻辑斯谛增长模型,而整个曲线则呈明显的“M”型,符合具有“时滞”(time lag)的种群增长模型[22],实验在多数种群第2个高峰期出现后种群密度开始下降时结束,完全符合实验要求。
表2 金属浓度与环境浓度交互作用对萼花臂尾轮虫种群增长率(r)和最大种群密度(K)的双因素方差分析结果
Table 2 Two-way ANOVA of interactions of a given element with the other four in the solution in concentration on population growth rate (r) and maximal population density (K) ofBrachionuscalyciflorus
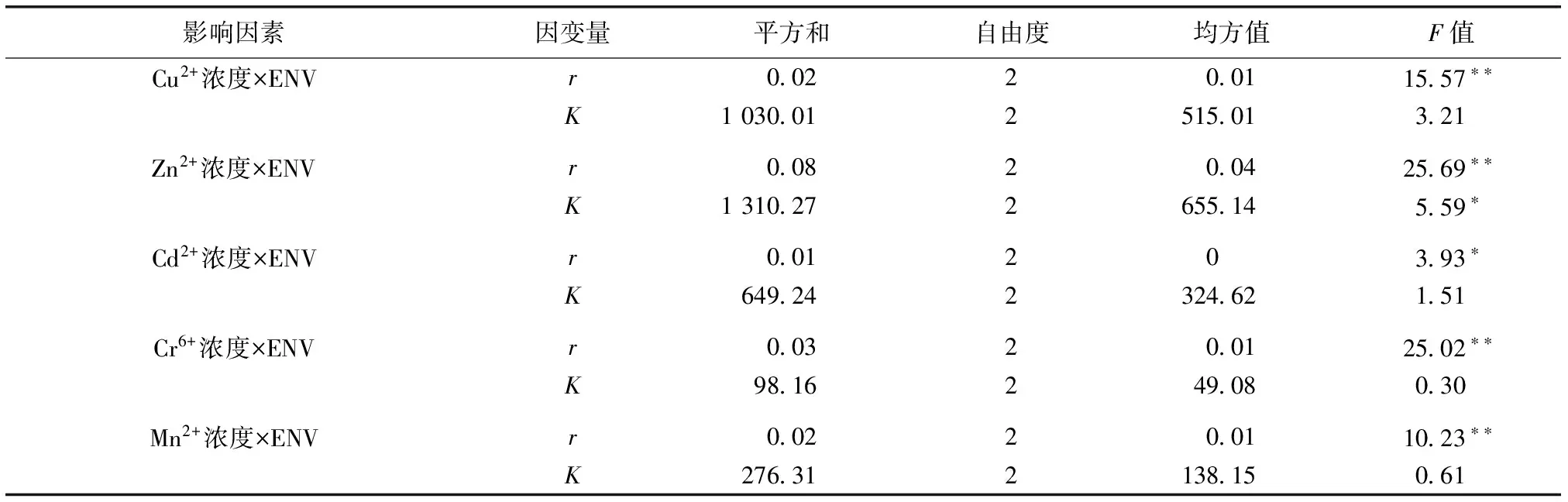
影响因素因变量平方和自由度均方值F值Cu2+浓度×ENVr00220011557∗∗K103001251501321Zn2+浓度×ENVr00820042569∗∗K131027265514559∗Cd2+浓度×ENVr00120393∗K64924232462151Cr6+浓度×ENVr00320012502∗∗K981624908030Mn2+浓度×ENVr00220011023∗∗K27631213815061
*P<0.05,**P<0.01。r为萼花臂尾轮虫种群增长率,K为最大种群密度,ENV为环境浓度。
在最佳或接近最佳的生态条件下萼花臂尾轮虫等多数臂尾属轮虫种群增长率大小为0.2~2.0 d-1[23]。笔者研究中,在投喂1.0×106mL-1斜生栅藻情况下,对照组轮虫种群增长率为0.69 d-1。但随着金属混合液组成成分和浓度的变化,轮虫种群增长率出现不同程度的波动,指标最大值出现在 Cd2++ENV(L+0)组,为0.74 d-1,较对照上升7.54%;最小值出现在Zn2++ENV(L+H)组,仅为0.17 d-1,较对照下降75%。可见,由于金属混合物组成成分和浓度的变化导致轮虫种群增长率上下波动幅度超过80%。同样,对照组最大种群密度为83 mL-1,与赵兰兰[24]在相同藻密度下培养轮虫所得出的45~112 mL-1的最大种群密度大致相当。但是,随着金属混合液组成成分和浓度的变化,最大种群密度同样出现不同程度的波动,这一指标的最大值出现在Cu2++ENV(L+0)组,为89 mL-1,较对照上升8.05%;最小值出现在Zn2++ENV(L+H)组,仅为6 mL-1,较对照下降93%。可见,由于金属混合物组成成分和浓度的变化导致轮虫最大种群密度上下波动幅度达到100%。该2项指标的最小值均出现在Zn2++ENV(L+H)组,说明此组组成成分和浓度的配比对轮虫的毒性是所有处理组中最大的。
该研究中重金属混合物组成成分和浓度的变化导致轮虫种群增长率和最大种群密度均出现不同程度的变化,但是双因素方差分析显示,相对于种群最大密度,轮虫种群增长率更容易受金属浓度与环境浓度之间交互作用的影响(表2),表明轮虫种群增长率对金属混合物中各组成成分和浓度的变化以及它们之间的交互作用更加敏感,更加适合用来监测重金属复合污染对轮虫种群的长期、慢性的毒性影响。也正是由于毒物对轮虫种群增长率和最大种群密度的影响存在差异,导致Cu2++ENV(L+0、H+0、H+L)、Zn2++ENV(H+0、H+L)、Cd2++ENV(L+0)和Cr6++ENV(H+0)处理对轮虫种群增长率和最大种群密度的影响不尽相同,如Cu2++ENV(L+0)处理与对照相比显著降低了轮虫种群增长率,但同时最大种群密度却较对照提高7%。但是,所有混合物中L+H和H+H这2种组合对种群增长率和最大种群密度的影响却始终一致:均分别显著降低了这2项指标。这一结果表明,无论是哪一种金属处于什么浓度水平,当其ENV浓度上升到高浓度水平,该5种重金属组成的混合物都会对轮虫种群产生负面影响。
XU等[25]研究了相同处理对轮虫生命表参数的影响,结果发现所有高浓度的某一金属与高浓度的环境水平(H+H)对轮虫净生殖率(R0)、世代时间(T)、生命期望(e0)和种群内禀增长率(rm)均没有产生显著影响,笔者研究结果与之不尽相同。究其原因,笔者认为与暴露时间长短以及轮虫不同世代对毒物的适应性存在差异有关。XU等[25]研究的是毒物对F0代轮虫的毒性影响,而笔者研究考察的是毒物对轮虫累积多世代长期暴露(18 d)的综合影响。GUO等[26]研究发现,将轮虫暴露于农药乐果(dimethoate)中,轮虫F0代种群增长呈现出明显的毒物兴奋效应,F1和F2代生长均显著受到乐果的抑制,F2代个体明显比F1代个体对毒物更加敏感。一般认为,机体在受到毒物胁迫时,亲代会将更多的能量投入到解毒过程中,而投入到子代的能量将会减少,导致子代的质量下降,进而子代的适合度会降低[27]。因此,在评价重金属复合污染对轮虫等水生生物联合毒性效应时需要考虑不同世代对毒物敏感度差异的影响。
此外,除了上述重金属浓度和轮虫不同世代等因素影响以外,重金属对轮虫的毒性效应还受到温度、藻以及pH值等水体理化因子的影响[28-29]。研究发现,随着温度的上升和藻密度的下降,Zn2+、Cd2+以及Zn2+-Cd2+协同作用对萼花臂尾轮虫的毒性增加,Zn2+-Cd2+协同作用效应也越加明显[29]。笔者研究是在特定实验条件下开展的,并未考察上述理化因子对实验结果的影响,因此,尚需进一步研究在其他水质背景条件下该5种重金属混合液对轮虫的毒性效应是如何变化的。
水体及其沉积物以及工业废水排放中含有多种重金属,它们的协同作用往往对水生生物产生不良影响并带来潜在生态风险[30-31]。研究表明,污染物共存时,基于单一化合物毒性制定的水质基准很可能不足以保护水体生物的安全[3]。如在单一重金属均处于安全浓度的情况下,铜、锌、镉、铬、铅、镍、汞和砷8种重金属混合液对大型溞(Daphniamagna)产生显著毒性作用[32]。该研究中,重金属浓度是参照我国现行的地表水标准和工业废水排放标准设置的,实验结果表明这些标准中的重金属浓度在复合污染情况下对轮虫种群存在着潜在威胁。因此,在制定含有重金属的水质环境标准和各类废水排放标准的过程中,必须尽可能考虑重金属复合污染造成的毒性效应的影响[3]。
联合毒性效应研究中,由于毒物种类繁多,每种毒物又具有不同浓度水平,因此,研究其交互作用时实验设计显得十分重要,尤其要恰当地采用统计学原理和方法,正确地配比混合物中各组分浓度以及分析其相互作用的关系[33],这也是开展该项研究的复杂性和困难所在。析因设计是目前研究联合毒性交互作用时采用较多的实验设计方法[34],它是一种多因素的交叉分组实验,不仅可以检测每个因素水平间的差异,而且可以检验各因素之间的交互作用,其结果可以通过SPSS等分析软件获得。在XU等[25]和笔者研究中,实验设计时将处理组视作由2种因素:特定的重金属和其所处的环境,每种因素又包含了不同水平。该方法较好地显示出重金属之间交互作用的不同影响效果,达到了实验设计的目的,值得进一步推广。
[1] 王琳,刘冉,李文慧,等.不同重金属离子胁迫对斜生栅藻生长及叶绿素荧光特性的影响[J].生态与农村环境学报,2015(5):743-747.[WANG Lin,LIU Ran,LI Wen-hui,etal.Effects of Stresses of Different Heavy Metals on Growth and Chlorophy Ⅱ Fluorescence ofScendesmusobliquus[J].Journal of Ecology and Rural Environment,2015(5):743-747.]
[2] NORWOOD W P,BORGMANN U,DIXON D G,etal.Effects of Metal Mixtures on Aquatic Biota:A Review of Observations and Methods[J].Human and Ecological Risk Assessment,2003,9(4):795-811.
[3] COOPER N L,BIDWELL J R,KUMAR A.Toxicity of Copper,Lead,and Zinc Mixtures toCeriodaphniadubiaandDaphniacarinata[J].Ecotoxicology and Environmental Safety,2009,72(5):1523-1528.
[4] BLISS C I.The Toxicity of Poisons Applied Jointly[J].Annals of Applied Biology,1939,26(3):585-615.
[5] ALTENBURGER R,BACKHAUS T,BOEDEKER W,etal.Simplifying Complexity:Mixture Toxicity Assessment in the Last 20 Years[J].Environmental Toxicology and Chemistry,2013,32(8):1685-1687.
[6] WALLACE R L,SNELL T W.Phylum Rotifera[M]∥THORP J H,COVICH A P.Ecology and Classification of North American Freshwater Invertebrates.San Diego,USA:Academic Press,2001:195-254.
[7] DAHMS H U,HAGIWARA A,LEE J S.Ecotoxicology,Ecophysiology,and Mechanistic Studies With Rotifers[J].Aquatic Toxicology,2011,101(1):1-12.[8] ASTM.Standard Guide for Acute Toxicity Tests With the Rotifer Brachionus[M]∥Annual Book of ASTM Standards.Philadelphia,USA:American Society for Testing and Material,1991:1440-1491.[9] ARIAS-ALMEIDA J C,RICO-MARTNEZ R.Toxicity of Cadmium,Lead,Mercury and Methyl Parathion onEuchlanisDilatataEhrenberg 1832 (Rotifera:Monogononta)[J].Bulletin of Environmental Contamination and Toxicology,2011,87(2):138-142.
[10]ARNOLD W R,DIAMOND R L,SMITH D S.Acute and Chronic Toxicity of Copper to the Euryhaline Rotifer,Brachionusplicatilis("L" Strain)[J].Archives of Environmental Contamination and Toxicology,2011,60(2):250-260.
[11]SANTOS-MEDRANO G E,RICO-MARTNEZ R.Lethal Effects of Five Metals on the Freshwater RotifersAsplanchnabrigthwelliiandBrachionuscalyciflorus[J].Hidrobiológica,2013,23(1):82-86.
[13]Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms[R].5th ed.Washington D C,USA:US Environmental Protection Agency,2002.
[14]章宗涉,黄祥飞.淡水浮游生物研究方法[M].北京:科学出版社,1991:410-411.[ZHANG Zong-she,HUANG Xiang-fei.Research Methods of Freshwater Plankton[M].Beijing:Science Press,1991:410-411.]
[15]WANG X,CHU Z,ZHA F,etal.Determination of Heavy Metals in Water and Tissue of Crucian Carp (CarassiusauratusGibelio) Collected From Subsidence Pools in Huainan Coal Fields (China)[J].Analytical Letters,2015,48(5):861-877.
[16]DUMONT H J,SARMA S S S,ALI A J.Laboratory Studies on the Population Dynamics ofAnuraeopsisfissa(Rotifera) in Relation to Food Density[J].Freshwater Biology,1995,33(1):39-46.
[17]ZAR J H.Biostatistical Analysis[M].4th ed.Upper Saddle River,USA:Prentice Hall,1999:663.
[18]SNELL T W,JOAQUIM-JUSTO C.Workshop on Rotifers in Ecotoxicology[J].Hydrobiologia,2007,593(1):227-232.
[19]SARMA S S S,CORRAL-JCQUEZ F I,NANDINI S,etal.Population Level Indicators of Stress:Effects of Two Heavy Metals (Copper and Mercury) on the Growth ofLecanequadridentata(Ehrenberg,1830) (Rotifera:Lecanidae)[J].Journal of Environmental Science and Health(Part A):Toxic/Hazardous Substances and Environmental Engineering,2010,45(1):32-36.
[20]ZHANG L,NIU J,LI Y,etal.Evaluating the Sub-Lethal Toxicity of PFOS and PFOA Using RotiferBrachionuscalyciflorus[J].Environmental Pollution,2013,180(3):34-40.
[21]SHA J,WANG Y,CHEN H,etal.Using Population Demographic Parameters to Assess Impacts of Two Polybrominated Diphenyl Ethers (BDE-47,BDE-209) on the RotiferBrachionusplicatilis[J].Ecotoxicology and Environmental Safety,2015,119:106-115.
[22]孙儒泳.动物生态学原理[M].3版.北京:北京师范大学出版社,2001:190-193.[SUN Ru-yong.Principles of Animal Ecology[M].3th ed.Beijing:Beijing Normal University Publishing,2001:190-193.]
[23]SARMA S S S,LARIOS JURADO P S,NANDINI S.Effect of Three Food Types on the Population Growth ofBrachionuscalyciflorusandBrachionuspatulus(Rotifera:Brachionidae)[J].Revista de Biología Tropical,2001,49(1):77-84.
[24]赵兰兰.三种邻苯二甲酸酯类物质对萼花臂尾轮虫实验种群动态的影响[D].芜湖:安徽师范大学,2007.[ZHAO Lan-lan.Effects of Three Phthalate Acid Esters on Experimental Population Dynamics of Freshwater RotiferBrachionuscalyciflorusPallas[D].Wuhu:Anhui Normal University,2007.]
[25]XU X P,XI Y L,HUANG L,etal.The Life-Table Demographic Response of Freshwater RotiferBrachionuscalyciflorusto Multi-Metal (Cu,Zn,Cd,Cr,and Mn) Mixture Interaction[J].Bulletin Environmental Contamination and Toxicology,2014,93(2):165-170.
[26]GUO R,REN X,REN H.Effects of Dimethoate on RotiferBrachionuscalyciflorusUsing Multigeneration Toxicity Tests[J].Journal of Environmental Science and Health(Part B),2012,47(9):883-890.
[27]KOOIJMAN S A L M,BAAS J,BONTJE D,etal.Ecotoxicological Applications of Dynamic Energy Budget Theory[M]∥DEVILLERS J,KULKARNI S A,ZHU J,etal.Ecotoxicology Modeling.New York,USA:Springer,2009:237-259.
[28]ARNOLD W R,DIAMOND R L,SMITH D S.The Effects of Salinity,pH,and Dissolved Organic Matter on Acute Copper Toxicity to the Rotifer,Brachionusplicatilis("L" Strain)[J].Archives of Environmental Contamination and Toxicology,2010,59(2):225-234.
[29]徐晓平,席贻龙,黄林.Zn2+和Cd2+对萼花臂尾轮虫种群增长的单一和联合毒性效应[J].环境科学研究,2016,29(3):368-375.[XU Xiao-ping,XI Yi-long,HUANG Lin.Single and Combined Toxicities of Zn2+and Cd2+to the Population Growth ofBrachionuscalyciflorus[J].Research of Environmental Sciences,2016,29(3):368-375].
[30]原居林,胡大雁,杨卫明,等.印染废水对3种水生生物的毒性作用[J].生态与农村环境学报,2012,28(2):209-212.[YUAN Ju-lin,HU Da-yan,YANG Wei-ming,etal.Toxicity of Printing-Dyeing Wastewater to Aquatic Organisms[J].Journal of Ecology and Rural Environment,2012,28(2):209-212.]
[31]郑玲芳.黄浦江水源地沉积物重金属潜在生态风险评价[J].生态与农村环境学报,2013,29(6):762-767.[ZHENG Ling-fang.Potential Ecological Risk Assessment of Heavy Metals in River Sediments of Drinking Water Sources of Huangpu River[J].Journal of Ecology and Rural Environment,2013,29(6):762-767.]
[32]ENSERINK E L,MASS-DIEPEVEEN J L,VAN LEEUWEN C J.Combined Effects of Metals:An Ecotoxicological Evaluation[J].Water Research,1991,25(6):679-687.
[33]孙铁珩,周启星.污染生态学研究的回顾与展望[J].应用生态学报,2002,13(2):221-223.[SUN Tie-heng,ZHOU Qi-xing.Retrospect and Prospect of Pollution Ecology[J].Chinese Journal of Applied Ecology,2002,13(2):221-223.]
[34]ROSENFELDT R R,SEITZ F,SCHULZ R,etal.Heavy Metal Uptake and Toxicity in the Presence of Titanium Dioxide Nanoparticles:A Factorial Approach UsingDaphniamagna[J].Environmental Science & Technology,2014,48(12):6965-6972.
(责任编辑: 陈 昕)
Effects of Mixture of Different Heavy Metal Ions on Population of Freshwater Rotifer Brachionus calyciflorus.
XU Xiao-ping1,2, XI Yi-long1, HUANG Lin1
(1.College of Life Sciences, Anhui Normal University/ Collaborative Innovation Center of Recovery and Reconstruction of Degraded Ecosystem in Wanjiang City Belt, Wuhu 241000, China;2.College of Civil Engineering and Architecture, Anhui Polytechnic University, Wuhu 241000, China)
To explore effects of combined heavy metal pollution on aquatic organisms, an experiment was carried out using fresh water rotifers,Brachionuscalyciflorus, which are among the most important groups of zooplankton in terms of biomass, ecological importance and bio-diversity, and are recognized as ideal bioassay animals for toxicity tests because of their small size, short generation time and rapid reproduction rate. However, few reports are available in the literature on impacts of combined heavy metal pollution on rotifers. This experiment was designed to use solutions of heavy metal mixture, containing Cu2+(0.001 and 0.01 mg·L-1), Zn2+(0.01 and 0.1 mg·L-1), Cd2+(0.01 and 0.1 mg·L-1), Cr6+(0.01 and 0.1 mg·L-1), Mn2+(0.1 and 1 mg·L-1) and 18 d old freshwater rotifers in the cumulative culture test. Population growth rate and maximal population density of the rotifers were monitored. Results show that concentrations of the metals in the solution was the major factor affecting toxicity of the solution to the rotifers. Population growth rate and maximal population density of the rotifers were significantly lowered by solutions high in heavy metal concentration. Interactions of any given element with the other 4 in concentration in the solution all significantly influenced population growth rate of the rotifers, while interactions of Zn2+with the other 4 in concentration in the solution significantly influenced maximal population density of the rotifers. The rotifers were more sensitive to interactions between the elements in the solution in population growth rate than in maximal population density. So they can be used as bio-indicator to monitor combined heavy metals pollution of water bodies.
solution of heavy metal mixture;Brachionuscalyciflorus; population growth rate; maximal population density
2016-01-28
国家自然科学基金(31470015); 安徽省高等学校自然科学研究重点项目(KJ2016A063); 安徽工程大学青年科研基金(2015YQ01)
X52
A
1673-4831(2017)01-0077-07
10.11934/j.issn.1673-4831.2017.01.011
徐晓平(1979—),男,安徽当涂人,讲师,博士,研究方向为水污染检测与控制及水生态毒理学。E-mail: xuxp1979@126.com
① 通信作者E-mail: ylxi1965@126.com
