南方水稻黑条矮缩病毒安徽分离物S5片段的克隆及S5-2基因的原核表达
2017-02-09单文书夏伟伟张享享蒋西子
江 彤,单文书,夏伟伟,张享享,蒋西子
(安徽农业大学 植物保护学院, 安徽 合肥 230036)
南方水稻黑条矮缩病毒安徽分离物S5片段的克隆及S5-2基因的原核表达
江 彤,单文书,夏伟伟,张享享,蒋西子
(安徽农业大学 植物保护学院, 安徽 合肥 230036)
【目的】探讨南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus,SRBSDV)安徽分离物(SRBSDV-AnHui-HN2)的遗传特性,并获得原核表达的P5-2蛋白。【方法】RT-PCR扩增SRBSDV S5片段,克隆、测序并进行序列分析。将S5-2基因插入原核表达载体,重组载体转化大肠埃希菌并用IPTG诱导,Ni2+-NTA亲和柱纯化融合蛋白,SDS-PAGE分析P5-2蛋白的表达情况。【结果】SRBSDV-AnHui-HN2 S5片段全长3 167 bp,包含S5-2基因全长612 bp,编码204个氨基酸。序列比对结果显示,SRBSDV-AnHui-HN2 S5片段与其他SRBSDV分离物S5片段的序列相似性极高,达99.0%~99.7%,而与斐济病毒属(Fijivirus)其他成员S5片段的序列相似性较低,仅为38.0%~71.3%;构建的 S5片段系统发育树表明SRBSDV和RBSDV聚成1个分支,其中6个SRBSDV分离物聚成1个亚分支。原核表达获得相对分子质量约为47 000的重组蛋白,Western blot分析显示,GST单抗能够与重组融合蛋白发生特异性反应。【结论】SRBSDV各分离物之间亲缘关系非常近,而与Fijivirus其他成员亲缘关系较远,原核表达获得的融合蛋白为靶标蛋白。
南方水稻黑条矮缩病毒; S5片段;S5-2基因; 原核表达
南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus, SRBSDV)为呼肠孤病毒科Reovirides斐济病毒属Fijivirus[1]。该病毒由迁飞性昆虫介体白背飞虱Sogatellafurcifera传播[2],病毒可在虫体内增殖,虫体一旦获毒,可终身带毒[3]。研究[4]表明SRBSDV可侵染水稻Oryzasativa、玉米Zeamays、稗草Echinochloacrusgalli和白草Pennisernmflaccidum等多种禾本科植物。感染SRBSDV的水稻表现出植株矮缩、叶色深绿、节部气生须根倒生等典型症状[5]。近年来,由于耕作制度的改变、气候变暖和白背飞虱暴发等多种因素的影响,SRBSDV在我国多个省市流行成灾。2009年,SRBSDV在江西、湖南和广东等部分地区严重发生,受害面积超过30万hm2,约6 500 hm2水稻绝收[6-7]。2010年,SRBSDV在安徽省6市26县水稻种植区大发生,受灾面积约3.3万hm2[8]。
SRBSDV病毒粒体为正二十面体等轴状粒子,直径70~75 nm,其基因组由 10 条 dsRNA 组成,分别命名为S1~S10,共编码 13 个蛋白[1,9]。根据水稻黑条矮缩病毒(Rice black-streaked dwarf virus, RBSDV)基因组结构推测SRBSDV共编码6个结构蛋白(S1、S2、S3、S4、S8、S10)和7个非结构蛋白(S5-1、S5-2、S6、S7-1、S7-2、S9-1、S9-2)[10-12]。目前,仅有部分片段编码的蛋白功能得到注释,S1 编码Rep蛋白,指导基因组RNA的复制;S4编码外壳蛋白的B型突起[13];S5-2编码的蛋白主要定位于细胞质,且能在细胞质中形成较大的颗粒状聚集体[14];S6编码1个RNA沉默抑制子,协助病毒克服寄主的防御体系,利于病毒的侵染[15];S7-1编码一种小管蛋白,与病毒的胞间移动有关[10];S8编码核心内衣壳蛋白,参与形态构建[16];S9-1编码蛋白与病毒基质的形成密切相关,是 dsRNA 合成及病毒组装的重要场所[10];S10编码外壳蛋白,决定了该病毒的表面抗原特性[17]。
水稻叶片胶体金定位和本氏烟叶片亚细胞定位研究[18]发现,RBSDV编码的13个蛋白中,仅S5-2编码的P5-2蛋白定位在叶绿体上,RBSDV侵染水稻表现的叶色深绿症状可能与P5-2蛋白有关,推测P5-2蛋白可能是RBSDV的症状决定子。SRBSDVS5-2基因编码的P5-2蛋白可能具有相似的功能,因此,本研究克隆SRBSDV安徽分离物S5片段序列,探究来源于安徽的SRBSDV S5片段与Fijivirus其他成员S5片段之间的序列差异;再进行原核表达获得P5-2融合蛋白,以期为深入研究P5-2蛋白的功能奠定基础。
1 材料与方法
1.1 材料
感染SRBSDV的水稻样本于2012年8月采自安徽怀宁,样本保存于-80 ℃冰箱;大肠埃希菌EscherichiacoliDH5α和BL21及原核表达载体pET-GST保存于安徽农业大学植物保护学院植物病理研究室;克隆载体pMD19-T、T4-DNA连接酶及DNA内切酶购自TaKaRa公司,硝酸纤维素膜购自北京索莱宝公司,Ni2+柱购自QiaGen公司;GST-Taq·Antibody单抗、AP·羊抗小鼠IgG二抗及异丙基硫代半乳糖苷(IPTG)购自美国Amersham Pharmacia公司;DNA marker、蛋白marker、PCR凝胶回收试剂盒和质粒提取试剂盒购自天根生化科技公司;Trizol® Plus RNA Purification Kit购自北京全氏金生物科技有限公司;TaqDNA聚合酶、HiFi-MMV反转录试剂盒购自Promega公司;其余试验药品均购自国药生物公司。引物合成及测序为上海Invitrogen公司。
1.2 方法
1.2.1 SRBSDV S5片段的克隆与序列分析 称取0.1 g水稻感病样本,加液氮研磨,再用RNA抽提试剂盒提取水稻叶片总RNA,详细方法参照Trizol® Plus RNA Purification Kit说明书。反转录水稻总RNA,得到cDNA。 以cDNA为模板扩增S5片段,引物S5-F:5′-AAGTTTTTTTCACTCATGACATATTCGA-3′/S5-R:5′-GACATCAGCTGTATTCACTCC-3′,反应条件为 94 ℃ 45 s,53 ℃ 45 s,72 ℃ 120 s,循环30次。用纯化的目的片断连接载体pMD19-T,热击转化DH5α,挑取单菌落为模板,PCR扩增筛选阳性转化子。根据测序结果获得SRBSDV S5片段核苷酸序列。运用软件DNAMAN Version 5.22和DNAStar进行序列分析。采用邻近相连法(Neighbor-joining)构建系统发育树。
1.2.2 SRBSDVS5-2基因的克隆及原核表达载体的构建 根据SRBSDV片段S5的核苷酸序列设计扩增引物,正向引物添加酶切位点BamH I,S5-2-F:5′-ACGGATCCATGTCTATGACACGTT-3′,反向引物添加酶切位点SalI位点,S5-2-R:5′-CCGTCGACTCA-AACATGAAGTATA-3′。以含有S5片段的质粒DNA为模板,PCR扩增S5-2基因,反应条件为94 ℃ 45 s,56 ℃ 45 s,72 ℃ 60 s,循环30次。琼脂糖电泳纯化扩增的DNA目的片段,连接载体pMD19-T,热击转化DH5α,挑取单菌落PCR筛选阳性转化子pMD-S5-2。重组载体pMD-S5-2和表达载体pET-GST均用限制性内切酶BamH I和SalI酶切,再将S5-2基因插入表达载体pET-GST,热击转化DH5α,挑取单菌落PCR筛选阳性转化子pET-S5-2。
1.2.3 融合蛋白的表达、纯化与检测 将获得的质粒pET-S5-2转化BL21,挑取阳性转化子接种于LB培养基,37 ℃条件下振荡培养12 h,再扩大培养至菌液D600 nm= 0.6。诱导条件为28 ℃、10 h、0.2 mmoL·L-1IPTG。将培养好的菌液离心,收集菌体,在超声破碎仪内处理15 min,12 000 r·min-1条件下,将破碎的菌液离心 30 min;上清液转移至新的离心管,加入1 mL的镍胶亲和纯化琼脂糖(Ni2+-NTA),过柱纯化获得融合蛋白。
共设 4 个处理的菌液,空载体pET-GST未诱导、空载体pET-GST诱导、重组载体pET-S5-2未诱导和重组载体pET-S5-2诱导。各处理菌液用PBS缓冲液重新悬浮,混入5×Buffer,在沸水中处理 5 min,再冰浴 10 min;离心后,上清液转移到新的离心管,即为制备的上样样品。相同方法处理过柱纯化获得的融合蛋白制备上样样品。制备2块聚丙烯酰胺凝胶,同时电泳,第 1 块凝胶用考马斯亮蓝染色后观察蛋白条带,第 2 块凝胶用作Western blot分析,先覆盖NC膜进行转印,再将NC膜转移至 50 g·L-1奶粉溶液中,25 ℃轻微振荡处理 2 h,加入稀释 2 000 倍的GST-Taq·Antibody单抗(一抗),25 ℃条件下振荡处理 1 h,PBST溶液冲洗 3 次,再用稀释 2 000 倍的AP·羊抗小鼠IgG(二抗)振荡处理 2 h,PBST溶液冲洗 5 次,最后加入NBT/BCIP显色。
2 结果与分析
2.1 SRBSDV S5片段的克隆与序列分析
将PCR扩增的SRBSDV安徽分离物(SRBSDV-AnHui-HN2)S5片段克隆并测序,序列长度为3 167 bp,序列的GenBank登录号为:HF954999。比对SRBSDV-AnHui-HN2 S5片段和NCBI下载的斐济病毒属(Fijivirus)其他分离物S5片段的序列相似性,发现SRBSDV-AnHui-HN2 S5片段与其他SRBSDV S5片段的序列相似性极高,达99.0%~99.7%,而与其他Fijivirus成员S5片段的序列相似性较低,仅为38.0%~71.3%(表1)。
表1 SRBSDV-Anhui-HN2 S5片段与16个斐济病毒属其他分离物S5片段核苷酸序列的相似性
Tab.1 Nucleotide sequence similarity between S5 segment of SRBSDV-Anhui-HN2 and S5 segments of 16 other isolates ofFijivirus
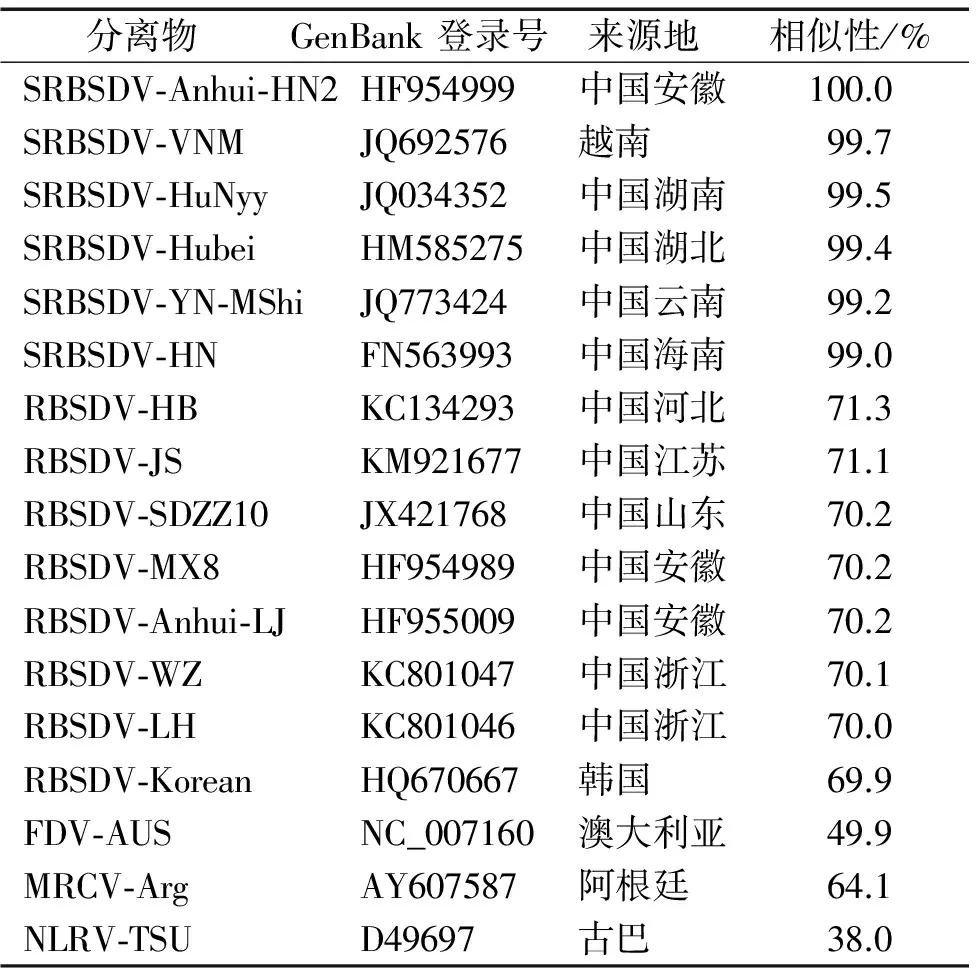
分离物GenBank登录号来源地相似性/%SRBSDV⁃Anhui⁃HN2HF954999中国安徽100.0SRBSDV⁃VNMJQ692576越南99.7SRBSDV⁃HuNyyJQ034352中国湖南99.5SRBSDV⁃HubeiHM585275中国湖北99.4SRBSDV⁃YN⁃MShiJQ773424中国云南99.2SRBSDV⁃HNFN563993中国海南99.0RBSDV⁃HBKC134293中国河北71.3RBSDV⁃JSKM921677中国江苏71.1RBSDV⁃SDZZ10JX421768中国山东70.2RBSDV⁃MX8HF954989中国安徽70.2RBSDV⁃Anhui⁃LJHF955009中国安徽70.2RBSDV⁃WZKC801047中国浙江70.1RBSDV⁃LHKC801046中国浙江70.0RBSDV⁃KoreanHQ670667韩国69.9FDV⁃AUSNC_007160澳大利亚49.9MRCV⁃ArgAY607587阿根廷64.1NLRV⁃TSUD49697古巴38.0
构建SRBSDV安徽分离物与Fijivirus其他成员S5核苷酸序列系统关系树(图1),结果发现,SRBSDV和RBSDV聚成一个分支,其中6个SRBSDV分离物聚成一个亚分支,8个RBSDV分离物聚成另一个亚分支。而里奥夸尔托病毒(Mal de Rio Cuarto virus, MRCV)、稻飞虱呼肠孤病毒(Nilaparvata lugens reovirus, NLRV)和斐济病病毒(Fiji disease virus, FDV)分别单独聚成一个分支。

图1 基于S5片段核苷酸序列构建的系统关系树
Fig.1 Relationship dendrogram of SRBSDV-Anhui-HN2 and other isolates ofFijivirusbased on S5 segment sequences
2.2 SRBSDV S5-2重组表达载体的构建
PCR扩增的模板为含有S5片段的质粒DNA,引物为S5-2-F和S5-2-R,只能扩增出1条约600 bp的条带,将此特异性条带克隆并测序,证明插入pMD19-T simple的S5-2基因没有发生变异。再将S5-2基因亚克隆到原核表达载体pET-GST上,BamH I和SalI双酶切验证,片段大小和理论值完全相符(图2),测序验证S5-2基因序列未发生突变,说明插入的S5-2基因读码框正确。
2.3 重组蛋白的诱导表达与纯化
从图3a 可以看出,pET-S5-2诱导表达的P5-2蛋白条带相对分子质量大约为47 000,与理论预测完全符合。从图3b 可以看出,GST-Taq·Antibody单抗可以和pET-S5-2诱导表达的P5-2融合蛋白以及纯化的P5-2融合蛋白特异性结合,在蛋白相对分子质量47 000的P5-2融合蛋白位置均出现一条明显的条带;而pET-GST空载体未诱导、pET-GST空载体诱导和pET-S5-2未诱导3个处理,各个泳道蛋白相对分子质量47 000位置均未出现条带。

M:DNA marker DL2000; 1:BamH I和SalI双酶切pET-S5-2; 2:BamH I单酶切pET-S5-2;3:SalI单酶切pET-S5-2;4:重组质粒pET-S5-2。
图2 重组质粒pET-S5-2的酶切电泳图谱
Fig.2 Electrophoresis pattern of recombinant plasmid pET-S5-2 digested with restriction enzyme

M:分子质量蛋白Marker;1:pET-GST空载体未诱导;2:pET-GST空载体诱导;3:pET-S5-2未诱导;4:pET-S5-2诱导;5:纯化的融合蛋白。
图3 融合蛋白的SDS-PAGE和Western blot分析
Fig.3 SDS-PAGE and Western blot analysis of fusion protein
3 讨论与结论
序列比对发现SRBSDV-AnHui-HN2与其他SRBSDV各分离物S5片段的序列相似性极高,说明SRBSDV S5片段核苷酸序列在序列进化过程中非常保守。系统关系树表明SRBSDV和RBSDV聚成一个分支,而NLRV、FDV和MRCV分别单独聚成一个分支。研究发现,SRBSDV和RBSDV同属于Fijivirus属亚组II,SRBSDV和RBSDV的血清学关系较强[19],均为害水稻和玉米,主要发病地区是东亚和东南亚,但SRBSDV的传播介体是白背飞虱,RBSDV的传播介体是灰飞虱Laodelphaxstriatellus[2]。NLRV属于Fijivirus属亚组V,只能侵染褐飞虱Nilaparavatalugens,与Fijivirus属其他成员没有任何血清学关系[20]。FDV属于Fijivirus属亚组I,传播介体是甘蔗扁角飞虱Perkinsiellaspp.,自然寄主为甘蔗Saccharumofficinarum,主要发病地区是澳大利亚,与Fijivirus属其他成员也没有任何血清学关系[21]。MRCV虽属于Fijivirus属亚组II,但其传播介体是明飞虱Delphacodeskuscheli,主要寄主是玉米,也能侵染高粱SorghumbicolorL.、小麦TriticumaestivumLinn.和燕麦AvenasativaL.等禾本科作物,一般发生于南美洲的阿根廷和巴西南部,与SRBSDV和RBSDV血清学关系均较弱[22]。
张蔚明等[17]制备的SRBSDV P10蛋白特异性抗血清,可用于带毒白背飞虱和感病水稻寄主的快速检测。羊健等[16]原核表达了RBSDV P8蛋白并制备了P8蛋白的多抗血清,可用于RBSDV田间病株的快速诊断。张上林等[23]原核表达了RBSDV P7-2蛋白,与水稻总蛋白进行了Pull-Down试验,鉴定出与P7-2互作的4个水稻蛋白。本研究利用载体pET-GST获得了带有6×His和GST双标签的P5-2融合蛋白,28 ℃、10 h和0.2 mmol·L-1IPTG条件下诱导,P5-2蛋白能够快速、大量地表达,但表达的P5-2蛋白为沉淀蛋白,缺乏生物活性,可用于抗血清制备,但不能进行蛋白互作试验[24]。为了获得具有生物活性的可溶性蛋白,需降低诱导温度,延长诱导时间,调整IPTG诱导浓度等优化诱导条件,提高可溶性蛋白的表达量,为开展Pull-down和Co-IP等蛋白互作试验奠定基础。
[1] ZHOU G H, WEN J J, CAI D J, et al. Southem rice black-streaked dwarf virus: A new proposedFijivirusspecies in the family Reoviridae[J]. Chinese Sci Bull, 2008, 53(23): 3677-3685.
[2] 季英华, 高瑞珍, 张野, 等. 一种快速同步检测水稻黑条矮缩病毒和南方水稻黑条矮缩病毒的方法[J]. 中国水稻科学, 2011, 25(1): 91-94.
[3] 王强, 周国辉, 张曙光. 南方水稻黑条矮缩病毒一步双重RT-PCR检测技术及其应用[J]. 植物病理学报, 2012, 42(1): 84-87.
[4] 周国辉, 张曙光, 邹寿发, 等. 水稻新病害南方水稻黑条矮缩病发生特点及危害趋势分析[J]. 植物保护, 2010, 36(2): 144-146.
[5] ZHOU G H, XU D L, XU D G, et al. Southern rice black-streaked dwarf virus: A white-backed planthopper-transmittedfijivirusthreatening rice production in Asia[J]. Front Microbiol, 2013, 4: 270.
[6] 刘欢, 倪跃群, 饶黎霞, 等. 南方水稻黑条矮缩病毒和水稻条矮缩病毒的单抗制备及其检测应用[J]. 植物病理学报, 2013, 43(1): 27-34.
[7] 杨迎青, 兰波, 孟凡, 等. 江西省白背飞虱消长动态及南方水稻黑条矮缩病带毒率的测定[J]. 华中农业大学学报, 2013, 32(6): 60-64.
[8] 郑兆阳, 张启勇, 沈光斌. 安徽省南方水稻黑条矮缩病发生现状和综防对策[J]. 安徽农学通报, 2011, 17(7): 132-188.
[9] 丁铭, 尹跃艳, 方琦, 等. 云南水稻上检测到南方水稻黑条矮缩病毒[J]. 植物病理学报, 2011, 41(6): 640-644.
[10]LIU Y, JIA D S, CHEN H Y, et al. The P7-1 protein of Southern rice black-streaked dwarf virus, afijivirus, induces the formation of tubular structures in insect cells[J]. Arch Virol, 2011, 156(10): 1729-1736.
[11]羊健. 水稻黑条矮缩病毒S5基因组功能的研究[D]. 长沙:湖南农业大学, 2007: 1-57.
[12]ZHANG P, MAR T T, LIU W W, et al. Simultaneous detection and differentiation of Rice black streaked dwarf virus (RBSDV) and Southern rice black streaked dwarf virus (SRBSDV) by duplex real time RT-PCR[J]. Virol J, 2013(10): 24-35.
[13]张恒木, 雷娟利, 陈剑平, 等. 浙江和河北发生的一种水稻, 小麦, 玉米矮缩病是水稻黑条矮缩病毒引起的[J]. 中国病毒学, 2001, 16(3): 246-251.
[14]章松柏, 王开放, 刘小娟, 等. 南方水稻黑条矮缩病毒非结构蛋白的亚细胞定位研究[J]. 热带作物学报2013, 34(11): 2102-2107.
[15]卢嫣红, 张金凤, 熊如意, 等. 南方水稻黑条矮缩病毒S6编码一个沉默抑制子[J]. 中国农业科学, 2011, 44(14): 2909-2917.
[16]羊健, 张恒木, 陈剑平, 等. 水稻黑条矮缩病毒p8蛋白的原核表达、抗血清制备及其特性[J]. 植物保护 学报, 2007, 34(3): 252-258.
[17]张蔚明, 刘燕娟, 周倩, 等. 南方水稻黑条矮缩病毒外壳蛋白P10的原核表达和抗血清制备及应用[J]. 湖南农业大学学报(自然科学版), 2011, 37(4): 400-402.
[18] LIU X Y, YANG J, XIE L, et al. P5-2 of Rice black-streaked dwarf virus is a non-structural protein targeted to chloroplasts[J]. Arch Virol, 2015, 160(5): 1211-1217.
[19]洪健, 李德葆, 周雪平, 等. 植物病毒分类图谱[M]. 北京: 科学出版社, 2001: 64-67.
[20]NAKASHIMA N, KOIZUMI M, WATANABE H, et al. Complete nucleotide sequence of theNilaparvatalugensreovirus: A putative member of the genusFijivirus[J]. J Gen Virol, 1996, 77(1): 139-146.
[21]HARDING R M, BURNS P, GEIJSKES R J, et al. Molecular analysis of Fiji disease virus segments 2, 4 and 7 completes the genome sequence[J]. Virus Genes, 2006, 32(1): 43-47.
[22]DISTEFANO A J, CONCI L R, HIDALGO M M, et al. Sequence analysis of genome segments S4 and S8 ofMaldeRioCuartovirus(MRCV): Evidence that the virus should be a separateFijivirusspecies[J]. Arch Virol, 2002, 147(9): 1699-1709.
[23]张上林, 孙丽英 ,陈剑平. 四种水稻蛋白与水稻黑条矮缩病毒编码非结构蛋白P7-2的互作分析[J]. 浙江农业学报, 2013, 25(6): 1298-1303.
[24]陈秀, 饶雪琴, 阮小蕾, 等. 香蕉线条病毒MP功能域基因的克隆、原核表达及抗血清制备[J]. 华南农业大学学报, 2014, 35(2): 47-52.
【责任编辑 霍 欢】
Prokaryotic expression of S5-2 gene and cloning of S5 segment from Anhui isolate of Southern rice black-streaked dwarf virus
JIANG Tong, SHAN Wenshu, XIA Weiwei, ZHANG Xiangxiang, JIANG Xizi
(School of Plant Protection, Anhui Agricultural University, Hefei 230036, China)
【Objective】 To study genetic characteristics of the isolates of Southern rice black-streaked dwarf virus(SRBSDV) from Anhui province, and to obtain P5-2 protein by prokaryotic expression. 【Method】The S5 segment of SRBSDV was amplified by RT-PCR, and it was cloned, sequenced and analyzed. GeneS5-2 was inserted into prokaryotic expression vector. The recombinant vector was transformed intoEscherichiacoliand was induced by IPTG. The fusion protein was purified by Ni2+-NTA affinity column. The expression of P5-2 protein was analyzed by SDS-PAGE. 【Result】 The S5 segment from Anhui isolate of SRBSDV(SRBSDV-AnHui-HN2) was 3 167 bp in full length and contained a 612 bpS5-2 gene encoding 204 amino acids. Sequence comparison showed that the S5 segment of SRBSDV-AnHui-HN2 shared high sequence similarity(99.0%-99.7%) with other SRBSDV isolates, while had relatively low sequence similarity(38.0%-71.3%) to otherFijivirusmembers. The phylogenetic tree based on S5 segment sequences showed that SRBSDV and RBSDV clustered into a branch, and six isolates of SRBSDV clustered into a sub-branch. The recombinant protein with approximately 47 000 relative molecular mass was obtained by prokaryotic expression. Western blot analysis revealed that GST monoclonal antibody could specifically bind to the fusion protein. 【Conclusion】All isolates of SRBSDV are closely related, and they have relatively far relationship to otherFijivirusmembers. The fusion protein obtained by prokaryotic expression is the target protein.
Southern rice black-streaked dwarf virus; S5 segment;S5-2 gene; prokaryotic expression
2016- 04- 18优先出版时间:2016-12-28
江 彤(1970—),男,副教授,博士,E-mail: jiangtong4650@sina.com
国家自然科学基金(31371915);公益性行业(农业)科研专项(201303028)
S435.111.4
A
1001- 411X(2017)01- 0058- 05
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20161228.0937.040.html
江 彤,单文书,夏伟伟,等.南方水稻黑条矮缩病毒安徽分离物S5片段的克隆及S5-2基因的原核表达[J].华南农业大学学报,2017,38(1):58- 62.
