基于SRAP标记的任豆遗传多样性分析
2017-02-09周祥斌吴林瑛陈晓阳
林 玮,周 玮,周 鹏,周祥斌,吴林瑛,陈晓阳
(华南农业大学 林学与风景园林学院/广东省森林植物种质创新与利用重点实验室/广东木本饲料工程技术研究中心,广东 广州 510642)
基于SRAP标记的任豆遗传多样性分析
林 玮,周 玮,周 鹏,周祥斌,吴林瑛,陈晓阳
(华南农业大学 林学与风景园林学院/广东省森林植物种质创新与利用重点实验室/广东木本饲料工程技术研究中心,广东 广州 510642)
【目的】研究任豆Zeniainsignis种群遗传多样性,为有效保护任豆种质资源并进行遗传改良提供理论基础。【方法】在建立任豆SRAP-PCR反应体系的基础上,对17个任豆种源进行遗传多样性分析,并利用UPGMA聚类分析,对任豆种源进行类群划分。【结果】12对引物组合共扩增出151条带,平均每对引物获得12.58条。其中,多态性条带106条,平均每对引物8.83条,平均多态率为70.39%。种源间多态位点比率为38.96%~72.73%,平均为59.66%;基因多样性指数为0.175 5~0.313 3,平均为0.256 8;Shannon信息指数为0.249 4~0.450 2,平均为0.369 1;观测等位基因数(na)为1.519 5~1.727 3,平均达1.600 0,种源水平的na为1.724 9;有效等位基因数(ne)为1.330 5~1.577 3,平均达1.471 3,种源水平的ne为1.502 6;种源间的遗传一致度为0.703 1~0.886 5;遗传距离为0.120 5~0.352 3。根据聚类结果,将任豆17个种源分为3个地理类群:第1类为广西和贵州种源,第2类为广东、湖南和广西种源,第3类为云南种源,地理距离相近的种源基本上聚在同一类。【结论】任豆种源间和种源个体间均存在较丰富的遗传多样性,且种源内更丰富,遗传改良时应更注重种源内个体的选择。任豆种源间基因流不高,且根据聚类结果划分的3个类群的地理格局明显,应是由任豆特定的生活环境造成的隔离所致。
任豆; 种源; SRAP; 遗传多样性
任豆Zeniainsignis又称翅荚木、任木,苏木科任豆属落叶大乔木,为单种属,是华南石灰岩地区的特有种,也是国家二级重点保护植物[1]。该树种树形高大、通直,树高可达15~20 m,胸径可达1 m以上。任豆在我国主要分布于广西、广东、云南、湖南、贵州等地[2],也分布于印度-马来西亚-越南(或中南半岛)一带。任豆适应性广,具有适应干旱、干热性强等优良特点,能在石灰岩风化发育的酸性红壤和赤红壤上生长,是西南和华南地区石质山地造林、植被恢复重建的首选乡土树种之一[3]。任豆耐刈割,萌芽力强,枝叶粗蛋白含量高,适口性好,也是优良的木本饲料[4]。
遗传多样性研究可以为揭示物种的起源、物种间的亲缘关系等提供依据,对于有效地保护种质资源、开展遗传改良具有重要的意义。目前,对任豆遗传多样性的研究不多见,ISSR已有报道[1]。SRAP (Sequence-related amplified polymorphism)是一种基于PCR的分子标记技术,它结合了AFLP及RAPD的优点,具有简便、稳定、产率高、容易克隆目标片段等特点[5],且试验结果稳定,重复性较好[6]。本研究以17个任豆种源作为研究材料,采用SRAP分子标记技术,对任豆种源间以及种源内的遗传多样性进行分析,以期在DNA分子水平上揭示任豆的遗传多样性。
1 材料与方法
1.1 材料
根据任豆的天然分布,按照均衡抽样的原则,选取广东阳山和乐昌,广西那坡和平果,贵州罗甸和册亨,云南西畴和麻栗坡,湖南通道和江华等17个种源任豆作为研究材料,采种点覆盖任豆主要分布区,并均匀分布(表1)。于2013—2014年分批播种,苗圃设在华南农业大学。2014年7月初,每个种源选取10个家系,每个家系选出2株作为样株并挂牌标记,以幼嫩叶片作样品,叶片按单株编号,再分别置入塑料封口袋中,放入-80 ℃冰箱中保存备用。
表1 任豆采种点地理位置
Tab.1 Geographic location of different seed collection sites ofZeniainsignis
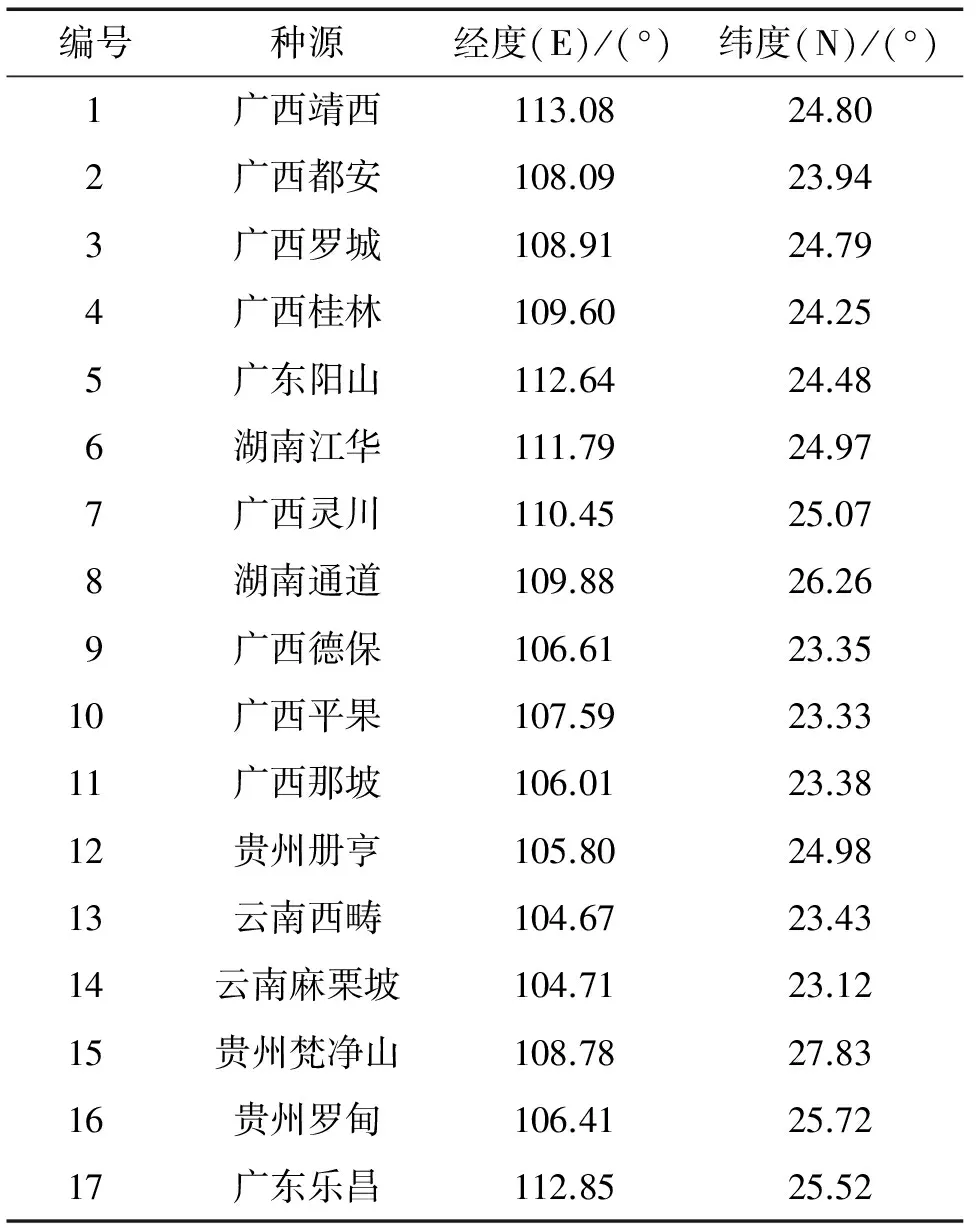
编号种源经度(E)/(°)纬度(N)/(°)1广西靖西113.0824.802广西都安108.0923.943广西罗城108.9124.794广西桂林109.6024.255广东阳山112.6424.486湖南江华111.7924.977广西灵川110.4525.078湖南通道109.8826.269广西德保106.6123.3510广西平果107.5923.3311广西那坡106.0123.3812贵州册亨105.8024.9813云南西畴104.6723.4314云南麻栗坡104.7123.1215贵州梵净山108.7827.8316贵州罗甸106.4125.7217广东乐昌112.8525.52
1.2 方法
1.2.1 DNA提取与纯化 使用由Omega Bio-tek公司生产的DNA提取试剂盒(HP plant DNA Kit, OMEGA)对任豆总DNA进行提取和纯化。用质量浓度为8 g·L-1的琼脂糖凝胶电泳检测纯度,对照DNA标准相对分子质量,计算所提取基因组DNA的浓度。
1.2.2 SRAP-PCR反应体系建立与优化 对SRAP反应体系主要因素[包括Taq酶,Mg2+浓度,模板DNA,三磷酸脱氧核苷酸(dNTP),引物]进行多水平优化试验。PCR产物用2.0 g·kg-1琼脂糖凝胶和溴化乙锭(EB)染色检测。根据最佳因素水平组合进行梯度退火试验,建立并优化SRAP反应体系。最适宜任豆的25 μL体系为:10×PCR buffer 2.5 μL、模板DNA 80 ng、Mg2+2.0 mmol·L-1、dNTP 0.225 mol·L-1、引物0.3 μmol·L-1和TaqDNA聚合酶1.25 U。经过反复试验,反应程序为:94 ℃预变性5 min;94 ℃变性1 min、35 ℃退火1 min、72 ℃延伸 1 min,5个循环;94 ℃ 变性 1 min、55 ℃退火1 min、72 ℃延伸 1 min,30个循环;72 ℃ 延伸10 min,4 ℃条件下保存。
再随机选取6个种源的任豆DNA,对建立的体系进行验证。
1.2.3 引物筛选 运用优化的SRAP-PCR反应体系进行引物筛选,挑选出4个地理差距较大的任豆种源DNA(云南西畴,湖南江华,贵州罗甸,广东阳山)作为模板,对729对引物组合进行初步筛选。从中挑选出120对可以产生多态性条带的引物组合,其条带较为清晰。再以随机选取的广东阳山、湖南通道、广西桂林、广西灵川、广西平果、广西那坡、贵州册亨、云南西畴8个种源为模板,对引物进行复筛,最后确定出12对效果最佳、扩增条带较多、背景清晰的引物用于SRAP-PCR反应。本试验根据Li等[7]提出的原则,设计SRAP引物,PCR扩增的引物采用上海生工生物工程技术服务有限公司的产品。最终设计出的引物见表2。
表2 任豆SRAP分析的引物序列
Tab.2 Primer sequences used for SRAP analysis ofZeniainsignis

引物编号正向序列引物编号反向序列Me15′TGAGTACAAACCGGATA3′Em15′GACTGCGTACGAATTTGC3′Me25′TGAGTACAAACCGGAGC3′Em25′GACTGCGTACGAATTTGC3′Me35′TGAGTACAAACCGGAAT3′Em35′GACTGCGTACGAATTGAC3′Me45′TGAGTACAAACCGGACC3′Em45′GACTGCGTACGAATTTGA3′Me55′TGAGTACAAACCGGAAG3′Em55′GACTGCGTACGAATTAAC3′Me65′TGAGTACAAACCGGTAA3′Em65′GACTGCGTACGAATTGCA3′Me75′TGAGTACAAACCGGTCC3′Em75′GACTGCGTACGAATTGAG3′Me85′TGAGTACAAACCGGTGC3′Em85′GACTGCGTACGAATTGCC3′Me95′TGAGTACAAACCGGACA3′Em95′GACTGCGTACGAATTTCA3′Me105′TGAGTACAAACCGGACG3′Em105′GACTGCGTACGAATTCAA3′Me115′TGAGTACAAACCGGACT3′Em115′GACTGCGTACGAATTGCA3′Me125′TGAGTACAAACCGGAGG3′Em125′GACTGCGTACGAATTCAT3′Me135′TGAGTACAAACCGGAAA3′Em135′GACTGCGTACGAATTCTA3′Me145′TGAGTACAAACCGGAAC3′Em145′GACTGCGTACGAATTCTC3′Me155′TGAGTACAAACCGGAGA3′Em155′GACTGCGTACGAATTCTT3′Me165′TGAGTACAAACCGGATA3′Em165′GACTGCGTACGAATTGAT3′Me175′TGAGTACAAACCGGTAG3′Em175′GACTGCGTACGAATTATG3′Me185′TGAGTACAAACCGGCAT3′Em185′GACTGCGTACGAATTAGC3′Me195′TGAGTACAAACCGGTTG3′Em195′GACTGCGTACGAATTACG3′Me205′TGAGTACAAACCGGTGT3′Em205′GACTGCGTACGAATTTAG3′Me215′TGAGTACAAACCGGTCA3′Em215′GACTGCGTACGAATTTCG3′Me225′TGAGTACAAACCGGGCA3′Em225′GACTGCGTACGAATTGTC3′Me235′TGAGTCCAAACCGGATG3′Em235′GACTGCGTACGAATTGGT3′Me245′TGAGTCCAAACCGGGAT3′Em245′GACTGCGTACGAATTCAG3′Me255′TGAGTCCAAACCGGGCT3′Em255′GACTGCGTACGAATTCTG3′Me265′TTCAGGGTGGCCGGATG3′Em265′GACTGCGTACGAATTCGG3′Me275′TGGGGACAACCCGGCTT3′Em275′GACTGCGTACGAATTCCA3′
1.2.4 数据统计与分析 SRAP-PCR产物经聚丙烯酰胺凝胶电泳分离后,统计凝胶同一位置上DNA带的有和无,有带的记为“1”,无带的记为“0”,形成0、1数据矩阵。采用POPGENE软件对全部群体和各单个群体分别进行基因多样性指数(h)、Shannon信息指数(I)、总基因多样度(Ht)、群体内的基因多样度(Hs)、种源遗传分化系数(Gst)和基因流(Nm)等遗传参数的分析[8],利用POPGENE 1.32计算遗传距离,根据采种点的经纬度,在http://jan.ucc.nau.edu/cvm/latlongdist.html上计算任豆各种源之间的地理直线距离(m),运用GenLAE 6.2进行Mantel检验[9],分析地理距离与遗传距离的相关性,分析时设定9 999次数据随机选择,利用NTSYS 2.1软件进行UPGMA聚类分析。
2 结果与分析
2.1 SRAP扩增结果分析
对样本进行了SRAP-PCR分析,用筛选出来的12对SRAP引物扩增出151条带(图1)。其中,106条具有多态性。平均每个引物扩增的多态性条带为8.83条,各引物多态性条带占58.34%~81.18%,平均为70.39%。多态性条带占比最高的引物组合为Me9/Em14,达到了81.18%,其次为Me7/Em10和Me17/Em14,均达到了76.92%。多态性条带占比最低的引物组合为Me1/Em17,但也达到了58.34%(表3)。
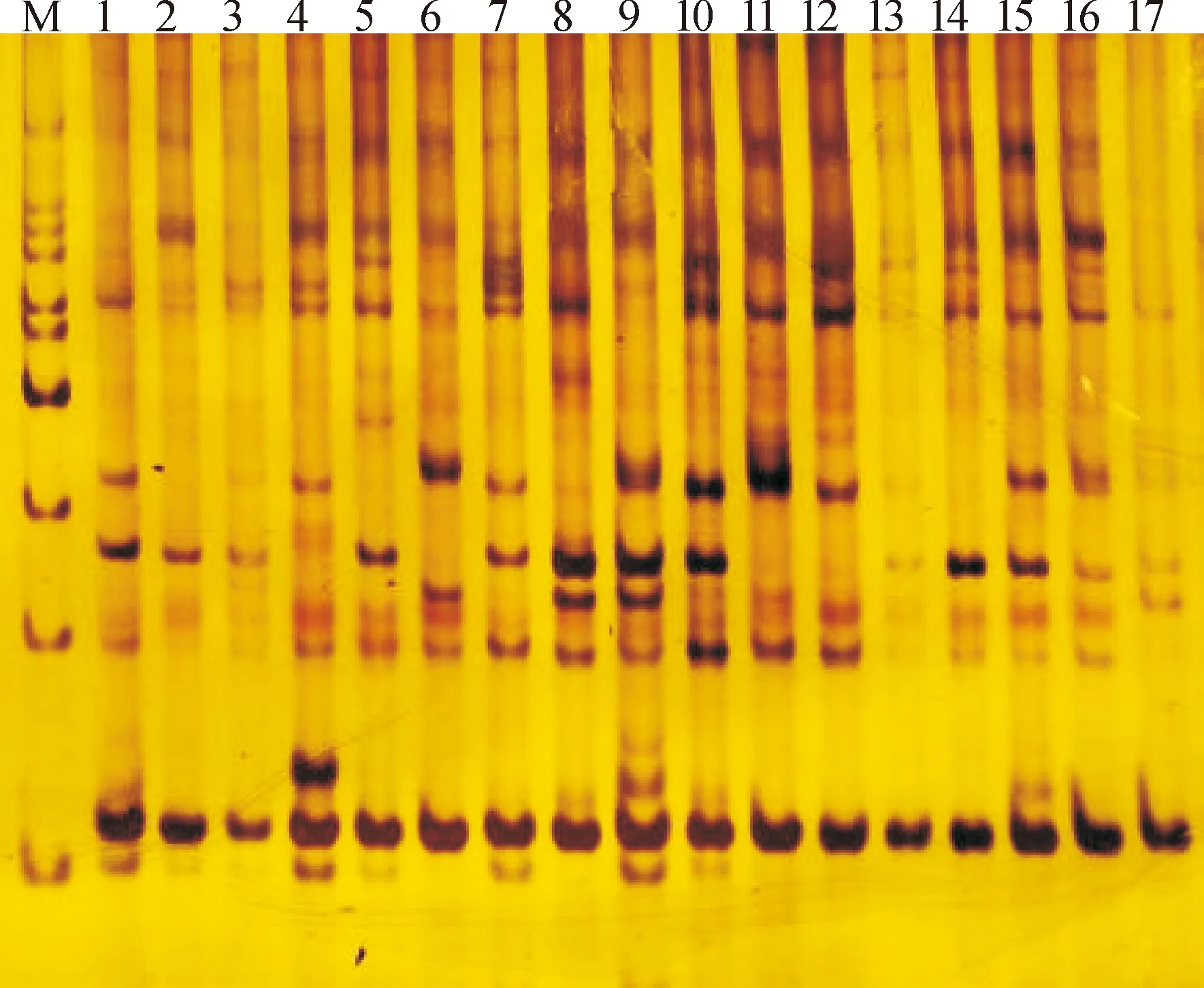
M:100 bp DNA ladder;任豆种源分别为1:广西靖西;2:广西都安;3:广西罗城;4:广西桂林;5:广东阳山;6:湖南江华;7:广西灵川;8:湖南通道;9:广西德保;10:广西平果;11:广西那坡;12:贵州册亨;13:云南西畴;14:云南麻栗坡;15:贵州梵净山;16:贵州罗甸;17:广东乐昌。
图1 各种源任豆SRAP引物扩增结果
Fig.1 Amplified results of SRAP primers
表3 任豆不同引物组合的多态性条带
Tab.3 Polymorphic bands of different primer combinations ofZeniainsignis
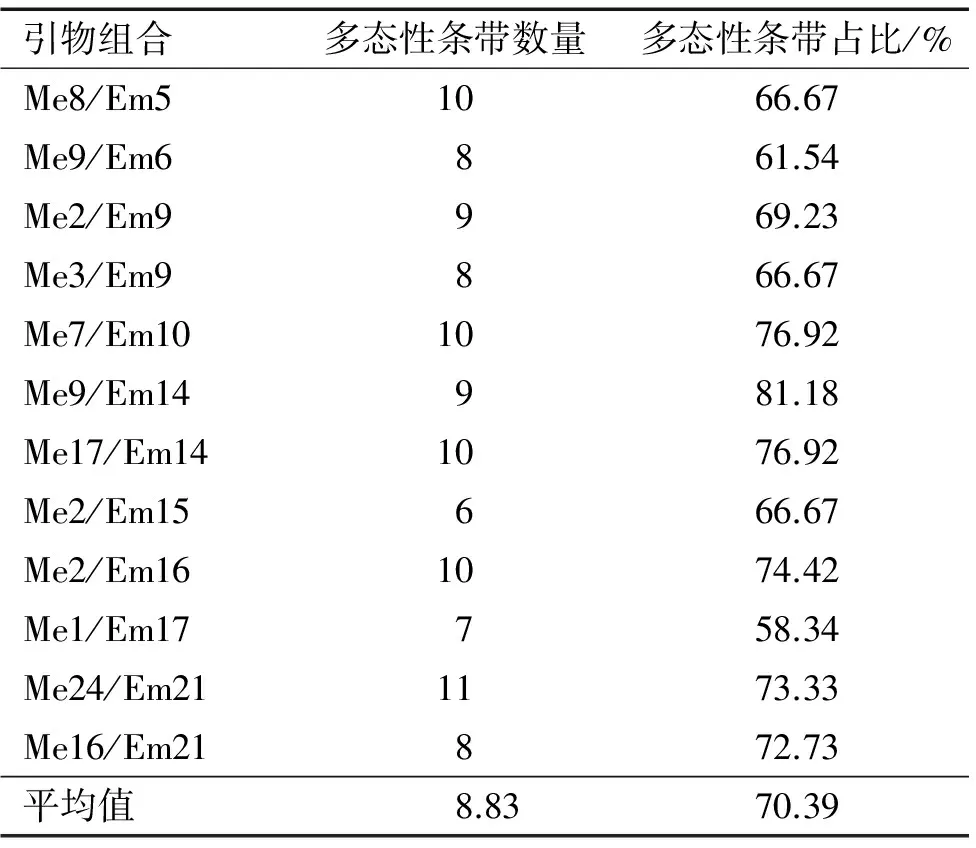
引物组合多态性条带数量多态性条带占比/%Me8/Em51066.67Me9/Em6861.54Me2/Em9969.23Me3/Em9866.67Me7/Em101076.92Me9/Em14981.18Me17/Em141076.92Me2/Em15666.67Me2/Em161074.42Me1/Em17758.34Me24/Em211173.33Me16/Em21872.73平均值8.8370.39
从表4可以看出,任豆17个种源的多态位点比率为38.96%~72.73%,平均为59.66%。其中贵州册亨种源的多态位点比率最高(72.73%),广西灵川种源的最低(38.96%)。由此表明:任豆种源间具有较高的多态位点比率,在种源内也存在较丰富的遗传多样性。种源内遗传多样性丰富有利于任豆对环境变化的适应。
表4 不同种源任豆的多态位点
Tab.4 Polymorphic loci forZeniainsignisfrom different provenances
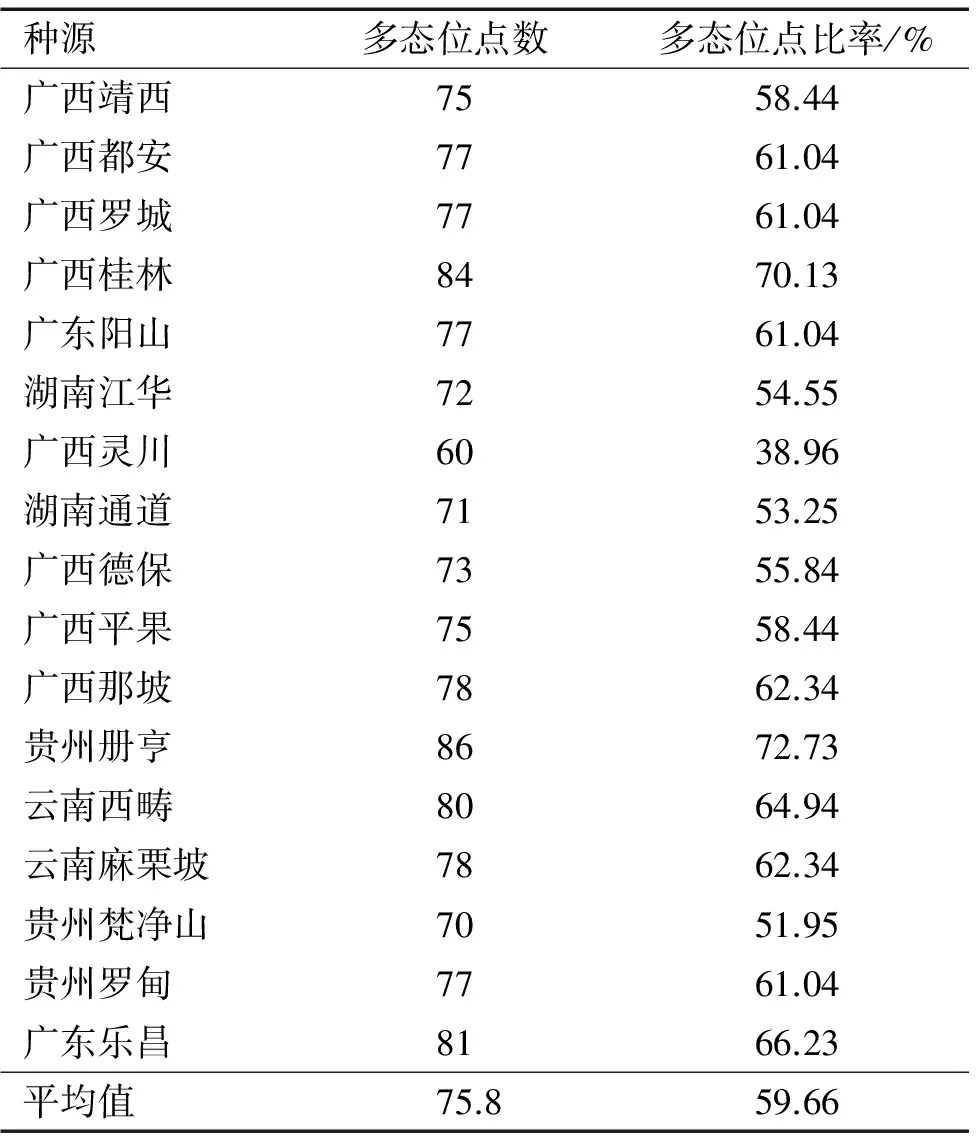
种源多态位点数多态位点比率/%广西靖西7558.44广西都安7761.04广西罗城7761.04广西桂林8470.13广东阳山7761.04湖南江华7254.55广西灵川6038.96湖南通道7153.25广西德保7355.84广西平果7558.44广西那坡7862.34贵州册亨8672.73云南西畴8064.94云南麻栗坡7862.34贵州梵净山7051.95贵州罗甸7761.04广东乐昌8166.23平均值75.859.66
2.2 任豆种源的遗传分化
各个种源的遗传多样性水平高低,可采用基因多样性指数(h)和Shannon信息指数(I)2种表型多样性指数来衡量。从表5可以看出:不同种源任豆的基因多样性指数差异明显。其中贵州册亨种源的基因多样性指数最高,达0.313 3,广西灵川种源的基因多样性指数最低,为0.175 5,全部种源间的基因多样性指数为0.285 8。不同种源任豆的Shannon信息指数以贵州册亨种源最高,达0.450 2,以广西灵川种源的Shannon信息指数最低,为0.249 4,全部种源间的Shannon信息指数为0.418 6。综合基因多样性和Shannon 2个指数,贵州册亨和广西桂林种源的遗传多样性水平较高,而贵州梵净山和广西灵川种源的遗传多样性水平较低,这可能与采种地的任豆林分布密集程度相关。此外,从表5还可以看出:17个种源任豆的观测等位基因数(na)为1.389 6~1.727 3,平均达1.600 0,种源水平的na为1.724 9;有效等位基因数(ne)为1.330 5~1.577 3,平均达1.471 3,种源水平的ne为1.502 6。以上分析结果均反映出任豆种源具有一定的遗传多样性。
表5 各种源任豆的遗传多样性
Tab.5 Genetic diversities inZeniainsignisfrom different provenances
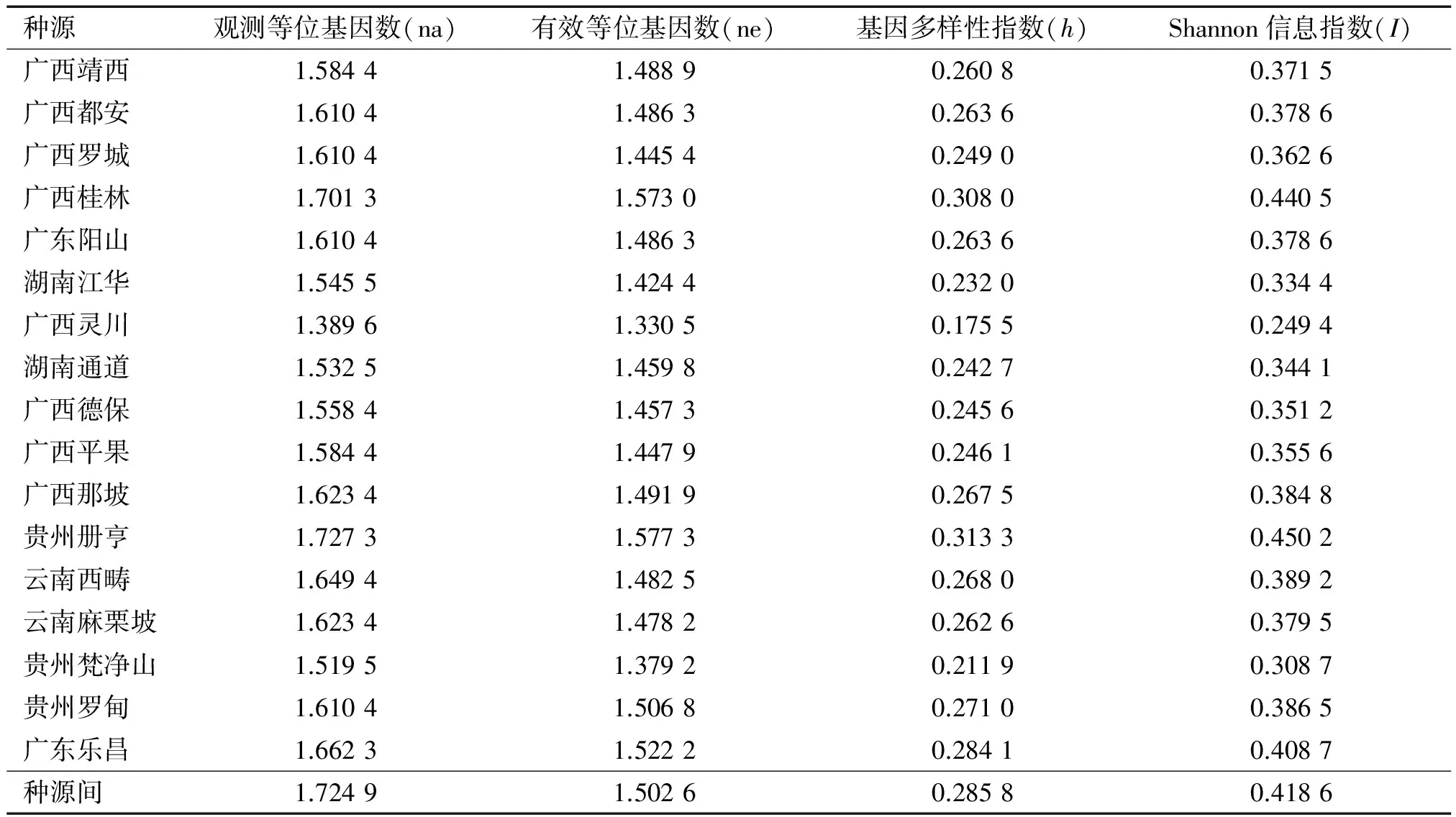
种源观测等位基因数(na)有效等位基因数(ne)基因多样性指数(h)Shannon信息指数(I)广西靖西1.58441.48890.26080.3715广西都安1.61041.48630.26360.3786广西罗城1.61041.44540.24900.3626广西桂林1.70131.57300.30800.4405广东阳山1.61041.48630.26360.3786湖南江华1.54551.42440.23200.3344广西灵川1.38961.33050.17550.2494湖南通道1.53251.45980.24270.3441广西德保1.55841.45730.24560.3512广西平果1.58441.44790.24610.3556广西那坡1.62341.49190.26750.3848贵州册亨1.72731.57730.31330.4502云南西畴1.64941.48250.26800.3892云南麻栗坡1.62341.47820.26260.3795贵州梵净山1.51951.37920.21190.3087贵州罗甸1.61041.50680.27100.3865广东乐昌1.66231.52220.28410.4087种源间1.72491.50260.28580.4186
任豆种源的遗传多样性相关指数显示,任豆所有种源总基因多样度(Ht)为0.382 6,种源群体内的基因多样度(Hs)为0.256 8,种源遗传分化系数(Gst)为0.328 8。这表明任豆种源内存在一定的遗传多样性。此外,任豆的基因流(Nm)为1.020 7,与其他异花授粉植物相比偏小,说明任豆种源间存在一定的基因交流,但偏少。种源间的遗传变异占总遗传变异的32.88%,67.12%的遗传变异发生在种源内的个体间,表明任豆种源间存在一定的遗传分化,但遗传变异主要还是来源于种源内。
2.3 任豆种源间遗传一致度和遗传距离
遗传一致度可用来判断种源之间的亲缘关系。当2个种源无亲缘关系时,遗传一致度为0,当2个群体完全一样时,遗传一致度为1。为了进一步了解任豆种群间的遗传关系,表6列出了17个任豆种源的遗传一致度和遗传距离。从表6可知,广西德保种源与云南西畴种源的遗传一致度最小,仅为0.703 1,二者遗传距离最大,为0.352 3。而广西都安与广西罗城、云南西畴与云南麻栗坡种源的遗传一致度最大,达0.886 5,遗传距离最小,为0.120 5。种源之间的亲缘关系虽然比较近,但仍然存在一定程度的遗传差异和遗传分化。
运用IBD软件对任豆遗传距离及地理距离进行Mantel检验,结果表明,任豆种源间遗传距离与地理距离之间的相关性达到极显著水平(r=0.312 5,P=0.001)。
2.4 任豆种源聚类分析
根据Nei[8]的遗传距离,采用UPGMA聚类分析,绘制任豆种源遗传关系聚类图(图2)。以遗传一致度为0.78为界,可以将17个种源分为3大类。第1类来自广西、贵州,包含有广西靖西、都安、罗城等种源和贵州罗甸、梵净山、册亨种源;第2类来自广东、湖南和广西,包括广东阳山、乐昌种源,湖南江华和通道种源,以及广西灵川种源;第3类仅来自云南,包括云南西畴和麻栗坡种源。从聚类结果可以看出,地理距离相近的种源几乎都聚在了同一类群。
表6 任豆种源间的遗传一致度和遗传距离1)
Tab.6 Genetic identity degrees and genetic distances betweenZeniainsignisfrom different provenances
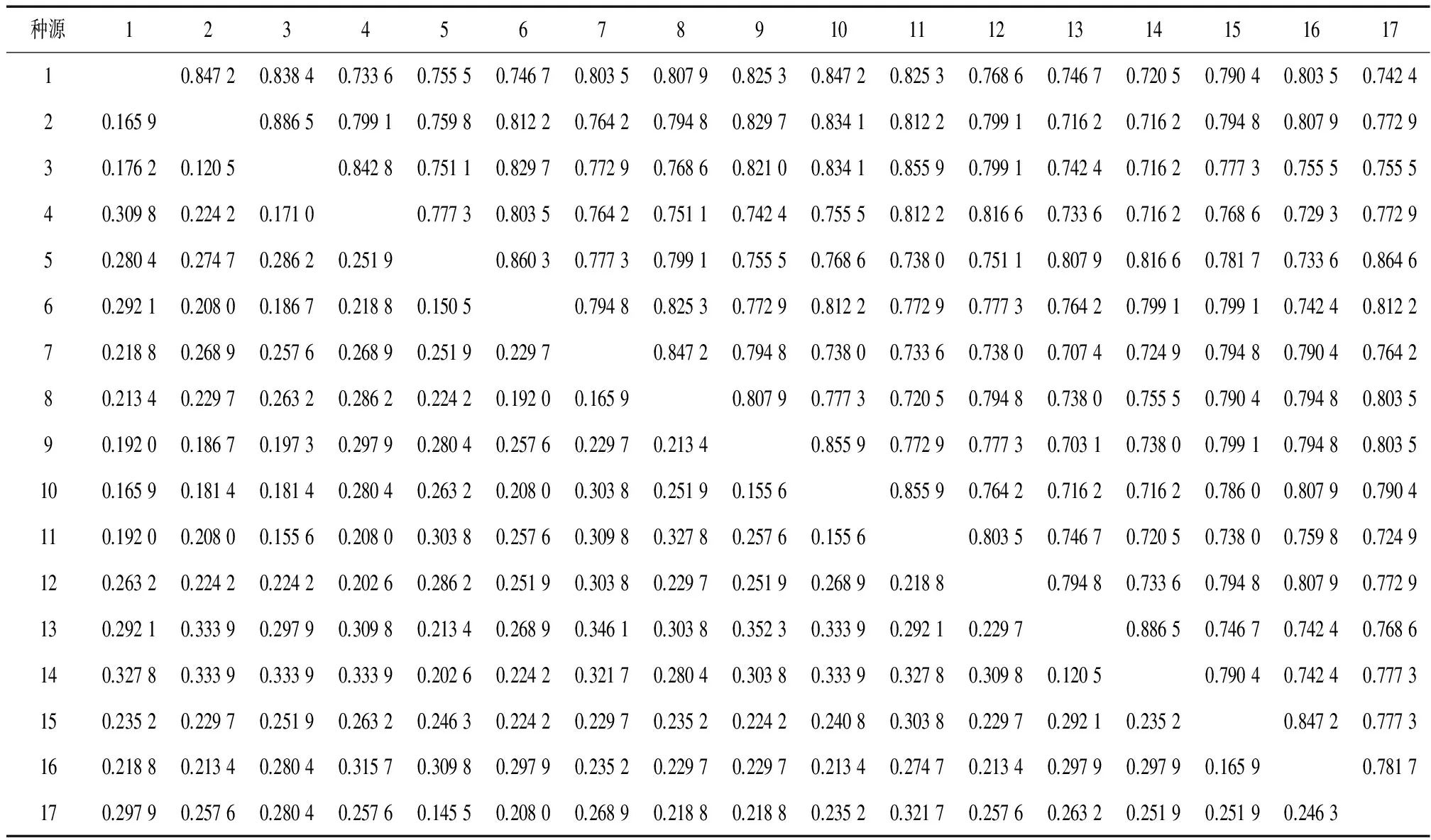
种源123456789101112131415161710.84720.83840.73360.75550.74670.80350.80790.82530.84720.82530.76860.74670.72050.79040.80350.742420.16590.88650.79910.75980.81220.76420.79480.82970.83410.81220.79910.71620.71620.79480.80790.772930.17620.12050.84280.75110.82970.77290.76860.82100.83410.85590.79910.74240.71620.77730.75550.755540.30980.22420.17100.77730.80350.76420.75110.74240.75550.81220.81660.73360.71620.76860.72930.772950.28040.27470.28620.25190.86030.77730.79910.75550.76860.73800.75110.80790.81660.78170.73360.864660.29210.20800.18670.21880.15050.79480.82530.77290.81220.77290.77730.76420.79910.79910.74240.812270.21880.26890.25760.26890.25190.22970.84720.79480.73800.73360.73800.70740.72490.79480.79040.764280.21340.22970.26320.28620.22420.19200.16590.80790.77730.72050.79480.73800.75550.79040.79480.803590.19200.18670.19730.29790.28040.25760.22970.21340.85590.77290.77730.70310.73800.79910.79480.8035100.16590.18140.18140.28040.26320.20800.30380.25190.15560.85590.76420.71620.71620.78600.80790.7904110.19200.20800.15560.20800.30380.25760.30980.32780.25760.15560.80350.74670.72050.73800.75980.7249120.26320.22420.22420.20260.28620.25190.30380.22970.25190.26890.21880.79480.73360.79480.80790.7729130.29210.33390.29790.30980.21340.26890.34610.30380.35230.33390.29210.22970.88650.74670.74240.7686140.32780.33390.33390.33390.20260.22420.32170.28040.30380.33390.32780.30980.12050.79040.74240.7773150.23520.22970.25190.26320.24630.22420.22970.23520.22420.24080.30380.22970.29210.23520.84720.7773160.21880.21340.28040.31570.30980.29790.23520.22970.22970.21340.27470.21340.29790.29790.16590.7817170.29790.25760.28040.25760.14550.20800.26890.21880.21880.23520.32170.25760.26320.25190.25190.2463
1)对角线上方为遗传一致度,对角线下方为遗传距离; 任豆种源分别为 1:广西靖西, 2:广西都安, 3:广西罗城, 4:广西桂林, 5:广东阳山, 6:湖南江华, 7:广西灵川, 8:湖南通道, 9:广西德保, 10:广西平果, 11:广西那坡, 12:贵州册亨, 13:云南西畴, 14:云南麻栗坡, 15:贵州梵净山, 16:贵州罗甸, 17:广东乐昌。

图2 任豆种源UPGMA聚类图Fig.2 Dendrogram based on genetic distances among Zenia insignis from different provenances
3 讨论与结论
SRAP-PCR反应体系受诸多因素的影响。本试验建立并优化了任豆SRAP-PCR反应体系,并进行了任豆种源遗传多样性分析。本试验所得到的任豆SRAP-PCR扩增体系与麻疯树Jatrophacarcas[10]、油茶Camelliaoleifera[11]、杨树Populusadenopoda[12]等的扩增体系及循环条件都有所不同,可能与不同材料的基因组和材料本身的特殊性以及读带时主观性等因素有关,因此需要对PCR体系进行优化,对任豆模板DNA 、Mg2+、引物和Taq酶等关键条件水平进行探索。研究发现,SRAP对任豆DNA浓度的要求不高,有一个较宽的适宜浓度范围。经过反复试验后,根据电泳条带的数量、清晰度及背景颜色等条件为所得条带综合评分。最终探索出的25 μL体系为:10×PCR buffer 2.5 μL、模板DNA 80 ng、Mg2+2.0 mmol·L-1、dNTP 0.225 mol·L-1、引物0.3 μmol·L-1和TaqDNA聚合酶1.25 U。该体系实现了最佳扩增的目的。以广西平果、广西那坡、湖南通道、湖南江华、广东阳山、贵州册亨的6个任豆种源DNA为模板,选取引物Me7/Em8进行SRAP-PCR反应体系稳定性验证,结果表明,筛选体系能很好地满足任豆基因组SRAP-PCR扩增的要求,且不同种源间条带有明显差异。对筛选出的12对引物组合进行PCR扩增,平均每对引物扩增出8.83条带,多态带比率平均为70.39%,较好地显示了任豆的多态性。
多态位点比率、Shannon信息指数和基因多样性指数作为评价种群内和种群间遗传多样性的指标,其数值越大,表明种群的遗传多样性越高。据测定,17个任豆种源平均多态位点比率达到59.66%,种源间Shannon信息指数为0.249 4~0.450 2,平均为0.369 1,基因多样性指数在0.175 5~0.313 3,平均为0.256 8。与其他树种相比,任豆种群遗传多样性并不高。例如,枫香Liquidambarformosana、木荷Schimasuperba、油松Pinustabuliformis、蜡梅Chimonanthuspraecox群体多态位点比率分别为87.41%、90.02%、91.67%、88.70%[13]。此外,近几年基于SPRAP分子标记的木本植物遗传多样性研究结果表明:红椎Castanopsishystrix多态性比率为94.89%[13],小果油茶Camelliameiocarpa多态性比率和Shannon信息指数分别为84.96%~95.58%和0.4732~0.5676[14];白花树Styraxtonkinensis在物种水平上的多态位点比率为91.0%,Shannon表型多样性指数为0.453 6[15];侧柏Platycladusorientalis的Shannon信息指数为0.194 9[16];大花黄牡丹Paeonialudlowii多态位点比率为90.15%,Shannon信息指数平均为0.252 1[17];构树Broussonetiapapyrifera多态位点比率为72.6%,Shannon信息指数均值为0.227 5[18]。
不同种源的遗传多样性差异较大,而物种遗传多样性水平决定着物种对选择的反应能力,是制定物种遗传多样性保护与利用策略的必需信息。贵州册亨和广西桂林种源的遗传多样性水平较高,这可能与其生境多样复杂、地理隔离特殊等因素有关,从而有利于遗传变异的积累。在开展任豆种质资源保护中,应更加重视对贵州册亨和广西桂林等遗传多样性水平较高种群的保护。
任豆种源间和种源内均存在显著的遗传变异。其中,种源间的遗传变异占总遗传变异的32.88%,种源内的个体间遗传变异占67.12%,说明任豆种源内个体间的遗传变异是主要的。Hamrick等[19]总结了322种木本植物的遗传结构,认为广布、异交且种子随风传播或鸟兽取食的木本植物,其群体内的遗传多样性比群体间更丰富。根据目前国内所报道的木本植物遗传多样性的研究结果,所有树种的遗传多样性主要来自种群内个体间。例如,麻疯树[10]、小果油茶[14]、白花树[15]、侧柏[16]和大花黄牡丹[17]等,都表明种群间的遗传多样性小于种群内个体间。 因此,任豆遗传改良要注重优良种源选择,更要注重种源内个体的选择。
物种基因流是影响植物种群遗传结构的重要因子[20],对物种形成及其适应性进化有积极的作用。基因流越大,群体间花粉和种子互相迁移的频率越高,则种源间相似性就越大。受限制的基因流使群体间发生分化,因为每个群体中都会或多或少的独立发生适应演变和遗传漂变。植物濒危的原因是多方面的,遗传多样性贫乏可造成种群或物种难以适应变化的环境,人为破坏和过度采伐也可能导致植物濒危。任豆为国家二级保护植物,随着人类对天然林的砍伐、破坏,导致任豆种群的片段化,降低了种群间的基因交流,造成有效群体较小,种群间出现遗传分化。 一般认为,基因流有利于珍稀濒危植物的保护,当基因流>1时,基因流就可以防止种群之间由遗传漂变引起的遗传分化,当基因流<1时,就会产生遗传漂变,导致种群间遗传结构的变化。经估算,任豆的基因流(Nm)为1.020 7。与其他树种相比,任豆基因流不高。例如,西伯利亚杏Armeniacasibirica群体间的基因流为3.836 0[21],花楸树Zanthoxylumbungeanum的基因流为3.047 2[22]。 由于任豆种群间基因流不高,长期隔离会导致地理遗传变异,虽然任豆种源间的遗传变异小于种群间,但仍然达到32.88%。
根据任豆种群间遗传一致度聚类结果,可将17个种群大体分为3大类:第1类为广西和贵州种源;第2类为广东、湖南和广西种源;第3类为云南种源。基本上地理距离相近的种源聚为一类,地理格局明显。地理距离和遗传距离的相关性错综复杂,受植物的进化、分布格局等影响较大。很多植物的遗传距离均与地理距离相关,如香果树Emmenopteryshenryi[23]、紫丁香Syringaoblata[24]、西伯利亚杏[21]和栓皮栎Quercusvariabilis[25]等。Mantel检验表明,任豆种群间的遗传距离和地理距离之间的相关性达到极显著水平(r=0.312 5,P=0.001)。这也解释了任豆各种源类群地理格局明显的现象。3个种源类群间所处地形差异较大,一定程度造成了地理隔离。第1类群处于任豆分布区域高海拔地区,第2类群基本处于海拔较低的平原地带,第3类群为云南种源,与其他2类相距甚远,处于地理封闭状态。由于西南山区的地形等特定的隔离机制阻碍了群体间基因的交流,造成种群之间的差异。
[1] 何小勇. 翅荚木种源遗传多样性及其抗低温胁迫能力研究[D]. 长沙:中南林业大学, 2007.
[2] 陈永密. 珍稀树种:翅荚木[M]. 福州:福建教育出版社, 1989.
[3] 侯伦灯,李玉曹,李平宇,等. 任豆树综合利用研究[J]. 林业科学, 2010, 37(3):139-143.
[4] 范霭萱,梁兆彦,宋喜宣. 可开发的木本饲料[J]. 广西畜牧兽医, 1995, 11(2):20-23.
[5] 郑学项,冯素萍,李维国. DNA分子标记研究进展[J]. 安徽农业科学, 2009, 37(26):12420-12422.
[6] 陈丽君,刘明骞,廖柏勇,等. 苦楝SRAP-PCR反应体系的建立及优化[J]. 华南农业大学学报, 2015, 36(3):104-108.
[7] LI G, QUIROS C F. Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction: Its application to mapping and gene tagging inBrassica[J]. Theor Appl Genet, 2001, 103(103):455-461.
[8] NEI M. Molecular evolutionary genetics[M]. New York: Columbia University Press, 1987.
[9] MANTEL N. The detection of disease clustering and a generalized regression approach[J]. Cancer Res, 1967, 27(2):209-220.
[10]沈俊岭,倪慧群,陈晓阳,等. 麻疯树遗传多样性的相关序列扩增多态性(SRAP)分析[J]. 浙江林学院学报, 2010, 27(3):347-353.
[11]祝全东,张党权,李晓云,等.油茶SRAP标记的PCR体系建立与优化[J]. 中南林业科技大学学报, 2010, 30(3):57-62.
[12]谭碧玥,王源秀,徐立安.杨树基因组SRAP扩增体系的建立与优化[J]. 林业科技开发, 2009, 23(2):25-29.
[13]徐斌,张方秋,潘文,等. 我国红锥天然群体的遗传多样性和遗传结构[J]. 林业科学, 2013, 49(10):162-166.
[14]黄勇. 基于SRAP分子标记的小果油茶遗传多样性分析[J]. 林业科学, 2013, 49(3):43-50.
[15]李楠,柳新红,李因刚,等. 白花树天然群体的遗传多样性[J]. 林业科学, 2012, 48(11):49-56.
[16]王玉山,邢世岩,唐海霞,等.侧柏种源遗传多样性分析[J].林业科学, 2011, 47(2):90-96.
[17]唐琴,曾秀丽,廖明安,等.大花黄牡丹遗传多样性的SRAP分析[J].林业科学, 2012, 48(1):70-76.
[18]刘志远,范卫红,沈世华.构树SRAP分子标记[J].林业科学, 2009, 45(12):54-58.
[19]HAMRICK J L, GODT M J W, SHERMAN-BRNYES S L. Factors influencing levels of genetic diversity in woody plant species[J].New Forests, 1992, 42(6):95-124.
[20]HAMRICK J L. Isozymes and the analysis of genetic structure in plant populations[C]//SOHIS D E,SOHIS P S.Isozymes in plant biology. London: Chapman and Hall, 1990:87-105.
[21]刘华波,王哲,刘君,等. 燕山山脉西伯利亚杏的遗传多样性和遗传结构[J]. 林业科学研究,2012, 48(8):68-74.
[22]郑健,郑勇奇,张川红,等. 花楸树天然群体的遗传多样性研究[J]. 生物多样性, 2008,16(6): 562-569.
[23]张文标,金则新,李钧敏. 濒危植物香果树自然居群遗传多样性的RAPD分析[J]. 浙江大学学报(农业与生命科学版), 2007, 33(1):61-67.
[24]明军,顾万春. 紫丁香天然群体遗传多样性的AFLP分析[J]. 园艺学报, 2006, 33(6):1269-1274.
[25]徐小林,徐立安,黄敏仁,等. 栓皮栎天然群体SSR遗传多样性研究[J]. 遗传, 2004, 26(5):683-688.
【责任编辑 李晓卉】
Genetic diversity of Zenia insignis based on SRAP markers
LIN Wei, ZHOU Wei, ZHOU Peng, ZHOU Xiangbin, WU Linying, CHEN Xiaoyang
(College of Forestry and Landscape Architecture, South China Agricultural University/Guangdong Key Laboratory for Innovation Development and Utilization of Forest Plant Germplasm/Guangdong Research Center of Woody Forage Engineering Technology, Guangzhou 510642, China)
【Objective】 To study population genetic diversity ofZeniainsignis, and to provide a basis forZ.insignisgermplasm protect and promote genetic improvement.【Method】 Base on establishing of SRAP-PCR system inZ.insignis, the genetic diversity among 17 provenances was analyzed. UPGMA clustering analysis was used to divideZ.insignisprovenances into different groups.【Result】 A total of 151 bands were amplified from 12 primer pairs, and in average 12.58 bands were amplified from each primer pair. There were 106 polymorphic bands, in average 8.83 bands per primer sets, and the average percentage of polymorphic bands was 70.39%. The ratios of polymorphic loci among provenances were 38.96%-72.73%, and 59.66% in average. The genetic diversity indices were 0.175 5-0.313 3, and 0.256 8 in average. The Shannon information indices were 0.249 4-0.450 2, and 0.369 1 in average. The numbers of alleles (na) observed were 1.519 5-1.727 3, and 1.600 0 in average. The number of alleles (na) at the provenance level was 1.724 9. The numbers of effective alleles (ne) were 1.330 5-1.577 3, and 1.4713 in average. The number of effective alleles (ne) at the provenance level was 1.502 6. The genetic identity degrees among provenances were 0.703 1-0.886 5.The genetic distances were 0.120 5-0.352 3. According to cluster analysis, 17 provenances were divided into three groups. The first group included Guangxi and Guizhou provenances. The second group included Guangdong, Hunan and Guangxi provenances. The third group only included Yunnan provenance. The provenances with geographic proximity were generally clustered into the same group.【Conclusion】The genetic diversity is abundant amongZ.insignisprovenances and among individuals within provenance, but is mainly from individuals within provenance. Therefore more attention should be paid to individuals in genetic improvement ofZ.insignis. Both the low level of gene flow among provenances and three clear geographic clustering should be caused by the geographic isolation due to the specific living environment ofZ.insignis.
Zeniainsignis; provenance; SRAP; genetic diversity
2016- 02- 23优先出版时间:2016-12-28
林 玮(1989—),男,硕士研究生,E-mail:35417328@qq.com;通信作者:陈晓阳(1958—),男,教授,博士,E-mail:xychen@scau.edu.cn
863计划专项(2011AA10020203)
S792.99
A
1001- 411X(2017)01- 0082- 08
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20161228.0924.020.html
林 玮,周 玮,周 鹏,等.基于SRAP标记的任豆遗传多样性分析[J].华南农业大学学报,2017,38(1):82- 89.
