五味子、黄芪混合多糖的提取及对小鼠急性酒精性肝损伤的保护作用
2017-02-08苑荣爽张宇航师继超陈建光王春梅
孙 卉,苑荣爽,李 贺,张宇航,师继超,陈建光,王春梅*
五味子、黄芪混合多糖的提取及对小鼠急性酒精性肝损伤的保护作用
孙 卉,苑荣爽,李 贺,张宇航,师继超,陈建光,王春梅*
(北华大学药学院,吉林 吉林 132013)
目的:优化五味子、黄芪混合多糖的提取工艺,并探讨其对急性酒精所致小鼠肝损伤的保护作用。方法:采用正交试验优化水提醇沉法提取五味子、黄芪混合多糖,将40只小鼠随机分为空白对照组(CON)和空白对照+五味子黄芪多糖治疗组(CON+SAP)、肝损伤模型组(MOD)、肝损伤模型+五味子黄芪多糖治疗组(MOD+SAP)。SAP组小鼠每日灌胃给予五味子黄芪混合多糖100 mg/kg,CON组和MOD组给予同体积蒸馏水,连续30 d。末次给药后1 h,MOD组和MOD+SAP组小鼠灌胃给予50%酒精12 mL/kg,CON组和CON+SAP组灌胃给予同体积蒸馏水。16 h后取血与肝脏,计算各组小鼠的肝脏指数,测定小鼠血清中谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)的水平,并测定肝组织中的甘油三酯(triglyceride,TG)、微量还原型谷胱甘肽(glutathione,GSH)和丙二醛(malondialdehyde,MDA)的含量,苏木精-伊红染色法观察肝脏病理学变化。结果:五味子、黄芪混合多糖最佳提取工艺为料液比1∶45(g/mL)、提取时间3 h、提取温度100℃;与酒精性肝损伤模型组比较,五味子、黄芪混合多糖可降低小鼠肝脏指数(P<0.05),降低血清中ALT和AST水平(P<0.05),升高肝组织GSH含量(P<0.01),并显著降低肝组织MDA和TG含量(P<0.05),改善肝脏病理学变化。结论:五味子、黄芪混合多糖对小鼠急性酒精性肝损伤具有一定的保护作用。
五味子;黄芪;多糖;急性酒精性肝损伤
长期饮酒容易引起酒精性肝病,严重危害身体健康[1]。常见的保肝药有很多种类,中草药中的五味子作为传统保肝药,具有降酶、促进肝再生、抗脂质过氧化、利胆、抗疲劳和增强免疫功能等作用[2-3]。目前的研究多集中在五味子木脂素类成分,而多糖是从五味子干燥成熟果实中提取出来的含有五味子总多糖的混合物[4],在五味子中高达20%[5]。研究表明,五味子多糖药理活性强、毒性低,在护肝降酶、提高免疫、抗疲劳、抗衰老、抗肿瘤等方面具有显著的作用和广泛的应用前景[6-10]。黄芪的药用历史悠久,应用广泛,多糖为其主要药效成分,具有提高人体免疫功能、增强巨噬细胞活性、双向调节血糖等作用[11]。有药理研究表明,黄芪多糖具有明显的减轻酒精性肝损伤作用[12]。本研究在中医理论的指导下,通过五味子的滋肾敛阴,黄芪的补气健脾,研究两药混合多糖的提取工艺以及对急性酒精性肝损伤的保护作用,为进一步的开发利用提供参考依据。
1 材料与方法
1.1 材料、试剂与实验动物
五味子 吉林省集安五味子种植基地;中药饮片黄芪(批号20140701-1) 河北祁新中药颗粒饮片有限公司;谷丙转氨酶(alanine aminotransferase,ALT,批号20150724)、谷草转氨酶(aspartate aminotransferase,A S T,批号2 0 1 5 0 6 2 5)、微量还原型谷胱甘肽(glutathione,GSH,批号20150723)及甘油三酯(triglyceride,TG,批号20150728)4 种测定试剂盒南京建成生物工程研究所;丙二醛(malondialdehyde,MDA)检测试剂盒(批号 20150726) 上海碧云天生物技术有限公司;其他试剂均为国产分析纯。
清洁级健康ICR小白鼠,雄性,体质量(20±2)g,由长春亿斯实验动物研究中心提供,许可证号为SCXK-(吉)2012-0005,合格证号为0007195。实验室条件:室温20~25℃,分笼饲养,饲料充足,饮水不限,适应环境5 d后用于实验。
1.2 仪器与设备
JY92-IID超声波细胞粉碎机 宁波新芝生物科技股份有限公司;KDM调温电热套 山东鄄城华鲁电热仪器有限公司;旋转蒸发器 上海申生科技有限公司;Eppendorf AG小型台式冷冻离心机、721B 型分光光度计上海第三分析仪器厂;Inf nite M200酶标仪 瑞士Tecan集团公司。
1.3 方法
1.3.1 五味子、黄芪混合多糖提取工艺
取五味子、黄芪药材→粉碎→水提取→抽滤→浓缩→醇沉→干燥→称质量得粗多糖→溶解→稀释→苯酚-浓硫酸法测定含量→计算多糖质量浓度
1.3.2 单因素试验
多糖提取工艺中涉及3 个关键条件即料液比(1∶10、1∶20、1∶30、1∶40、1∶50(g/mL))、提取温度(70、80、90、100℃)、提取时间(1、2、3、4、5 h),因此本研究针对这3 个条件分别做单因素试验。
1.3.3 正交试验设计
通过单因素试验结果结合文献资料,进行正交试验设计,因素与水平如表1所示。
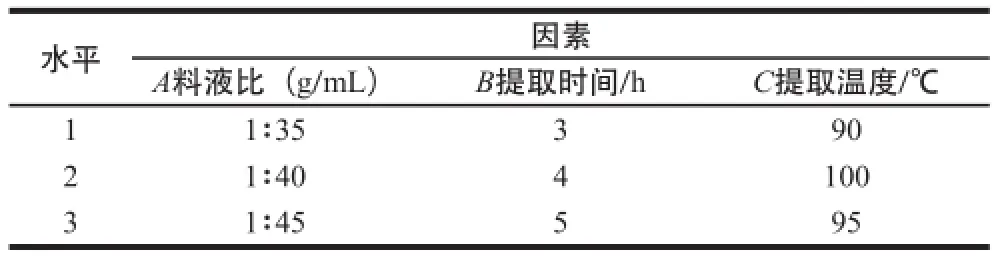
表1 正交试验因素与水平设计Table1 Factors and their levels used in orthogonal array design
1.3.4 多糖提取率及含量测定
五味子、黄芪样品质量的比例为1∶3,多糖提取率计算如式(1)所示:

准确称取5 mg无水葡萄糖稀释到5 mL,再取0.5 mL稀释到10 mL制成0.05 mg/mL的标准溶液,分别取0.1、0.2、0.4、0.6、0.8、1.0、1.2 mL补水至2 mL,加1.0 mL 5%苯酚溶液,混匀,加入5 mL浓硫酸,充分振摇2 min,80℃水浴15 min,冷却,488 nm波长处测定吸光度,以吸光度Y为纵坐标,质量浓度X(mg/mL)为横坐标,绘制标准曲线,得回归方程:y=15.076x+0.465(R²=0.998 8),以此曲线测定并计算所提粗多糖中的多糖含量。
1.3.5 动物实验分组与处理
40只小鼠随机分成4 组,分别为空白对照组(CON)、空白对照+五味子黄芪多糖治疗组(CON+SAP)、酒精性肝损伤模型组(MOD)、肝损伤模型+五味子黄芪多糖治疗组(MOD+SAP)。常规饲料喂养,自由饮水。CON+SAP组和MOD+SAP组小鼠每日灌胃给予五味子黄芪混合多糖100 mg/kg,CON组和MOD组每天灌胃给予同体积蒸馏水,连续30 d。末次给药1 h后,MOD组和MOD+SAP组小鼠分别灌胃给予50%酒精12 mL/kg,CON组和CON+SAP组给予同体积蒸馏水,禁食,不禁水。16 h后,各组小鼠分别摘眼球取血,分离血清,分装入EP管,-80℃冻存。断髓处死小鼠,迅速剖腹取出肝脏,于冷的生理盐水中洗净血液,滤纸吸干,称取肝脏质量,计算肝脏指数,如式(2)所示。剪下肝左叶置于10%甲醛溶液中固定,待做肝病理检查。取肝组织加入9倍量的生理盐水于冰水浴中制成组织匀浆,离心后取上清液,冻存。采用酶法测定血清中AST、ALT水平及肝组织中的GSH、TG、MDA含量,具体方法参照试剂盒说明书。
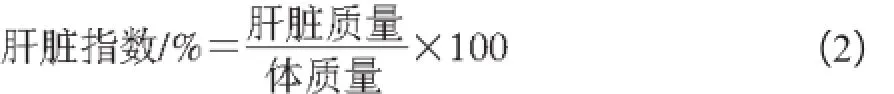
1.4 统计学分析
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对五味子、黄芪混合多糖提取率的影响
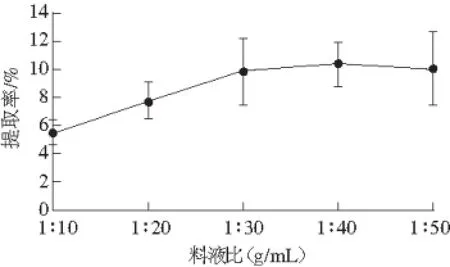
图1 料液比对混合多糖提取率的影响Fig. 1 Effect of solid-to-liquid ratio on the yield of SAP
分别选取料液比1∶10、1∶20、1∶30、1∶40、1∶50(g/mL),提取温度90℃,提取时间2 h进行浸提,抽滤,75%醇沉,干燥,称质量,计算提取率,观察料液比对浸提效果的影响。由图1可知,五味子、黄芪混合多糖的提取率随溶剂用量的增大而增加,当料液比在1∶40之后时,提取率下降,因此选取料液比为1∶40较为合适。

图2 提取时间对混合多糖提取率的影响Fig. 2 Effect of extraction time on the yield of SAP
2.1.2 提取时间对五味子和黄芪混合多糖提取率的影响分别选取时间1、2、3、4、5 h,提取温度为90 ℃,料液比1∶40(g/mL),进行浸提,抽滤,75%醇沉,干燥,称质量,计算提取率,观察提取时间对浸提效果的影响。如图2所示,随着提取时间的延长,混合多糖提取率增加,4 h后增加趋于平缓,因此选择最佳提取时间为4 h。
2.1.3 提取温度对五味子和黄芪混合多糖提取率的影响

图3 提取温度对混合多糖提取率的影响Fig. 3 Effect of temperature on the yield of SAP
分别选取温度70、80、90、100 ℃,料液比1∶40(g/mL),时间4 h,观察温度对浸提效果的影响。如图3所示,随着温度的升高,多糖提取率增加,因此确定最佳提取温度为100 ℃。
2.2 正交试验结果
综合单因素试验结果,选择提取温度100 ℃、提取时间4 h与料液比1∶40(g/mL)3 个因素的较优水平,按L9(33)设计进行正交试验,结果见表2和表3。
由表3可知,3 个因素对多糖含量的影响顺序为提取温度>料液比>提取时间,方差分析结果表明,料液比与提取温度对提取的多糖含量有一定的影响,提取时间的影响不显著。综合考虑,选取的最佳工艺条件为A3B1C2,即料液比1∶45、提取时间3 h、提取温度100 ℃。

表2 五味子、黄芪混合多糖提取正交试验结果Table2 Orthogonal array design with experimental results
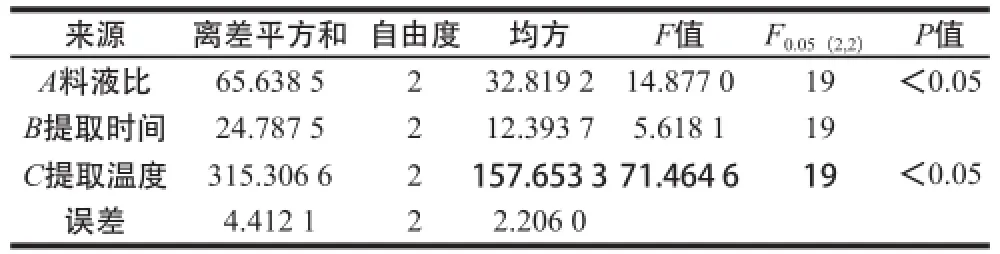
表3 方差分析Table3 Analysis of variance
2.3 五味子、黄芪混合多糖对小鼠急性酒精性肝损伤的影响
2.3.1 各组小鼠体质量和肝脏指数

表4 各组小鼠体质量和肝脏指数(x±s,n=1100)Table4 Body weights and liver indexes of mice in different groups (x ± s,, n = 1100))
由表4可知,与CON组比较,MOD组小鼠体质量未见明显变化,而肝脏质量和肝脏指数均明显增大,差异显著(P<0.05),说明灌胃给予50%酒精后对小鼠肝组织造成了损伤,引起肝组织水肿。与MOD组相比,MOD+SAP组小鼠的体质量无明显差异,而肝脏质量及肝脏指数均有所下降。五味子黄芪多糖对正常小鼠体质量及肝脏质量均无明显影响。
2.3.2 各组小鼠血清中ALT和AST水平
由表5可知,与CON组比较,模型组小鼠血清AST和 ALT水平均显著增高(P<0.05或P<0.01),说明小鼠一次性灌胃50%酒精可引起小鼠肝细胞损伤。与MOD组比较,MOD+SAP组小鼠血清中ALT、AST水平均显著下降(P<0.05),提示其对酒精诱导的小鼠肝损伤具有一定的保护作用。而五味子黄芪多糖对正常小鼠血清中ALT和AST水平均无明显影响。
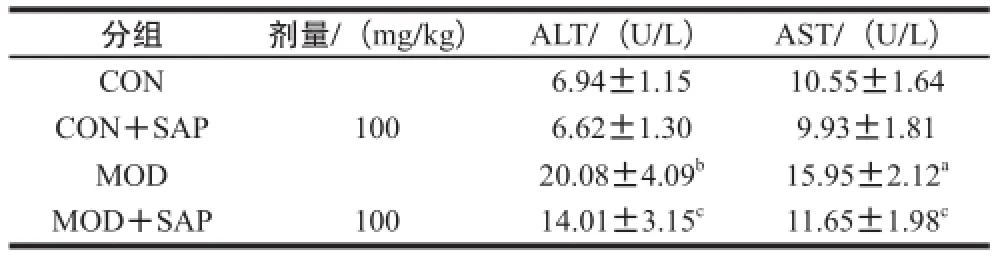
表5 各组小鼠血清中ALT和AST水平(x±s,n=1100)Table5 Activities of serum ALT and AST in different groups (x ± s,, n = 1100))
2.3.3 各组小鼠肝组织中GSH、MDA和TG的含量
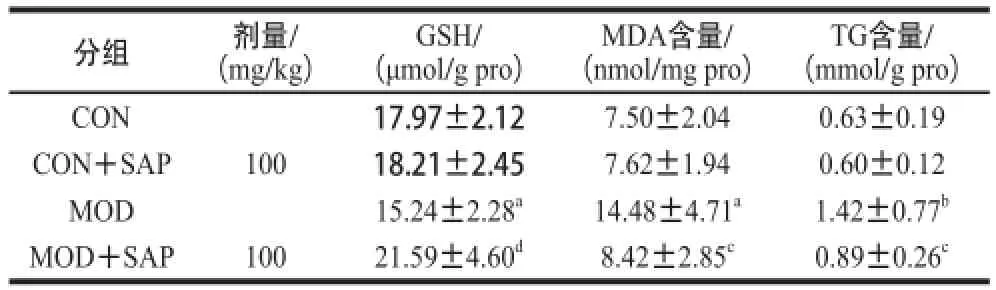
表6 各组小鼠肝组织中GSH、MDA和TG的含量(x±s,n=1100)Table6 Levels of GSH,TG and MDA in liver tissue in different groups (x ± s,, n = 1100))
由表6可知,与CON组比较,MOD组小鼠肝组织中GSH水平显著降低(P<0.05)、MDA和TG含量均显著升高(P<0.05或P<0.01),表明酒精致肝损伤小鼠肝脏抗氧化能力降低,氧化应激增强,肝组织中脂质含量增加。与MOD组比较,MOD+SAP 组小鼠肝组织中GSH含量明显升高(P<0.01),MDA和TG含量均有显著性降低(P<0.05),提示小鼠肝脏的氧化应激状况得以改善,脂类物质含量下降。而五味子黄芪多糖对正常小鼠肝组织中GSH、MDA和TG含量水平均无明显影响。
2.3.4 各组小鼠肝组织病理形态变化
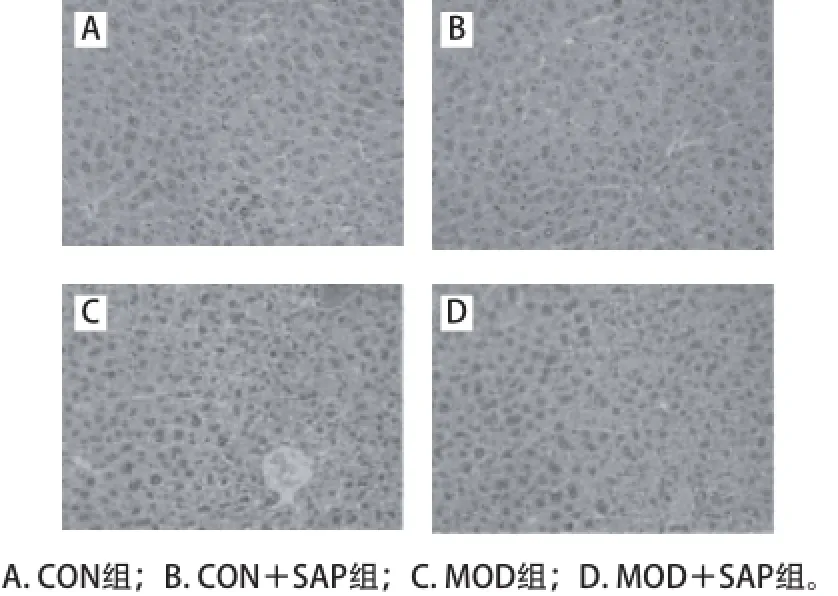
图4 各组小鼠肝组织病理形态(苏木精-伊红染色,×200)Fig. 4 Liver pathomorphology in different groups (HE staining, × 200)
由光学显微镜结果显示,CON组小鼠的肝细胞排列整齐,大小正常,细胞核大而圆,核质均匀分布,无水肿、变性、坏死、无炎症细胞浸润等现象(图4A)。MOD组小鼠肝组织中肝索排列不规则,整个肝细胞胞浆疏松化,表明小鼠急性酒精性肝损伤模型建立成功(图4C)。MOD+SAP组小鼠肝细胞排列整齐,整个肝细胞胞浆疏松化明显减轻,表明五味子黄芪多糖对小鼠酒精性肝损伤预防治疗有效(图4D)。
3 讨 论
五味子为木兰科植物五味子的果实,传统中医理论研究表明五味子具有益气生津、补肾养心、收敛固涩之功效,实验证明五味子能降酶护肝,可用于治疗慢性肝炎[13]。黄芪具有补气固表、利水消肿、脱毒生肌等功效,研究表明黄芪对中毒性肝损伤有保护作用,能增强机体的免疫功能,有助于肝炎恢复[14]。两药合用无配伍禁忌,且可同时发挥肝脏保护作用。
近年来,对植物多糖的研究越来越广泛,其抗肿瘤、抗病毒、抗氧化、增强免疫力等多种生物活性日益受到重视[15]。多糖是五味子和黄芪的主要活性成分,然而关于两药的多糖成分并未得到很好的研究开发和利用。本研究采用正交试验考察料液比、提取时间、提取温度对五味子、黄芪混合多糖含量的影响并优选出了提取工艺。经直观分析和方差分析确定了五味子、黄芪混合多糖最佳提取工艺为料液比1∶45、提取时间3 h、提取温度100℃。
为了探讨五味子、黄芪混合多糖对肝损伤有保护作用,本实验采用50%酒精一次性灌胃建立小鼠急性酒精性肝损伤模型[16],因AST和ALT是肝细胞内的主要功能酶,是肝细胞损害的敏感性指标,故小鼠血中AST和ALT水平的高低可判断其肝细胞损伤的程度[17]。本研究MOD组小鼠血清中AST和ALT水平均高于CON组,加之病理结果显示MOD组小鼠整个肝细胞胞浆明显疏松化,表明小鼠急性酒精性肝损伤动物模型制备成功,五味子、黄芪混合多糖可使肝损伤小鼠血清中AST和ALT水平明显降低,肝细胞病理恢复正常,显示出良好的肝损伤保护作用。
机体摄入大量酒精后,酒精经过酶类代谢时,产生大量的氧自由基,消耗很多还原性保护物质如GSH,引起脂质过氧化反应,导致肝损伤[18-19],因此GSH含量的多少是衡量机体抗氧化能力大小的重要因素[20],而脂质过氧化反应的最终代谢产物MDA[21],可破坏细胞膜结构,导致细胞肿胀坏死[22],MDA的含量可以反映过氧化损伤和细胞受损的程度[23-25]。本实验中MOD组小鼠肝组织中MDA水平升高、GSH水平降低,而五味子、黄芪混合多糖治疗显著降低了肝组织MDA水平,升高了GSH水平,对抗自由基脂质过氧化反应,阻止肝细胞脂质过氧化,维持细胞质膜的正常结构,保护肝细胞免受损伤。酒精还可以使三羧循环和脂肪酸氧化受阻从而影响脂肪代谢,致使脂肪在肝细胞内沉积,大量蓄积可能导致病变。本实验中MOD组小鼠肝组织中TG水平显著升高,五味子、黄芪多糖治疗使TG水平均显著降低,改善了小鼠肝脏的脂肪代谢。
综上所述,本研究通过正交试验优选了五味子、黄芪混合多糖的提取工艺,并发现其对酒精诱导的急性肝损伤具有显著的保护作用,其作用机制可能与抗自由基脂质过氧化反应及改善肝脏脂质代谢有关,这些结果为五味子、黄芪的进一步开发利用提供了理论依据。
[1] 王洪岩, 李鑫, 徐有青. 酒精性肝病发病机制研究进展[J]. 实用肝病杂志, 2014(1): 5-8. DOI:10.3969/j.issn.1672-5069.2014.01.002.
[2] 齐雁辉, 赵彩玉. 五味子的现代药理作用研究进展[J]. 中国医药指南, 2011, 9(26): 43-44. DOI:10.3969/j.issn.1671-8194.2011.26.027.
[3] CHEN C, WEN D C, GAO S D, et al. The protective effects of buzui on acute alcoholism in mice[J]. Evidence-Based Complementary and Alternative Medicine, 2016(3): 1-8. DOI:10.1155/2016/3539748.
[4] 孟繁军. 正交试验法优化北五味子多糖提取工艺的研究[J]. 中国林副特产, 2014(2): 33-34. DOI:10.3969/j.issn.1001-6902.2014.02.013.
[5] 李晓光, 高勤, 翁文, 等. 五味子多糖的研究概况[J]. 时珍国医国药, 2006, 17(6): 931-932. DOI:10.3969/j.issn.1008-0805.2006.06.129.
[6] 高善军, 朴云峰, 郭晓林, 等. 北五味子粗多糖保肝作用的机理[J].白求恩医科大学学报, 1996, 22(1): 23-24.
[7] 可成有, 马春雁, 边蔷, 等. 五味子多糖的研究概况分析[J]. 时珍国医国药, 2009, 20(7): 1729-1731. DOI:10.3969/j.issn.1008-0805.2009.07.083.
[8] 许莉, 王晓华, 赵美瑾, 等. 五味子多糖的研究进展[J]. 食品研究与开发, 2013, 34(7): 127-130.
[9] 陆兔林, 吴杨, 季德, 等. 五味子多糖提取分离和药理作用研究进展[J].中国中药杂志, 2014, 39(4): 752-753.
[10] 高雁, 李廷利. 五味子有效成分的药理作用研究进展[J]. 中医药学报, 2011, 39(6): 104-105. DOI:10.3969/j.issn.1002-2392.2011.06.042.
[11] 黄桢. 黄芪多糖的药理研究进展[J]. 中国临床药学杂志, 2002, 11(5): 315-318. DOI:10.3969/j.issn.1007-4406.2002.05.032.
[12] 舒慧, 魏蕾. 黄芪预防小鼠急性酒精性肝损伤的作用机制研究[J].湖北科技学院学报(医学版), 2012, 26(6): 470-472. DOI:10.3969/ j.issn.1008-0635.2012.06.005.
[13] 刘继勇, 王英平. 五味子化学成分及药理研究进展[J]. 特产研究, 2005, 27(3): 49-53. DOI:10.3969/j.issn.1001-4721.2005.03.014.
[14] 侯世荣, 林厚基, 刘海肃. 黄芪口服液治疗慢性肝炎的疗效观察[J]. 中草药, 2000, 31(10): 766-768. DOI:10.3321/ j.issn:0253-2670.2000.10.026.
[15] 申利红, 王建森, 李雅, 等. 植物多糖的研究及应用进展[J]. 中国农学通报, 2011, 27(2): 349-352.
[16] 赵敏, 池莉平, 王凤岩, 等. 小鼠急性酒精性肝损伤模型的建立及应用[J]. 华南预防医学, 2005, 31(1): 14-17. DOI:10.3969/ j.issn.1671-5039.2005.01.004.
[17] 宋成军, 陈光晖, 佟继铭. 杞椇饮乙醇提取物对小鼠酒精性肝损伤的保护作用[J]. 辽宁中医杂志, 2006, 33(7): 898-899. DOI:10.3969/ j.issn.1000-1719.2006.07.094.
[18] LIEBER C S. Alcoholic liver disease: new insights in pathogenesis lead to new treatments[J]. Journal of Hepatology, 2000, 32: 113-128. DOI:10.1016/S0168-8278(00)80420-1.
[19] JUNG J C, LEE Y H, KIM S H, et al. Hepatoprotective effect of licorice, the root of Glycyrrhiza uralensis, Fischer, in alcohol-induced fatty liver disease[J]. BMC Complementary and Alternative Medicine, 2015, 16(1): 1-10.
[20] 高姝娟, 刘锡锰, 高贵, 等. 谷胱甘肽的抗线粒体脂质过氧化作用[J].生物化学杂志, 1997, 13(3): 287-290.
[21] TOORI M A, JOODI B, SADEGHI H, et al. Hepatoprotective activity of aerial parts of Otostegia persica against carbon tetrachlorideinduced liver damage in rats[J]. Avicenna Journal of Phytomed, 2015, 5(3): 238-246.
[22] 段荟, 付成效, 邹瑾. 黄芪对酒精性肝损伤小鼠MDA、GSH和TG的影响及肝脏保护作用的研究[J]. 陕西医学杂志, 2010, 39(3): 271-273. DOI:10.3969/j.issn.1000-7377.2010.03.005.
[23] 冯琴, 方志红, 崔剑巍, 等. 葛根对大鼠酒精性肝损伤的干预作用[J]. 上海中医药杂志, 2007, 41(4): 64-66. DOI:10.3969/ j.issn.1007-1334.2007.04.029.
[24] HAO L J, XIE Y X, WU G K, et al. Protective effect of Hericium erinaceus on alcohol induced hepatotoxicity in mice[J]. Evidence-Based Complementary and Alternative Medicine, 2015: 1-5. DOI:10.1155/2015/418023.
[25] PANDA V, ASHAR H, SRINATH S. Antioxidant and hepatoprotective effect of Garcinia indica fruit rind in ethanol-induced hepatic damage in rodents[J]. Interdiscip Toxicol, 2012, 5(4): 207-213. DOI:10.2478/v10102-012-0034-1.
Extraction of Polysaccharides from Mixed Fructus Schisandrae and Radix Astragali and Their Protective Effects on Acute Liver Injury Induced by Alcohol in Mice
SUN Hui, YUAN Rongshuang, LI He, ZHANG Yuhang, SHI Jichao, CHEN Jianguang, WANG Chunmei*
(School of Pharmacy, Beihua University, Jilin 132013, China)
Objective: This study aimed to optimize the extraction of polysaccharides from mixed Fructus Schisandrae and Radix Astragali (SAP) and to examine their protective effects on alcohol-induced acute liver injury in mice. Methods: An orthogonal array design was applied to optimize SAP extraction by water extraction and alcohol precipitation. A total of 40 mice were randomly divided equally into normal control (CON) group, CON + SAP group, liver injury model (MOD) group and MOD + SAP group. The mice in the SAP-treated groups were intragastrically administered with 100 mg/kg SAP, and those in the CON and MOD groups were administered with an equal volume of distilled water for 30 days in the same way. Fifty percent ethanol (12 mL/kg) was orally given to the mice in the MOD and MOD + SAP groups at 1 hour after the last administration, and those in the CON and CON+SAP group were given an equal volume of distilled water intragastrically. Sixteen hours later, blood and liver samples were collected for the calculation of liver indexes of the mice in each group and the detection of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) levels in serum as well as the contents of reduced glutathione (GSH), malondialdehyde (MDA) and triglyceride (TG) in liver tissues. Hematoxylin-eosin staining (HE) was performed to observe pathological changes of liver tissues. Results: The optimum conditions for SAP extraction were determined as follows: solid-to-liquid ratio, 1:45; extraction time, 3 h; and temperature, 100 ℃. Compared with the alcohol-induced liver injury model, SAP significantly reduced the liver index in mice (P < 0.05) and the levels of ALT and AST in serum (P < 0.05), elevated the content of GSH (P < 0.01), significantly reduced the contents of TG and MDA in livertissues (P < 0.05), and improved the pathological changes of liver tissues. Conclusions: SAP could have a protective effect on alcohol-induced acute liver injury in mice.
Fructus Schisandrae; Radix Astragali; polysaccharide; alcohol-induced acute liver injury
10.7506/spkx1002-6630-201702043
R285.5
A
1002-6630(2017)02-0278-05
2016-03-24
吉林省科技厅医药产业推进计划项目(20140311052YY);吉林省科技厅产业技术创新战略联盟项目(20150309004YY)
孙卉(1989—),女,硕士研究生,研究方向为内分泌药理学及药物研发。E-mail:511047902@qq.com
*通信作者:王春梅(1974—),女,教授,博士,研究方向为内分泌药理学及药物研发。E-mail:wangcm74@126.com
孙卉, 苑荣爽, 李贺, 等. 五味子、黄芪混合多糖的提取及对小鼠急性酒精性肝损伤的保护作用[J]. 食品科学, 2017, 38(2): 278-282. DOI:10.7506/spkx1002-6630-201702043. http://www.spkx.net.cn
SUN Hui, YUAN Rongshuang, LI He, et al. Extraction of polysaccharides from mixed Fructus Schisandrae and Radix Astragali and their protective effects on acute liver injury induced by alcohol in mice[J]. Food Science, 2017, 38(2): 278-282. (in Chinese with English abstract)
10.7506/spkx1002-6630-201702043. http://www.spkx.net.cn
