电针对佐剂性关节炎大鼠关节滑膜细胞内TAK1表达的影响
2017-02-08刘梨祁芳李艳玲艾坤蔡雄李鑫张泓
刘梨,祁芳,李艳玲,艾坤*,蔡雄,李鑫,张泓
(1.湖南中医药大学第一附属医院,湖南长沙410007;2.湖南中医药大学,湖南长沙410208)
电针对佐剂性关节炎大鼠关节滑膜细胞内TAK1表达的影响
刘梨1,祁芳2,李艳玲2,艾坤2*,蔡雄2,李鑫2,张泓2
(1.湖南中医药大学第一附属医院,湖南长沙410007;2.湖南中医药大学,湖南长沙410208)
目的观察电针足三里、关元穴对佐剂性关节炎(AIA)大鼠踝关节滑膜细胞内转化生长因子β激活激酶1(TAK1)表达的影响,探索电针对类风湿性关节炎(RA)可能的干预机制。方法40只SD大鼠随机分为空白组、模型组、甲氨蝶呤(MTX)组、电针组,每组10只。采用Fueund氏完全佐剂(FCA)法造模。电针组予以电针大鼠关元穴、双侧足三里穴,MTX组予以0.35 mg/kg剂量的MTX灌胃治疗,空白组与模型组每日予以特制大鼠固定器固定后松绑放回笼内饲养。实验期间每3天1次测量大鼠体质量、足爪容积,并对关节炎指数进行评分;采用放射免疫法检测TNF-α、用Western Blot检测TAK1、NF-κB蛋白表达。实验结束后比较各组大鼠踝关节滑膜滑膜组织中TNF-α,滑膜细胞内TAK1,胞核内NF-κB表达水平。结果与空白组比较,模型组大鼠体质量增长明显缓慢、足趾肿胀明显、关节炎指数明显升高(P<0.01),滑膜组织内TNF-α显著升高、滑膜细胞内TAK1含量显著升高、胞核内NF-κB表达显著升高(P<0.01);与模型组比较,电针组大鼠体质量增长较快、足趾肿胀较轻、关节炎指数较低(P<0.05),滑膜组织中TNF-α低于模型组、滑膜细胞内TAK1、NF-κB表达较低(P<0.05)。结论电针AIA大鼠足三里、关元等穴能够有效抗炎,其干预机制可能与抑制关节滑膜细胞内TAK1的表达,良性调控NF-κB这一炎症信号通路有关。
转化生长因子β激活激酶1;NF-κB;电针;佐剂性关节炎;足三里;关元穴
本文引用:刘梨,祁芳,李艳玲,艾坤,蔡雄,李鑫,张泓.电针对佐剂性关节炎大鼠关节滑膜细胞内TAK1表达的影响[J].湖南中医药大学学报,2017,37(1):65-69.
类风湿性关节炎(rheumatoid arthritis,RA)最重要的病理改变是关节滑膜的炎症与增生,目前的研究表明:RA是人体内多条炎性细胞信号通路被激活的结果,其中NF-κB信号通路在疾病的发生发展中起核心作用[1-3]。研究证实,运用针灸治疗RA疗效确切且副作用极少[4],然而有关针灸对NF-κB信号通路的干预机制的深入研究却甚少,因而本实验通过电针佐剂性关节炎(adjuvant induce arthritis,AIA)大鼠足三里、关元等穴,再现电针的抗炎效应,并基于NF-κB信号通路,通过检测关键性指标,进一步阐释电针治疗可能的抗炎机制。
1 材料与方法
1.1 动物
雄性健康SD大鼠40只,由湖南中医药大学动物实验中心提供,体质量80~100 g,动物许可证号:SYXK(湘)2013-0005,饲养温度20~25℃,湿度50%~70%,大鼠适应性饲养1周后。实验过程中对动物的处置均符合《Ethical issues in animal experimentation》[5]中相关动物伦理学标准条例。
1.2 主要试剂与仪器
灭活结核杆菌H37Ra(Detroit,Ml,USA);Sigma矿物油(湖南长沙维尔生物科技有限公司);Mettler Toledo精密电子天平(常州称重设备系统有限公司),动物纹身仪(深圳市瑞沃德生命科技有限公司);足肿测量仪(意大利UGO Basile);瑞士Hamilton微量注射器(250 μL),Terumo 27 G针头(北京博朗宁科技有限公司);华佗牌电针治疗仪,针灸针:0.18×13 mm(半寸,苏州医疗用品厂有限司)兔抗TAK1多克隆抗体(Thr184/187)(北京博奥森公司);NF-κB1 p105/p50(5D10D11)Mouse mAb(上海优宁维生物科技股份有限公司);山羊抗兔标记二抗、山羊抗鼠二抗(美国Proteintech公司);ECL显影液(美国Thermo公司)。
1.3 造模方法
MT悬浮液制备[6]:高温灭菌后的干燥研钵于精密天平上称取Mtb 10 mg;移液枪精密吸取矿物油8 mL入研钵中充分研磨,直至矿物油清亮无明显悬浮杂质;将研磨好的MT悬浮液移入EP管中,经震荡仪混合均匀后,稀释、分装,制成浓度为1.25 mg/mL的悬浮液。
AIA大鼠模型制备[6]:大鼠固定,酒精棉擦拭大鼠尾根部,精密吸取MT悬浮液0.1 mL于大鼠尾根部皮下注射,出针,用棉签压进针口片刻,将大鼠放回笼内。
造模后的大鼠第3天皮温明显升高,尾根部进针口皮肤开始溃烂;9~12 d大鼠皮毛松散,精神萎靡,体质量下降,耳廓、小趾关节、足趾关节、踝关节不同程度的发红、肿胀,活动受限,关节炎指数评分>4分,提示造模成功。
1.4 分组与干预方法
SD大鼠按照体质量分层原则随机分为空白组、模型组、甲氨蝶呤(methotrexate,MTX)组、电针组,每组10只。
1.4.1 电针组取穴定位:参照“十五”国家规划统编教材《实验针灸学》[7]大鼠标准穴位图谱定位及拟人对照法定位。足三里:膝关节后外侧,腓骨小头下约5 mm;关元:从胸剑联合至耻骨联合上缘以松紧带平均分为13等份(每一等分模拟大鼠同身寸一寸),关元为耻骨联合上缘3寸;阿是穴为关节周围肿胀严重部位。
参照《中国兽医针灸学》及《实验针灸学》[8]。自造模后的第1天开始,电针组大鼠固定于特制固定器上,每只大鼠接两组电针,左、右足三里穴为一组,关元穴与阿是穴为一组,刺激参数:疏密波,频率为20 Hz,电流1 mA,针身轻颤为宜,治疗时间20 min,7 d为1个疗程,共3个疗程21 d。
1.4.2 MTX组MTX作为阳性药物,根据人临床剂量以及大鼠体质量关系换算得出以0.35 mg/kg剂量的MTX灌胃,每周2次,共治疗3周。
1.4.3 空白组与模型组每日予以特制大鼠固定器固定20 min后松绑,放回笼内饲养。
1.5 观察方法与检测指标
1.5.1 大鼠体质量的测量自造模后的第12天开始(包括第12天)测量每只大鼠体质量,每3天1次,共4次。
1.5.2 足爪容积的测量造模后第9天,用小动物纹身仪在每只大鼠双侧踝关节外上侧打点标记,作为足爪容积测量时的标准对线点,然后立即用精确度为0.01 mL的足肿测量仪测量出各组大鼠的基础足爪容积。随后于第12天、第15天、第18天、第21天行足爪容积测量。
1.5.3 关节炎评分[9]模型制备完成后每天观察致炎大鼠的四肢各关节有无红肿出现,第12天开始(包括第12天)每3天行一次行关节炎的评分,直至第21天实验结束。具体评分细则为,0分:无关节红肿;1分:小趾关节的红肿;2分:足趾关节与小趾关节均有肿胀;3分:踝关节以下的足趾关节及小趾关节肿胀;4分:包括踝关节在内的全部足爪的肿胀。每只大鼠四肢均进行评分,将四肢分数累积,累积分数越高则提示炎症越严重。最高累计为16分。
1.5.4 TNF-α、TAK1转化生长因子β激活激酶1(transforming growth factor-β activation of protein kinase,TAK1)、NF-κB检测采用放射免疫法检测TNF-α、用Western Blot检测TAK1、NF-κB蛋白表达。第22天处死大鼠取踝关节囊的滑膜组织,用于Western Blot检测。步骤如下:(1)核蛋白提取:剪取组织,加入CER试剂,匀浆,离心后弃上清,加入NER沉淀,离心后弃上清,加入Suspension Buffer沉淀即得到核蛋白,冻存于-20℃;(2)蛋白浓度检测:根据样品数量配制适量BCA工作液,充分混匀,完全溶解蛋白标准品,浓度为2 mg/mL;(3)将标准品按0,1,2,3,4,5,6 μL加到96孔板的标准品孔中,加用于稀释标准品的溶液补足到20 μL;(4)加适当体积样品到96孔板的样品孔中,加用于稀释标准品的溶液到20 μL;(5)各孔加入200 μL BCA工作液,37℃放置30 min;(6)测定A562。根据标准曲线计算出蛋白浓度。(7)Western-blotting:电泳,转膜,加免抗TAK1一抗(1∶300),加入NF-KB一抗(1∶200),孵育4℃过夜,加入山羊抗兔标记二抗(1∶40 000)、山羊抗鼠标记二抗(1∶50 000)孵育2 h,清洗后加ECL液显影,显色曝光。在每张膜上做一种目的蛋白和相应内参蛋白β,用Image J分析软件将图片中每个特定条带灰度值数字化;目的蛋白的灰度值除以内参β-actin的灰度值作为结果。
1.6 统计学处理
所有数据统计分析均用SPSS 17.0处理。所有数据用“±s”表示,数据资料均行正态性及方差齐性检验,符合正态分布且方差齐则用LSD或SNK法,方差不齐用Tamhane`s T2或Dunnett`s T3法;不符合正态分布的资料采用秩和检验。
2 结果
2.1 各组大鼠体质量、足趾容积、关节炎指数评分比较
自造模后第3天开始,模型组、MTX组、电针组均出现不同程度精神萎靡、体毛欠规则,大便溏稀,以模型组为甚;各组大鼠体质量、足趾容积、关节炎指数评分比较见图1。结果显示:(1)体质量:造模后的第12,15,18,21天测量大鼠体质量,统计分析结果表明:空白组、电针组、MTX组大鼠的体质量显著高于模型组(P<0.01);电针组体质量则在第21 d显高于MTX组(P<0.05)(如图A)。(2)足爪容积:造模后的第9天开始,造模的大鼠先后出现不同程度的足趾关节红肿、畸形等炎性表现,各组大鼠第12、15、18和21天的足爪容积测量数据显示:模型组大鼠足趾关节肿胀程度与其余三组比较组大鼠比较有显著性差异(P<0.01),电针组大鼠肿胀程度相较于空白组与MTX组有统计意义(P<0.05),而电针组与模型组比较,肿胀较轻有统计学意义(P<0.05);说明电针治疗能有效减轻关节的水肿,缓解炎症的发展(如图B)。(3)关节炎指数评分:模型组、电针组的关节炎评分均与空白组存在显著性差异(P<0.01),而电针组关节炎指数则明显低于模型组(P<0.05),进一步表明电针治疗减轻了致炎大鼠体内的炎症反应见图1。
2.2 各组大鼠踝关节滑膜滑膜组织中TNF-α,滑膜细胞内TAK1,胞核内NF-κB比较
指标检测数据显示:(1)模型组大鼠踝关节中滑膜组织内TNF-α显著高于空白组(P<0.01),而电针组滑膜组织中TNF-α则低于模型组(P<0.05);(2)模型组滑膜细胞内TAK1含量明显高于空白组(P<0.01),电针组TAK1亦明显高于空白组(P<0.01),而低于模型组(P<0.05);(3)模型组大鼠滑膜细胞胞核内NF-κB表达显著高于空白组(P<0.01),而电针组大鼠NF-κB表达亦高于空白组(P<0.05),但低于模型组(P<0.05)。结果见表1。
2.3 TNF-α与TAK1、NF-κB的相关性分析
将每个样本TAK1、TNF-a、NF-κB值用SPSS软件进行相关性分析,得出以下结果:(1)TAK1与TNF的相关分析中,P<0.01,R值为0.938;(2)TAK1与NF-κB的相关分析结果为P<0.01,R为0.933;(3)而TNF与NF-κB之间的相关性分析结果P<0.01,R为0.879;以上结果显示:三者之间有强的正相关性。三者线性关系如图2所示。

图1 各组大鼠体质量(A)、足爪容积(B)、关节炎指数评分(C)比较
表1 各组大鼠滑膜组织中TNF-α、关节滑膜细胞内TAK1、胞核内NF-κB比较(±s,n=10,pg/moL)

表1 各组大鼠滑膜组织中TNF-α、关节滑膜细胞内TAK1、胞核内NF-κB比较(±s,n=10,pg/moL)
注:与空白组比较ΔP<0.05,ΔΔP<0.01;与模型组比较▲P<0.05,▲▲P<0.01。
组别空白组模型组MTX组电针组TNF-α 2.703±0.404 6.951±1.294ΔΔ4.258±0.690▲▲5.699±0.757▲ΔΔTAK1 5.017±0.830 8.015±0.643ΔΔ5.892±0.658▲▲7.047±0.399▲ΔΔNF-κB 0.2578±0.0525 0.4492±0.0343ΔΔ0.2522±0.0656▲▲0.3482±0.0942Δ▲
3 讨论
NF-κB信号通路的激活大体分为标准NF-κB信号通路、旁路NF-κB途径和非经典型NF-κB信号通路三类[10]。其中标准NF-κB信号通路主要介导与炎症反应和炎症细胞增殖与凋亡有关的基因表达,在RA的病情发展中贯穿始终。一方面该信号通路的激活能高效诱导多种细胞因子(如TNF-α、IL-1、IL-6)、黏附分子、趋化因子、免疫受体和急性期反应蛋白等编码基因的表达,促进炎症反应,而另一方面它作用于多种凋亡抑制蛋白如c-IAP1、c-IAP2等的表达,保护细胞免受凋亡,打破滑膜细胞增殖与凋亡的平衡最终导致的滑膜细胞类肿瘤样增殖[11-12]。
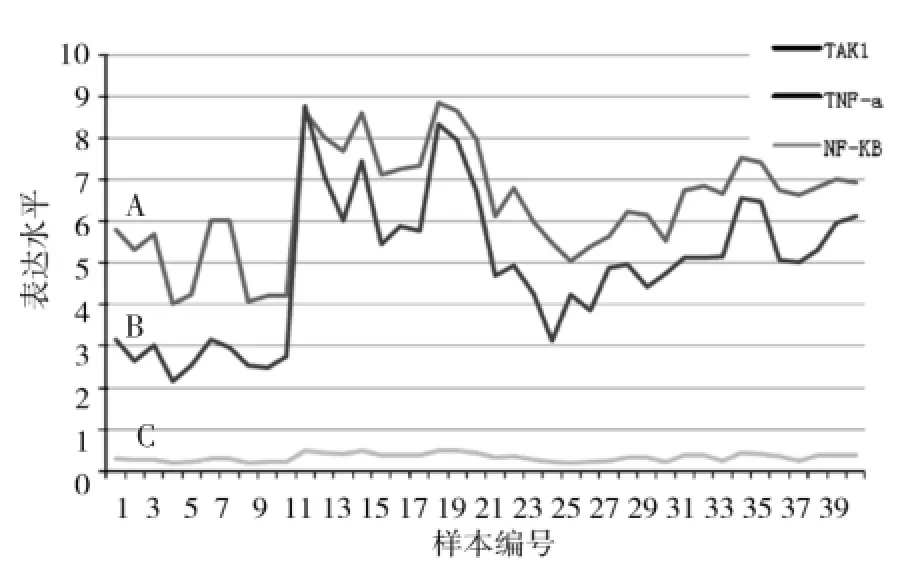
图2 TAK1、TNF-α、NF-κB三者的线性相关分析
NF-κB的激活主要是TNF-α、IL1β、IL6等多种炎性因子作用的结果,而TNF-α作为一种激活标准NF-κB信号通路的最常见的外部刺激因子,其介导的NF-κB激活机制是[13]:TNF-α与其特异性受体结合后,迅速招募肿瘤坏死因子受体相关因子(TRAF),TRAF通过与TAK1以及TAK1结合蛋白2(TAB2)和TAB3的相互作用,激活TAK1,磷酸化激活IKKβ。活化后的IKK最终使IκB磷酸化降解,激活NF-κB,NF-κB的NLS暴露,进入核内,与靶基因的κB位点结合,发挥转录活性,促进炎症反应的发生。有文献报道[14]:当TAK1激活环上保守的磷酸化位点Thr/Ser用Ala取代,使得TAK1失活后,IKKβ磷酸化水平显著下降,抑制NF-κB的表达和NF-κB通路的激活,由此可见,TAK1在TNF-α介导的NF-κB激活机制中起重要的调节作用。本实验研究中也发现:造模后的大鼠滑膜组织中TNF-α含量显著增加(P<0.01),滑膜细胞内TAK1含量明显升高(P<0.01),滑膜细胞内NF-κB在细胞核内高度表达(P<0.01)。
根据临床特征,RA属于中医学“痹证”范畴,其主要治疗原则为“扶正祛邪”,选穴配方以局部取穴为主,配合调节免疫功能的特殊治疗穴位,本实验选取了足三里、关元、阿是穴,前期的实验研究[15-17]显示:电针足三里、关元等穴能明显缓解RA动物模型(佐剂性关节炎大鼠)足跖肿胀程度,下调血浆TNF-α、IL-1、IL-2等炎性细胞因子的含量,改善局部炎症。
本实验研究结果显示,造模后的大鼠滑膜细胞内NF-κB在细胞核内高度表达,NF-κB信号通路激活,炎症反应明显;而电针佐剂性关节炎大鼠足三里、关元等穴有效下调了炎性细胞因子和NF-κB的表达,减轻大鼠足跖肿胀度,对抗炎症,且TAK1与NF-κB之间存在很明显的正性相关关系。结果表明电针佐剂性关节炎大鼠对抗炎症的作用机制与抑制了NF-κB信号通路上游的TAK1,从而良性调控该信号通路有关。
[1]Li G,Ma Y,Cheng TS,et al.Identical subchondral bone micro architecture pattern with increased bone resorption in rheumatoid arthritis as compared to osteoarthritis[J].Osteoarthritis and Cartilage,2014,22(12):2083.
[2]Bheeshma R,Ruth C,Peter CA,et al.Increased Surgeon Experience With Rheumatoid Arthritis Reduces the Risk of Complications Following Total Joint Arthroplasty[J].Arthritis&Rheumatology,2014,66(3):488-496.
[3]Junpei Teramachi,Akiko Kukita,Yin-Ji Li,et al.Adenosine abolishes mtx-induced suppression of osteoclastogenesis and inflammatory bone destruction in adjuvant-induced arthritis[J].Laboratory Investigation,2011,91(5):719-731.
[4]陆燕,李茹英.王顺贤治疗寒湿型类风湿性关节炎经验举隅[J].南京中医药大学学报,2011,27(2):175-177.
[5]Adolphe M,Parodi AL.Ethical issues in animal experimentation [J].Bull Acad Natl Med,2009,193(8):1803-1804.
[6]祁芳,李艳玲,艾坤,等.SD大鼠佐剂性关节炎模型的建立与评估[J].湖南中医药大学学报,2016,36(1):23-26.
[7]林文注,王佩.实验针灸学[M].上海:上海科学技术出版社,1999:288-290.
[8]郭纪光.中国兽医针灸学[M].北京:农业出版社,1984:60-62.
[9]薛彬.免疫毒理学实验技术[M].北京:北京医科大学、中国协和医科大学联合出版社,1995:58.
[10]Momoko N.Classical and alternative NF-κB activation pathways and their roles in lymphoid malignancies[J].Clin.Exp. Hematopathol,2005,45(1):15-24.
[11]Gregersen PK.REL,encoding a member of the NF-kappaB family of transcription factors,is a newly defined risk locus for rheumatoid arthritis[J].Nature Genetics,2009,41(7):820–823.
[12]SimmondsRE,FoxwellBM.Signalling,inflammationand arthritis:NF-kappa B and its relevance to arthritis and inflammation.Rheumatology(Oxford),2008,47(5):584-590.
[13]Joanne M.Hildebrand,Zuoan Yi,Claire M.Buchta,et al. Roles of tumor necrosis factor receptor associated factor 3 (TRAF3)and TRAF5 in immune cell functions[J].Immunological Reviews,2011,244(1):55–74.
[14]Chuan OY,Li N,Gu M,et al.Transforming growth factor(TGF)-β-activated kinase 1(TAK1)activation requires phosphorylation of serine 412 by protein kinase A catalytic subunit α(PKACα) and X-linked protein kinase(PRKX)[J].The Journal of Biological Chemistry,2014,289(35):26-37.
[15]艾坤,武丹,常小荣,等.电针对佐剂性关节炎大鼠足跖肿胀度和炎性细胞因子的影响[J].中国康复理论与实践,2011,17 (7):622-624.
[16]常小荣,艾坤,刘梨,等.电针足三里、关元对佐剂性关节炎大鼠β-内啡肽,ACTH的影响[J].中华中医药学刊,2009,27(4): 685-687.
[17]常小荣,刘梨,艾坤,等.电针足三里、关元对佐剂性关节炎大鼠IL-1,IL-2,IL-10,TNF-α的影响[J].中国骨质疏松杂志,2009,15(2):107-110.
(本文编辑 匡静之)
Effects of Electroacupuncture on TAK1 Expression in Articular Synovial Cell of Rats with Adjuvant-Induced Arthritis
LIU Li1,QI Fang2,LI Yanling2,AI Kun2*,CAI Xiong2,LI Xin2,ZHANG Hong2
(1.The First Affiliated Hospital of Hunan University of Chinese Medicine,Changsha,Hunan 410007,China;2.Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
ObjectiveTo observe the effect of electroacupuncture on Zusanli,Guanyuan acupoints on expression of Transforming growth factor-βactivation of Protein kinase(TAK1)in articular synovial cell of rats with adjuvant-induced arthritis(AIA),and explore the possible intervention mechanisms of electroacupuncture.Methods40 SD rats were randomly divided into blank group,model group,Methotrexate(MTX)group,the electroacupuncture group,10 rats in each group.The AIA model was made according to the Fueund's complete adjuvant(FCA)method.The electroapuncture group rats were given electroacupuncture at Zusanli and Guanyuan point for 20 minutes everyday,3 weeks in all.The MTX group rats were treated with MTX suspension at the dosage of 0.35 mg/kg twice a week since the injection day,3 weeks in total.The weight,paw volume and arthritis scores of rats were measured every 3 days.The TNF-α was detected by using radioimmunoassay.The expressions of TAK1,NF-κB in ankle synovial cell of rats were detected by Western Blot.The TNF-α,TAK1,NF-κB of eachgroupwerecomparedafterintervention.ResultsComparedwiththenormalgroup,thebodyweightgrowth in model group was slow,the feet swelling was significantly severe,arthritis scores increased significantly(P<0.01)and the TNF-α significantly increased,TAK1 in synovial cell significantly increased,NF-κB expression significantly increased faster(P<0.01).Compared with the model group,the body weight in electropuncture group increased faster,the feet swelling was slighter,and arthritis scores got lower(P<0.05),the TNF-α,TAK1 and NF-κB expression in synovial cells were lower(P<0.05).ConclusionElectroacupuncture on Zusanli,Guanyuan of AIA rats is effective,its intervention mechanism may be related to inhibiting the expression of TAK1 in synovial cells,then beneficial regulating on NF-κB the inflammatory signaling pathways.
TAK1;NF-κB;electroacupuncture;adjuvant induce arthritis;Zusanli acupoint;Guanyuan acupoint
R245.97
A
2016-08-23
国家自然科学青年基金(81303048);湖南省科技厅科技计划一般项目(2014SK3046);湖南省教育厅科学研究优秀青年项目(15B176);湖南省教育厅科学研究项目(14C0854)。
刘梨,女,博士,副教授,研究方向:针灸治病机制研究。
*艾坤,男,医学硕士,副教授,Email:aikun650@qq.com。
