加味丹参饮预处理调节ODC活性抗大鼠心肌缺血再灌注损伤研究
2017-02-08任婷杨胜辉饶春梅彭霞孙彦波吴若霞陈聪成细华黄政德湖南中医药大学湖南长沙410208
任婷,杨胜辉,饶春梅,彭霞,孙彦波,吴若霞,陈聪,成细华*,黄政德*(湖南中医药大学,湖南长沙410208)
加味丹参饮预处理调节ODC活性抗大鼠心肌缺血再灌注损伤研究
任婷,杨胜辉,饶春梅,彭霞,孙彦波,吴若霞,陈聪,成细华*,黄政德*(湖南中医药大学,湖南长沙410208)
目的探讨加味丹参饮通过调节鸟氨酸脱羧酶(ODC)活性在抗SD大鼠心肌缺血再灌注损伤(IRI)中的保护机制。方法建立SD大鼠心肌IRI模型,设对照组、假手术组、缺血再灌注损伤(IRI)组、加味丹参饮(JWDSY)+IRI组共4组。酶联免疫(ELISA)法测定ODC含量,实时荧光定量PCR(RT-PCR)方法检测ODC mRNA表达水平,免疫印迹(Western blot)法检测ODC蛋白表达水平,高效液相色谱检测心肌组织中多胺的含量。结果与对照组比较,假手术组的ODC含量、ODC mRNA及蛋白表达水平均无统计学意义(P>0.05);与假手术组比较,IRI组的ODC含量显著增加、ODC mRNA及蛋白表达水平显著升高,差异有统计学意义(P<0.01);与IRI组比较,JWDSY+IRI组ODC含量显著减少,ODC mRNA和蛋白表达水平显著降低,差异有统计学意义(P<0.01)。结论加味丹参饮可能通过调节ODC活性,从而发挥对IRI后心肌的保护作用。
加味丹参饮;心肌;缺血再灌注损伤;多胺;鸟氨酸脱羧酶
本文引用:任婷,杨胜辉,饶春梅,彭霞,孙彦波,吴若霞,陈聪,成细华,黄政德.加味丹参饮预处理调节ODC活性抗大鼠心肌缺血再灌注损伤研究[J].湖南中医药大学学报,2017,37(1):13-17.
心肌缺血再灌注损伤(ishemia reperfusion injury,IRI)机制及心肌保护的研究一直是当今倍受重视的课题,多胺(polyamines,PA)是心肌细胞正常生存不可缺少的一组重要小分子化合物,鸟氨酸脱羧酶(ornithine decarboxylase,ODC)是多胺合成代谢限速酶。在心肌缺血再灌注损伤时,多胺代谢失衡,ODC活性发生改变[1]。前期研究发现,加味丹参饮预处理对IRI心肌细胞具有保护作用,可模拟缺血预适应样保护作用(拮抗钙离子超载、保护线粒体结构,抗凋亡,抗氧化)[2-4],但其保护机制有待深入研究。据此,可以推测加味丹参饮可能通过调节ODC活性,从而发挥对心肌缺血后心肌的保护作用。本研究采用SD大鼠IRI模型,研究加味丹参饮预处理对大鼠IRI后ODC活性的影响,从调控多胺的代谢角度深入探讨加味丹参饮抗IRI的保护作用机制。
1 材料与方法
1.1 实验动物
健康SD大鼠48只,雌雄各半,体质量220~300 g。购于湖南中医药大学实验动物中心。许可证号:SYXK(湘)2013-0005。
1.2 药品与试剂
加味丹参饮(由丹参20 g,檀香6 g,赤芍10 g,川芎6 g,当归6 g,红花6 g,生地黄12 g,黄芪20 g)含生药量86 g,购自湖南中医药大学第一附属医院中药房,浸泡30 min,再按照W/V=1/8量加水煎煮2次(檀香后下),药液经1 000 r/min离心10 min除杂质,浓缩为含生药量1 g/mL。
TTC试剂(南京建成科技有限公司,批号:20150622),ELISA试剂盒(SIGMA,批号:E-ELR0694c),Trizol试剂(Invitrogen公司,批号:15596-026),RevertAidTMH Minus First Strand cDNA Syn thesis Kit(Fermentas公司,批号:K1631),DNase I(Fermentas公司,批号:EN0521),RiboLockTMRibonuclease Inhibitor(Fermentas公司,批号:EO0381),SYBR GreenPCR Master Mix(ABI,批号:4309155),Western blot显影液(Beyotime公司,批号:P0020),ODC一抗(Abcam公司,批号:ab193338),羊抗鼠二抗(南京生兴生物技术有限公司,批号:SN133),腐胺、精脒、精胺(Sigma公司)。
1.3 主要仪器
小动物呼吸机(浙江大学医学实验仪器,DH-8型);十六导生理记录仪(Biopac公司,MPl50型);高速离心机(SIGMA,1-13型);Realtime-PCR仪(ABI公司,7900型);水平电泳槽(北京君意东方仪器公司,JY-SPC型);电泳仪(北京鼎国生物技术发展中心,170-3930型);电转仪及附件(BIO-RAD公司,170-3930型);NC膜(PIERCE公司,88018型);滤纸(Whatman公司,3MMCHR型);高效液相色谱仪(Agilent,1260 infinity型)。
1.4 SD大鼠在体心肌缺血再灌注模型建立
SD大鼠,10%水合氯醛腹腔注射麻醉(0.3 mL/ 100 g)。开胸暴露心脏,剪开心包,于冠状动脉左心室前降支离左心耳下缘约1.5 mm处绕左心室支穿线结扎,缺血30 min后剪开结扎线,再灌注90 min,造成心肌缺血再灌注损伤。假手术组仅做冠状动脉穿线,不结扎。术中连续监视心电图Ⅱ导联的变化,以ST段抬高、T波高耸、倒置或左心室变为苍白色为心肌缺血结扎成功(心肌缺血)的标志,剪开结扎线后ST段下降50%以上、高耸的T波下降或左心室由苍白变为暗红色表示再灌注成功。
1.5 分组与给药方法
48只SD大鼠随机分为4组,每组12只。对照组(control):处理前14 d灌胃与JWDSY等量的生理盐水2次/d,连续14 d,末次灌胃1 h后开始试验,120 min后行开胸取出心脏;假手术组(blank):开胸左冠状动脉前降支下穿线不结扎,余同对照组;心肌缺血再灌注损伤组(IRI):开胸结扎左冠状动脉前降支30 min后松线,再灌注90 min,余同对照组;JWDSY+IRI组:大鼠造模前14 d予加味丹参饮灌胃,按大鼠与人的体质量及体表面积比值换算公式得到大鼠每天灌胃7.74 g/(kg·d),2次/d,连续14 d于末次灌胃1 h后行开胸结扎左冠状动脉前降支30 min后松线,再灌注90 min。
1.6 心肌组织梗死面积的测定
取40只老鼠分为4组,每组10只另行实验,实验结束后取下心脏,置于-20℃冰箱冰冻10 min后,沿垂直心脏长轴方向从心尖到结扎线下方切片,每片厚约1.5 mm,放入1%TTC磷酸盐缓冲液(pH7.4)37℃水浴箱中孵育20 min,然后置于10%甲醛中固定过夜。应用ImagemasterVDS图像分析仪分析心肌梗死面积占心肌总面积百分比,梗死区呈灰白色,非梗死区呈深红色。心肌梗死面积率=(所有切片梗死面积之和/心肌总面积之和)×100%。
1.7 酶联免疫(ELISA)法检测ODC含量
取心肌组织,参照试剂盒说明检测大鼠心肌组织ODC含量。具体步骤如下:(1)加样。分别设标准孔、待测样品孔、空白孔,空白孔加标准品和样品稀释液100 μL,余孔分别加标准品100 μL,覆膜,37℃孵育90 min;(2)弃液甩干。加入生物素抗体工作液100 μL,覆膜,37℃温育1 h;(3)洗涤;(4)每孔加酶结合物工作液100 μL,覆膜,37℃温育30 min;(5)洗涤;(6)每孔加底物(TMB)溶液90 μL,覆膜,37℃避光显色20 min;(7)每孔加终止溶液50 μL;(8)用酶标仪记录450 nm处OD值。
1.8 RT-PCR检测心肌组织ODC mRNA的表达
取心肌组织30 mg,研磨匀浆,加入1 mL Trizol提取心脏总RNA,采用A260/A280鉴定RNA纯度及浓度。根据反转录试剂盒说明书将RNA反转录为cDNA,-20℃保存备用。引物序列见表1。Realtime PCR扩增程序为95℃5 min;随后进行40次如下循环:94℃20 s、60℃20 s、72℃20 s。随后进行融点曲线分析。ABI7900型实时荧光定量RT-PCR仪检测记录数据,结果根据标准曲线由软件自动计算后得出。每组标本重复3次,取平均值为Ct值,计算目的基因ODC mRNA相对含量2-ΔΔCt。ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=最低样本ΔCt值—其它各样本ΔCt值[5],用扩增曲线、熔点曲线监测各样本PCR反应的特异性。

表1 ODC和β-actin PCR引物序列
1.9 Western blot检测心肌组织ODC蛋白表达
取大鼠左心室组织0.5 mg匀浆,加入1 mL蛋白提取液,匀浆20 min,冰上放置20 min,再匀浆20 min,9 000 r/min,离心10 min,取上清进行蛋白质定量。取50 μg总蛋白样品加入蛋白上样缓冲液煮沸变性后于SDS-PAGE电泳,随后转印至PVDF膜,用5%脱脂牛奶封闭37℃2 h后,用1∶1 000抗ODC抗体1 mL 37℃摇床孵育2 h。加入1∶8000 ODC酶标二抗1 mL 4℃过夜。加入发光底物试剂显色,扫描显影条带光密度。
1.10 高效液相色谱法测定心肌组织多胺含量
取左心室组织150 mg,加入0.3 mmol/L冷的高氯酸在冰水浴中制成匀浆,3 500 r/min离心10 min,取上清贮存在-20℃直至分析使用。具体操作方法参照赵雅君等的研究[6]。
1.11 统计学处理
2 结果
2.1 JWDSY对大鼠缺血再灌注心肌梗死面积率的影响
与control组相比,blank组心肌梗死面积率无统计学差异(P>0.05),IRI组显著增加(P<0.01)。JWDSY预处理IRI模型后,心肌梗死面积率与模型组相比显著降低(P<0.01)。见图1。

图1 TTC染色检测心肌梗死面积
2.2 ELISA法检测各组ODC含量变化
各组ODC含量变化,与control组相比,blank组无统计学意义(P>0.05)。与blank组相比,IRI组ODC含量差异有统计学意义(P<0.01);JWDSY预处理IRI模型后,ODC含量与IRI组相比差异有统计学意义(P<0.01)。见图2。
2.3 各组ODC mRNA表达的比较
Realtime PCR检测心肌细胞内ODC mRNA表达。结果显示:与control组相比,blank组无统计学意义(P>0.05)。与IRI组相比,IRI模型组ODC mRNA表达有统计学意义(P<0.01)。JWDSY预处理IRI模型后,ODC mRNA表达有统计学意义(P<0.01)。见图3。

图2 ELISA检测ODC含量变化
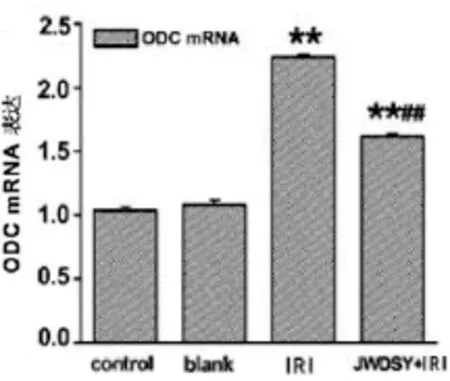
图3 Realtime PCR检测心肌细胞ODC mRNA表达
2.4 Western blot检测各组ODC蛋白表达的差异
与control组比较,blank组ODC相对表达量无统计学差异(P>0.05),IRI组ODC蛋白表达有统计学意义(P<0.01)。JWDSY预处理IRI组ODC蛋白表达与IRI组比较有统计学意义(P<0.01)。见图4、图5。

图4 Western blot检测ODC蛋白表达
2.5 各组多胺含量的比较
与对照组比较,IRI组的精胺在缺血再灌注90 min后减少具有统计学意义(P<0.01),而腐胺在缺血再灌注90 min后逐渐增加具有统计学意义(P< 0.01),精脒变化较小,总多胺池减少具有统计学意义(P<0.05);加味丹参饮预处理后,腐胺逐渐减少具有统计学意义(P<0.05),精胺和总多胺池含量增加(P<0.05),见图6。

图5 Western blot检测ODC蛋白表达条带

图6 各组大鼠心肌组织多胺含量变化
3 讨论
多胺包括腐胺、精胺和精脒,细胞内多胺的水平主要受多胺合成及逆转化分解的调节,ODC作为多胺合成代谢限速酶能精确调控多胺的平衡和代谢[7]。多胺具有广泛生物学作用,参与着体内多种生理病理过程,与多种疾病关系密切,耗竭细胞内的多胺可诱导细胞凋亡。转基因小鼠和大鼠ODC过度表达,表现出高水平的腐胺,尤其是在大脑和睾丸,发作阈值升高,缺血再灌注损伤梗塞出现较慢,体积较小[8]。多胺与胰腺炎,以及炎症相关疾病也密切相关[9]。精胺介导二氮嗪改善大鼠脑缺血再灌注损伤时的神经功能缺损并减少梗死面积和氧化应激[10]。Sigrist等建立记忆障碍(age-induced memory impairment AMI)模型发现,亚精胺药物治疗或调节内源性多胺水平都可以缓解记忆障碍,这种影响严格依赖于自噬[7]。研究发现在心肌缺血再灌注损伤时,多胺代谢失衡,ODC活性改变[11]。ODC的活性在十余分钟内的短暂缺血阶段中与缺血时间呈正相关关系[12]。ODC/多胺系统在心肌缺血再灌注损伤[13]和缺血预适应心肌保护中具有重要地位[14]。中医药是否能促进内源性多胺合成,从而调控ODC活性,目前尚未见报道。
本研究采用整体实验,造成大鼠心肌缺血再灌注病理模型。研究发现在缺血再灌注时,ODC活性增强,ODC mRNA和蛋白表达均显著升高,与假手术组和对照组相比有统计学意义。同时发现ODC活性改变后,腐胺显著增加,总多胺池水平下降,尤其是精胺含量减少。ODC是多胺合成代谢的限速酶,表明了心肌缺血再灌注损伤时,可能诱导ODC活性改变,ODC催化鸟氨酸生成腐胺增加,精胺减少,总多胺池含量减少,可见精胺与心肌缺血再灌注损伤关系密切。
加味丹参饮全方益气活血,通络止痛,用于气虚血瘀的冠心病有良好的治疗效果,加味丹参饮预处理对防治心肌IRI具有重要作用[2-4],本次研究结果显示,加味丹参饮预处理缺血再灌注损伤模型后,ODC含量显著减少,ODC mRNA和蛋白表达均显著降低,与缺血再灌注损伤组有统计学意义,提示加味丹参饮可能通过调节ODC活性,调控多胺代谢途径,减少IRI后腐胺生成,增加多胺池总量,从而发挥对缺血再灌注损伤后心肌的保护作用,其具体的机制有待进一步深入研究。
[1]Jänne J,Alnonen L.Pietilä M.et al.Genetic approaches to the cellular functions of polyamines in mammals[J].Eur J Biochem. FEBS,2004,271(5):877-894.
[2]彭霞,黄政德,成细华,等.加味丹参饮预处理调控自噬相关基因Beclin-1和Atg5表达抗大鼠心肌缺血再灌注损伤[J].湖南中医药大学学报,2016,36(7):20-24.
[3]陈聪,任婷,胡华,等.加味丹参饮预处理对大鼠心肌缺血再灌注损伤的保护作用[J].湖南中医药大学学报,2016,36(6):11-15.
[4]任婷,黄政德,田雪飞,等.心痛舒含药血清预处理对乳鼠心肌细胞缺氧/复氧损伤及TNF-α、IL-1β的影响[J].湖南中医药大学学报,2012,32(11):11-15.
[5]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△GMethod [J].Methods,2001,25(4):402-408.
[6]赵雅君,徐长庆,李全风,等.应用反向高效液相色谱分析离体心脏灌流大鼠心肌组织中的多胺[J].中国病理生理杂志,2005,21(2): 412-413.
[7]Nadège Minois,Didac Carmona-Gutierrez,Frank Madeo.Polyamines in aging and disease[J].AGING,2011,3(8):716-732.
[8]Jänne J,Alhonen L,Pietilä M,et al.Genetic approaches to the cellular functions of polyamines in mammals[J].European journal of biochemistry,2004,271(5):877-894.
[9]Puntambekar SS,Davis DS,Hawel III L,et al.LPS-induced CCL2 expression and macrophage influx into the murine central nervous system is polyamine-dependent[J].Brain,Behavior, and Immunity,2011,25(4):629-639.
[10]Dong H,Wang S,Zhang Z,et al.The effect of mitochondrial calcium uniporter opener spermine on diazoxide against focal cerebral ischemia-reperfusion injury in rats[J].Stroke Cerebrovasc Dis,2014,23(2):303-309.
[11]赵雅君,王丽娜,李鸿珠,等.大鼠心肌多胺代谢限速酶ODC、SSAT活性分析[J].中国药理学通报,2005,21(5):555-559.
[12]万新,姜冰.多胺与脑缺血[J].国际神经病学神经外科学杂志, 2001,28(6):453-455.
[13]Zhao YJ,Zhang WH,Xu CQ,et al.Involvement of the ornithine decarboxylase/polyamine system in precondition-induced cardioprotection through an interaction with PKC in rat hearts[J]. Molecular and cellular Biochemistry,2009,3271/2:135-144.
[14]张国中,刘增长.内质网应激与心肌缺血再灌注损伤[J].实用临床医药杂志,2015,19(7):4714-4717.
(本文编辑 李杰)
Study of Modified Danshen Decoction Pretreatment on Adjusting ODC Activity Against the Rats Myocardial Ischemia Reperfusion Injury
REN Ting,YANG Shenghui,RAO Chunmei,PENG Xia,SUN Yanbo,WU Ruoxia,CHEN Cong, CHENG Xihua*,HUANG Zhengde*
(Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
ObjectiveTo explore the protective mechanism of modified Danshen decoction on SD rats myocardial ischemia-reperfusion injury(IRI)by ornithine decarboxylase(ODC)activity.MethodsThe SD rat models of myocardial IRI were established,the four groups of control group,sham-operation group,ischemia/reperfusion(IRI)group,Jiawei Danshen Decoction (JWDSY)+IRI group were assigned.The content of ODC was determined by ELISA method.The ODC mRNA expression level was detected by fluorescence quantitative RT-PCR method.The ODC protein expression level was detected by Western blot method,and the polyamine content was determined by HPLC.ResultsCompared with the control group,the content of ODC,ODC mRNA and protein expression level in sham-operationa group were increased,the difference had no statistically significant(P>0.05),while compared with the sham-operation group,the content of ODC,ODC mRNA and protein expression level in IRI group were increased significantlay(P<0.01).Compared with IRI group,the ODC content in JWDSY+IRI group was significantly reduced,and the ODC mRNA and protein expression level were decreased significantly,the difference was statistically significant(P<0.01).ConclusionModified Danshen decoction could adjust the ODC activity,and then play a protective effect on myocardium after IRI.
modified Danshen decoction;cardiac muscle;ischemia reperfusion injury;polyamine;orinithine decarboxylase
R285.5;R541.4
A
2016-08-13
国家自然科学基金资助项目(81373576,81503536);湖南省教育厅项目(14B136,14C0872);湖南省中医药管理局重点课题(201304);湖南省科技厅一般项目(2014SK3034);中西医结合防治心脑疾病的相关基础研究湖南省高校科技创新团队科研项目(5)。
任婷,女,博士研究生,讲师,研究方向:心血管疾病的中医药防治研究。
*黄政德,男,教授,博士研究生导师,E-mail:Hzd112@163.com;*成细华,女,教授,硕士研究生导师,E-mail:1357655170@qq.com。
