亚厘米肺结节的外科诊疗分析*
2017-02-08支修益许庆生李元博
苏 雷 支修益 张 毅 许庆生 胡 牧 钱 坤 李元博
(首都医科大学宣武医院胸外科 首都医科大学肺癌诊疗中心,北京 100053)
·临床研究·
亚厘米肺结节的外科诊疗分析*
苏 雷 支修益**张 毅 许庆生 胡 牧 钱 坤 李元博
(首都医科大学宣武医院胸外科 首都医科大学肺癌诊疗中心,北京 100053)
目的 探讨亚厘米(<10 mm)孤立性肺结节(solitary pulmonary nodule,SPN)的临床诊断和外科治疗方法。方法 对我院2006年1月~2015年12月手术治疗62例亚厘米SPN进行回顾性分析。术前均行多次胸部CT扫描随访,随访观察时间3~72个月(平均6.8月)。术前胸部CT肺窗测定病变大小,直径≤5 mm 28例,6~9 mm 34例。实性结节17例,半实性结节36例,纯磨玻璃样病变9例。其中56例行术前病变定位。术式包括胸腔镜单纯病变切除或剔除术2例,肺楔形切除术47例,肺段切除术8例,肺叶切除术5例。 结果 术后病理证实恶性结节54例(87.1%),包括非典型性腺瘤样增生(atypical adenomatous hyperplasia,AAH)和原发恶性肿瘤共49例,转移瘤5例;良性结节8例(12.9%)。 结论 亚厘米SPN影像学静态特征相对缺乏,需要通过其实质变化及动态观察确定诊疗策略。影像学定位技术有助于胸腔镜术中准确定位,肺叶和亚肺叶切除对亚厘米SPN的诊疗安全有效。
亚厘米肺结节; 胸腔镜手术; 诊断; 治疗
孤立性肺结节(solitary pulmonary nodule,SPN)是指肺内直径≤30 mm的类圆形病灶。对于SPN的定性诊断和外科治疗策略越来越成为胸部肿瘤外科的临床工作重点和研究热点[1~5],但对亚厘米(<10 mm)SPN(又称肺微小结节)的临床资料相对较少。我们在2013年和2015年报道了SPN的胸腔镜治疗结果[3,6]。在此基础上,我们对2006年1月~2015年12月手术治疗的62例亚厘米SPN的临床治疗进行回顾性分析,对亚厘米肺结节的外科诊疗策略做初步探讨。
1 临床资料与方法
1.1 一般资料
本组62例,男28例,女34例。年龄32~65岁,平均50.3岁。47例因体检发现SPN,14例有咳嗽、胸痛、咯血症状,1例因外伤检查发现。CT提示病变位于肺周围53例,近肺门9例;实性结节17例,半实性结节36例(图1A、B),纯磨玻璃样病变(ground-glass nodule,GGN)9例;右肺上叶21例,右肺中叶3例,右肺下叶17例,左肺上叶12例,左肺下叶9例。首次检出SPN后均行多次胸部CT扫描随访,随访观察时间3~72个月(平均6.8月),53例实性/半实性结节中体积增大和(或)密度增高43例(其中17例实性SPN中体积增大14例,36例半实性SPN中体积增大9例,密度增高12例,二者均有8例),9例GGN中出现实性成分5例。术前根据胸部CT肺窗测量结节直径,≤5 mm 28例,6~9 mm 34例;边缘清晰47例,分叶征11例,毛刺征4例。
1.2 方法
1.2.1 术前定位 56例SPN术前2 h定位,CT引导下在病灶邻近部位注射生物胶[北京福爱乐科技发展有限公司生产,国食药监械(准)字2004第3650308号]0.4~0.6 ml[6]。另6例因解剖部位靠近肺门(5例)或肺尖前段(1例,图1C)而未施行定位。
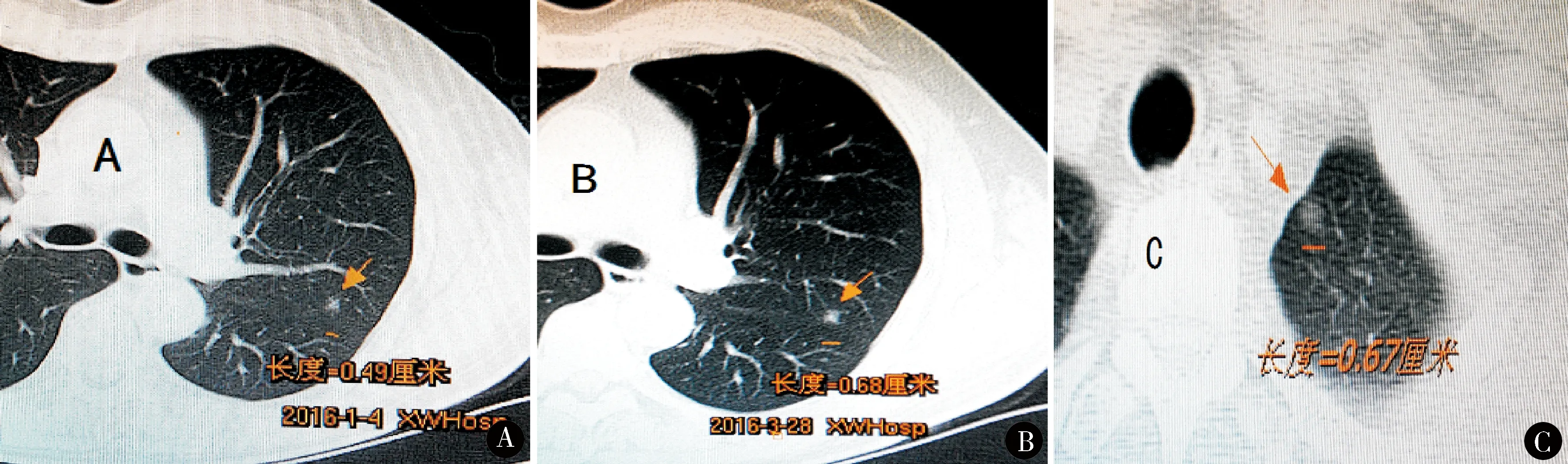
图1 亚厘米肺结节的CT表现,A、B显示左肺上叶半实性肺结节随访3个月后明显增大(长度从0.49 cm到0.68 cm),C显示左肺上叶GGN,该部位定位操作困难
1.2.2 手术方法 静吸复合麻醉,双腔气管插管,健侧卧位。选择患侧腋中线第7或8肋间做胸腔镜观察孔。根据术前定位标志或通过触摸手法确定病变部位。对于周围性SPN,用内镜切割缝合器(Endo-GIA)或铥激光距病变2 cm处楔形切除病变所在部位肺组织;对于肺实质内深在的结节病变,通过剔除或摘除的方法获取病变组织,或直接行肺段切除[1~3,6]。均做术中冰冻快速病理检查,根据冰冻病理结果,8例良性病变及5例转移癌结束手术(2例剔除,11例楔形切除);冰冻病理报告22例非典型性腺瘤样增生(atypical adenomatous hyperplasia,AAH)行单纯肺楔形切除,其中1例术后病理诊断为右肺中叶类癌行二次胸腔镜右肺中叶切除、纵隔淋巴结清除术;冰冻病理报告16例原位腺癌(adenocarcinoma in situ,AIS)和7例微浸润腺癌(microinvasive adenocarcinoma,MIA)行亚肺叶切除(肺段切除8例,楔形切除15例)纵隔淋巴结清除术;冰冻病理报告2例肺鳞癌和2例小细胞肺癌均行肺叶切除、纵隔淋巴结清除术。
1.2.3 术后处理 良性SPN术后随访半年。AAH和恶性SPN术后均建议服用以扶正为主的中药治疗,并根据机体细胞免疫水平(如T/B细胞亚群和自然杀伤细胞水平等)应用免疫增强治疗,如胸腺肽类药物。随访第1年每3个月一次,第2年6个月一次,病情稳定者以后每年1次。转移瘤转入对应科室继续治疗。
2 结果
2.1 定位效果
56例CT引导穿刺定位过程顺利,无严重血气胸发生。3例定位后咳嗽,服用止咳药后缓解。56例胸腔镜术中均可快速准确定位。
2.2 术式
胸腔镜下行单纯病变剔除术2例,亚肺叶切除术55例(肺段切除8例,肺楔形切除47例),肺叶切除术5例,联合纵隔淋巴结清除28例。术后无严重并发症发生。
2.3 病理结果
术后病理诊断恶性SPN 54例(87.1%),包括AAH和原发恶性肿瘤49例(AAH 21例,AIS 16例,MIA 7例,肺鳞癌2例,小细胞肺癌2例,类癌1例),转移瘤5例(甲状腺癌2例,肾癌2例,乳腺癌1例)。良性结节8例(12.9%),包括感染性或炎症疾病5例(肺慢性肉芽肿2例,炎性淋巴结肿大1例,炎性假瘤1例,隐球菌肉芽肿1例),良性肿瘤3例(硬化性血管瘤2例,肺错构瘤1例)。
不同术前影像学特征的术后病理结果见表1。

表1 不同术前影像学特征的术后病理结果
2.4 随访结果
8例良性SPN术后随访半年,无严重并发症。5例转移瘤转入对应科室继续治疗。49例AAH和恶性SPN随访时间6个月~5年,平均26.0月,其中31例随访时间超过36个月,均未发现复发和转移证据。
3 讨论
随着健康体检增多和胸部CT的广泛应用,越来越多SPN需要得到诊治[1,3~7]。对SPN的关注基于两方面,一是早期肺癌术后可以获得更多的生存机会,文献综合报道[1~3,5~8]的T1或T2N0M0非小细胞肺癌外科治疗效果明显,5年生存率达到70%以上,T1N1M0的5年生存率为52%,而Ⅲ期N2病例仅为25%;二是尽量避免对可能的良性结节实施外科手术而带来的风险。虽然在早期有关SPN文献中以肺部良性病变为主,占50%~70%,恶性占35%~50%[1~3,8,9],恶性病例的可能性随着结节的增大而增大,但并不能够排除小结节恶性病变的可能性。尤其是对于亚厘米SPN,不能因为其体积小而轻视[3,5,8,9]。
本组62例亚厘米SPN术后病理报告恶性SPN共54例(87.1%),包括AAH和原发肺恶性肿瘤共49例(其中AAH 21例,AIS 16例,MIA 7例,肺鳞癌2例,小细胞肺癌2例,类癌1例),转移瘤5例(包括甲状腺癌2例,肾癌2例,乳腺癌1例)。与2013年我们报道的51例恶性SPN中有11例AAH和AIS[6]相比,本组数量明显增多,49例恶性SPN中有37例AAH和AIS,提示关注亚厘米SPN的重要性。
相比10~30 mm的SPN,本组影像学特征更为细微,其静态征象包括边缘征象(分叶征、毛刺征、多边形、周围晕轮征等),内部征象(空泡征、支气管充气征等)和周围征象(血管集束征和胸膜凹陷征等)三方面缺乏明显特征[1~5,7,8],但亚厘米SPN的影像学特点在于其内部成分的构成如是否存在实性成分及所占比例[1~5,8,9]。本组36例在影像学表现为半实性亚厘米SPN的术后病理均为恶性结节。
对于在影像学表现为实性病变的亚厘米SPN的动态随访观察尤为重要,即观察亚厘米SPN病变的倍增时间。应该指出的是,不应仅靠测量亚厘米SPN病变的直径观察。按照几何球体体积的计算公式V=4πr3/3,当一结节病变体积倍增时,其直径仅增加26%。换句话说,当一个直径4 mm的结节体积增加1倍时,其直径也不会增长到5 mm,而这一变化几乎在CT扫描中很难观察到。肺部结节直径从5 mm增长到6.2 mm,肿瘤体积也增加了1倍,但是CT片子上看不出太大差别。如果肺部结节本身直径有3 cm,倍增一次就能明显看出瘤体变大。这就是亚厘米SPN的观察评估必须借助CT三维成像来计算肿物的体积,判断肺部结节的体积有没有出现成倍增长[1~5,7~10]。
对于影像学表现为纯磨玻璃样病变的结节的随访观察,虽然类似磨玻璃样病变可以在长达3年的时间没有明显改变,但其实性成分比例的变化应特别引起重视[1~5,7,9,10]。本组9例GGN中,术后病理7例为AAH,1例为AIS,1例为隐球菌肉芽肿性炎。
与胸部CT扫描相比,PET-CT虽然在显示病变大小、形态、与周围组织的关系、CT值以及PET图像上病灶的放射性分布、平均SUV值(standard uptake value)等方面明显弥补CT扫描在SPN的鉴别诊断方面的不足[1~6,8],但由于葡萄糖代谢在不同肿瘤中有很大差异,特别是受到容积效应的影响,PET-CT对于亚厘米SPN的鉴别意义不大[1,3,7]。
对于包括亚厘米在内的早期肺原发恶性肿瘤的切除术式,还没有明确定论,根据术中病理类型确定具体术式是目前达成的共识[1,5,8~10]。在本回顾性研究中,术中明确为恶性的亚厘米SPN有49例,其中亚肺叶切除44例(90.0%)(肺楔形切除术36例,肺段切除术8例),肺叶切除术5例(10.0%),随访6个月~5年,均没有发现复发证据。但由于受病例数和随访时间所限,亚肺叶切除的有效性有待今后的数据和随机对照研究论证。
1 Sakurai H,Nakagawa K,Watanabe S.Clinicopathologic features of resected subcentimeter lung cancer.Ann Thorac Surg,2015,99(5):1731-1738.
2 Lee KH,Goo JM,Park SJ,et al.Correlation between the size of the solid component on thin-section CT and the invasive component on pathology in small lung adenocarcinomas manifesting as ground-glass nodules.J Thorac Oncol,2014,9(1):74-82.
3 苏 雷,支修益,张 毅,等.胸腔镜治疗孤立性肺小结节的分析.首都医科大学学报,2015,36(4):525-528.
4 Patel VK,Naik SK,Naidich DP,et al.A practical algorithmic approach to the diagnosis and management of solitary pulmonary nodules: part 1:radiologic characteristics and imaging modalities.Chest,2013,143(3):825-839.
5 Shin KE,Lee KS,Yi CA,et al.Subcentimeter lung nodules stable for 2 years at LDCT:long-term follow-up using volumetry.Respirology,2014,19(6):921-928.
6 苏 雷,支修益,张 毅,等.胸腔镜辅助治疗孤立性肺结节120例分析.中国微创外科杂志,2013,13(11):966-973.
7 Bak SH,Lee HY,Kim JH,et al.Quantitative CT scanning analysis of pure ground-glass opacity nodules predicts further CT scanning change.Chest,2016,149(1):180-191.
8 Smith CB,Swanson SJ,Mhango G,et al.Survial after segmentectomy and wedge resection in stage I non-smallcell lung cancer.J Thorac Oncol,2013,8(1):73-78.
9 Tsutani Y,Miyata Y,Nakayama H,et al.Appropriate sublobar resection choice for ground glass opacitydominant clinical stage IA lung adenocarcinoma.Wedge resection or segmentectomy.Chest,2014,145(1):66-71.
10 Cao C,Gupta S,Chandrakumar D,et al.Meta-analysis of intentional sublobar resections versus lobectomy for early stage non-small cell lung cancer.Ann Cardiothorac Surg,2014,3(2):134-141.
(修回日期:2016-12-01)
(责任编辑:王惠群)
Clinical Diagnosis and Surgical Treatment of Sub-centimeter Solitary Pulmonary Nodules
SuLei,ZhiXiuyi,ZhangYi,etal.
DepartmentofThoracicSurgery,XuanwuHospitalofCapitalMedicalUniversity,Beijing100053,China
ZhiXiuyi,E-mail:xiuyizhi@aliyun.com
Objective To investigate the clinical diagnosis and surgical treatment of sub-centimeter solitary pulmonary nodule (SPN). Methods A retrospective analysis was performed on 62 patients with sub-centimeter SPN receiving resection in our hospital from January 2006 to December 2015. All the patients underwent repeatedly preoperative chest CT scans, and were followed up for 3-72 months (mean, 6.8 months). According to the preoperative chest CT lung window, the diameter of the lesion was less than 5 mm in 28 cases and 6-9 mm in 34 cases. There were 17 cases of solid nodules, 36 cases of semi solid nodules, and 9 cases of pure grinding glass like lesions. Of these 56 underwent preoperative lesion location. Surgical methods included thoracoscopic lesion resection or eliminate surgery in 2 cases, pulmonary wedge resection in 47 cases, pulmonary segmentectomy in 8 cases, and lobectomy in 5 cases. Results Postoperative pathological examination confirmed malignant nodules in 54 cases (87.1%), including 49 cases of atypical adenomatous hyperplasia and primary malignant tumors and 5 cases of metastatic tumors. Benign nodules were seen in 8 cases (12.9%). Conclusions The sub-centimeter SPN imaging relatively lacks of static characteristics, so its substantial changes and dynamic observations are needed to determine diagnosis and treatment strategy. Imaging location technique helps thoracoscopic surgery of accurate positioning. Lobectomy and sublobar resection are safe and effective methods for patients with sub-centimeter SPN.
Sub-centimeter solitary pulmonary nodule; Video-assisted thoracic surgery; Diagnosis; Treatment
北京市自然科学基金(7132106);973国家科技计划课题(2011CB510100)
A
1009-6604(2017)01-0011-04
10.3969/j.issn.1009-6604.2017.01.004
2016-10-11)
**通讯作者,E-mail:xiuyizhi@aliyun.com
