贝类腹泻性毒素现场高通量前处理及快速检测仪器设计*
2017-02-07万梓健邱先鑫钟隆洁苏凯麒邹瞿超方佳如潘宇祥
万梓健,邱先鑫,钟隆洁,苏凯麒,邹瞿超,方佳如,潘宇祥,王 平
(浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州 310027)
贝类腹泻性毒素现场高通量前处理及快速检测仪器设计*
万梓健,邱先鑫,钟隆洁,苏凯麒,邹瞿超,方佳如,潘宇祥,王 平*
(浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州 310027)
为实现贝类腹泻性毒素的现场快速检测,本论文设计了一种现场高通量前处理装置及基于移动终端的快速检测系统。通过使用酶联免疫反应技术对腹泻性贝毒进行显色反应,结合基于移动终端的快速检测装置,采集显色反应结果图像,实现准确快速的检测结果分析。采用所设计的前处理装置与实验室手工前处理标准方法对比,其回收率分别为89%和93%,结果表明,本文设计的前处理装置能够满足现场检测分析的需求。通过加标样品检测,采用移动终端的快速检测系统测量标准差为0.13,平均回收率89.5%。实验结果表明,该检测系统的准确性和重复性满足实际检测的需求。最后,针对实际样品,与酶标仪检测结果相比较,表明了所设计的现场高通量前处理装置及快速检测系统能达到对贝类腹泻性毒素现场快速精确检测,为贝类腹泻性毒素现场检测提供了新的方法和仪器。
贝类腹泻性毒素;前处理装置;快速检测系统;移动终端
腹泻性贝毒DSP(Diarrhetic Shellfish Poisoning)是有毒赤潮藻类鳍藻属和原甲藻属中一些种类产生的脂溶性多环醚类生物活性物质。腹泻性贝毒主要为大田软海绵酸(OA)及其衍生物鳍藻毒素(DTX-3),扇贝毒素(PTX2)等大类,可经过贝类等滤食性动物食用后在贝类消化腺内富集。毒素对贝类无害,但人们在食用腹泻性贝毒污染的贝类后,会出现呕吐,腹泻等急性中毒症状[1-2]。并且,大田软海绵酸(OA)经过动物实验证明其具有致癌性,致突变性和免疫毒性。为了满足在现场对贝类样品中的腹泻性毒素进行有效评估,有必要设计一套现场快速检测系统及前处理装置。本文主要以腹泻性贝类毒素中的主要成份OA进行实验。
为了客观评估待测样品中的毒素含量,保证以上检测方法得到正确的结果,合适有效的前处理方法必不可少。传统的前处理方法有膜分离和固相萃取。膜分离是利用选择透过性膜来起到物质分离,广泛应用于海水淡化、溶胶及混合液分离和浓缩、工业废水中重金属离子去除、饮用水净化、蛋白质和酶分离等领域[3];固相萃取是通过固体吸附剂对液体样品中的目标化合物进行吸附,再经解吸附完成对目标化合物的富集,固相萃取适用于浓度较低的样品,广泛应用于微量或痕量的分离,富集和分析[4]。为了满足现场快速检测的便携性等需求,传统前处理仪器体积较大,需专业人员操作,不适合于现场环境下使用。
在DSP毒性的评估方法中,作为标准方法的是动物实验,如小鼠生物测定法(MBA)腔注射毒素,观察小白鼠存活情况,计算毒力[5]。小鼠生物测定法由Yasumoto等人建立,是美国官方分析化学师协会(AOAC)使用的标准方法,运用非常广泛,其测量单位是鼠单位(MU)。小鼠法虽然被许多国家作为标准方法所使用,但是其受到的限制较多:注射小鼠的专业性较强,需要专业人员操作;除了毒素之外,注射液中的盐含量,重金属离子等其他物质可能也会对毒性评估造成影响[6-7]。高效液相色谱法(HPLC)是目前较为常用的检测贝类毒素的理化分析方法,常见贝类毒素均能使用HPLC进行检测,灵敏度和准确性高,是比较成熟的理化分析技术[8]。HPLC方法利用毒素分子上的羧基官能团与荧光物质反应,生成的荧光性物质经反相色谱分离后在检测器上响应。HPLC的灵敏度和准确性高,同时还能确定毒素种类,但其荧光标记试剂极不稳定[9],且设备精密复杂,检测用时长。而免疫方法检测是利用抗原-抗体反应确定毒素的类型及含量,包括酶联免疫反应(ELISA),放射免疫反应(RIA),竞争性酶免疫分析(EIA)等方法。免疫方法的专一性较强,其灵敏度可达10-9[10-11]。而免疫方法在针对有些贝类毒素的检测时,如麻痹性毒素STX,可能存在与其他毒素之间的交叉反应;在检测过程中,还有可能出现假阳性的情况[12-14]。
而目前实验室检测腹泻性贝类毒素的方法中,小鼠法和HPLC无法发展成现场的快速检测方法;免疫方法较为适合发展成现场检测的方法[15]。但由于常规酶标仪的体积较大,不适合在现场环境下使用。并且免疫方法的样品前处理设备及方法仍不适用于现场快速检测。为了能够适应贝类毒素的现场快速检测,样品前处理方法及毒素检测方法均需要满足现场快速检测的要求。因此,本文设计了一种高通量半自动的前处理装置和腹泻性贝毒现场检测系统,利用移动终端进行检测。在下文中介绍了高通量前处理装置和现场检测系统的设计原理和组成结构,并通过对实际样品的分析测试来验证系统的功能。

图1 高通量前处理装置结构图和实物
1 材料与方法
1.1 试剂和仪器
腹泻性贝毒检测试剂盒,甲醇,纯水,便携式离心机,手持式均质器,移液枪,振荡器,高通量前处理装置,快速检测系统,酶标仪。
1.2 高通量前处理系统设计及前处理方法
1.2.1 高通量前处理系统硬件设计
为了减少前处理过程中因实验操作习惯带来的误差,提高样品处理效率,设计了一种高通量前处理装置。前处理装置主要由电路和管路所组成,通过微控制器控制蠕动泵的工作,完成前处理过程中的各个步骤。所设计的高通量前处理装置的结构图如图1(a)所示,使用开关电源为整个系统供电,并通过变压电路为不同工作模块提供电源。微控制器MSP430接收上位机的指令,控制不同的蠕动泵和外接设备完成正常工作,实现对前处理过程中贝肉样品的灌注,过滤以及萃取液的添加和样品的称重,振荡和离心。按照样品前处理的步骤分别进行相对应的功能,可实现4个萃取样品的同时过滤,得到样品的毒素萃取液。图1(b)为实际装置的外观图。
1.2.2 高通量前处理系统软件设计
软件设计包括上位机和下位机软件两部分组成。其中上位机用于对前处理流程的参数进行设置、存储、导入以及对各模块完成功能的顺序进行控制,起到操作者与系统交互的作用,使用LabVIEW平台对上位机软件进行编写;下位机用于各模块功能的初始化,与上位机通讯,确定前处理流程的时序及控制各模块的执行,下位机软件由MSP430F149单片机执行,在IAR for MSP430平台上使用C语言进行编写。
前处理软件的整体构成如图2(a)所示。首先通过上位机将所设定的工作参数传入下位机中,下位机接收参数赋值后将当前状态传回上位机;操作人员通过上位机对某工作模块发送工作命令,下位机将工作命令转换成时序控制电路的工作时序并监控其运行状态;时序控制电路按照预定的时序控制各功能模块有序地完成各环节的工作;下位机接收到时序控制电路的终止信号,将状态返回上位机;重复此过程,可以完成对前处理流程各个环节的控制,高效有序地完成贝肉样品前处理工作。图2(b)为上位机的操作界面。
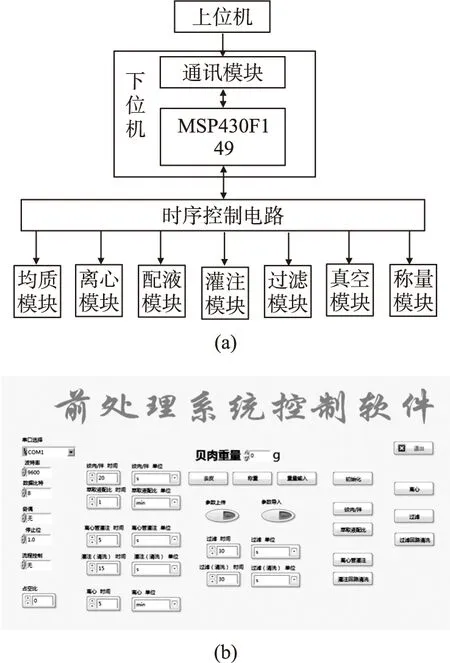
图2 前处理系统结构图和上位机操作界面
1.2.3 样品前处理
使用所设计的高通量前处理装置对贝肉样品进行前处理。首先将高通量前处理装置与上位机以及其他外接设备相连接,并完成初始化。使用电子秤称量剥好的贝肉样品,装置将根据得到的贝肉样品重量按1∶5的比例配比80%甲醇溶液并加入贝肉样品中。待配比环节完成后,使用均质器将贝肉和80%萃取液充分混合,得到贝肉悬浊液。将贝肉悬浊液通过前处理装置灌注至2 mL离心管中,灌注完成后,使用纯水清洗管路并用固定转速7 000 r/min离心机离心5 min。待离心完成后,将离心管内上清液通过0.45 μm过滤器进行过滤,过滤蠕动泵组可以同时过滤四路样品,实现样品的高通量处理。将过滤得到上清液使用80%甲醇溶液至标定曲线浓度范围之内。若有多个样品,可重复均质和灌注环节,将得到的贝肉悬浊液样品同时过滤,得到各个样品所对应的OA萃取液。
1.3 快速检测系统设计及检测方法
1.3.1 ELISA检测原理
使用ELISA技术对腹泻性贝毒进行检测。将OA和牛血清白蛋白(BSA)的偶连体(OA-BSA)固定在多孔板上,加入待测样品后,使待测样品和OA-BSA偶连体竞争性结合经过辣根过氧化物酶(HRP)标记的OA抗体(OA-HRP)。OA的浓度决定了HRP催化反应生成的产物的浓度。待反应结束后,加入终止液使溶液显黄色,其颜色的深浅与样品中OA的浓度成正相关关系。根据已知浓度的标准品反应结果绘制标定曲线,通过采集多孔板图像,通过标定曲线对图像进行分析,得到待测样品中OA的浓度结果[16-18]。

图3 快速检测系统结构图和实物图
1.3.2 快速检测系统硬件设计
设计快速检测装置以配合移动终端对完成显色反应的腹泻性贝毒试剂盒进行检测。快速检测装置主要为检测提供暗环境,能固定移动终端和检测试剂盒,并易于更换。检测系统的结构图如图3(a)所示,主要由暗室,移动载物台,移动终端适配器和平面光源所组成。检测装置主体为暗室结构,移动终端适配器位于暗室上方,既便于更换,又组成了暗室的顶部。使用冷光片作为检测的平面光源。冷光片通过固定器固定在暗室底部,所使用的冷光片具有发热小,发光强度高,光线均匀的特点,能满足检测需求。通过导轨和直线轴承将试剂盒载物台固定于暗室底座上,实现载物台的水平滑动,便于试剂盒的放置和取出。置于装置上方的移动终端适配器可以固定移动终端的位置,保证采集图像的一致性。检测系统的实物图如图3(b)所示。

图4 检测软件流程图和软件操作界面
1.3.3 快速检测系统软件设计
本系统中使用iPhone 4s作为移动终端进行实验。使用Objective-C语言开发检测用App。由于当背光为单光源时,采集图像得到的颜色分量与待测样品中所含OA的浓度成线性关系。软件流程图和软件操作界面分别如图4(a)和图4(b)所示,软件的主要功能是通过内置摄像头采集完成显色反应的试剂盒图像,通过对OA标准品显色图像结果的RGB某一通道的颜色比率绘制标定曲线。依照标准曲线和待测样品的颜色分量结果,计算出待测样品中OA的浓度;若是稀释后的结果,再乘上稀释倍数即可得到实际样品中所含有的OA浓度。为了方便实验结果的存储,软件可将实验结果通过邮件的形式发送至指定邮箱,便于实验的分析和汇总。
标定曲线的准确性将直接决定检测结果的准确性。标定曲线由OA标准品浓度以10为底的对数和相对应微孔的颜色比率计算得到。颜色比率的计算方法如下:
式中:Cr(n)为浓度为n的OA标准品的颜色比率,Ck(n)为浓度为n的OA标准品微孔中图像RGB某一分量的平均值,C0为OA标准品浓度为0的微孔的RGB分量平均值。根据最小二乘法拟合OA标准品浓度以10为底的对数和相对应微孔的颜色比率,得到系统标定曲线。
得到标定曲线后,采集待测样品微孔的RGB分量平均值,计算出待测样品微孔的颜色比率,代入标定曲线,可计算得出相对于微孔的浓度,即可完成对待测样品中OA浓度的检测。
1.3.4 样品快速检测
在进行快速样品检测之前,首先要使用试剂盒对OA标准品和待测样品进行抗原抗体反应并显色。所需试剂和试剂盒需要置于20 ℃~28 ℃的环境之下。使用100 μL浓度分别为0,0.2×10-9,0.5×10-9,1×10-9,2×10-9和5×10-9的OA标准品为检测系统制定标准曲线,将不同浓度的OA标准品依次加入对应的微孔内,同时取等量待测样品提取液加入指定微孔内。添加OA标准品及待测样品,将溶液混匀,静置于室温下孵育30 min。待孵育完毕后,将孔内的溶液倒出废弃,使用缓冲液(含有0.05% Tween-20的PBS溶液)对孵育完毕的微孔进行清洗,并将试剂盒倒置于吸水纸上拍打至孔内无残留液体,清洗过程重复三到四次。清洗完成后,加入100 μL底物溶液,室温下避光孵育30 min,孵育完毕后,加入100 μL终止液使溶液显色。然后,使用快速检测装置对反应完成的试剂盒进行检测。
2 结果与讨论
2.1 高通量前处理装置回收率测试
将OA标准品(80×10-9)加入无毒的贝肉样品中,分别使用手工和所设计的高通量前处理装置对贝肉样品进行前处理步骤,将得到的样品提取液进行检测得到提取液的OA浓度,计算不同方式的前处理的毒素回收效率。实验结果如表1所示。
其中,平均回收率为三次实验测得的毒素浓度的平均值比上所加入的OA标准品的浓度,平均回收率体现了不同前处理方式对实际样品中毒素的提取效率。由实验结果可知,前处理装置的毒素回收率虽略低于手工,但是其稳定性高于手工方式,可以满足现场前处理的需求。

表1 不同方式前处理毒素回收率
2.2 快速检测装置系统性能测试
使用浓度分别为0,0.2×10-9,0.5×10-9,1×10-9,2×10-9和5×10-9的OA标准品制定标准曲线,标准曲线结果如图5。其中,横坐标为各个OA标准品浓度以10为底的对数,纵坐标为各浓度对应微孔图像的颜色比率,其斜率为-0.863 9,截距为1.641 1,线性度为0.990 6。
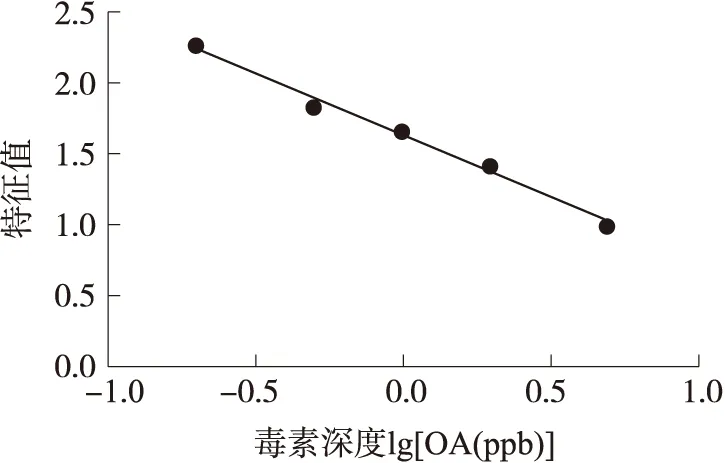
图5 快速检测系统标定曲线
使用快速检测装置对浓度分别为20×10-9,40×10-9,80×10-9,160×10-9和250×10-9的OA标准品进行检测,每种浓度。将测得的结果与已知浓度数值相对比,测试装置的稳定性。在此标定曲线的基础上,对已知浓度OA标准品的测试结果如表2所示。

表2 OA加标实验检测结果
平均回收率体现了前处理方法对毒素的提取效率。表中可以看出,本仪器对样品中OA毒素的浓度进行检测是可靠和稳定的,所设计的快速检测装置的性能可满足现场检测的需求。
2.3 快速检测装置重现性与检测下限测试
使用不同浓度的OA加标样品进行实验,测定其日内和日间的变异系数,通过变异系数反应快速检测装置的重现性,实验结果如表3所示。
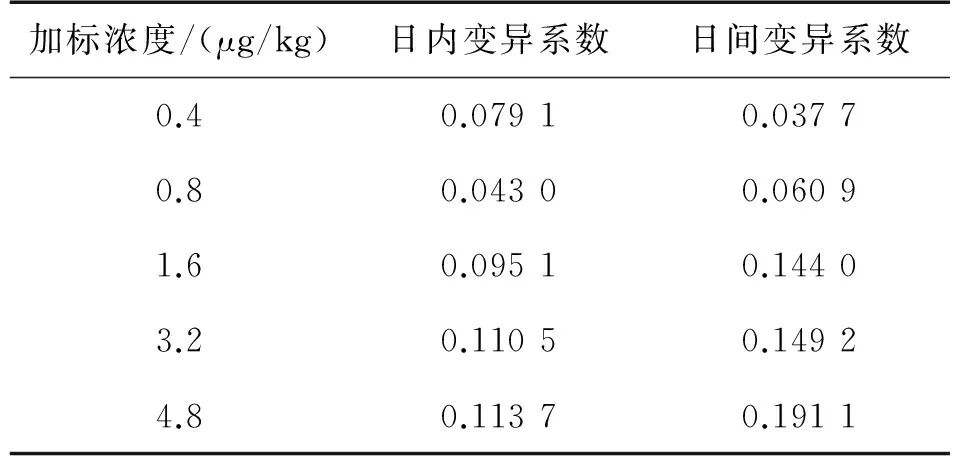
表3 OA重现性实验检测结果
由表3可知,在标定曲线的浓度范围内,日内变异系数小于15%,重现性较好;而当浓度较大时,日间变异系数接近或大于15%。由于快速检测装置定位于现场检测,日内变异系数的数值更具有参考意义,由实验结果可知,快速检测装置的重现性满足实际需求。
使用空白孔检测结果计算快速检测装置的检测下限。测定一定数量的空白孔,通过快速检测装置计算得出对应数值,如表4所示。
表4中,C0为空白孔的实际检测值,AVG为空白孔实际检测值的平均值,SD为测量值的标准差,LOD为检测下限。其中检测下限的计算方法如下:
LOD=AVG+3SD
由计算结果可知,快速检测装置的检测下限约为0.182×10-9,当检测样品中OA浓度小于检测下限时,无法被系统检测。在实际应用中,应选择合理的稀释或浓缩倍数对样品进行处理。
2.4 快速检测装置特异性测试
使用一系列不同浓度的OA标准品和PTX2-b标准品对快速检测装置的特异性进行实验。可得系统的响应曲线如图6所示。

图6 快速检测系统特异性响应
图6中,横坐标为毒素标准品浓度以10为底的对数,纵坐标为检测系统得出的毒素浓度标准化结果。毒素浓度的选择以制定标准曲线的浓度0,0.2×10-9,0.5×10-9,1×10-9,2×10-9和5×10-9为标准,加入介于0和0.2×10-9及大于5×10-9的浓度测定完整的特异性响应曲线。由图6的实验结果可知,快速检测系统对OA有着良好的线性响应,而对于PTX2-b,响应结果无线性规律。由实验结果可知,快速检测装置对OA有着良好的特异性。
2.5 实际样品测试
使用快速检测系统和酶标仪对实际贝肉样品中的毒素含量进行测定。首先是确定标定曲线,分别使用快速检测装置和酶标仪的结果如图7。

图7 实际样品标定曲线
从图7中可以看出快速检测系统与商用酶标仪在标定曲线标定上具有一致性。表5为15个实际样品的检测结果,最大偏差小于15%,其中第1、3、4、5、6、7、8、9、11、12号共10个样品含有的OA毒素浓度低于本系统检测下限。第2、10、13、14号共4个样品的浓度较低,在10 μg/kg左右。第15号样品浓度较高,超过了80 μg/kg,但仍低于判定有害的标准。因此,这一批共15个实际样品中未检出有害样品。

表5 OA实际样品检测结果
准确率是以酶标仪的检测结果为参考,将快速检测装置的检测结果与之相比所得到。其中,准确率大于100%表示快速检测系统所得的结果高于酶标仪的检测结果。由检测结果可以看出,所设计的快速检测装置的检测结果与商用酶标仪具有一致性,在实验室环境下使用酶标仪完成15个实际样品检测的用时为200 min,而使用快速检测装置的用时为170 min,且样品数量越多能够节省的时间越多。由实验结果可知,所设计的快速检测装置能够满足现场快速检测的需求。
由表6可知而对于快速检测装置和主流的小鼠法的比较可知,所设计的快速检测装置具有检测时间短,一致性好,检测限低,操作难度低等优点,体现了仪器方法的优越性。

表6 快速检测装置与其他方法的比较
3 结论
本文介绍了一种现场高通量前处理装置和快速检测系统的设计方法,利用免疫分析技术中的酶联免疫反应(ELISA),实现了贝类腹泻性毒素的现场快速筛查。依照现场快速检测的需求设计了高通量前处理装置和快速检测系统。对比了前处理装置处理与实验室手工前处理的标准方法的回收率。使用贝类腹泻性毒素标准品和实际贝肉样品对系统性能进行了测试和标定,实验结果与商用酶标仪进行了比较。结果表明,相比于标准的小鼠法,本文所设计的前处理装置和快速检测系统能够较方便地应用于现场快速检测,并提供直观的数值,从而为现场贝类腹泻性毒素的现场快速筛查提供了一种新的快速,有效的方法和仪器。
[1] 张少君,丁永生,李大志,等. 贝毒及检测方法的研究进展[J]. 大连海事大学学报:自然科学版,2004,29(4):62-65.
[2] Haystead T A J,Sim A,Carling D,et al. Effects of the Tumour Promoter Okadaic Acid on Intracellular Protein Phosphorylation and Metabolism[J]. Nature,1989,337(6202):78-81.
[3] Stookey D,Patton C,Malcolm G. Membrane Separation Technology. American Institute of Chemical Engineers,New York,NY,1986.
[4] Hennion M C. Solid-Phase Extraction:Method Development,Sorbents,and Coupling with Liquid Chromatography[J]. Journal of Chromatography A,1999,856(1):3-54.
[5] Hummert C,Shen J,Luckas B. Automatic High-Performance Liquid Chromatographic Method for the Determination of Diarrhetic Shellfish Poison[J]. Journal of Chromatography A,1996,729(1):387-392.
[6] Ben-Gigirey B,Rodríguez-Velasco M,Otero A,et al. A Comparative Study for PSP Toxins Quantification by Using MBA and HPLC Official Methods in Shellfish[J]. Toxicon,2012,60(5):864-873.
[7] 曹际娟,卫锋,马惠蕊,等. 贝类毒素检测技术及研究进展[J]. 检验检疫科学,2004,14(1):53-56.
[8] Carmichael W,Evans W,Yin Q,et al. Evidence for Paralytic Shellfish Poisons in the Freshwater Cyanobacterium Lyngbya Wollei(Farlow ex Gomont)Comb. Nov[J]. Applied and Environmental Microbiology,1997,63(8):3104-3110.
[9] 吴施卫,张纯超,卢楚谦,等. 南海近岸海域腹泻性贝类毒素分析[J]. 海洋环境科学,2005,24(4):48-51.
[10] 黄玉柳,黄国秋,叶欣宇,等. 酶联免疫法快速检测贝类中腹泻性贝类毒素[J]. 化学与生物工程,2011,28(11):93-94.
[11] 王峰,刘飞,孟令花,等. 基于抗体包被金磁纳米微粒修饰的磁性安培免疫传感器研制及对人血清癌抗原19-9的检测[J]. 传感技术学报,2009(9):1232-1238.
[12] Usleber E,Dietrich R,Bürk C,et al. Immunoassay Methods for Paralytic Shellfish Poisoning Toxins[J]. Journal of AOAC International,2001,84(5):1649-1656.
[13] Qi-Fang L. Detection of Paralytic Shellfish Poisoning(PSP),Diarrhetic Shellfish Poison(DSP),Neurotoxic Shellfish Poison(NSP)by ELISA[J]. China Tropical Medicine,2012,11:38.
[14] 苏凯麒,邹玲,王琴,等. 基于细胞阻抗传感器的腹泻性毒素检测系统设计与实现[J]. 传感技术学报,2014,27(3):283-288.
[15] 谢东华,干宁,王峰,等. 鱼肉中氯霉素检测用抗体包被金磁纳米微粒修饰安培免疫传感器[J]. 传感技术学报,2009(10):1371-1377.
[16] Vashist S K,van Oordt T,Schneider E M,et al. A Smartphone-Based Colorimetric Reader for Bioanalytical Applications Using the Screen-Based Bottom Illumination Provided by Gadgets[J]. Biosensors and Bioelectronics,2015,67:248-255.
[17] Berg B,Cortazar B,Tseng D,et al. Cellphone-Based Hand-Held Microplate Reader for Point-of-Care Testing of Enzyme-Linked Immunosorbent Assays[J]. ACS Nano,2015,9(8):7857-7866.
[18] Dixon L G,Hamdy M K,Hayden M A,et al. Elisa for Detecting Okadaic Aced in Model Systems Using Purified Polyclonal Antibodies[J]. Journal of Rapid Methods and Automation in Microbiology,1997,5(4):269-283.
[19] Cusick K D,Sayler G S. An Overview on the Marine Neurotoxin,Saxitoxin:Genetics,Molecular Targets,Methods of Detection and Ecological Functions[J]. Marine Drugs,2013,11(4):991-1018.
[20] Rossini G P. Functional Assays in Marine Biotoxin Detection[J]. Toxicology,2005,207(3):451-462.
Design of In-Suit High Throughput Pretreatment and Detection System for Diarrhetic Shellfish Poisons*
WANZijian,QIUXianxin,ZHONGLongjie,SUKaiqi,ZOUQuchao,FANGJiaru,PANYuxiang,WANGPing*
(Biosensor National Special Laboratory,Key Laboratory for Biomedical Engineering of Education Ministry,Department of Biomedical Engineering,Zhejiang University,Hangzhou 310027,China)
In order to achieve the requirement of diarrhetic shellfish poison(DSP)in-suit detection,we design a high throughput pretreatment system and a mobile terminal based detection system. Our system can make fast and accurate DSP detection by analyzing image of chromogenic reaction come from ELISA method. The rate of recovery by our pretreatment system and by hand are 89% and 93% respectively,it means that our pretreatment system can meet the follow-up detection requirement. Detect the prevented samples by our detection system,the standard deviation is approximately 0.13 and average rate of recovery is 89.5%,it can satisfy the accuracy and repeatability of detection. In the detection of actual samples,comparing our results with the results come from microplate reader,it shows that our pretreatment and detection system can do a fast and accurate in-suit work and provide a new method for the detection.
diarrhetic shellfish poison;pretreatment system;detection system;mobile terminal

万梓健(1993-),男,浙江大学生物医学工程2015级硕士研究生,从事生物医学工程与生物医学传感器研究,wanzijian@zju.edu.cn;王 平(1962-),男,浙江大学,教授,博士生导师,主要研究方向为传感器与检测技术、生物芯片与生物电子学、人工嗅觉与人工味觉等,cnpwang@zju.edu.cn。
项目来源:国家海洋公益专项项目(201305010)
2016-06-08 修改日期:2016-09-19
R318
A
1004-1699(2017)01-0001-07
C:7230
10.3969/j.issn.1004-1699.2017.01.001
