甘油气相脱水制备丙烯醛催化剂的研究进展
2017-01-21徐华龙
黄 亮,徐华龙,沈 伟
(复旦大学 化学系 上海市分子催化与功能材料重点实验室 复旦大学先进材料实验室,上海 200433)
甘油气相脱水制备丙烯醛催化剂的研究进展
黄 亮,徐华龙,沈 伟
(复旦大学 化学系 上海市分子催化与功能材料重点实验室 复旦大学先进材料实验室,上海 200433)
以生物质源甘油为原料,通过甘油催化脱水制备丙烯醛是一个非常重要的生物质转化反应。综述了近年来有关甘油气相脱水制备丙烯醛催化剂的研究进展,将催化剂分为分子筛、金属氧化物和复合金属氧化物、杂多酸和磷酸盐3大类进行介绍,指出了在该反应催化剂设计方面面临的问题和挑战,展望了未来的发展趋势。
甘油;丙烯醛;催化脱水;生物质转化;固体酸催化剂
甘油是人类最早从生物质中获得的有机物之一,同时也是许多生物质转化反应的副产品[1]。无论是传统的皂化反应、脂肪酸及脂肪醇制备反应,还是新兴的酯交换反应(制备生物柴油),都能获得大量的副产物甘油。近十几年来,生物柴油产量迅速增加,而每生产10 t生物柴油就副产1 t甘油,因此如何有效利用大量过剩的生物质源甘油已成为目前急需解决的问题[2]。
近年来对甘油深加工的研究主要集中在将甘油转化为1,3-丙二醇、1,2-丙二醇、丙烯醛和合成气等产品等方面[3]。其中,丙烯醛是一种重要的化工中间体,主要用于生产丙烯酸及其酯类。目前工业上生产丙烯醛的主要方法是丙烯氧化法,但此法不符合可持续发展的要求。而通过甘油脱水法制备丙烯醛,原料甘油来源于生物质,低碳环保,具有非常高的研究意义和应用价值[4]。甘油脱水制取丙烯醛是一个酸催化反应,催化剂既可以是液体酸(如H2SO4),又可以是固体酸[5]。若采用液体酸类作催化剂,虽可取得较好的反应结果,甘油转化率可达90%,丙烯醛选择性在80%左右,但反应需在苛刻的条件(如超临界水或次临界水)下进行,对设备腐蚀非常严重。因此,人们更多地把目光投向了更有利于工业应用的固体酸催化甘油气相脱水制丙烯醛。
本文综述了近年来甘油气相脱水制丙烯醛催化剂研究的最新进展,将催化剂按其组成特征分为3大类(分子筛、金属氧化物和复合金属氧化物、杂多酸和磷酸盐)进行了介绍,并在此基础上探讨了甘油气相脱水制丙烯醛催化剂研制过程中所存在的问题和挑战。
1 甘油气相脱水制丙烯醛催化剂
用于甘油气相脱水制丙烯醛的催化剂包括分子筛、无定型硅铝酸盐、酸性金属氧化物和复合金属氧化物、杂多酸、磷酸盐、硫酸盐和负载离子液体等固体酸催化剂[6]。实验结果表明,催化剂的酸性和结构对甘油脱水的活性和丙烯醛的选择性起着重要作用。图1为固体酸催化甘油脱水制丙烯醛的反应机理,反应生成主产物为丙烯醛,主要副产物为羟基丙酮,反应往往会伴随着积碳,导致催化剂的失活[7]。一般认为该反应是一个酸性敏感反应,酸性质对选择性有决定性的影响。B酸倾向于在反应过程中首先与甘油中间的羟基发生作用,之后通过烯醇式互变得到3-羟基丙醛,然后经过第2次脱水形成目标产物丙烯醛。而催化剂表面的L酸则倾向于首先与甘油相邻的2个羟基发生相互作用,经过脱水形成2,3-双羟基丙烯,之后通过烯醇式互变得到羟基丙酮。除了酸性质外,催化剂表面的酸强度对甘油脱水反应也有非常重要的影响。Chai等[8]测试了一系列固体酸催化剂,发现酸强度在-8.2≤H0≤-3.0的范围内丙烯醛的选择性较高,可达到70%。进一步提高酸强度(H0≤-8.2)则会导致丙烯醛的选择性下降至40%~50%,同时引起严重的积碳。此外,催化剂的结构对甘油脱水反应同样有着显著的影响,大的孔道有利于原料和产物分子的扩散,从而使催化剂具有更好的反应性能和稳定性。因此,对催化剂进行结构上的改进,在催化剂中引入介孔,或合成具有多级孔结构的催化剂也是甘油脱水催化剂研究的一个重要方面。
本文将近年来用于甘油脱水制丙烯醛的固体催化剂按其组成特征分为分子筛、金属氧化物和复合金属氧化物、杂多酸和磷酸盐3大类,分别进行介绍。

图1 固体酸催化剂的反应机理[7]Fig.1 Reaction mechanism over solid acid catalysts[7].
1.1 分子筛催化剂
分子筛催化剂由于具有丰富酸性位和择形选择性,广泛应用于各类液-固相和气-固相反应(如乳酸脱水反应和正癸烷裂解反应)。在甘油气相脱水制丙烯醛反应上,分子筛表现出了较高的反应活性和丙烯醛选择性,因而受到了广泛关注。
分子筛的孔结构和硅铝比对甘油脱水制丙烯醛的催化性能有显著影响。Gu等[9]研究了沸石分子筛孔径对甘油脱水反应的影响。选择了十元环孔道的HZSM-5和HZSM-11、十二元环孔道的HY和H-β 4种不同类型的沸石进行了比较。HZSM-5和HZSM-11的十元环孔径能够抑制稠环芳烃等积碳前体的生成,稳定性更好。而微孔孔道较大且具有超笼结构HY和H-β沸石,则孔道内相对易形成积碳。Kim等[10]研究了几种典型的H型沸石在甘油脱水反应上的稳定性,包括H-β、H-丝光沸石、H-镁碱沸石、H-ZSM-5和H-Y等催化剂。实验结果表明,在315 ℃下反应12 h后,H-β、H-Y、H-镁碱沸石、H-丝光沸石和H-ZSM-5上的积碳量(w)分别为21.5%,15.4%,9.9%,9.9%,8.7%,孔径较小的ZSM-5上其积碳量也相对较小,这与Gu等[9]的结论一致。Kim等[11]进一步研究了ZSM-5的硅铝比对反应的影响。发现在H型ZSM-5上,随着硅铝比从15提高至500,酸量从0.92 mmol/g下降至0.01 mmol/g,且酸强度逐渐降低,其中硅铝比为75的HZSM-5表现出了最佳的活性,这是由于虽然低硅铝比HZSM-5具有高的酸量和酸强度,但也吸附了大量水分子,吸附的水分子会覆盖活性位点从而降低催化剂的反应活性,吸附水分子的量随着硅铝比的提高而降低,因而在硅铝比为75时催化剂具有最佳的活性。对于Na型ZSM-5,由于拥有较多的L酸位且与吸附水的相互作用较强;在H2O-TPD测试中,Na型ZSM-5的峰温为171.4 ℃,而H型ZSM-5峰温最高只有116.7 ℃。Carriço等[12]则研究了MWW型层状沸石在这个反应上的应用,首先选用了经典的MCM-22沸石,研究其硅铝比对反应活性的影响。结果发现催化剂随着硅铝比的提高(硅铝比从15提高至40)而酸量下降(从1.19 mmol/g下降至0.70 mmol/g),硅铝比为15的MCM-22由于拥有最大的比表面积和最高的总酸量,因而表现出了最好的活性。在此基础上又进一步研究了通过交联和分层技术制备的MCM-36和ITQ-2沸石[13]。结果发现其中ITQ-2沸石酸性位的可接触性更好,酸密度较高,其丙烯醛选择性达到了76.5%,优于MCM-36和MCM-22。
图2总结了上述文献中所研究的几种典型分子筛上,在甘油几乎完全转化条件下丙烯醛的选择性。由图2可知,ZSM-5具有最佳的性能,丙烯醛选择性达到80%以上,同时也具有很好的水热稳定性,因此在分子筛催化剂中,ZSM-5获得了最多关注。但常规ZSM-5在反应中非常容易积碳失活,虽然研究表明与十二元环的八面体分子筛相比,ZSM-5具有更好的抗积碳性能[9],但其活性通常在几小时内即显著下降。为了提高ZSM-5的活性和稳定性,很多研究者致力于制备多级孔ZSM-5分子筛,以改善催化剂的扩散性能,在甘油脱水这个反应上同时实现高选择性和高稳定性。Jia等[14]制备了纳米晶堆积的多级孔ZSM-5分子筛,催化剂同时具备微孔和堆积介孔。实验结果表明,当在反应温度320 ℃、GHSV=1 438 h-1时,即使甘油溶液浓度提高至50%(w),该催化剂也具有很高的活性,反应10 h后的转化率仍有60%。可见,纳米晶堆积的ZSM-5与大块的ZSM-5相比具有更大的外表面积,同时晶粒中的扩散距离大大缩短了,从而降低了积碳形成的速率。

图2 分子筛催化剂上丙烯醛的选择性Fig. 2 Selectivity to acrolein over molecular sieve-type catalysts.
碱处理脱硅是另一种引入介孔的方法,Possato等[15]和Decolatti等[16]研究了经过NaOH脱硅处理的ZSM-5分子筛的催化活性,发现在脱硅过程中ZSM-5的强酸位没有受到破坏,ZSM-5的微孔体积从0.25 cm3/g下降到0.08 cm3/g,介孔体积则由0 cm3/g上升到2.1 cm3/g。实验结果表明,催化剂的活性和稳定性在引入介孔后显著提高。在常规ZSM-5中,积碳更倾向于沉积在表面的微孔孔道中,造成原料无法进入且产物无法采出,导致快速失活。而在引入介孔的ZSM-5中,积碳则更倾向于沉积在介孔中,在介孔孔道被积碳完全堵塞之前,其中的微孔仍具有相对较好的传质和扩散性能,因此稳定性更高。本课题组采用碱处理法对ZSM-5孔结构和表面酸性能进行调控[17],在碱处理过程中骨架中近表面的硅发生了溶脱现象,在分子筛表面上形成了大量介孔,增强了反应物的扩散能力。同时硅溶脱形成的介孔区域的硅铝比低于其骨架中的,表面酸密度显著提高(由0.29 μmol/m2提高至0.38 μmol/m2),形成了更多的表面活性位。这2个因素显著提高了甘油脱水合成丙烯醛的反应活性和稳定性。
为了进一步研究多级孔ZSM-5中介孔结构对甘油脱水反应的影响,本课题组合成了4种典型的多级孔ZSM-5分子筛[18]。这4种多级孔ZSM-5的酸性质基本一致,差异主要体现在孔道结构。分别为含有较大量晶内介孔的ZSM-5沸石、含有大量晶内小介孔的ZSM-5沸石、不含晶内介孔的纳米晶堆积的ZSM-5沸石和含有大量晶内小介孔的纳米晶堆积的ZSM-5沸石。实验结果表明,只有拥有较大开放介孔的试样才具有好的稳定性。这主要是由于甘油及其衍生物在小介孔内容易发生凝结效应形成高聚物,而这些高聚物会进一步反应形成积碳并堵塞孔道,最终导致催化剂失活。
除了硅铝分子筛之外,其他一些分子筛也在甘油气相脱水反应上表现出了比较好的活性。Lourenço等[19]研究了SAPO系列催化剂(SAPO-11,SAPO-34,SAPO-40)在甘油脱水反应上的应用。在反应温度350 ℃、甘油10%(w)的条件下,SAPO-40表现出了相对最好的稳定性。在反应120 h后仍保持丙烯醛选择性在70%左右,转化率仍超过50%。可见,孔结构与稳定性有密切的关系,SAPO-34和SAPO-40具有相近的微孔体积(0.27 cm3/g),但SAPO-34中笼的开口明显小于SAPO-40,导致其更严重的扩散限制以及更高的积碳速率。SAPO-11相比于SAPO-34孔径更大,有更好的传质和扩散性能。但其一维直孔道不利于原料和产物进出,因此活性低于具有三维孔道结构的SAPO-40。
除了微孔分子筛,有些研究还涉及到了酸功能化的介孔分子筛。全硅介孔分子筛本身并不能像微孔分子筛晶体那样提供酸性位,需要通过嫁接或负载的方法进行酸功能化。Lourenço等[20]使用一锅法制备了磺酸基功能化的SBA-15作为甘油脱水催化剂。在较低温(275 ℃)下,该催化剂在反应140 h后转化率仍有50%,且丙烯醛的选择性一直保持在80%左右。此外还发现更大孔径的SBA-15有更好的催化活性,提高酸密度则会降低丙烯醛的选择性。Cecilia等[21]则合成了负载磷钨和钒磷的Zr-SBA-15,结果发现负载12%(w)V+0.2%(w)P和20%(w)W+0.2%(w)P的试样具有最优的活性,其中P的引入不仅可提高总酸量还可提高B酸比例。García等[22]则将Nb2O5负载在Zr掺杂的介孔SiO2中(硅锆比为5)。发现Nb2O5可将丙烯醛的选择性从25%提高至45%。
1.2 金属氧化物和复合金属氧化物
Nb2O5,ZrO2,TiO2,Al2O3等金属氧化物是非常重要的固体催化剂,兼有载体和活性组分双重功能。在甘油气相脱水制丙烯醛反应中,金属氧化物及复合金属氧化物催化剂由于有较好的水热稳定性也得到广泛研究。
图3列出了文献中单一组分酸性金属氧化物在甘油几乎完全转化条件下其丙烯醛的选择性[23-26],其中Nb2O5和Ta2O5的丙烯醛选择性较高,因而获得了较多关注。Chai等[24]通过控制焙烧温度制备了一系列Nb2O5催化剂,其中焙烧温度为350~400 ℃的试样呈无定形态,表面酸度大部分分布在-8.2≤H0≤-3.0的范围内。当焙烧温度不低于500 ℃时,Nb2O5结晶度逐渐提高,由TT相转化为T相,同时表面强酸量减少。焙烧温度为400℃的试样表现出了最好的活性和最高的丙烯醛选择性(51%)。其他试样由于强酸(H0≤-8.2)或弱酸(-3.0≤H0≤6.8)比例较高导致活性较差。Foo等[27]通过Na+交换法制备了不同B/L的Nb2O5催化剂,并通过FTIR表征和DFT计算得出B酸更有利于丙烯醛的生成,而L酸更有利于羟基丙酮的生成。Tao等[23]通过控制焙烧温度制备了一系列Ta2O5催化剂,其中焙烧温度为350 ℃的Ta2O5-350试样酸性适宜(在-8.2<H0≤-3.0范围内),同时不存在碱性位,在甘油脱水反应上表现出了最高的丙烯醛选择性(75%)和甘油消耗速率;而焙烧温度为600~700 ℃的Ta2O5试样表面强酸位消失,同时产生了一定的碱性位,丙烯醛的选择性只有不到40%。这表明碱性位不利于丙烯醛的生成。

图3 金属氧化物催化剂上丙烯醛的选择性Fig.3 Selectivity to acrolein over metal oxide-type catalysts.
金属氧化物由于其表面的L酸较高,影响了丙烯醛的选择性。通过元素修饰法可有效调节金属氧化物表面的酸量和酸性质,从而提高丙烯醛的选择性,并进一步提高其稳定性。Ulgen等[28]采用负载WO3对ZrO2表面进行修饰,催化剂的酸性和丙烯醛的选择性随着WO3含量的增加而提升。采用未经修饰的ZrO2为催化剂,丙烯醛选择性只有不到10%,而当WO3含量为19%(w)时,丙烯醛的选择性可达72.6%。Lauriol等[29]通过在WO3/ZrO2掺杂SiO2显著提高了催化剂的稳定性,这是因为掺杂在ZrO2表面的SiO2可形成较大介孔并同时抑制易积碳的副产物。该催化剂可在反应177 h后保持转化率在82%以上,同时丙烯醛的选择性保持在78%左右。Massa等[26]在ZrO2表面分别负载W和Nb,比较了两者之间的活性差异。实验结果表明,在反应的初始阶段两者都能达到接近100%的甘油转化率,但负载W的试样其丙烯醛选择性略高。Massa等[25]进一步研究了一系列以TiO2,Al2O3,SiO2为载体,负载W和Nb的催化剂。结果表明W和Nb可以更好地分散在TiO2和Al2O3的表面,负载W和Nb的Al2O3其丙烯醛选择性可以达到70%,而负载W的TiO2其丙烯醛选择性可以达到80%。Ulgen等[30]还研究了WO3/ TiO2催化剂,主要原因是相比于ZrO2,TiO2的成本更低,有更好的应用前景。实验结果表明,在甘油完全转化的前提下,丙烯醛的选择性最高可以达85%,反应过程中通入氧气可有效地抑制副反应的发生。Suprun等[31]则制备了磷酸修饰的TiO2和Al2O3,用以研究酸性与反应活性之间的关系。实验结果表明,Al2O3-PO4活性相对较好。并在此基础上又掺杂了一系列过渡金属进行修饰[32]。实验结果表明,添加Cu有利于羟基丙酮的生成,添加Cr,Mn,V有利于乙醛、CO和CO2的生成,添加V和Fe则有利于丙烯醇的生成。在丙烯醛选择性方面,Ce<Mn<Cr<V~Fe<Cu<Mo<W,但这一系列催化剂的丙烯醛选择性最高也只有54%。
在复合金属氧化物中,Tao等[33]将ZrO2,SnO2,TiO2,Al2O3等金属氧化物两两复配制备催化剂,考察了酸性与丙烯醛选择性之间的关系。实验结果表明,TiO2-Al2O3(焙烧温度为600 ℃)和TiO2-ZrO2(焙烧温度为550 ℃)具有最好的性能,但转化率最高也只有60%,而丙烯醛的选择性也未超过50%。Lima等[34]制备了纳米级的SnO2-Mn2O3,SnO2-ZrO2,SnO2-TiO2,ZrO2-Mn2O3,NiO-Co3O4等复合金属氧化物并将其应用于甘油脱水反应,其中SnO2-TiO2在反应温度为250 ℃,甘油和水的物质的量比为0.25的条件下具有最好的活性,转化率为86.9%,丙烯醛选择性为34%。这主要是由于纳米结构带来的良好的可接触性以及Sn和Ti之间的协同作用的结果。Vasconcelos等[35]研究铈锆复合氧化物在甘油脱水制丙烯醛反应上的应用,并采用了纯氧化铈作为对比。纯氧化铈有较高的碱性位密度,主产物羟基丙酮的产率为39%,但失活较快(10 h后转化率只有30%)。而CeZrO显示出了较高的稳定性(反应10 h后转化率仍大于90%)。de Sousa等[36]进一步研究了三元复合氧化物在甘油脱水制丙烯醛反应上的应用。在氧化铈中掺杂了Zr,Ni,Co等金属元素。掺杂后的催化剂同时存在酸性位和碱性位,其中铈锆钴复合氧化物(CZC)具有明显的碱性,更有利于生成羟基丙酮而不是丙烯醛。Lauriol等[37]制备了一系列锆铌催化剂,其中锆铌比为12的试样在甘油脱水反应中表现出了较高的稳定性,在反应177 h后仍保持转化率在82%以上,丙烯醛选择性在72%左右。在此基础上进一步研究了锆铌催化剂的酸碱性质与反应活性之间的关系[38]。发现锆铌比为31的试样上存在强酸位和一定数量的碱性位,而锆铌比为12的试样则以中强酸位和弱酸位为主。活性测试显示,在锆铌催化剂上,酸性位有利于丙烯醛的生成,强酸位的本征活性是弱酸位的10倍以上,但强酸位更易引起积碳,而快速失活,故弱酸位的稳定性更好。而催化剂上的碱性位有利于羟基丙酮的生成。Omata等[39]研究了W-Nb-O催化剂在甘油脱水反应上的应用。与WO3/ZrO2和HZSM-5相比,W-Nb-O催化剂的优势在于其积碳失活的速率更低。
1.3 杂多酸和磷酸盐
杂多酸兼有配合物和金属氧化物的结构特征,具有强酸性,在酸催化反应中常常具有很好的活性和选择性。杂多酸在甘油脱水反应中表现出了较高的丙烯醛选择性,但其比表面积和热稳定性均较低,故一般需要负载在一定载体(SiO2,ZrO2,TiO2,Al2O3等)上。载体与杂多酸之间的相互作用和载体本身的形貌都对反应有着重要的影响[40]。
Kang等[41]合成了一系列SiO2-Al2O3载体上负载10%(w)磷钨杂多酸的催化剂,载体中SiO2含量从0~100%(w)。其中SiO2含量为85%(w)的试样B酸含量最高为0.77 mmol/g,丙烯醛产率达到最高为19.9%。Chai等[42]研究了SiO2-ZrO2载体上负载磷钨杂多酸的催化剂,实验结果表明,将磷钨杂多酸负载在ZrO2上,其活性远优于负载在SiO2上。主要原因是将HPW负载在ZrO2热稳定性更好,经650 ℃焙烧处理后其Keggin结构基本没有受到破坏,而负载在SiO2上则几乎被完全破坏,且磷钨杂多酸在ZrO2上的分散度更高。在315 ℃反应10 h后,HPW/ZrO2上丙烯醛选择性可达70%,丙烯醛产率可达54%。Talebian等[43]研究了一系列负载硅钨杂多酸的ZrO2催化剂(负载量为10%~40%(w))。随着HSiW负载量的提高,其酸量由0.38 mmol/g提高至1.24 mmol/g。其中负载量为30%(w)的试样具有最好的活性,在300 ℃下,反应3 h后转化率为92%,丙烯醛产率为63.75%。
Katryniok等[44]为了提高硅钨酸/ZrO2催化剂的比表面积,使用凝胶法,以正丙醇锆为锆的前体,将ZrO2嫁接在SBA-15上,再在ZrO2上负载杂多酸。实验结果表明,影响催化剂活性的因素主要为ZrO2含量、硅钨酸负载量和SBA-15的孔径。研究发现ZrO2和硅钨酸阴离子之间有很强的电子作用,这种作用降低了表面的B酸强度,减少了积碳,提高了催化剂的稳定性。优选的催化剂是ZrO2负载量为20 %(w),硅钨杂多酸的负载量为20 %(w),焙烧温度为650 ℃,SBA-15孔径为8 nm的催化剂,其在24 h后丙烯醛的产率仍有69%。Kim等[45]对更多的载体进行了比较研究,采用TiO2,ZrO2,SiO2,γ-Al2O3,SiO2-Al2O3,AC,CeO2,MgO为载体,负载10%(w)硅钨杂多酸制备催化剂。研究发现载体对催化剂的酸密度有显著的影响,其总酸性位数目顺序为HSiW/ SiO2-Al2O3>HSiW/γ-Al2O3>HSiW/CeO2>HSiW/ AC>HSiW/ZrO2>HSiW/TiO2>HSiW/SiO2>HSiW/ MgO,甘油转化率随着酸密度的增加而增加。图4为负载硅钨杂多酸催化剂上丙烯醛的选择性。由图4可知,载体对丙烯醛的选择性有显著影响,其中HSiW负载在ZrO2上的催化剂丙烯醛选择性最高可达58%,这与HSiW在ZrO2上其Keggin结构比较稳定和分散度较高有关。
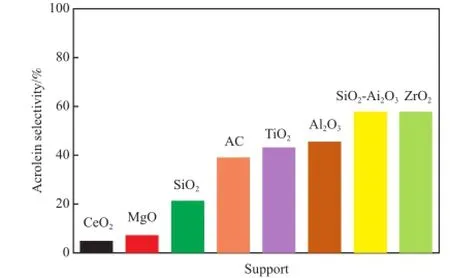
图4 负载硅钨杂多酸催化剂上丙烯醛的选择性Fig. 4 Selectivity to acrolein over supported silicotungstic acids catalysts.
此外,还发现负载型杂多酸催化剂的焙烧温度与催化性能有密切关系,Liu等[46]通过控制焙烧温度制备了一系列HSiW/Al2O3催化剂。HSiW中氧的配位数随着焙烧温度的提高而增加,在350 ℃和450 ℃焙烧条件下HSiW的Keggin结构只有轻微的破坏,但在550 ℃和650 ℃焙烧条件下HSiW的Keggin结构发生分解并生成了WO6和WO3。Keggin结构破坏导致B/L值从未焙烧时的0.78降至0.56(焙烧温度为650 ℃),丙烯醛的选择性则随B酸比例的降低而降低。其中未经焙烧处理的HSiW/Al2O3丙烯醛产率最高达到66%。
除了筛选载体之外,通过引入杂原子进行修饰也是一种有效地改性方法。Dubois等[47]以硅钨杂多酸和磷钨杂多酸为基础,制备了相应的含Cs,Rb,Ca,Zr,La,Fe等离子的盐。研究发现Cs和Rb分别取代部分杂多酸的H后催化剂所需的反应温度更低,只需260~280 ℃,而普通的杂多酸的反应温度为300~350 ℃。Cs2.5H1.5SiW12O40显示了最好的活性,丙烯醛的产率为91.3%。但此类催化剂若没有同时通入氧气,丙烯醛的选择性仅仅只有40%。Alhanash等[7]研究了Cs盐修饰的磷钨酸催化剂在甘油脱水反应上的活性。其初始转化率接近100%,丙烯醛的选择性接近98%。然而催化剂由于积碳很快失活,反应6 h后转化率降至40%,但丙烯醛选择性保持不变。此外还发现在其上进一步添加贵金属有助于提高活性,顺序为:Pd>Ru~Pt。Haider等[48]采用Rb和Cs对Al2O3负载杂多酸催化剂进行修饰,显著提高了丙烯醛的选择性,在甘油浓度为10%(w)的条件下,可在反应90 h后仍保持接近100%的转化率同时丙烯醛的选择性接近90%。在此基础上又研究了将Ce和Zr嫁接在Al2O3载体上,以硅钨杂多酸为活性组分应用于甘油脱水反应[49]。其中Zr的含量为5%(w)的试样具有最好的活性,在甘油转化率接近100%的条件下,丙烯醛的选择性可以达到85%,而未添加Zr的试样其丙烯醛选择性只有75%。可见,Zr的引入可将酸强度调至有利于丙烯醛生成的范围(-8≤H0≤-2)内,从而提高丙烯醛的选择性。
甘油脱水制丙烯醛反应研究基本上都采用固定床反应器,催化剂易积碳,导致催化剂寿命较低。Dalil等[50]以HPW/TiO2为催化剂,在流化床反应器上研究了甘油脱水制丙烯醛反应。研究发现在反应的第1个小时内大约85%(w)的甘油转化成了积碳,只有不到20%(w)的甘油转化成了丙烯醛。还通过在催化剂表面添加积碳的促进剂(四氢化葵和十氢化萘),证实了积碳可钝化非选择性的催化位点。此外,还发现TiO2的孔径大小对积碳的形成有较大影响。较小孔径的TiO2上的积碳量约是大孔径TiO2上的积碳量的3倍,这主要是由于甘油的毛细凝聚作用造成的。另外对于流化床反应器,使积碳量保持在一个恒定水平是十分重要的,这可使质量和热量都平均分布,从而避免热点的形成。
除了杂多酸之外,磷酸盐由于具有合适的酸性,在甘油脱水反应中也表现出了较高的活性和丙烯醛选择性。与杂多酸相比,磷酸盐廉价且易制备,因此也得到了关注。Liu等[51]使用稀土焦磷酸盐为催化剂(包括La,Ce,Nd,Sm,Eu,Gd,Tb,Ho,Er,Tm,Yb,Lu),在甘油脱水制丙烯醛反应中有较好活性。在反应温度为320 ℃的条件下,甘油的转化率可接近90%,丙烯醛选择性可接近80%。Deleplanque等[52]使用Fex(PO4)y为催化剂,实验结果表明,甘油的转化率最高可达100%,丙烯醛选择性最高可达92%。但其寿命未超过24 h。Patience等[53]将掺杂Ce的FePO4催化剂应用于甘油脱水反应。干慧媚等[54]通过沉淀、水热合成和浸渍法制备了ZrPO4催化剂并应用于甘油脱水反应。实验结果表明,使用沉淀法制备的ZrPO4具有最好的活性,在接近100%转化的条件下,丙烯醛的选择性可达81%,而且在反应24 h后没有明显的失活。Rao等[55]通过控制焙烧温度制备了一系列磷酸氧铌催化剂(焙烧温度为350~650 ℃),所有试样在甘油脱水反应上都表现出了较好的活性,甘油转化率为75%~100%,丙烯醛选择性为69%~86%。其中焙烧温度为550 ℃的试样表现出了最好的活性,这归功于它的表面酸位酸强度适中,而且以B酸为主。
2 存在的问题和挑战
针对甘油气相脱水制备丙烯醛反应,制备出同时具有高稳定性和高丙烯醛选择性的催化剂是最主要目标。但至今所筛选出的催化剂普遍寿命较短,只有在低空速下寿命才能达到几百小时,在工业生产所要求的高空速条件下寿命一般不超过24 h,因此应根据不同类型催化剂的不同特点有针对性地进行改进。
对于分子筛类催化剂,高丙烯醛选择性是其突出优点,而其孔道易被积碳堵塞,且堵塞之后会快速失活是其主要缺点。因此开发同时具备微孔和介孔的多级孔材料,通过引入介孔提高扩散效率,降低传质阻力,以达到抑制积碳形成、提高催化剂寿命的目的。虽然目前有一些初步的探索,但多级孔材料的结构与反应活性之间对应的构效关系还有待进一步明确。此外,甘油脱水反应的最主要的2个产物丙烯醛和羟基丙酮尺寸相近,微孔的择型选择效果并不突出,其选择性主要由酸性质决定,因此开发表面酸性与分子筛接近但以介孔或是大孔为主的多孔材料也是一个可研究的方向,因为其形貌和孔结构相对分子筛更易调控。如Choi等[56]制备了介孔NbPSi复合氧化物,其表面基本为B酸,有较高的丙烯醛选择性(76.3%),而介孔的存在可提高传质和扩散,最大程度地减缓堵塞,其中铌磷比为0.5的试样表现出了最好的活性。Choi等[57]进一步制备了具有放射状开放介孔的花状硅铝酸纳米球(ASN)和硅铝磷酸纳米球(ASPN),并与经典的介孔分子筛Al-MCM-41和微孔分子筛ZSM-5进行对比,结果发现具有开放介孔和合适酸性的ASPN和ASN表现了更高的稳定性。但从单个活性位点的TOF值来看,与Al-MCM-41相比,纳米球催化剂活性位点可接触性较低导致其转化频率较低。而与ZSM-5相比,硅铝酸盐的丙烯醛选择性低。主要原因是HZSM-5以B酸为主,而无定形硅铝酸盐L酸含量较高。Yun等[58]则制备了具有开放大孔的花状纳米硅球(MS-FS),经丙磺酸功能化后表面具有较强的B酸性,在甘油脱水反应中丙烯醛选择性(73.4%)与ZSM-5(73.0%)相似,但稳定性远高于ZSM-5。在反应10 h后ZSM-5的转化率降至21.9%,而MS-FS的转化率仍接近100%。
对于金属氧化物和复合金属氧化物类催化剂,相比于沸石类催化剂在甘油气相脱水反应中有更好的稳定性,一般认为这可能与其表面的活性位较多且含有较高的L酸有关,但其表面较高的L酸也会使丙烯醛选择性降低。在酸催化反应中,B酸可直接给出质子,而给出的质子在积碳前体(稠环芳烃等)的形成过程中起到了关键作用,因此与L酸相比更易导致积碳。如何有效地调节表面酸性,在提高丙烯醛选择性的同时不影响催化剂的稳定性将是金属氧化物和复合金属氧化物类催化剂今后研究的重点。对于杂多酸和磷酸盐类催化剂,其活性组分在高温水热环境下易流失是目前最主要的问题。因此开发合适的载体,使其与杂多酸和磷酸盐类催化剂有效结合,发挥协同作用将会是今后研究的重点。
3 结语
甘油脱水制丙烯醛反应是“生物炼油”技术路线中的一个重要步骤,通过该反应可有效利用生物柴油制备过程中产生的副产物粗甘油,在降低生物柴油生产成本的同时提高碳资源的利用率,符合当今绿色化学和可持续发展的要求。在目前的研究中原料以精制甘油为主,很少使用粗甘油,有关粗甘油中的杂质对催化剂影响的相关报道也较少。从经济角度考虑,设计直接使用廉价的粗甘油为原料的催化剂将是未来研究的重点。此外,有关这个反应工艺方面的研究还较少,能否通过工艺上的改良来弥补催化剂上的不足也是今后研究的一个方向。最后,由于丙烯醛的主要用途是作为化工的中间体,因此将甘油脱水后进一步氧化或氨氧化制备丙烯酸或丙烯腈,实现甘油一步转化为丙烯酸或丙烯腈也将是今后研究的热点问题。
[1]Ciriminna R,Pina C D,Rossi M,et al. Understanding the glycerol market[J]. Eur J Lipid Sci Tech,2014,116(10):1432 - 1439.
[2]Behr A,Eilting J,Irawadi K,et al. Improved utilisation of renewable resources:New important derivatives of glycerol[J]. Green Chem,2008,10(1):13 - 30.
[3]Bagheri S,Julkapli N M,Yehye W A. Catalytic conversion of biodiesel derived raw glycerol to value added products[J]. Renew Sust Energ Rev,2015,41(41):113 - 127.
[4]Liu Lu,Ye X P,Bozell J J. A comparative review of petroleum-based and bio-based acrolein production[J]. ChemSus-Chem,2012,5(7):1162 - 1180.
[5]Ayoub M,Abdullah A Z. Critical review on the current scenario and signifcance of crude glycerol resulting from biodiesel industry towards more sustainable renewable energy industry[J]. Renew Sust Energ Rev,2012,16(5):2671 - 2686.
[6]Katryniok B,Paul S,Dumeignil F. Recent developments in the feld of catalytic dehydration of glycerol to acrolein[J]. ACS Catal,2013,3(8):1819 - 1834.
[7]Alhanash A,Kozhevnikova E F,Kozhevnikov I V. Gas-phase dehydration of glycerol to acrolein catalysed by caesium heteropoly salt[J]. Appl Catal,A,2010,378(1):11 - 18.
[8]Chai Songhai,Wang Haopeng,Liang Yu,et al. Sustainable production of acrolein: Investigation of solid acid-base catalysts for gas-phase dehydration of glycerol[J]. Green Chem,2007,9(10):1130 - 1136.
[9]Gu Yunlei,Cui Naiyun,Yu Qingjun,et al. Study on the infuence of channel structure properties in the dehydration of glycerol to acrolein over H-zeolite catalysts[J]. Appl Catal,A,2012,429/430(25):9 - 16.
[10]Kim Y T,Jung K D,Park E D. A comparative study for gas-phase dehydration of glycerol over H-zeolites[J]. Appl Catal,A,2011,393(1/2):275 - 287.
[11]Kim Y T,Jung K D,Park E D. Gas-phase dehydration of glycerol over ZSM-5 catalysts[J]. Micropor Mesopor Mat,2010,131(1/3):28 - 36.
[12]Carriço C S,Cruz F T,Santos M B,et al. Efficiency of zeolite MCM-22 with diferent SiO2/Al2O3molar ratios in gas phase glycerol dehydration to acrolein[J]. Micropor Mesopor Mat,2013,181(11):74 - 82.
[13]Carriço C S,Cruz F T,dos Santos M B,et al. MWW-type catalysts for gas phase glycerol dehydration to acrolein[J]. J Catal, 2016,334:34 - 41.
[14]Jia Chunjiang,Liu Yong,Schmidt W,et al. Small-sized HZSM-5 zeolite as highly active catalyst for gas phase dehydration of glycerol to acrolein[J]. J Catal,2010,269(1):71 - 79.
[15]Possato L G,Diniz R N,Garetto T,et al. A comparative study of glycerol dehydration catalyzed by micro/mesoporous MFI zeolites[J]. J Catal,2013,300:102 - 112.
[16]Decolatti H P,Dalla Costa B O,Querini C A. Dehydration of glycerol to acrolein using H-ZSM5 zeolite modifed by alkali treatment with NaOH[J]. Micropor Mesopor Mat,2015,204:180 - 189.
[17]潘文雅,黄亮,秦枫,等. 甘油脱水合成丙烯醛ZSM-5催化剂的孔结构和酸性调控[J]. 物理化学学报,2015(5):965 - 972.
[18]Zhang Hongbin,Hu Zhijie,Huang Liang,et al. Dehydration of glycerol to acrolein over hierarchical ZSM-5 zeolites:Efects of mesoporosity and acidity[J]. ACS Catal,2015,5(4):2548 - 2558.
[19]Lourenço J P,Fernandes A,Bértolo R A,et al. Gas-phase dehydration of glycerol over thermally-stable SAPO-40 catalyst[J]. RSC Adv,2015,5(14):10667 - 10674.
[20]Lourenço J P,Macedo M I,Fernandes A. Sulfonic-functionalized SBA-15 as an active catalyst for the gas-phase dehydration of Glycerol[J]. Catal Commun,2012,19(10):105 -109.
[21]Cecilia J A,García-Sancho C,Mérida-Robles J M,et al. WO3supported on Zr doped mesoporous SBA-15 silica for glycerol dehydration to acrolein[J]. Appl Catal,A,2016,516:30 - 40.
[22]García S C,Cecilia J A,Moreno-Ruiz A,et al. Infuence of the niobium supported species on the catalytic dehydration of glycerol to acrolein[J]. Appl Catal,B,2015,179:139 -149.
[23]Tao Lizhi,Yan Bo,Liang Yu,et al. Sustainable production of acrolein:Catalytic performance of hydrated tantalum oxides for gas-phase dehydration of glycerol[J]. Green Chem,2013,15(3):696 - 705.
[24]Chai Songhai,Wang Haopeng,Liang Yu,et al. Sustainable production of acrolein:Gas-phase dehydration of glycerol over Nb2O5catalyst[J]. J Catal,2007,250(2):342 - 349.
[25]Massa M,Andersson A,Finocchio E,et al. Gas-phase dehydration of glycerol to acrolein over Al2O3-, SiO2-,and TiO2-supported Nb- and W-oxide catalysts[J]. J Catal,2013,307(6):170 - 184.
[26]Massa M,Andersson A,Finocchio E,et al. Performance of ZrO2-supported Nb- and W-oxide in the gas-phase dehydration of glycerol to acrolein[J]. J Catal,2013,297:93 - 109.
[27]Foo G S,Wei D,Sholl D S,et al. Role of Lewis and Brønsted acid sites in the dehydration of glycerol over niobia[J]. ACS Catal,2014,4(9):3180 - 3192.
[28]Ulgen A,Hoelderich W. Conversion of glycerol to acrolein in the presence of WO3/ZrO2catalysts[J]. Catal Lett,2009,131(1/2):122 - 128.
[29]Lauriol G P,Loridant S,Bellière B V,et al. Gas phase dehydration of glycerol to acrolein over WO3/ZrO2catalysts:Improvement of selectivity and stability by doping with SiO2[J]. Catal Commun,2011,16(1):170 - 174.
[30]Ulgen A,Hoelderich W F. Conversion of glycerol to acrolein in the presence of WO3/TiO2catalysts[J]. Appl Catal,A,2011,400(1/2):34 - 38.
[31]Suprun W,Lutecki M,Haber T,et al. Acidic catalysts for the dehydration of glycerol:Activity and deactivation[J]. J Mol Catal A:Chem,2009,309(1/2):71 - 78.
[32]Suprun W,Lutecki M,Gläser R, et al. Catalytic activity of bifunctional transition metal oxide containing phosphated alumina catalysts in the dehydration of glycerol[J]. J Mol Catal A:Chem,2011,342/343(6):91 - 100.
[33]Tao Lizhi,Chai Songhai,Zuo Yi,et al. Sustainable production of acrolein:Acidic binary metal oxide catalysts for gasphase dehydration of glycerol[J]. Catal Today,2010,158(3/4):310 - 316.
[34]Lima C L,Vasconcelos S J S,Filho J M,et al. Nanocasted oxides for gas phase glycerol conversion[J]. Appl Catal,A,2011,399(1/2):50 - 62.
[35]Vasconcelos S J S,Lima C L,Filho J M,et al. Activity of nanocasted oxides for gas-phase dehydration of glycerol[J]. Chem Eng J, 2011,168(2):656 - 664.
[36]de Sousa H S A,Barros F d A A,Vasconcelos S J S,et al. Ternary composites for glycerol conversion:The infuence of structural and textural properties on catalytic activity[J]. Appl Catal,A,2011,406(1/2):63 - 72.
[37]Lauriol G P,Millet J M M,Loridant S,et al. New efcient and long-life catalyst for gas-phase glycerol dehydration to acrolein[J]. J Catal,2011,281(2):362 - 370.
[38]Lauriol G P,Postole G,Loridant S,et al. Acid-base properties of niobium-zirconium mixed oxide catalysts for glycerol dehydration by calorimetric and catalytic investigation[J]. Appl Catal,B,2011,106(1):94 - 102.
[39]Omata K,Izumi S,Murayama T,et al. Hydrothermal synthesis of W-Nb complex metal oxides and their application to catalytic dehydration of glycerol to acrolein[J]. Catal Today,2013,201(1):7 - 11.
[40]Martin A,Armbruster U,Atia H. Recent developments in dehydration of glycerol toward acrolein over heteropolyacids[J]. Eur J Lipid Sci Tech,2012,114(1):10 - 23.
[41]Kang T H,Choi J H,Bang Y,et al. Dehydration of glycerin to acrolein over H3PW12O40heteropolyacid catalyst supported on silica-alumina[J]. J Mol Catal A:Chem,2015,396:282 - 289.
[42]Chai Songhai,Wang Haopeng,Liang Yu,et al. Sustainable production of acrolein:Gas-phase dehydration of glycerol over 12-tungstophosphoric acid supported on ZrO2and SiO2[J]. Green Chem,2008,10(10):1087 - 1093.
[43]Talebian K A,Amin N A S. Supported silicotungstic acid on zirconia catalyst for gas phase dehydration of glycerol to acrolein[J]. Catal Today,2015,256:315 - 324.
[44]Katryniok B,Paul S,Capron M,et al. A long-life catalyst for glycerol dehydration to acrolein[J]. Green Chem,2010,12(11):1922 - 1925.
[45]Kim Y T,Jung K D,Park E D. Gas-phase dehydration of glycerol over supported silicotungstic acids catalysts[J]. Bull Korean Chem Soc,2010,31(11):3283 - 3290.
[46]Liu Licheng,Wang Bo,Du Yonghua,et al. Supported H4Si-W12O40/Al2O3solid acid catalysts for dehydration of glycerol to acrolein:Evolution of catalyst structure and performance with calcination temperature[J]. Appl Catal, A,2015,489:32 -41.
[47]Dubois J L,Magatani Y,Okumura K. Process for manufacturing acrolein from glycerol:WO 2009127889[P]. 2009-10-22.
[48]Haider M H,Dummer N F,Zhang D,et al. Rubidium- and caesium-doped silicotungstic acid catalysts supported on alumina for the catalytic dehydration of glycerol to acrolein[J]. J Catal,2012,286(2):206 - 213.
[49]Haider M H,D’Agostino C,Dummer N F,et al. The effect of grafting zirconia and ceria onto alumina as a support for silicotungstic acid for the catalytic dehydration of glycerol to acrolein[J]. Chem Eur J,2014,20(6):1743 - 1752.
[50]Dalil M,Edake M,Sudeau C,et al. Coke promoters improve acrolein selectivity in the gas-phase dehydration of glycerol to acrolein[J]. Appl Catal,A,2016,522:80 - 89.
[51]Liu Qingbo,Zhang Zhen,Du Ying,et al. Rare earth pyrophosphates:Efective catalysts for the production of acrolein from vapor-phase dehydration of glycerol[J]. Catal Lett,2008,127(3/4):419 - 428.
[52]Deleplanque J,Dubois J L,Devaux J F,et al. Production of acrolein and acrylic acid through dehydration and oxydehydration of glycerol with mixed oxide catalysts[J]. Catal Today,2010,157(1/4):351 - 358.
[53]Patience G S,Farrie Y,Devaux J F,et al. Oxidation kinetics of carbon deposited on cerium-doped FePO4during dehydration of glycerol to acrolein[J]. Chem Eng Technol,2012,35(9):1699 - 1706.
[54]干慧媚,赵秀阁,宋宝宁,等. 磷酸锆催化甘油气相脱水制备丙烯醛[J]. 催化学报, 2014(7):1148 - 1156.
[55]Rao G S,Rajan N P,Pavankumar V,et al. Vapour phasedehydration of glycerol to acrolein over NbPO4catalysts[J]. J Chem Tech Biotechnol,2014,89(12):1890 - 1897.
[56]Choi Y,Park D S,Yun H J,et al. Mesoporous siliconiobium phosphate as a pure Bronsted acid catalyst with excellent performance for the dehydration of glycerol to acrolein[J]. ChemSusChem,2012,5(12):2460 - 2468.
[57]Choi Y,Park H,Yun Y S,et al. Effects of catalyst pore structure and acid properties on the dehydration of glycerol[J]. ChemSusChem,2015,8(6):974 - 979.
[58]Yun D,Kim T Y,Park D S,et al. A tailored catalyst for the sustainable conversion of glycerol to acrolein:mechanistic aspect of sequential dehydration[J]. ChemSusChem,2014,7(8):2193 - 2201.
(编辑 杨天予)
Progresses in catalysts for gas phase dehydration of glycerol to acrolein
Huang Liang,Xu Hualong,Shen Wei
(The Department of Chemistry,Fudan University,Shanghai Key Laboratory of Molecular Catalysis and Innovative Materials,Laboratory of Advanced Materials of Fudan University,Shanghai 200433,China)
The catalytic dehydration of glycerol to acrolein is an important biomass conversion reaction for the sustainable production of acrolein from bio-based glycerol. This paper summarized the research progresses in catalysts for the gas phase dehydration of glycerol to acrolein. These catalysts were divided into three families,namely molecular sieves,metal oxides and mixed metal oxides,and heteropolyacids and phosphates. In addition, current main problems and challenges in the catalyst design were also discussed. The trend of development for high ef cient catalysts was forecasted.
glycerol;acrolein;catalytic dehydration;biomass conversion;solid acid catalyst
1000 - 8144(2016)09 - 1021 - 10
TQ 224.13
A
10.3969/j.issn.1000-8144.2016.09.001
2016 - 07 - 18;[修改稿日期]2016 - 07 - 20。
黄亮(1989—),男,浙江省嘉兴市人,博士生,电话 13162530898,电邮 115110220047@fudan.edu.cn。联系人:徐华龙,电话 021 - 65642401,电邮 shuhl@fudan.edu.cn。
上海市科学技术委员会资助国际合作项目(14120700700)和重点实验室基金项目(14DZ2273900)。
