靶向血管内皮生长因子受体2超声造影剂的制备及其体外寻靶能力实验研究
2017-01-20袁海霞汪瀚韬孔文韬王文平复旦大学附属中山医院超声科上海0003江苏省南京鼓楼医院超声科江苏南京0008
袁海霞,汤 阳,汪瀚韬,孔文韬,王文平. 复旦大学附属中山医院超声科,上海 0003;. 江苏省南京鼓楼医院超声科,江苏 南京 0008
靶向血管内皮生长因子受体2超声造影剂的制备及其体外寻靶能力实验研究
袁海霞1,汤 阳1,汪瀚韬1,孔文韬2,王文平1
1. 复旦大学附属中山医院超声科,上海 200032;
2. 江苏省南京鼓楼医院超声科,江苏 南京 210008
目的:制备靶向血管内皮生长因子受体2 (vascular endothelial growth factor receptor 2,VEGFR2)超声造影剂,评价其物理性质及对肿瘤细胞的寻靶能力。方法:利用生物素-亲和素桥接法将微米级超声造影剂USphere与VEGFR2抗体结合,制备靶向VEGFR2超声造影剂,检测其粒径分布;用免疫荧光法检测不同细胞株(高转移肝肿瘤细胞MHCC-97H及正常肝细胞LO2)中VEGFR2表达强度,以及靶向与非靶向VEGFR2超声造影剂对MHCC-97H和LO2细胞的结合能力。结果:靶向VEGFR2超声造影剂微泡分布均匀,平均粒径(1 012.67±78.59) nm,免疫荧光法显示VEGFR2抗体可特异性连接于微泡表面。标记荧光的VEGFR2抗体在MHCC-97H细胞高表达,在LO2细胞低表达。免疫荧光定量显示靶向VEGFR2造影剂在MHCC-97H细胞中的荧光强度比值(微泡荧光强度/细胞荧光强度)为0.75±0.32,显著高于其他3组(P<0.01)。结论:本研究成功制备靶向VEGFR2超声造影剂,其大小稳定均一,可与高表达VEGFR2的MHCC-97H细胞特异性结合。
靶向超声造影剂;生物素-亲和素;血管内皮生长因子受体2;超声分子成像;肿瘤血管生成
肿瘤生长和转移过程中,血管内皮生长因子(vascular endothelial growth factor,VEGF)起重要作用。血管内皮生长因子受体2 (vascular endothelial growth factor receptor 2,VEGFR2)在多种肿瘤新生血管内皮细胞表面高度表达,而在正常组织中低表达[1-4]。以VEGFR2为靶点,旨在减少肿瘤内血管生成,从而抑制肿瘤生长的靶向药物已进入临床使用阶段[5-6]。目前,临床上实体肿瘤疗效的评价体系采用实体瘤疗效评价新标准(Response Evaluation Criteria in Solid Tumors,RECIST)及改良实体瘤疗效评价标准(modified Response Evaluation Criteria in Solid Tumors,mRECIST)。这些评价标准仍是基于肿瘤最大平面的长径变化及肿瘤数目的多少来反映靶向治疗对肿瘤是否有效,但在早期反映肿瘤病灶内血管生成改变方面有欠缺[7-9]。因此,临床上迫切需要找到一种能早期、准确、无创反映肿瘤内微血管灌注变化的评价手段,从而更早发现肿瘤对治疗是否应答。
Baetke等[10]将靶向VEGFR2微泡造影剂(BR55,Bracco公司)用于裸鼠皮下移植瘤模型显像中,发现其可特异性显示瘤内血流灌注改变。然而,这种商品化的靶向造影剂不利于转换其他靶点进行后续研究。因此,本研究尝试利用生物素-亲和素法,将微米级超声造影剂USphere与VEGFR2抗体结合,以期获得一种制作简便的靶向VEGFR2微泡造影剂,并对其粒径分布及体外肝肿瘤细胞寻靶能力进行探讨,为后续肿瘤治疗监测提供研究基础。
1 资料和方法
1.1 实验材料
超声造影剂USphere™ Labeler购自台湾博信生物科技公司,生物素化大鼠抗小鼠CD309 单抗、VEGFR2抗体、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记小鼠抗大鼠IgG2a购自美国BioLegend公司,磷酸盐缓冲液(phosphate bufered saline,PBS)购自ThermoFisher Scientifc公司,Alexa fluor555购自美国Life Technology公司,DMEM培养液、胎牛血清购自美国Gibco公司,青/链霉素溶液购自杭州吉诺生物医药技术有限公司。人高转移肝癌细胞株MHCC-97H、正常肝细胞株LO2来自复旦大学附属中山医院肝病研究所。AM-1高速振荡器为台湾Monitex公司产品,低速离心机(3-18KS)为德国Sigma公司产品,纳米粒度电位分析仪Nano ZS90为英国马尔文仪器有限公司产品,激光共聚焦显微镜为日本Olympus公司产品。
1.2 靶向VEGFR2微泡造影剂的制备及理化性质测定
按USphere™ Labeler说明书,将微泡溶液室温下置于专用高速振荡器内振荡40 s活化。将活化后的微泡与生物素化VEGFR2单抗在室温下混合15 min,混合比例根据产品说明书(0.7 nmol抗体/mL USphere™ Labeler微泡),1 000 r/min离心3 min,弃下清,PBS洗3次,获得制备完成的靶向微泡。非靶向及靶向微泡悬液分别用PBS稀释1 000倍,粒度分析仪测定微泡粒径分布。VEGFR2抗体与FITC标记的荧光二抗4 ℃避光反应10 min,1 000 r/min离心3 min,弃上清,获得荧光标记VEGFR2抗体。将该抗体与USphere微泡接靶并离心洗涤,弃下清,获得荧光标记的靶向微泡。用PBS稀释100倍后,激光共聚焦荧光显微镜下观察微泡形态。
1.3 免疫荧光测定不同细胞株中VEGFR2的表达
在37 ℃、5% CO2孵箱中,用含10%胎牛血清、1%青/链霉素溶液的DMEM培养液培养人高转移肝癌细胞株MHCC-97H和正常肝细胞株LO2,每 2~3 d传代1次。收集对数生长期MHCC-97H、LO2细胞,消化离心,取200 uL 细胞悬液(1×105/mL细胞密度)接种于铺有盖玻片的12孔板中,加入DMEM培养液,于孵箱内培养过夜。第2天加入标记Alexa fuor555的VEGFR2单抗(1∶50稀释)共孵育30 min,PBS洗3次,多聚甲醛固定,4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染色,共聚焦显微镜下观察不同细胞表达VEGFR2的荧光强度。
1.4 靶向造影剂体外寻靶能力
同1.3方法培养上述两种细胞,接种于12孔板中,每种细胞接种4孔。分别加入标记FITC的靶向造影剂和非靶向造影剂(1∶20稀释),于培养箱中共孵育30 min,多聚甲醛固定,PBS洗3次,DAPI染色。共聚焦显微镜下观察不同细胞表达FITC的荧光强度,20倍镜下每孔于左上、左下、中央、右上、右下扫描拍片,ImageJ软件分析荧光强度。
1.5 统计学处理
2 结 果
2.1 靶向造影剂的理化性质
荧光显微镜下放大400倍,显示FITC标记的靶向VEGFR2微泡呈彼此分散、较均匀的绿色透亮圆形空泡(图1B)。粒径分析结果显示,新鲜配制的靶向微泡平均粒径为(1 012.67±78.59 ) nm (n=3)。粒径分布图显示,粒径大小均一,离散度小(图1 A) 。

图1 靶向VEGFR2微泡粒径分布图及荧光显微镜下FITC标记的靶向VEGFR2微泡形态(×400)
2.2 免疫荧光检测MHCC-97H和LO2细胞中VEGFR2表达强度
激光共聚焦荧光显微镜下放大400倍,显示Alexa fuor555标记的红色VEGFR2单抗与MHCC-97H细胞结合强度(图2 A)明显高于LO2细胞(图2 B)(蓝色部分为DAPI染色的细胞核)。表明VEGFR2在MHCC-97H细胞中高表达,而在正常肝细胞中低表达。
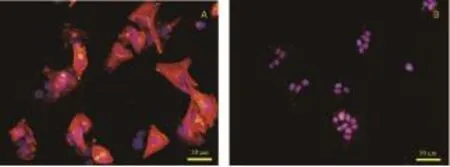
图2 标记Alexa fluor555的VEGFR2抗体与MHCC-97H、LO2细胞结合的荧光照片(×400)
2.3 靶向造影剂对肿瘤细胞的寻靶能力
激光共聚焦荧光显微镜下,放大200倍,MHCC-97H细胞加靶向VEGFR2微泡组中,FITC标记的靶向微泡与DAPI染色的细胞核荧光比值(图3 A)明显高于其余3组(图3 B、3 C、3 D)。荧光显微镜照片显示,靶向VEGFR2微泡与MHCC-97H细胞共孵育后,MHCC-97H细胞周围绿色荧光明显多于其余3组,表明靶向VEGFR2微泡可特异性结合于高表达VEGFR2的MHCC-97H细胞表面。
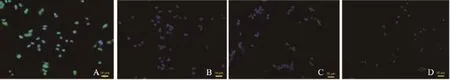
图3 MHCC-97H和LO2细胞与靶向、非靶向微泡结合荧光照片(荧光显微镜,×200)
用ImageJ软件对靶向与非靶向VEGFR2微泡分别作用于MHCC-97H细胞及LO2细胞的图像进行分析,计算FITC标记的靶向微泡荧光与DAPI标记的细胞核荧光的比值。结果显示,靶向VEGFR2微泡与MHCC-97H细胞共孵育组中微泡与细胞核的荧光比值为0.75±0.32,与其余3组相比有统计学差异(P<0.01) (图4) 。
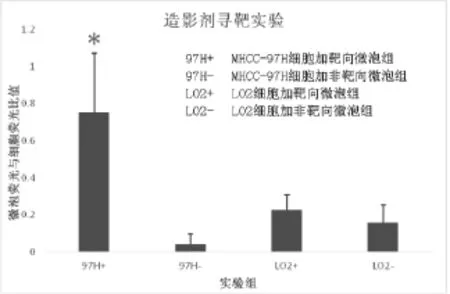
图4 ImageJ软件计算各组微泡荧光与细胞核荧光的比值
3 讨 论
肿瘤发生发展及转移过程中有多种机制参与。近年来,针对肿瘤治疗的方法中,以抑制肿瘤血管生成、诱导细胞凋亡的靶向治疗发展迅速。由于肿瘤的耐药性及个体差异,临床需一种能早期发现治疗有效性的评估手段。影像学评估标准RECIST 及mRECIST根据肿瘤体积或病灶数量的变化来监测实体肿瘤治疗的疗效,缺点是无法在肿瘤大小发生变化之前反映肿瘤内血流灌注强度的改变。本研究探讨了一种靶向VEGFR2的微米级超声微泡在评估肿瘤血管生成中的作用。微米级超声造影剂因大小限制,不能通过肿瘤血管内皮间隙,可通过血液循环主动靶向于肿瘤血管内皮VEGFR2,从而实现肿瘤的特异显像或药物的定向释放功能。
超声造影剂结合配体的方法主要有吸附法、掺入法、交联法和抗体衍生法[11-12]。生物素-亲和素桥接法作为最常用的制作靶向微泡造影剂的方法之一,具有简便、稳定、敏感、多靶点、结合率高等优势[13-14]。本研究采用这一方法,将商品化的USphere超声造影剂与VEGFR2单抗结合,成功制备了以肿瘤血管内皮细胞表面VEGFR2为靶点的超声造影剂,荧光显微镜显示微泡大小均一,均值在1 012.67 nm,无聚集,可用于后续超声特异显像。USphere超声造影剂活化简便,活化前可长期存储,亲和素化的结构使其外接VEGFR2抗体简单易行,且可重复性和稳定性强。这些均为后续动物体内显像研究及靶向其他特异肿瘤靶点提供了良好的材料学基础。
肝癌靶向治疗以索拉菲尼和贝伐单抗为代表[15-17]。肿瘤细胞中VEGFR2表达高于正常肝细胞。本研究选择人高转移肝肿瘤细胞株MHCC-97H和正常肝细胞株LO2进行对照,结果与文献报道相符,证实MHCC-97H细胞内VEGFR2表达显著高于正常肝细胞LO2[18]。进一步的靶向微泡实验显示,靶向VEGFR2微泡与高表达VEGFR2的MHCC-97H细胞结合能力显著强于非靶向造影剂组及正常肝细胞LO2组。超声造影是通过接收微泡造影剂的背向散射信号进行显像,配合定量分析技术,可尝试在动物体内检测肿瘤内与正常肝实质内超声强度及定量指标的差异,来反映肿瘤内血流灌注的改变。针对细胞的靶向微泡结合实验结果可作为动物体内实验的研究基础。
本研究存在一定的局限性。如靶向造影剂的内径约1 μm,在正常情况下无法穿过肿瘤血管内皮间隙,因此仍属于血池造影剂,无法对直接靶向肿瘤细胞进行显像或载药治疗[19-20]。然而,本研究旨在评估肿瘤血管灌注,用该靶向造影剂特异反映肿瘤内皮细胞生长状态改变的目的是可以达到的。本研究结果可作为靶向肿瘤血管内皮的特异性显像及治疗的研究基础,早期反映肿瘤血管内皮生成变化,从而建立一种新的超声造影定量评价靶向治疗的体系。此外,在后续实验中也可考虑将这种造影剂外接其他单抗,用于不同肿瘤的特异显像。
综上所述,本研究成功制备了一种靶向VEGFR2微泡造影剂,方法简便,微泡大小均一稳定,能特异性地与高表达VEGFR2的MHCC-97H细胞高度结合,可作为一种较可靠的监测肿瘤血管内皮VEGFR2表达的分子影像学探针。
[1] CHEN S, ZHANG X, PENG J, et al. VEGF promotes gastric cancer development by upregulating CRMP4 [J]. Oncotarget, 2016, 7(13): 17074-17086.
[2] KOLBL A C, BIRK A E, KUHN C, et al. Influence of VEGFR and LHCGR on endometrial adenocarcinoma [J]. Oncol Lett, 2016, 12(3): 2092-2098.
[3] NASIR A, REISING L O, NEDDERMAN D M, et al. Heterogeneity of vascular endothelial growth factorreceptors 1, 2, 3 in primary human colorectal carcinoma [J]. Anticancer Res, 2016, 36(6): 2683-2696.
[4] 康从民, 王大伟, 吕英涛, 等. 血管内皮生长因子受体-2 所介导信号通路的研究进展 [J]. 生物化学与生物物理进展, 2009, 36(10): 8.
[5] APARICIO J, GARCIA-MORA C, MARTIN M, et al. A phase I, dose-finding study of sorafenib in combination with gemcitabine and radiation therapy in patients with unresectable pancreatic adenocarcinoma: a Grupo Espanol Multidisciplinario en Cancer Digestivo (GEMCAD) study [J]. PLoS One, 2014, 9(1): e82209.
[6] BERARDI R, BRUNELLI A, PAGLIARETTA S, et al. Impact of VEGF, VEGFR, PDGFR, HIF and ERCC1 gene polymorphisms on thymic malignancies outcome after thymectomy [J]. Oncotarget, 2015, 6(22): 19305-19315.
[7] EDELINE J, BOUCHER E, ROLLAND Y, et al. Comparison of tumor response by Response Evaluation Criteria in Solid Tumors (RECIST) and modified RECIST in patients treated with sorafenib for hepatocellular carcinoma [J]. Cancer, 2012, 118(1): 147-156.
[8] GEORGIADES C, GESCHWIND J F, HARRISON N, et al. Lack of response after initial chemoembolization for hepatocellular carcinoma: does it predict failure of subsequent treatment? [J]. Radiology, 2012, 265(1): 115-123.
[9] BARGELLINI I, BOZZI E, CAMPANI D, et al. Modified RECIST to assess tumor response after transarterial chemoembolization of hepatocellular carcinoma: CT-pathologic correlation in 178 liver explants [J]. Eur J Radiol, 2013, 82(5): e212-e218.
[10] BAETKE S C, RIX A, TRANQUART F, et al. Squamous cell carcinoma xenografts: use of VEGFR2-targeted microbubbles for combined functional and molecular US to monitor antiangiogenic therapy effects [J]. Radiology, 2016, 278(2): 430-440.
[11] OVERVELDE M, GARBIN V, DOLLET B, et al. Dynamics of coated microbubbles adherent to a wall [J]. Ultrasound Med Biol, 2011, 37(9): 1500-1508.
[12] PILLAI R, MARINELLI E R, FAN H, et al. A phospholipid-PEG2000 conjugate of a vascular endothelial growth factor receptor 2 (VEGFR2)-targeting heterodimer peptide for contrast-enhanced ultrasound imaging of angiogenesis [J]. Bioconjug Chem, 2010, 21(3): 556-562.
[13] TARDY I P S, THERAULAZ M. Ultrasound molecular imaging of VEGFR2 in a rat prostate tumor model using BR55 [J]. Invest Radiol, 2010, 45(10): 6.
[14] KIESSLING F. Science to practice: the dawn of molecular US imaging for clinical cancer imaging [J]. Radiology, 2010, 256(2): 331-333.
[15] SWAMY S G, KAMESHWAR V H, SHUBHA P B, et al. Targeting multiple oncogenic pathways for the treatment of hepatocellular carcinoma [J]. Target Oncol, 2016. [Epub ahead of print].
[16] PRIETO-DOMINGUEZ N, ORDONEZ R, FERNANDEZ A, et al. Modulation of autophagy by sorafenib: effects on treatment response [J]. Front Pharmacol, 2016, 7: 151.
[17] TAKETOMI A. Clinical trials of antiangiogenic therapy for hepatocellular carcinoma [J]. Int J Clin Oncol, 2016, 21(2): 213-218.
[18] HUANG J, ZHANG X, TANG Q, et al. Prognostic significance and potential therapeutic target of VEGFR2 in hepatocellular carcinoma [J]. J Clin Pathol, 2011, 64(4): 343-348.
[19] GREISH K. Enhanced permeability and retention of macromolecular drugs in solid tumors: a royal gate for targeted anticancer nanomedicines [J]. J Drug Target, 2007, 15(7-8): 457-464.
[20] STYLIANOPOULOS T, WONG C, BAWENDI M G, et al. Multistage nanoparticles for improved delivery into tumor tissue [J]. Methods Enzymol, 2012, 508: 109-130.
Preparation of vascular endothelial growth factor receptor 2-targeted ultrasonic contrast agent and its ability of targeting tumor cells in vitro
YUAN Haixia1, TANG Yang1, WANG Hantao1, KONG Wentao2, WANG Wenping1
(1. Department of Ultrasound, Zhongshan Hospital, Fudan University, Shanghai 200032, China; 2. Department of Ultrasound, Nanjing Drum Tower Hospital, Nanjing University, Nanjing 210008, Jiangsu Province, China)
WANG Wenping E-mail: puguang61@126.com
Objective:To evaluate the targeting ability of vascular endothelial growth factor receptor 2 (VEGFR2)-targeted microbubbles to tumor cells and its preparation process.Methods:VEGFR2-targeted microbubbles were accomplished by biotinavidin linkage of VEGFR2 antibody and USphere ultrasonic contrast agent. The features were detected by dynamic light scattering (DLS) and laser scanning confocal microscope (LSCM). The VEGFR2 expression intensities in MHCC-97H cells (high metastatic human hepatic carcinoma cells) and LO2 cells (human liver cells) were compared by immunofuorescence method. The combination rates of VEGFR2-targeted microbubbles and non-targeted micro bubbles with both cell lines were documented by quantitative immunofluorescence technique.Results:VEGFR2-targeted microbubbles were distributed evenly with average particle size of (1 012.67±78.59) nm. Immunofuorescence assay showed green fuorescence visible on the surface of the targeted micro bubbles. The immunofuorescence signal was higher in MHCC-97H cells than that in LO2 cells. The fuorescence signal ratio of VEGFR2-targeted microbubbles was (0.75±0.32) in MHCC-97H cells, which was signifcantly higher than that in other three groups (P<0.01).Conclusion:VEGFR2-targeted microbubbles with a stable average size are successfully prepared. The micro bubbles could specifcally combind with VEGFR2-high-expressing MHCC-97H cells.
Targeted ultrasonic contrast agent; Biotin-advidin; Vascular endothelial growth factor receptor 2; Molecular ultrasound imaging; Tumor angiogenesis
R445.1
A
1008-617X(2016)04-0322-05
2016-11-17
2016-12-11)
国家自然科学基金资助项目(No:81371577;81571676)
王文平 E-mail:puguang61@126.com
