靶向血管内皮生长因子受体2微泡造影剂评价肿瘤血管生成的实验研究
2017-01-20孔文韬张小龙王文平复旦大学附属中山医院超声科上海000南京大学医学院附属鼓楼医院超声科南京0008上海市影像医学研究所上海000
汤 阳,孔文韬,张小龙,王文平. 复旦大学附属中山医院超声科,上海 000;. 南京大学医学院附属鼓楼医院超声科,南京 0008;. 上海市影像医学研究所,上海 000
·论著·
靶向血管内皮生长因子受体2微泡造影剂评价肿瘤血管生成的实验研究
汤 阳1,孔文韬2,张小龙3,王文平1
1. 复旦大学附属中山医院超声科,上海 200032;
2. 南京大学医学院附属鼓楼医院超声科,南京 210008;
3. 上海市影像医学研究所,上海 200032
目的:探讨靶向血管内皮生长因子受体2 (vascular endothelial growth factor receptor 2,VEGFR2)微泡造影剂用于肿瘤血管生成的超声分子成像。方法:用生物素-亲和素桥接法制备靶向VEGFR2超声微泡,免疫荧光法检测微泡与抗体的结合。建立裸鼠HepG2肝癌皮下种植瘤模型,随机分成靶向组(n=5)和非靶向组(n=5),经尾静脉团注相同剂量靶向微泡或非靶向微泡,录像并绘制时间-强度曲线(time-intensity curve,TIC);注入造影剂5 min后利用高声压爆破技术清除肿瘤内部微泡,比较爆破前后两组造影图像灰阶强度的下降,估计靶向微泡在体内与靶点的结合能力。结果:靶向造影剂和非靶向造影剂均表现为裸鼠皮下瘤的显著增强,但TIC显示两组间曲线下面积差异有统计学意义[(3 940.4±200.9) dB·s vs. (2 796.8±452.3) dB·s,P=0.001];微泡爆破后靶向组灰阶强度降低显著大于非靶向组[(7.61±2.20) dB vs. (3.74±1.40) dB,P=0.010]。结论:靶向VEGFR2微泡造影剂在体内能显著增强肿瘤血管成像,可作为监测肿瘤血管生成的较可靠分子影像学探针。
靶向血管内皮生长因子受体2微泡;HepG2肝癌模型;肿瘤血管生成;超声分子成像
血管内皮生长因子受体2 (vascular endothelial growth factor receptor 2,VEGFR2)在肿瘤新生血管内皮细胞表面高度表达,而在正常组织中表达保守[1-2]。本研究使用磷脂质包覆的USphere™造影剂,通过“生物素-亲和素”桥接法与抗VEGFR2 单克隆抗体(简称单抗)连接,构成靶向肿瘤血管的超声造影剂,旨在探索一种能在分子水平显示肿瘤新生血管的影像学技术。
1 资料和方法
1.1 资料
1.1.1 实验细胞
HepG2人肝癌细胞购自复旦大学附属中山医院肝癌研究所。
1.1.2 实验动物
BALB/c-nu/nu雄性裸鼠,10只,6周龄,无特定病原体(specifc pathogen free,SPF)级饲养,购自复旦大学实验动物中心。
1.1.3 主要实验药品与仪器
DMEM培养液、胎牛血清购自美国Gibco公司,磷酸盐缓冲液(phosphate buffered saline,PBS)购自赛ThermoFisher Scientific公司,青/链霉素溶液购自杭州吉诺生物医药技术有限公司,USphere™ Labeler全氟化碳微泡购自台湾博信生物科技,生物素化大鼠抗小鼠CD309单抗、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记小鼠抗大鼠IgG2a购自美国BioLegend公司,AM-1高速振荡器购自台湾Monitex公司,纳米粒度电位分析仪Nano ZS90购自英国马尔文仪器有限公司,激光共聚焦显微镜购自日本Olympus公司,IU22彩色多普勒超声成像系统购自荷兰Philips公司。
1.2 方法
1.2.1 裸鼠皮下种植瘤模型的建立
HepG2人肝癌细胞在含10%胎牛血清的DMEM培养液(含青霉素10 μg/mL、链霉素10 μg/mL)中生长。培养条件为37 ℃、5% CO2、完全饱和湿度,用0.25%胰酶和0.02%乙二胺四乙酸(ethylenedinitrilotetraacetic acid,EDTA)消化传代。按5×106/mL密度(约0.1 mL,细胞悬液密度以生理盐水调节)接种于裸鼠右肩背部皮下,接种前充分摇匀细胞悬液,约2周后肿瘤长至长径1 cm左右。
1.2.2 靶向VEGFR2超声微泡的制备及其理化性质的检测
将USphere™ Labeler微泡于室温置入专用高速振荡器内,设置振荡时间为30 s,振荡活化后便可产生密度约2.5×1010bubbles/mL的微气泡(参考产品说明书)。从瓶内抽取适量微泡与生物素化VEGFR2单抗室温下混合,混合比例根据产品说明书(0.7 nmol抗体/mL USphere™ Labeler微泡),放置15 min,不时轻轻混匀。修饰完毕的微泡用PBS稀释,4 ℃ 1 000 r/min离心洗涤3 min,弃下清液以去除未修饰成功的靶标分子,重复洗涤3次,获得制备完成的靶向微泡。吸取少量微泡悬液,用适量PBS稀释后滴于载玻片中央,置于光镜下观察。另外吸取少量微泡悬液用库尔特粒度分析仪测定修饰成功微泡的粒径分布。
1.2.3 免疫荧光法测定微泡与抗体的结合
在避光环境中,在制备完成的靶向微泡中加入FITC标记小鼠抗大鼠IgG2a荧光二抗(5 μL/107bubbles),冰上孵育15~20 min,适当混匀,PBS稀释,4 ℃ 1 000 r/m离心洗涤3 min,弃下清液以去除未结合的荧光二抗,重复洗涤3次。吸取少量微泡悬液滴于35 mm细胞培养皿中央,置于激光共聚焦显微镜载物台上,荧光模式高倍镜下观察并拍照。
1.2.4 靶向微泡对肿瘤血管的体内显像
将已成瘤的10只裸鼠随机分成靶向组和非靶向组,每组5只,测量肿瘤大小,根据公式长×宽×厚/2计算肿瘤体积。采用Philips IU22彩色多普勒超声诊断系统,5~12 MHz线阵探头,机械指数谐波造影技术,设定动态范围(dynamic range,DR) 83dB,机械指数0.07,帧频12 Hz,深度35 mm。焦点位于肿瘤下方,尽量避开肿瘤,减少超声波照射对微泡的破坏,以获得稳定的超声造影效果。裸鼠麻醉后取俯卧位固定,二维超声显示肿瘤图像清晰后探头保持不动,切换至造影模式,确定肿瘤位置无误后经裸鼠尾静脉一次性团注密度为2.0×109bubbles/mL的靶向造影剂或非靶向造影剂50 µL/只,立即开始录像3 min并存盘;注入造影剂5 min后录像5 s;高机械指数超声波照射破坏肿瘤内残余微泡,再次录像30 s。
1.2.5 超声造影结果及图像分析
应用Interface Design定量分析软件绘制时间-强度曲线(time-intensity curve,TIC),选取有增强的肿瘤实质为感兴趣区,排除始终未见增强的坏死区域及周围高增强的包膜,获得定量分析的主要参数,包括曲线上升及下降斜率、达峰时间(time to peak,TTP)、峰值强度(peak intensity,PI)、平均渡越时间(mean transit time,MTT)及曲线下面积(area under the curve,AUC)等数据,比较两组之间的差异;计算微泡爆破前后造影图像灰阶强度的差值,间接估计瘤体内与肿瘤血管内皮靶点结合的微泡量。
1.3 统计学处理
应用SPSS 19.0统计软件分析处理所得数据,计量资料以差表示,组间比较应用独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 靶向微泡的理化性质
光镜下靶向微泡呈彼此分散、较均匀的透亮圆形空泡(图1),粒径分析显示新鲜配制的靶向微泡平均粒径为1 214 nm,分布范围610~1 484 nm,多分散性指数(polydispersity index,PDI)为0.344 (图2)。
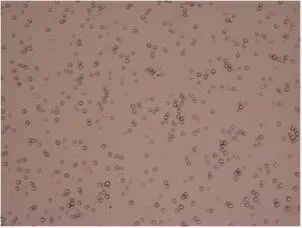
图1 靶向微泡的光镜图(×200)
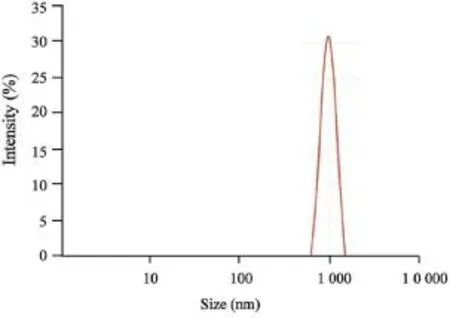
图2 靶向微泡的粒径分布图
2.2 微泡与抗体的结合情况
与FITC标记的荧光二抗孵育后,激光共聚焦显微镜下可见靶向微泡呈明亮的绿色荧光(200/ HP),而非靶向微泡仅有极少量微泡显示荧光(15/HP)(图3),表明抗VEGFR2单抗通过生物素-亲和素桥接法成功连接于微泡表面。
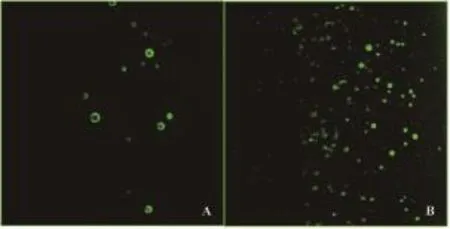
图3 与FITC标记的荧光二抗孵育后非靶向微泡与靶向微泡的激光共聚焦显微镜图(×630)
2.3 动物模型情况
10只裸鼠均成瘤,2周后肩背部隆起皮下种植瘤长径约1 cm。靶向组与非靶向组肿瘤体积分别为(0.95±0.23) cm3(范围0.57~1.16 cm3,与(1.12±0.32) cm3(范围0.69~1.56 cm3),两者差异无统计学意义(P=0.378)。
2.4 造影图像及定量分析结果
经尾静脉一次性团注靶向造影剂或非靶向造影剂后,在裸鼠体内均表现为肿瘤显著增强(图4)。比较靶向组与非靶向组TIC定量分析参数(表1)发现,肿瘤实质的曲线上升及下降斜率、TTP、MTT均无显著差异;靶向组肿瘤实质AUC值为(3 940.4±200.9) dB·s,非靶向组肿瘤实质AUC值为(2 796.8±452.3) dB·s,两组差异有统计学意义(P=0.001);靶向组肿瘤实质PI平均值为25.67 dB,高于非靶向组的21.62 dB,但差异无统计学意义(P=0.078)。
高机械指数超声波照射前后,靶向组肿瘤实质灰阶强度下降(7.61±2.20) dB,非靶向组仅下降(3.74±1.40) dB (图5),两组之间差异有统计学意义(P=0.010),表明更多的靶向VEGFR2超声微泡在体内与肿瘤血管内皮细胞结合并停留于靶组织中。
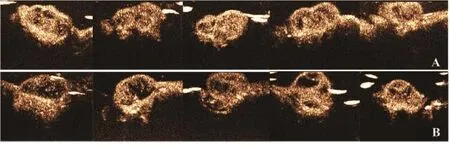
图4 靶向组(A)与非靶向组(B)造影达到峰值时的超声图像
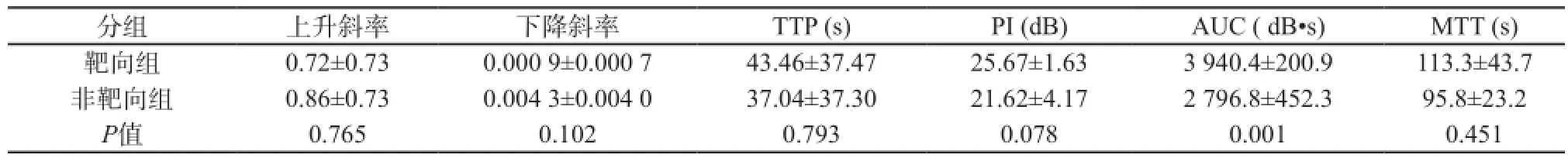
表1 靶向组与非靶向组TIC定量分析参数的比较
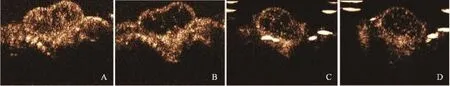
图5 微泡爆破前后靶向组与非靶向组的造影图像
3 讨 论
生物素-亲和素桥接法作为最常用的制作靶向微泡造影剂的方法之一,具有简便、稳定、敏感、多靶点、结合率高等优势。尽管亲和素的免疫原性限制了生物素-亲和素桥接法在临床的应用[3-4],但其对各种靶点有效性的研究有重要意义[5-6]。本研究应用免疫荧光法证实抗VEGFR2单抗能通过这种作用与微泡结合,成功制备以血管内皮细胞表面VEGFR2分子为靶点的超声造影剂,可用于肿瘤血管的特异性显像。体内实验显示,注入造影剂后肿瘤实质显著增强,5 min后仍有大量微泡存留其中。
与其他分子成像方法相似,超声分子成像需造影剂注入后在体内存留一段时间(通常4~15 min)。Dayton等[7]认为,靶向微泡造影剂在这段时间内聚集于靶组织并显像,同时未结合的微泡被循环清除,通过微泡破坏前后相减的方法即可获得残留微泡的信号强度。而Yeh等[8]通过小鼠心肌显像实验发现,靶向微泡造影剂注入20 min后,循环中的游离微泡完全检测不出,仍有部分微泡于靶组织中持续显像。因此,本研究中绘制TIC得到曲线上升及下降斜率、TTP、MTT、PI、AUC等主要定量参数,并计算5 min时微泡爆破前后灰阶强度的下降来间接估计结合微泡的灰阶信号强度,采用这两种方法对靶向微泡造影剂的显像效果进行评价。结果发现,靶向组与非靶向组灌注参数AUC有显著统计学差异,靶向组PI平均值高于非靶向组,两组间微泡爆破前后灰阶强度的下降也存在显著差异。以上结果均证实靶向微泡在体内与肿瘤血管内皮细胞的稳定结合。同时,本研究使用的USphere™ Labeler微泡直径约1.2 μm,与其他较大粒径微泡相比,因高通透和滞留(enhanced permeability and retention,EPR)效应在肿瘤组织中形成选择性分布[9],能显著提高显像效果。但其粒径过小,加大了定量检测抗体携带率的难度,而这种被动靶向作用同样能对靶向微泡在体内主动寻靶并结合的效应产生干扰。因此,本研究中尽管靶向组平均PI值高于非靶向组,但没有统计学差异;样本量小也可能是影响因素之一。既往研究显示,与普通超声造影比较,靶向超声造影的肿瘤组织TTP略提前,PI更高,且持续强化时间更长[10]。通过改进靶点选取、微泡构成、成像方法等,有助于提高微泡的寻靶能力与成像效果[11]。
本研究存在以下局限性:超声微泡较长时间与空气接触可引起微泡破坏及其理化特性改变,而操作时不可避免会出现微泡与空气的短暂接触;此外,种植瘤模型受到较多因素影响,如动物品系、肿瘤类型、种植瘤大小及种植部位等[12]。比较裸鼠皮下瘤的造影图像,显示该动物模型稳定性较好。尽管如此,仍需增加样本量以获得更可靠的结果。
综上所述,靶向VEGFR2微泡造影剂在体内与肿瘤血管内皮细胞的特异性结合能显著增强肿瘤血管显像,作为监测肿瘤灌注及血管生成较可靠的分子影像学探针,在研究疾病早期诊断、评价疾病进展及分子靶向治疗等方面存在一定的潜力。
[1] WILLMANN J K, LUTZ A M, PAULMURUGAN R, et al. Dual-targeted contrast agent for US assessment of tumor angiogenesis in vivo [J]. Radiology, 2008, 248(3): 936-944.
[2] CARMELIET P, JAIN R K. Principles and mechanisms of vessel normalization for cancer and other angiogenic diseases [J]. Nat Rev Drug Discov, 2011, 10(6): 417-427.
[3] TARDY I, POCHON S, THERAULAZ M, et al. Ultrasound molecular imaging of VEGFR2 in a rat prostate tumor model using BR55 [J]. Invest Radiol, 2010, 45(10): 573-578.
[4] KIESSLING F. Science to practice: the dawn of molecular US imaging for clinical cancer imaging [J]. Radiology, 2010, 256(2): 331-333.
[5] LINDNER J R. Molecular imaging of cardiovascular disease with contrast-enhanced ultrasonography [J]. Nat Rev Cardiol, 2009, 6(7): 475-481.
[6] WARRAM J M, SORACE A G, SAINI R, et al. A triple-targeted ultrasound contrast agent provides improved localization to tumor vasculature [J]. J Ultrasound Med, 2011, 30(7): 921-931.
[7] DAYTON P A, RYCHAK J J. Molecular ultrasound imaging using microbubble contrast agents [J]. Front Biosci, 2007, 12: 5124-5142.
[8] YEH J S, SENNOGA C A, MCCONNELL E, et al. Quantitative ultrasound molecular imaging [J]. Ultrasound Med Biol, 2015, 41(9): 2478-2496.
[9] KOBAYASHI H, WATANABE R, CHOYKE P L. Improving conventional enhanced permeability and retention (EPR) effects; what is the appropriate target? [J]. Theranostics, 2013, 4(1): 81-89.
[10] 伍星, 王志刚, 唐毅, 等. 携VEGFR2单抗靶向微泡评价小鼠肿瘤新生血管 [J]. 中国医学影像技术, 2009, 25(6): 932-934.
[11] SPIVAK I, RIX A, SCHMITZ G, et al. Low-dose molecular ultrasound imaging with e-selectin-targeted PBCA microbubbles [J]. Mol Imaging Biol, 2016, 18(2): 180-190.
[12] EBBERS H C, VAN MEER P J, MOORS E H, et al. Measures of biosimilarity in monoclonal antibodies in oncology: the case of bevacizumab [J]. Drug Discov Today, 2013, 18(17-18): 872-879.
Molecular ultrasound imaging with vascular endothelial growth factor receptor 2-targeted microbubbles in a mouse liver cancer model
TANG Yang1, KONG Wentao2, ZHANG Xiaolong3, WANG Wenping1
(1. Department of Ultrasound, Zhongshan Hospital, Fudan University, Shanghai 200032, China; 2. Department of Ultrasound, Nanjing Drum Tower Hospital Afliated to Nanjing University Medical School, Nanjing 210008, Jiangsu Province, China; 3. Shanghai Institute of Medical Imaging, Shanghai 200032, China)
WANG Wenping E-mail: puguang61@126.com
Objective:To evaluate the feasibility and reproducibility of molecular ultrasound imaging of tumor angiogenesis with vascular endothelial growth factor receptor 2 (VEGFR2)-targeted microbubbles.Methods:VEGFR2-targeted microbubbles were accomplished by anti-VEGFR2 monoclonal antibody conjugation to the microbubble surface using biotin-avidin linkage, which was assessed ex vivo using immunofuorescence. Ten mice bearing subcutaneous human liver tumor were divided into two groups randomly (targeted group, n=5; non-targeted group, n=5) and scanned at 2 weeks after implantation with contrast-enhanced ultrasound (CEUS) using either targeted or non-targeted microbubbles. Following CEUS, time-intensity curves were constructed ofline and perfusion parameters were calculated. The residual bubble signal was determined 5 min after contrast agent injection with destruction-replenishment analysis.Results:Both targeted and non-targeted microbubbles revealed signifcant enhancement in vivo. A signifcant diference in area under the curve (AUC) was recorded between targeted group and non-targeted group [(3 940.4±200.9) dB·s vs. (2 796.8±452.3) dB·s, P=0.001]. After the destruction sequence, there was a signifcant diference in the decrease of video intensity between targeted group and non-targeted group [(7.61±2.20) dB vs. (3.74±1.40) dB, P=0.010].Conclusion:Molecular ultrasound imaging with VEGFR2-targeted microbubbles is noninvasive, feasible and reproducible to assess tumor angiogenesis.
Vascular endothelial growth factor receptor 2-targeted microbubble; HepG2 liver cancer model; Tumor angiogenesis; Molecular ultrasound imaging
R445.1
A
1008-617X(2016)04-0317-05
2016-07-14
2016-09-03)
国家自然科学基金资助项目(No: 81371577)
王文平 E-mail:puguang61@126.com
