桦褐孔菌酸性蛋白酶基因的克隆及其生物信息分析
2017-01-19张宇婷安丹丹陈艳秋
李 健, 张宇婷, 安丹丹, 陈艳秋
(延边大学农学院,吉林 延吉 133002)
桦褐孔菌酸性蛋白酶基因的克隆及其生物信息分析
李 健, 张宇婷, 安丹丹, 陈艳秋*
(延边大学农学院,吉林 延吉 133002)
采用RACE法对桦褐孔菌JL01菌株的蛋白酶基因的cDNA全长序列进行克隆,并对其进行生物信息学分析。结果表明:本研究中克隆的目的基因的cDNA序列全长为1 178 bp,包含990 bp开放阅读框(ORF),编码由329个氨基酸组成的蛋白(IO-AP);IO-AP属于胃蛋白酶超级家族的天冬氨酸蛋白酶家族,具有天冬氨酸类型蛋白内切酶活性,是一种酸性蛋白酶。IO-AP与鲍姆桑黄菌(Sanghuangporusbaumii)的酸性蛋白酶(AP)的氨基酸序列一致性为88%,进化关系最近;与地中海嗜蓝孢孔菌(Fomitiporiamediterranea)的氨基酸序列一致性为85%;与其他来源AP的序列一致性均小于75%。
桦褐孔菌;酸性蛋白酶;RACE;克隆;序列分析
桦褐孔菌(Inonotusobliquus),是一种非常珍贵的药用真菌,具有很高的经济价值;又称为白桦茸、桦癌褐孔菌和斜生纤孔菌,主要分布在北纬45°~50°地区[1-4];其药用部分为菌核,呈瘤状,无柄,直径为25~40 cm,外表黑灰色,有不规则的沟痕及深裂,质硬且脆[5]。
早在16世纪,桦褐孔菌就广泛应用于防治各种疑难杂症,如肠癌、肝癌、胃癌等各种消化系统的癌症及心脏病等[6]。近年来,诸多研究发现桦褐孔菌提取物,如多糖、类固醇和三萜类化合物等,能够防止癌细胞转移和复发,抑制多种肿瘤细胞,抑制HIV和SARS病毒,具有抗衰老、增强免疫能力等功效[7-11]。桦褐孔菌精粉因其能够降低血糖,对糖尿病具有非常高的治愈率[12]。
蛋白酶是水解蛋白质肽键的一类酶的总称[13]。按其水解多肽的方式分成内肽酶和端肽酶2类;按其催化活性中心的不同,又可分为丝氨酸蛋白酶、巯基蛋白酶、金属蛋白酶和天冬氨酸蛋白酶(又称酸性蛋白酶)等4种[14]。在国外,对酸性蛋白酶研究的比较早,而且对曲霉酸性蛋白酶的结构和功能等研究已较为透彻。1954年,吉田文彦在黑曲霉中就已发现酸性蛋白酶[15]。2001年,Togai等从假丝酵母(Candidatropicalis)分离出一种酸性蛋白酶,并对其进行了核苷酸序列和功能分析[16]。我国对酸性蛋白酶的研究较晚,而且大多局限于生理、生化活性等方面,如王云等(2008年)通过质谱指纹法对黑曲霉niger H发酵液中所产蛋白进行了分析和鉴定,并对酸性蛋白酶进行了分子生物学方面的研究[17]。1991年,郑海歌等发现在草菇衰老阶段蛋白酶的活性增加[18],蛋白酶还影响盘基网柄菌蛋白质的周转、蘑菇几丁质的合成、真菌的自溶,特别是对裂褶菌、双孢蘑菇、盘基网柄菌、平菇及香菇的子实体形成具有非常重要的作用。然而,目前有关桦褐孔菌酸性蛋白酶的分子生物学研究还未见报道。
桦褐孔菌的人工栽培中,虽然能够产生菌核,但产量过低,严重限制其规模化生产[19]。据本课题组赵丽等(2011年)研究,菌核产量的增加伴随着蛋白酶活性的上升,说明菌核的形成可能与蛋白酶有关[20],本研究对桦褐孔菌蛋白酶基因进行克隆,并对其进行生物信息学分析,为探明菌核发育与蛋白酶的关系、揭示桦褐孔菌菌核发育的分子机理奠定理论与实验基础。
1 材料与方法
1.1 材料
桦褐孔菌菌株JL01,由采自吉林省汪清县的野生桦褐孔菌菌核菌丝体分离而来,保存于延边大学农学院应用真菌实验室。
1.2 克隆菌株及试验试剂
克隆菌株E.coliDH5α、TRIzol试剂、反转录酶M-MLV(RNase H-)、RNase Inhibitor、Oligo(dT)18、LATaq、DL 2 000 Marker、DL 5 000 Marker、氨苄青霉素和pMD18-T Simple Vector等购自大连宝生物有限公司;凝胶回收试剂盒(Gel Extraction Kit)购自OMEGA公司;SMARTerTMRACE cDNA Amplification Kit试剂盒采购于Clontech公司;胰蛋白胨、酵母提取物、琼脂糖、溴化乙锭(EB)等其它试剂均为进口或国产分析纯产品。
1.3 总RNA提取
采用TRIzol法提取桦褐孔菌菌丝体的总RNA。利用核酸蛋白测定仪检测提取的总RNA的纯度。
1.4 简并引物设计
在NCBI上下载与桦褐孔菌同属的嗜蓝孢孔菌和相近种属菌株的酸性蛋白酶和金属蛋白酶的氨基酸序列,利用Primer5软件分别设计酸性蛋白酶的1对简并引物(AP1和AP2)和金属蛋白酶的1对简并引物(MP1和MP2)(表1)。

表1 基因克隆使用的引物
1.5 目的基因的PCR扩增
以总RNA通过反转录获得的cDNA为模板,利用所设计的酸性蛋白酶基因和金属蛋白酶基因的简并引物,通过PCR扩增得到目的基因的cDNA片段。再根据此片段设计2对特异性巢式引物(GSP1、GSP2和NGSP1、NGSP2),采用3′-RACE和5′-RACE(Rapid Amplification of cDNA Ends,RACE)法扩增,具体步骤按照SMARTerTMRACE cDNA Amplification Kit试剂盒的说明书进行。将获得的3′-RACE片段和5′-RACE片段在琼脂糖凝胶上确认后,送交测序公司测序;根据测序结果,针对目标DNA全长序列设计1对全序克隆引物(APQC1和APQC2),通过PCR扩增目标DNA全长序列,经琼脂糖凝胶电泳确认后,回收和纯化目标DNA片段、连接到pMD-18T克隆载体上、转化DH 5ɑ,经平板培养、挑取阳性单克隆、经摇菌扩增培养后,将菌液送交测序公司测序。
1.6 序列分析与系统发育树构建
利用DNAMAN软件对目标DNA全长序列进行分析;利用MEGA6软件构建系统发育树;使用InterProScan5在线工具分析目的蛋白的结构域和功能域[21-25];目的蛋白的理化特性利用ProtParam tool在线工具分析;目的蛋白信号肽利用SignalP 4.1 Server在线工具进行预测;利用NCBI在线分析工具Conserved Domain Search Service (CD Search)对模块进行分析。
2 结果与分析
2.1 蛋白酶基因全长的克隆
以菌丝体的cDNA为模板,用简并引物进行PCR扩增后,金属蛋白酶未能获得片段(图1,第1泳道),酸性蛋白酶获得1条390 bp的中间片段(图1,第2泳道)。5′-端获得1条长度为861 bp的基因片段(图1,第4泳道),3′-端获得1条长度为375 bp的基因片段(图1,第3泳道)。cDNA全长测序结果表明,所得酸性蛋白酶基因的cDNA序列全长1 178 bp(图1,第5泳道)。
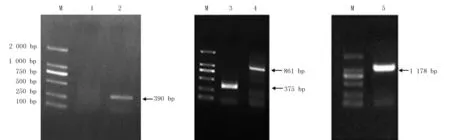
M-DL2000 marker;1-金属蛋白酶cDNA片段(未能扩增出目标片段);2-酸性蛋白酶基因cDNA片段;3-3′-RACE产物;4-5′-RACE产物;5-酸性蛋白酶基因cDNA全长
图1 蛋白酶基因的扩增产物
Fig.1 Amplified product of protease gene fromInonotusobliquus
2.2 序列分析
利用全序克隆引物扩增目标DNA片段获得的产物(图1,第5泳道),回收、纯化后连接到pMD-18T克隆载体上,再转化DH 5ɑ并扩增培养后,送菌测序(图2)。结果表明,试验从桦褐孔菌菌丝体中获得的酸性蛋白酶基因的cDNA序列全长1 178 bp,其序列中第25个碱基至第1 014个碱基之间,包含990 bp开放阅读框(ORF),编码由329个氨基酸所组成的蛋白(该试验中,命名为InonotusobliquusAcid protease,简称IO-AP);该cDNA序列的NCBI GenBank登录号为KT724964.1,其ORF编码的蛋白质的NCBI GenBank登录号为AOO94936.1。

图2 酸性蛋白酶基因的全长cDNA序列及其ORF编码的氨基酸序列
2.3 目的蛋白的理化特性及信号肽
利用在线分析工具ProtParam(http://web.expasy.org/)和SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)对目的蛋白的理化特性和信号肽进行分析(图3),结果表明,该蛋白分子量为34.6 k Da、理论等电点(pI)为4.23,无信号肽;其不稳定系数Instability index (II)为20.91,小于40.0,属于稳定蛋白,以自由态存在。
2.4 目的基因的功能
利用NCBI在线分析工具Conserved Domain Search Service (CD Search)模块进行分析(图4),结果表明,本研究中克隆的目的基因编码的蛋白是一种类胃蛋白酶超级家族的天冬氨酸蛋白酶(即,羧基蛋白酶),属于酸性蛋白酶(图4A)。

图3 目的蛋白(IO-AP)的理化特性及其信号肽
InterProScan5在线工具分析结果表明,该蛋白归属胃蛋白酶超级家族的天冬氨酸蛋白酶A1家族(图4B),含有天冬氨酸蛋白酶结构域、蛋白酶A1家族结构域和天冬氨酸蛋白酶活性中心(第14~25和第198~209氨基酸残基之间),其生物学功能是参与蛋白质水解、天冬氨酸类型蛋白内切酶活性。

GO term prediction:1) Biological Process: GO:0006508 proteolysis;2) Molecular Function: GO:0004190 aspartic-type endopeptidase activity;3) Cellular Component: Non predicted
图4 目的蛋白(IO-AP)的结构域及其功能分析
Fig.4 Structural domain and biological function of the target protein (IO-AP)
2.5 目的蛋白的亲缘关系
在NCBI上通过BLAST,对目的基因编码的蛋白(IO-AP)的氨基酸序列进行一致性搜索。。
由表2可知,IO-AP与来自其它真菌的酸性蛋白酶(acid protease, 简称AP)的氨基酸序列具有一致性;其中,IO-AP与来自鲍姆桑黄菌(Sanghuangporusbaumii)和地中海嗜蓝孢孔菌(Fomitiporiamediterranea)的AP氨基酸序列一致性最高,分别为88%和85%;与来自Gloeophyllumtrabeum(密褐褶孔菌)、Stereumhirsutum(毛韧革菌)、Daedalea quercina(栎迷孔菌)、Coniophora puteana(粉孢革菌)、Neolentinuslepideus(豹皮香菇)、Trametesversicolor(变色栓菌)和Peniophorasp.(隔孢伏革菌)的AP氨基酸序列一致性为68%~72%,均低于80%。
从利用13种不同来源的酸性蛋白酶(AP)所构建的系统进化树(图5)可知,来自13种不同真菌的AP蛋白,在进化上分为2个大分枝,来自桦褐孔菌的IO-AP与来自鲍姆桑黄菌(Sanghuangporusbaumii)、地中海嗜蓝孢孔菌(Fomitiporiamediterranea)和Coniophoraputeana(粉孢革菌)的AP位于同一分枝中,属于伞菌纲真菌AP分枝(类群);而来自其他9种伞菌纲真菌的AP则位于另一个不同的分枝中。相对而言,桦褐孔菌的IO-AP与鲍姆桑黄菌(Sanghuangporusbaumii)的AP在进化上关系最近,其次是地中海嗜蓝孢孔菌(Fomitiporiamediterranea)的AP,Coniophoraputeana(粉孢革菌)的AP在进化上与桦褐孔菌的IO-AP关系较远。从图5上看,图中所涉及的13种不同真菌来源的AP中,除以上3种伞菌纲真菌的AP外,其他同属伞菌纲的9种真菌的AP在进化上关系很远。

表2 IO-AP与其他来源AP的氨基酸序列一致性

桦褐孔菌(AOO94936.1);嗜蓝孢孔菌(XP_007270786.1);鲍姆桑黄菌(OCB89084.1);粉孢革菌(XP_007769668.1);密褐褶菌(XP_007866714.1);密褐褶菌(XP_007866715.1);韧黑伞(KJA23239.1);裂褶菌(XP_003037073.1);毛韧革菌(XP_007309157.1);干朽菌(XP_007319879.1);皱波褶尾菌(KII86690.1);灰树花(OBZ71216.1).
图5 IO-AP蛋白与其他真菌AP蛋白的系统进化树
Fig.5 Phylogenetic tree of IO-AP and other fungus AP proteins
3 讨论
桦褐孔菌(Inonotusobliquus)作为一种药用真菌[5],在市场上需求量很大,但其野生来源非常有限,而且人工栽培受到其子实体产量不足的限制。在实践中,如何提高桦褐孔菌子实体的产量,以满足桦褐孔菌生产的需要,是亟待解决的问题。蛋白酶是一类水解蛋白质肽键的酶[13],它不仅通过蛋白质的水解为生物体提供能量,而且为生物体的生长发育提供营养物质。蛋白酶活性的消长与草菇衰老有关,而且与裂褶菌、双孢蘑菇、盘基网柄菌、平菇及香菇的子实体形成有关[18]。另外,在桦褐孔菌中,也已被证实其子实体产量与蛋白酶活性也有关[20]。
酸性蛋白酶是4种蛋白酶之一,其生理、生化及分子生物学方面,在其他真菌中广泛被研究[15-17];但在桦褐孔菌中,迄今未见相关报道。为阐明蛋白酶与桦褐孔菌子实体形成的关系,该研究以其他真菌来源的酸性蛋白酶基因及其酶蛋白氨基酸序列为基础,采用RACE法,尝试从桦褐孔菌子实体中克隆出酸性蛋白酶基因。结果表明:从桦褐孔菌JL01菌株中分离的目的基因cDNA全长序列长度为1 178 bp,包含由990个碱基所组成的开放阅读框(ORF),编码由329个氨基酸所组成的蛋白(被命名为IO-AP);该cDNA序列的NCBI GenBank登录号为KT724964.1,其IO-AP的NCBI GenBank登录号为AOO94936.1。IO-AP分子量为 34.6k Da、理论等电点(pI)为4.23,无信号肽,是一种稳定蛋白,在细胞质中以自由态形式存在;对IO-AP的生物信息学分析表明,IO-AP属于类胃蛋白酶超级家族的天冬氨酸蛋白酶(即,羧基蛋白酶)A1家族,是一种酸性蛋白酶,其生物学功能是参与蛋白质水解,具有天冬氨酸类型蛋白内切酶活性。IO-AP在进化上与伞菌纲真菌的鲍姆桑黄菌(Sanghuangporusbaumii)AP关系最近,其次为伞菌纲真菌地中海嗜蓝孢孔菌(Fomitiporiamediterranea)AP和粉孢革菌(Coniophoraputeana)AP,在进化树中位于同一分枝中;而其他同属于伞菌纲的9种AP则位于完全不同的另一个分枝中,与IO-AP进化关系很远。
总之,该研究采用RACE法,从桦褐孔菌JL01菌株子实体中克隆出了桦褐孔菌子实体酸性蛋白酶基因cDNA全长序列,并对其进行了生物信息学分析[26-28],为揭示桦褐孔菌子实体发育与酸性蛋白酶的关系及其菌核发育的分子机理奠定了实验基础。
[1] 戴玉成,李玉.中国6种重要药用真菌名称的说明[J].菌物学报,2011,30(04):515-518.
[2] 潘学仁,池玉杰,吴庆禹.药用多孔菌新记录种—桦癌褐孔菌培养特性研究初报[J].中国食用菌,1998,17(04):23-24.
[3] 赵俊,戴玉成,闫绿光.长白山桦树上一种新腐朽病害[J].森林病虫通讯,1998(01):10-11.
[4] 黄年来.俄罗斯神秘的民间药用真菌—桦褐孔菌[J].中国食用菌,2002,21(04):7-8.
[5] 卯晓岚.中国大型真菌资源及其评价[J].西北植物学报,1989,9(01):52-61,68.
[6] Zheng W,Miao K,Liu Y,et al.Chemical diversity of biologically active metabolites in the sclerotia ofInonotusobliquusand submerged culture strategies for up-regulating their production[J].Applied Microbiology and Biotechnology,2010,87(04):1237-1254.
[7] 李喜范,李军,刘鑫,等.桦褐孔菌的药用价值及人工段木培养技术[J].食药用菌,2014,22(02):99-101.
[8] 姚雪松,弥春霞.药用真菌桦褐孔菌的研究进展[J]. 吉林农业,2016(01):80.
[9] Burczyk J,Gawron A,Slotwinska M, et al.Antimitotic activity of aqueous extracts ofInonotusobliquus[J].Bollettino chimico farmaceutico,1996,135(05):306-309.
[10] Ichimura T,Watanabe O,Maruyama S.Inhibition of HIV-1 Protease by Water-Soluble Lignin-Like Substance from an Edible Mushroom,Fuscoporiaobliqua[J].Agricultural and Biological Chemistry,1998,62(03):575-577.
[11] Cui Y,Kim D S,Park K C.Antioxidant effect ofInonotusobliquus[J].Journal of Ethnopharmacology,2005,96(1-2):79-85.
[12] Mizuno T,Zhuang C,Abe K,et al.Antitumor and Hypoglycemic Activities of Polysaccharides from the Sclerotia and Mycelia ofInonotusobliquus(Pers.:Fr.)Pil. (Aphyllophoromycetideae)[J].International Journal of Medicinal Mushrooms,1999,1(04):301-316.
[13] 李飞雄,李江红,梁勤,等.蜜蜂球囊菌几种胞外蛋白酶的特性[J].中国农业科学,2011,44(06):1247-1254.
[14] 王继莲,李明源,陈芸.蛋白酶基因的克隆与表达研究进展[J].食品科学,2015,36(23):377-381.
[15] 吉田文彦.麹菌蛋白分解酵素に關する研究[J].日本農芸化学会誌,1954,28(01):66-70.
[16] Zaugg Christophe,Borg-von Zepelin Margarete,Reichard Utz, et al. Secreted aspartic proteinase family ofCandidatropicalis[J].Infection and immunity,2001,69(1):405-412.
[17] 王云,曾沃坦,钱世凯.黑曲霉Aspergillus niger H菌株所产酸性蛋白酶的质谱法鉴定及酶学特性[J].食品工业科技,2008,29(09):159-161.
[18] 郑海歌,陈明杰,顾向红.草菇发育过程中某些衰老因子的变化[J].上海农业学报,1991(02):27-31.
[19] 郑社会,余建妹.桦褐孔菌人工栽培试验[J].食药用菌,2013,21(03):174-175.
[20] 赵丽.桦褐孔菌代料栽培期间胞外酶活性变化规律研究[D].延吉:延边大学,2011.
[21] 高颖,李梦竹,冯紫洲,等.蓖麻PAL基因片段的克隆与序列分析[J].内蒙古民族大学学报(自然科学版),2013,28(02):179-182.
[22] 杨琦玥,陈通,李键,等.猪NLRC5基因克隆及序列特征分析[J].西南民族大学学报(自然科学版),2016,42(01):39-46.
[23] 刘霜,卢建远,马力,等.山羊ZP3基因的cDNA克隆、序列分析及组织表达研究[J].西南民族大学学报(自然科学版),2015,41(04):412-416.
[24] 李雪峰,王利.一株短小芽孢杆菌的16s rDNA基因序列分析[J]. 西南民族大学学报(自然科学版),2015,41(03):291-294.
[25] 田思勤,张艳,常巧呈,等.两种兔艾美耳球虫顶质体rpoB和TufA基因的扩增及序列分析[J].黑龙江八一农垦大学学报,2014,26(02):40-43.
[26] 孙雨航,张宏,夏成,等.黑龙江地区流行犬瘟热病毒H基因克隆及序列分析[J].黑龙江八一农垦大学学报,2014,26(04):36-39,45.
[27] 王建科,芮萍,程悦宁,等.貉源犬瘟热病毒昌黎株的分离鉴定及其H基因序列分析[J].河北科技师范学院学报,2015,29(03):12-16.
[28] 张蕾,于永昂,杨天佑.小麦TaXRCC1基因的克隆及生物信息学分析[J].河南科技学院学报(自然科学版),2015,43(06):1-7.
Cloning and its bioinformatics analysis of acid protease gene from Inonotus obliquus
LI Jian, ZHANG Yuting, AN Dandan, CHEN Yanqiu*
(AgriculturalCollegeofYanbianUniversity,YanjiJilin133002,China)
In this study, the full-length cDNA sequence of the protease gene fromInonotusobliquusJL01 was cloned and its bioinformatics analysis was conducted. The results showed that the full-length cDNA sequence of the target gene was 1 178 bp containing a 990 bp-ORF encoding a protein (IO-AP) comprising of 329 amino acids. IO-AP was an acid protease involving aspartic-type endopeptidase activity, belonged to aspartic peptidase A1 family of pepsin-retropepsin-like superfamily. IO-AP fromInonotusobliquusrevealed a 88% identity in amino acid sequence with the AP fromSanghuangporusbaumii, a 85% identity with the AP fromFomitiporiamediterranea, whereas the identities of IO-AP fromInonotusobliquuswith the other APs were all less than 75%.
Inonotusobliquus; acid protease; RACE; cloning; sequence analysis
2016-09-27 基金项目:国家自然科学基金项目(31160408和31460536)
李健(1990—),男,吉林长春人,在读硕士,研究方向为生物技术在食药用真菌中的应用。 陈艳秋为通信作者,
E-mail:cyq326@126.com
1004-7999(2016)04-0292-08
10.13478/j.cnki.jasyu.2016.04.003
S567.39
A
