基于iTRAQ技术分析两个不同生态区烟草叶片蛋白组的表达差异
2017-01-18雷波秦嘉廖成松赵会纳丁福章任竹郭玉双潘文杰
雷波,秦嘉,廖成松,赵会纳,丁福章,任竹,郭玉双,潘文杰
(1.贵州省烟草科学研究院烟草行业山地烤烟品质与生态重点实验室,贵州贵阳550081;2.重庆文理学院,重庆402160)
基于iTRAQ技术分析两个不同生态区烟草叶片蛋白组的表达差异
雷波1,秦嘉2,廖成松1,赵会纳1,丁福章1,任竹1,郭玉双1,潘文杰1
(1.贵州省烟草科学研究院烟草行业山地烤烟品质与生态重点实验室,贵州贵阳550081;2.重庆文理学院,重庆402160)
种植在不同生态区的烟草具有不同的香型。但香型物质形成在蛋白组水平的分子机制尚不清楚。本研究用基团标记技术(iTRAQ)对种植在两个不同生态区的烟草主要生育时期叶片中蛋白质的表达进行定量研究及生物信息学分析。结果表明:在鉴定到的2005个蛋白中,有291个在两个生态区烟草4个重要生长发育期叶片中的表达有显著差异,团棵期、旺长期、现蕾期和生理成熟期差异表达蛋白的数目分别为:64、65、90、72。这些差异表达蛋白质主要位于细胞基质、细胞组分以及细胞器中,主要参与代谢过程、细胞组成以及对外界刺激的应激过程;参与光合作用、次生代谢途径的蛋白质在两个生态区的生理成熟期烟叶中的表达差异显著。这暗示不同生态区的烟草叶片蛋白组表达模式不同,参与光合作用和次生代谢物质生物合成相关蛋白质的差异表达,导致不同生态区的烟叶中形成不同的香型物质。
不同生态区;iTRAQ;叶片蛋白组;烟草
烟草是我国重要的经济作物之一,其品质形成与生态因素、品种和栽培技术相关。其中,生态因素对烟叶品质和风味特色影响最大[1、2]。生态因素如温度、水分、光照、大气、养分等都会对烟草的生长产生各种各样的影响,对烟草自身基因的mRNA表达和调控的影响导致蛋白质水平的变化,进而在更高水平上导致次生代谢物质、生理指标以及形态结构上的变化,最终影响烟叶的品质和特色。
受限于检测技术,生态因素对烟叶生长发育和品质的影响主要集中于基因表达量和初烤烟叶化学成分的研究,在蛋白质水平研究较少。Matsuoka等对细胞生长发育不同时期烟草基因的表达量进行了分析[3]。汪耀富等对渗透胁迫下烟草叶片基因的差异表达进行了研究,鉴定出了135个与防御和渗透调节相关的基因[4]。Lei等利用基因芯片技术比较不同生态区烟叶基因表达谱和代谢产物,鉴定了与烟叶香气形成相关的基因[5]。崔红等应用蛋白质双向电泳联用质谱技术对烟草叶片蛋白质组成进行了比较研究,鉴定出了25种表达量上升的蛋白质[6]。
同位素标记相对和绝对定量(isobaric Tags for Relative and Absolute Quantification,iTRAQ)技术是2004年由美国应用生物系统公司开发的蛋白质组学研究技术,具有定量精度高、重复性好的特点,该技术已在少数植物中得到应用[7]。前人研究表明生态环境决定烟叶特色,不同生态区种植烟叶具有不同香型[8],但香气物质形成的分子机制尚不明确,特别是蛋白质水平的分子机制还不清楚。本研究采用iTRAQ技术比较种植在云南省江川(传统典型清香型)和贵州省遵义(传统典型中间香型)烤烟品种K326的生长发育过程的4个关键生育期(团棵期、旺长期、现蕾期和生理成熟期)第11叶位烟叶蛋白质组的表达差异,采用生物信息学分析差异蛋白的功能,探讨生态环境影响烟叶香型物质形成的分子机理。
1 材料与方法
1.1 植物材料
本研究供试材料为烤烟品种K326,于2012年分别种植于贵州省遵义市播州区(简称“ZY”),东经106°17′22"~107°26′25",北纬27°13′15"~28°04′09",海拔1 000 m;云南省江川县(简称“JC”),东经102°45′,北纬24°17′,海拔1 730 m;栽培措施按照当地优质烟叶生产规程进行。在田间选择发育良好的烟株挂牌标记,每个生态点选择20株。分别在团棵期、旺长期、现蕾期和生理成熟期分4次采集新鲜烟叶(第11叶位)样品,每次每个生态区采集20片叶子,将叶片去掉基部和尖部,保留叶片中部,迅速放入液氮中运回实验室,保存于-80℃超低温冰箱中备用。
1.2 烟叶蛋白质的提取
称取适量的烟叶样品,加入500 μL蛋白裂解液溶解,然后分别添加终浓度为1 mmol·L-1的PMSF,2 mmol·L-1的EDTA,5 min后,添加终浓度为10 mmol·L-1的DTT;超声溶解15 min,然后25 000 g离心20 min,取上清;上清液在56℃条件下加入终浓度为10 mmol·L-1DTT处理1 h,还原打开二硫键;再加入终浓度为55 mmol·L-1IAM,暗室静置45 min,进行半胱氨酸的烷基化封闭;随后,加入适量冷丙酮,在-20℃静置2 h,然后25 000 g离心20 min,丢弃上清液;沉淀在200 μL 0.5 mol·L-1TEAB中超声溶解15 min;最后,25 000 g离心20 min后取上清液用于定量。采用Bradford定量技术对烟叶中的蛋白质进行定量,利用12%SDS电泳检测所提取的蛋白质的质量。
1.3 烟叶蛋白质iTRAQ标记、肽段分离及鉴定
取两个生态区4个不同发育阶段烟叶蛋白各100 μg,按照蛋白∶胰蛋白酶=20∶1比例酶解12 h以上。采用真空冷冻干燥酶解液,用30 μL 0.5 mol·L-1TEAB复溶肽段。采用8标iTRAQ试剂进行样品标记,将标记后的各组肽段混合,用SCX柱进行液相分离。其中JC 4个时期(团棵期、旺长期、现蕾期和生理成熟期)烟叶样品分别用113、114、115和116标记,ZY 4个时期(团棵期、旺长期、现蕾期和生理成熟)烟叶样品分别用117、118、119和121标记。将标记后抽干的混合肽段用4 mL缓冲液A(25 mmol·L-1NaH2PO4溶于25%ACN中,pH2.7)复溶。进柱后以1 mL·min-1的速率进行梯度洗脱,经过筛选得到12个组分。每个组分分别用Strata X除盐柱除盐,然后冷冻抽干。将抽干的每个组分分别用缓冲液A(5%ACN、0.1%FA)复溶至约0.5 μg·μL-1的浓度,20 000 g离心10 min,除去不溶物质。每个组分上样8 μL(约4μg蛋白),通过岛津公司LC-20AD型纳升液相色谱仪进行分离。分离程序如下:先以8 μL·min-1的流速进样4 min;然后用洗涤缓冲液B(95%ACN、0.1%FA)以0.3 μL·min-1的流速梯度洗涤40 min,浓度梯度从2%上升到35%;再从35%到80%线性洗涤5 min。最后用80%的缓冲液B洗柱4 min,缓冲液A洗柱1 min。
经过液相分离的肽段进入串联ESI质谱仪:Q-EXACTIVE(ThermoFisher Scientific,San Jose,CA)。一级质谱分辨率设置为70 000(质荷比/半峰宽)。用碰撞能量为27(±12%)的HCD(High energy Collision Dissociation)模式对肽段进行筛选,二级碎片在Orbi中检测,分辨率为17 500。每个峰强度超过20 000的一级母离子打15个二级谱图,一级扫描和二级扫描交替进行。动态排除设定为:15秒相同的母离子打二级不会超过2次。离子源电压设置为1.6 kV。AGC(Automatic Gain Control)通过Orbi来实现,其设置为:对Orbi内控制聚集量在3e-6~1e-5之间的离子进行二级扫描鉴定,扫描的质荷比范围为350~2 000。
1.4 数据分析
1.4.1 蛋白数据库的选择
从NCBI数据库中下载名称为:Nicotiana_benthamiana、Nicotiana_sylvestris、Nicotiana_tabacum的所有蛋白序列共106 856序列到本地磁盘构建新的数据库备用。
1.4.2 MASCOT搜索
使用Mascot 2.3.02在质谱数据输出结果搜索上述数据库,操作时以mgf文件为原始文件。Mascot搜索参数设置如下:Type of search:MS/MS Ion;Enzyme:Trypsin;Fragment Mass Tolerance:±0.02 Da;Mass Values:Monoisotopic;Variable modifications:Gln->pyro-Glu(N-term Q),Oxidation(M),iTRAQ8plex(Y);Peptide Mass Tolerance:±15 ppm;Instrument type:Default;Max Missed Cleavages:1;Fixed modifications: Carbamidomethyl(C),iTRAQ8plex(N-term),iTRAQ8plex(K);Protein Mass:Unrestricted。
1.4.3 生物信息学分析
将ZY和JC的同一生育期烟叶样品蛋白组进行两两比较,当蛋白质丰度水平差异倍数达到1.5倍以上,且经统计检验其P-value值小于0.05时,视为差异蛋白。差异蛋白进行Gene Ontology分析(简称GO分析)和Kyoto Encyclopedia of Genes and Genomes(KEGG)pathway分析[9、10]。
2 结果
2.1两个生态区烟叶中蛋白质的鉴定
两个生态区4个关键发育期共8个样品检测到二级谱图总数为150 913,其中匹配到特有肽段的谱图数量为7 200;对应的总肽段数为4 939,其中鉴定到特有肽段序列的数量为4 110。经Mascot软件比对Nicotiana_benthamiana、Nicotiana_sylvestris、Nicotiana_tabacum的所有106 856个蛋白序列构成的本地数据库后,获得2 005种蛋白质。鉴定到的蛋白质的相对分子质量主要集中在10~70 kDa,其中相对分子质量介于30~40 kDa的蛋白质比例最高,为22.44%,其次是分子量介于20~30 kDa的蛋白质,比例为18.50%。从蛋白质序列长度来看,大部分被鉴定到的蛋白质所含的肽段数量在10个以内,占蛋白质总数的54.91%。
2.2 两个生态区烟叶中蛋白质表达量的差异
在相对定量时,如果同一个蛋白质的量在两个样品间没有显著的差异,那么其蛋白质丰度比接近于1。当蛋白的丰度比即差异倍数达到1.5倍以上,且经统计检验其P-value值小于0.05时,视该蛋白为不同样品间的差异蛋白。以JC烟叶为对照,与团棵期、旺长期、现蕾期和生理成熟期4个时期ZY烟叶中蛋白质的表达量进行比较,两个生态区烟叶4个关键发育时期显著表达差异蛋白共计291个(图1)。
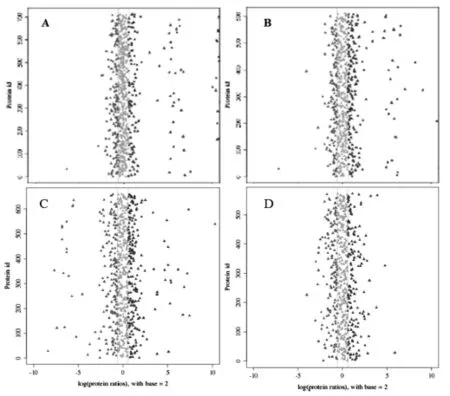
图1 团棵期(A)、旺长期(B)、现蕾期(C)和生理成熟期(D)烟叶蛋白质丰度分布注:横坐标表示差异倍数经过以2为底数的对数转化后的值。大于0的为表达量上调,小于0的为表达量下调。其中差异倍数大于1.5的点用黑色标出,差异倍数不显著用灰色标出。这些黑色的点可能是潜在的差异蛋白,是否是最终被筛选的差异蛋白,还需要进行统计学验证。Fig.1 The distribution of the fold change of the quantified proteins at rosette stage(A),rapid growth stage(B),budding stage(C),and physiologically maturing stage(D).Notes:the x-axis shows the protein ratio[log(protein ratios),with base=2].A protein ratio of>0 indicates up-regulation and<0 indicates down-regulation。The black points perhaps are the differential expressed proteins.Gray indicates no significant change. The differential expression of proteins is defined by both fold change and P-value;however,only fold change is considered here.
与JC烟叶相比,ZY烟叶团棵期总共有64个蛋白质表达量呈显著差异,其中33个蛋白质表达上调,31个蛋白质表达下调;旺长期有65个蛋白质表达量呈显著差异,其中28个表达上调,37个表达下调;现蕾期有90个蛋白质表达量呈显著差异,其中40个表达上调,50个表达下调;生理成熟期有72个蛋白质表达量呈显著差异,其中表达上调的蛋白38个,表达下调的蛋白质34个(图2)。
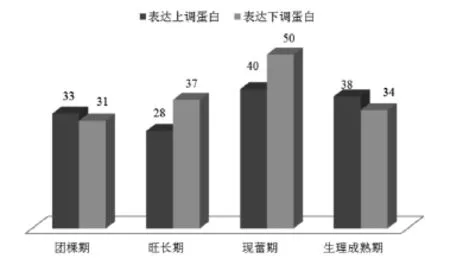
图24 个不同发育时期表达差异蛋白数目Fig.2The number of differentially expressed proteins at the four different developmental stages examined.
2.3两个生态区烟叶差异表达蛋白质的GO功能分析
利用GO工具对两个生态区291个差异表达蛋白进行了功能富集分析。在生物学进程分类中,两个生态区烟叶差异表达蛋白主要集中于新陈代谢(30.88%)、细胞组成(24.99%)和应激响应(13.59%)。在分子功能分类中,差异表达蛋白主要集中于酶(45.35%)和结合蛋白(43.51%)。在所处的细胞位置分类中,差异表达蛋白主要集中于细胞组分(27.24%)、细胞基质(27.24%)和细胞器(22.55%)。
GO分析表明两个生态区烟叶团棵期的64个差异表达蛋白可归于151个GO分类,在82个GO分类中差异达到显著水平(FDR<0.05),包括光合系统II、叶绿体囊膜、核糖蛋白复合体构成、离子结合(金属离子结合)、核苷酸结合、应激响应、离子运输、激素介导的信号转导等;旺长期的65个差异表达蛋白可归于135个GO分类,在43个GO分类中差异达到显著水平(FDR<0.05),包括氧化还原酶激活、叶绿体囊膜构成、大分子结合、碳—碳酶激活、碳固定、金属离子响应、化学刺激响应、葡萄糖代谢等;现蕾期的90个差异表达蛋白可归于165个GO分类,在39个GO分类中差异达到显著水平(FDR<0.05),包括叶绿体囊膜类囊体、光合系统II构成、阳离子结合、顺式—反式异构酶激活、阳离子转导等;而生理成熟期的72个差异表达蛋白可归于118个GO分类,在26个GO分类中差异达到显著水平(FDR<0.05),包括细胞外区域、叶绿体组成、阳离子结合、水解酶活化、葡萄糖苷酶活化、碳水化合物磷酸化酶活化等。
2.4 两个生态区烟叶差异表达蛋白质的KEGG pathway分析
为了进一步了解所检测到的差异蛋白的生物学功能,对两个生态区烟叶差异表达蛋白进行了KEGG Pathway分析[10]。两个生态区的团棵期、旺长期、现蕾期和生理成熟期烟叶差异表达蛋白分别参与63、50、86和51个代谢途径。其中,烟叶发育的4个关键时期差异表达蛋白都富集于光合作用和次生代谢途径,且随着烟叶的生长发育,差异表达的蛋白中参与次生代谢途径的蛋白数量增加。参与次生代谢途径的差异表达蛋白详细信息见表1。

表14 个时期烟叶参与次生代谢途径的差异表达蛋白Table 1 Proteins involved in the biosynthetic pathway of secondary metabolites at the four key stages
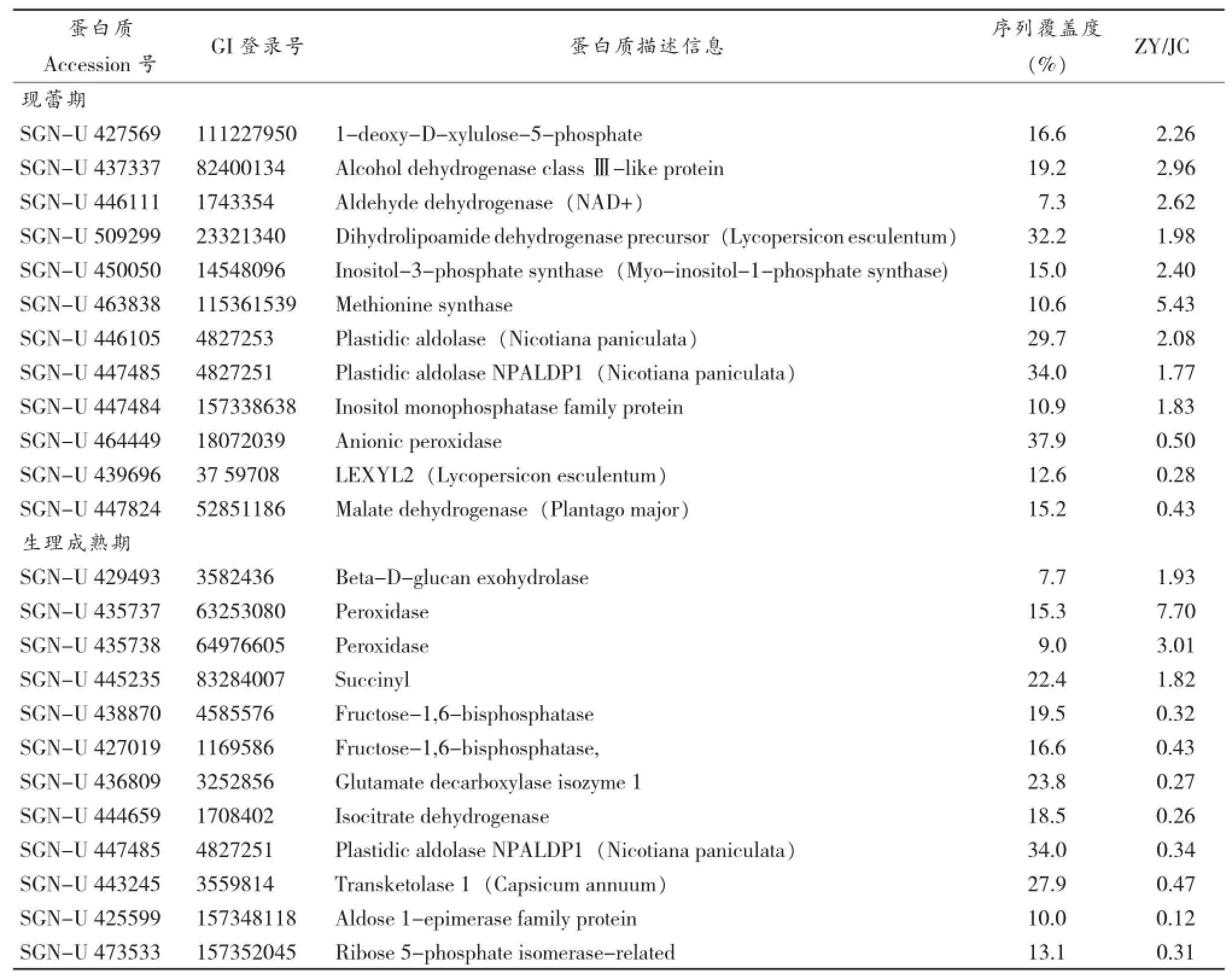
续表
3 结论与讨论
植物开始生长发育过程中,外在的生态环境因素影响植物体内的基因表达[11]。而基因表达是实现基因功能的生物过程。蛋白质是实现基因功能的最重要产物。在本研究中,291个蛋白在两个生态区4个发育时期烟叶中的差异表达,表明不同生态区烟叶在生长过程中生态环境因素导致其基因表达发生变化,从而导致蛋白质差异表达。Lei等的研究同样表明贵州省不同生态区烟叶基因谱表达变化导致次生代谢物质变化,从而影响烟叶的香型[5]。对其他作物的研究也表明,外部环境的改变将导致植物内在环境的改变,从而影响其基因表达、蛋白质合成,进而影响它的激素水平和代谢产物[11]。本文和前人的研究表明,烟叶的香型与烟叶中代谢产物相关[12]。烟叶蛋白质差异表达使得代谢产物不同,最终导致生长在江川和遵义两个生态区的烟叶具有不同的香型。
通常从植物开始生长发育,体内的蛋白质即开始合成。从团棵期到旺长期,第11叶位烟叶形态并没有完全形成。在这个时期内,叶片的生长发育需要大量的蛋白质用于叶片发育细胞的组成成分[13]。因此,在这段时间内烟叶中蛋白质合成代谢水平高,随着叶片的生长发育逐渐开始成熟,叶片中蛋白质分解代谢开始活跃[14、15]。从现蕾期到生理成熟期,烟叶逐渐成熟,蛋白水解酶活性增加,蛋白质降解代谢水平增高[14-16]。在本研究中第11叶位烟叶从现蕾期到生理成熟期差异表达蛋白富集于次生代谢进程、细胞成分和细胞代谢,差异表达蛋白与前人研究相符。
单萜类化合物和类胡萝卜素化合物是茶叶香味物质的重要组成成分或前体物,它们以糖苷化合物形式储存在茶叶中,这些糖苷物质在后续葡萄糖苷水解酶等酶作用下释放出茶叶香气物质[17、18]。前人的研究表明,K326种植在云南省江川时是传统典型性清香型烟叶,而种植在贵州省遵义时为传统典型性中间香型烟叶。在本研究中,种植在这两个地区烟叶的差异表达蛋白质显著富集于次生代谢途径,并且随着烟叶成熟,两个生态区烟叶中富集于次生代谢途径的差异表达蛋白数目增加。在烟草中,次生代谢途径诱导因子,如水杨酸或茉莉酸诱导子能影响次生代谢产物的合成,烟叶中蛋白质介导的次生代谢途径的改变可能会改变次生代谢物质的组成和含量,从而影响烟叶香气化合物的组成。
[1]邵丽,晋艳,杨宇虹,等.生态条件对不同烤烟品种烟叶产质量的影响[J].烟草科技,2002,34(10):40-45.
[2]许自成,刘国顺,刘金海,等.铜山烟区生态因素和烟叶质量特点[J].生态学报,2005,25(7):1748-1753.
[3]MATSUOKA K,DEMURA T,GALIS I,et al.A Comprehensive Gene Expression Analysis toward the Understanding of Growth and Differentiation of Tobacco BY-2 Cells[J].Plant&Cell Physiology,2004,45(9):1280-1289.
[4]汪耀富,杨天旭,刘国顺,等.渗透胁迫下烟草叶片基因的差异表达研究[J].作物学报,2007,33(6):914-920.
[5]LEI B,ZHAO X H,ZHANG K,et al.Comparative Transcriptome Analysis of Tobacco(Nicotiana tabacum)Leaves to Identify Aroma Compound-Related Genes Expressed in Different Cultivated Regions[J].Molecular Biology Reports,2013,40(1):345-357.
[6]崔红,冀浩,张华,等.不同生态区烟草叶片蛋白质组学的比较[J].生态学报,2008,28(10):4873-4880.
[7]YANG M,JIAN D,ZHAO W,et al.Characterization of Proteins Involved in Early Stage of Wheat Grain Development by iTRAQ[J]. Journal of Proteomics,2016,136:157-166.
[8]唐远驹.烟叶风格特色的定位[J].中国烟草科学,2008,29(3):1-5.
[9]PARKINSON J,ANTHONY A,WASMUTH J,et.al.Partigene-Constructing Partial Genomes[J].Bioinformatics,2004,20(9):1398-1404.
[10]SCHMID R,BLAXTER M L.Annot8r:GO,EC and KEGG Annotation of EST Datasets[J].BMC Bioinformatics,2008,9(1):180.
[11]LOBO I.Environmental Influences on Gene Expression[J].Nature Education,2008,1(1):39.
[12]ZHOU S P,XIAO Q,CHEN Y J,et.al.Analysis of Important Aroma Components in Flue-Cured Tobacco Leaves from Different Ecological Regions[J].Acta Tabacaria Sinica,2004,10(1):9-16.
[13]DICKMANN D I GORDON J C.Incorporation of 14C-Photosynthate into Protein during Leaf Development in Young Populus Plants[J].Plant Physiology,1975,56(1):23-27.
[14]ZAVALETA–MANCERA H A,FRANKLIN K A,OUGHAM H J,et.al.Regreening of Senescent Nicotiana Leaves I. Reappearance of NADPH-protochlorophyllide Oxidoreductase and Light Harvesting Chlorophyll A/B Binding Protein[J].Journal of Experimental Botany,1999,50(340):1677-1682.
[15]UEDA T,SEO S,OHASHI Y,et.al.Circadian and Senescence Enhanced Expression of a Tobacco Cysteine Protease Gene[J]. Plant Molecular Biology,2000,44(5):649-657.
[16]VEERASAMY M,HE Y,HUANG B.Leaf Senescence and Protein Metabolism in Creeping Bentgrass Exposed to Heat Stress and Treated with Cytokinins[J].Journal of the American Society for Horticultural Science,2007,132(4):467-472.
[17]SHARMA A,PUNETHA A,GROVER A,et.al.Insights into the Key Enzymes of Secondary Metabolites Biosynthesis in Camellia Sinensis[J].Journal of Bioinformatics and Sequence Analysis,2010,2(5):53-68.
[18]RAWAT R GULATI A.Seasonal and Clonal Variations in Some Major Glycosidic Bound Volatiles in Kangra Tea(Camellia sinensis(L.)O.Kuntze)[J].European Food Research and Technology,2008,226(6):1241-1249.
[责任编辑:和谐]
Comparative iTRAQ Analysis of the Leaf Proteome of Tobacco(Nicotina tabacum L.)Plants Grown in Two Different Ecological Regions
LEI Bo1,QIN Jia2,LIAO Cheng-song1,ZHAO Hui-na1,DING Fu-zhang1, REN Zhu1,GUO Yu-shuang1,PAN Wen-jie1
(1.Upland Flue-Cured Tobacco Quality&Ecology Key Laboratory of China Tobacco of Guizhou Academy of Tobacco Science, Guizhou Guiyang 550081,China;2.Chongqing University of Arts and Sciences,Chongqing 402160,China)
Tobacco plants grown in different ecological regions have different aromas.However,the proteomic mechanism of aromas formation is unknown.In this study,we used iTRAQ to identify differences in the constitutive proteomes of leaves collected from Nicotina tobacum L.plants grown in two typical ecological regions that produce distinct aroma of flue-cured tobaccos.We found that 291 out of a total of 2005 proteins expressions were significantly different between leaves harvested from the two regions in the four key developmental stages.Specifically,the expressions of 64 kinds of proteins in the rosette stage,65 kinds of proteins in the rapid growth stage,90 kinds of proteins in the budding stage,and 72 kinds of proteins in the physiologically maturing stage were different.The differentially expressed proteins mainly occur within the cell membrane,or as cellular components,or in organelles, and are involved in metabolic and cellular processes,and responds to external stimuli.Interestingly,the expression of some proteins involved in photosynthesis and secondary metabolite biosynthesis showed significant differences between leaves harvested from the two regions.These results suggest that the growth of tobacco in different ecological regions will result in different protein expression patterns of tobacco leaves,and that the differences in the expression of proteins involved in photosynthesis and secondary metabolite biosynthesis may largely underlie the differences in aroma.
different ecological regions;iTRAQ;leaf proteome;tobacco
S314;X17
A
096-2347(2016)03-0025-07
10.19478/j.cnki.2096-2347.2016.03.04
2016-05-16
国家自然科学基金项目(31360431);中国烟草总公司重大专项子课题(TS-02-20110014)。
雷波(1981—),女,四川都江堰人,博士,研究员,主要从事烟草栽培和分子生态学研究。E-mail:leibo_1981@163.com
