淹水对滴水观音抗氧化系统和丙二醛的影响
2017-01-18夏红霞朱启红
夏红霞,朱启红
(重庆文理学院水环境修复重点实验室,重庆402168)
淹水对滴水观音抗氧化系统和丙二醛的影响
夏红霞,朱启红*
(重庆文理学院水环境修复重点实验室,重庆402168)
本文研究了淹水对滴水观音抗氧化系统以及丙二醛的影响,揭示滴水观音的抗淹能力为构建理想的湿地植被系统提供实验依据。实验结果表明、淹水处理对植株抗氧化系统和MDA影响较大,1/4和1/2淹水下植株SOD、CAT、MDA含量均先增加后降低,实验后期时与对照组相近;而3/4和全淹处理植株SOD、POD含量持续升高,尤其是全淹处理植株SOD、POD、CAT、MDA等含量显著高于对照(P<0.05)。实验结果显示,滴水观音在1/4淹水时生长最好,高水位(3/4、全淹)胁迫下则抑制植株生长。因此,在利用滴水观音构建湿地系统时,仅能将其种植在低水位。
滴水观音;淹水;抗氧化系统;丙二醛
抗氧化系统中的超氧化物歧化酶(Super Oxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)以及膜脂过氧化产物丙二醛(Malondialdehyde,MDA),它们在抑制植物体内活性氧变化中扮演着十分重要的角色。在正常情况下,通过抗氧化酶的协调作用,植株体内活性氧的产生与消耗处于一个动态平衡状态,从而使植物能够正常生长和发育。但在逆境情况下,这种平衡会被打破,过多的活性氧会抑制抗氧化系统的作用,进而影响植株正常生长[1]。因此,抗氧化酶在缓解逆境对植物的伤害中起着重要的作用。研究植株体内抗氧化系统的变化,可揭示植株对逆境胁迫的适应程度。淹水是滩地植物最常见的逆境胁迫因子之一,淹水易导致土壤缺氧和光照不足,难以维持生物正常的生理代谢和生长发育,从而影响植物的正常功能[2]。植物对淹水逆境的响应包含着极其复杂的生理生化变化,并形成了内部适应机制[3]。因此,研究淹水下植株抗氧化酶系统以及丙二醛的变化,是了解植株对淹水环境适应程度的主要依据,进而为合理构建湿地生态系统提供理论依据。
滴水观音(Alocasia Macrorrhiza)属天南星科海芋属多年生草本植物。相关研究表明,滴水观音可用于湿地处理废水,并取得了较好效果[4]。利用滴水观音处理废水,既可实现废水达标排放,又可出售回收的湿地植物,从而产生一定的经济效益;既利于提高湿地技术的市场竞争力,又利于湿地技术的推广使用。但到目前为止,有关湿地系统中滴水观音生理方面的研究较少,尤其缺乏有关湿地水位对滴水观音生理影响方面的研究报道。为了解滴水观音对湿地水位变化的适应性,更好地服务于湿地系统,本文研究了滴水观音抗氧化系统以及丙二醛对湿地水位变化的响应,以期为利用滴水观音构建湿地系统提供理论依据。
1 材料与方法
1.1 试验材料
滴水观音购自永川某花卉苗圃中心。研究人员将植株种于塑料花盆中,每盆两株,植株高50 cm±3 cm,花盆尺寸为20 cm×15 cm×15cm。
1.2 实验设计
当植物生长正常后,将花盆置于水箱中。试验采用可控制水量的长方形水箱(2.0 m×0.5 m×0.7 m),利用水位调节阀来调节箱内水位。试验设计为不淹水(正常浇水)、1/4淹水、1/2淹水、3/4淹水和全淹。于淹水处理后的第0 d、10 d、20 d、30 d、40 d进行各项指标的测定。每一处理均重复3次。
1.3 样品分析与测定方法
试验时分析测定植株叶片抗氧化酶系统(SOD、POD、CAT)活性及MDA含量。SOD、POD、CAT活性以及MDA含量均采用试剂盒法(南京建成)进行测定。
2 结果与分析
2.1 SOD变化
SOD是一种源于生命体的活性物质,能消除生物体在新陈代谢过程中所产生的有害物质,以保证植物的正常生长[5]。淹水对滴水观音叶片SOD活性影响如图1所示。
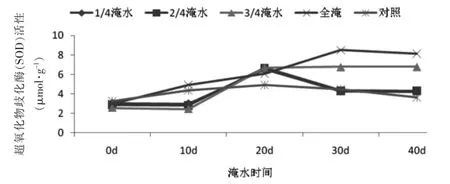
图1 淹水处理下滴水观音SOD活性变化Fig.1 SOD activity change of Alocasia Macrorrhiza under flooding treatment
由图1可见,对照组植株在整个试验阶段SOD活性的变化不大,一直处于相对稳定的状态;但淹水植株SOD变化较大,4组淹水程度不同的滴水观音SOD活性均有所提高,这说明植株自行启动了抗氧化系统酶SOD的表达,以此来清除由于淹水导致植物处于厌氧过程所产生的活性氧,增强自身的调节功能,从而减少活性氧对植物的伤害。何嵩涛等[6]在水涝胁迫对银杏影响的文章中也证实了这一点。实验结果还显示,在第20 d时,全淹植物高出对照组19.3%,达到显著水平(P<0.05);第30 d时,全淹、1/4淹水和1/2淹水SOD活性均有下降,直至最后趋于平稳。但全淹植物SOD酶活性显著高于其他处理(P<0.05);1/4和1/2淹水处理植株SOD酶活性与对照组植株相近。
2.2 POD变化
过氧化物酶(POD)是一类氧化还原酶,它能催化H2O2与酚类反应,从而清除植物体内的过氧化物[7]。淹水处理下滴水观音POD活性变化结果如图2所示。从图2中可以看出,对照组POD的活性基本保持平稳,4种不同淹水程度的植株均呈现上升趋势,POD活性均显著高于对照组(P<0.05)。滴水观音POD活性增加,说明产生的活性氧激活了植物体内的抗氧化系统,以消除其对植物自身的影响。本实验结果与李川等[8]的研究结果不一致,这有可能是因为不同植物对淹水胁迫的适应程度不同而导致的。

图2 淹水处理下滴水观音POD活性变化Fig.2 POD activity change of Alocasia Macrorrhiza under flooding treatment
2.3 CAT变化
过氧化氢酶(CAT)通过催化反应,将H2O2分解为O2和H2O,从而使植物免受过多的H2O2伤害。CAT是植物防御系统的关键酶之一,它的活性变化对植物生理平衡起着重要作用[9]。淹水处理对滴水观音CAT活性的影响见图3所示。由图3可知,对照组植株CAT活性一直处于相对稳定状态,而淹水处理植株变化明显。实验结果显示,1/4和1/2淹水处理植株CAT活性先增加后降低,在实验末期与对照植株相近;而高水位胁迫植株CAT活性持续增加,仅在试验后期上升缓慢,但明显高于对照植株。水位胁迫后第40 d时,全淹植物CAT含量高于对照组52.74%,3/4植物高于对照组47.64%,全淹和3/4淹水植物与对照组之间CAT酶活性增幅存在极显著差异(P<0.01)。

图3 淹水处理下滴水观音CAT活性变化Fig.3 CAT activity change of Alocasia Macrorrhiza under flooding treatment
2.4MDA变化
MDA是植物细胞膜脂过氧化产物之一,通常将其作为植物脂质过氧化指标来衡量植物受胁迫的程度[10]。淹水处理对滴水观音MDA水平的影响如图4所示。由图4可知,试验过程中对照组MDA水平始终处于稳定状态,而淹水植株MDA水平变化较大。1/4、1/2和3/4淹水处理植株MDA水平先增后降,在试验末期均高于对照植株,且3/4淹水处理植株MDA与对照植株相比,差异显著(P<0.05)。全淹处理植株MDA水平持续上升,远远高出对照组和其他淹水处理植株,且差异显著(P<0.05)。
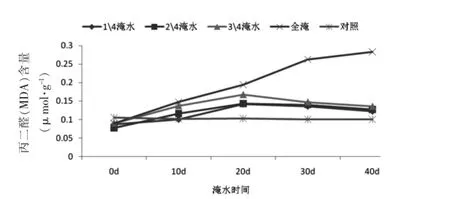
图4 淹水处理下滴水观音MDA活性变化Fig.4 MDA level change of Alocasia Macrorrhiza under flooding treatment
3 分析与讨论
SOD是一种源于生命体的活性物质,它主导歧化反应,使·O-2发生歧化反应生成H2O2和O2[11],从而降低植物体内·O-2和H2O2的浓度,使植物代谢正常。在淹水时,植物根系供氧不足,电子传导无法正常进行,导致植物体内活性氧大量累积,影响植物正常生长[12]。本实验结果显示,淹水期间,植株SOD活性发生明显变化,这是因为植株受到胁迫作用,体内活性氧浓度聚集,刺激植物启动抗氧化系统清除多余的活性氧[13],以保持植物的正常生长,因而SOD活性变化剧烈。随着滴水观音对淹水环境的逐渐适应,1/4淹水和1/2淹水的植株SOD活性开始下降,并最终接近于对照组,这主要是因为1/4淹水和1/2淹水处理植株逐渐适应了淹水环境,并在此环境下正常生长。但3/4处理和全淹处理植株SOD活性明显高于对照植株,且全淹处理与对照植株差异显著(P<0.05)。这主要是高水位胁迫下,植株产生的活性氧量较多,为降低活性氧的毒害,植物体内的抗氧化系统促使体内的SOD活性不断升高,以清除过多的活性氧。蔡金峰等[14]在乌桕幼苗叶片的研究中也提到,植物SOD的变化也是先升高后降低的趋势,说明乌桕幼苗叶片同样具有一定的抗淹能力。
过氧化物酶广泛存在于植物体中,是一种活性较高的酶。POD具有双重性,既能与CAT一起消除H2O2,使H2O2维持在一个较低的水平[15],让植物免受过氧化氢的伤害;也可以参与活性氧的生成,引发细胞膜脂化反应,对植物生长造成伤害[12]。当植物处于淹水状态时,淹水可使体内POD的活性增强,消除过量的过氧化氢,起到保护植物的作用。在实验初期,植物体内的POD含量变化缓慢,这可能是淹水时间较短,植株还未及时响应。淹水处理10 d之后,各实验植株的POD含量明显上升,说明此时植物体内已有大量活性氧产生,植物启动了抗氧化系统,因此POD活性明显增加[13]。而张志远等[16]在对药用菊花的研究中提到,植物体内的POD含量是先增后降再升高的变化趋势,说明了植物在初期不适应淹水的影响,导致植物启动抗氧化机制,最后慢慢适应。在本实验中,淹水后第30 d,各处理植株与对照组的差异达到最大,与对照相比均差异显著(P<0.05);但是各淹水处理植物之间的差异不明显,说明不同的淹水程度对植物POD含量多少影响不显著。
过氧化氢酶(CAT)是以铁卟啉为辅基的结合酶,它可促使H2O2分解为分子氧和水,清除植株体内的过氧化氢,从而使植物免受过氧化氢的毒害,是生物防御体系的关键酶之一。CAT专一清除H2O2,它与SOD协同作用可清除体内具有潜在危害的·O-2和H2O2,从而最大限度地减少·OH的形成[12]。在淹水状态下,植物体内的CAT活性增强,加速了对H2O2的分解从而避免羟基自由基(HO-)的生成,在一定程度上减缓了植物过氧化的发生。本实验结果显示,随着淹水时间延长,淹水植物CAT活性上升,说明因淹水产生的自由基和过氧化氢对细胞膜产生了伤害;作为植物关键酶之一的CAT随之升高,清除过多的自由基和过氧化氢,使植物免遭毒害[15]。20 d以后,1/4和半淹植物CAT活性逐渐降低与对照组持平,可能是植株适应了这一淹水环境,实现了植株的正常生长;而全淹和3/4淹水植物则一直缓慢上升,最终高出对照组52.7%,这可能是高水位胁迫在植物体内产生了过多的自由基和过氧化氢,植物要产生更多的CAT对其进行清除。
丙二醛(MDA)是植物细胞膜脂过氧化产物之一,其含量的高低可以反映逆境胁迫下植物受伤害程度,是膜脂过氧化程度的重要标志[16]。本实验研究表明,实验初期植株MDA含量均缓慢增加,说明了体内过多的活性氧促使植物启动了膜脂脱脂作用[17、18]。但1/4和1/2淹水植株在20 d之后MDA含量出现缓慢下降的趋势,说明滴水观音植物体内清除自由基的能力逐渐提升,从而抑制了膜脂过氧化作用,使植株生长恢复正常,朱启红[19]、刘文革等[7]在研究中也证明了这一点。在全淹条件下,植物体内的MDA含量继续上升,说明高水位胁迫已对植株产生毒害作用,致使植株细胞膜脂过度加重。
4 结论
刘文革等[7]在对西瓜幼苗淹水伤害的研究中提到,其叶片受伤害顺序为:SOD活性受抑制→活性氧增加→SOD、POD活性增加→清除活性氧→淹水水位加深→活性氧再增加→MDA积累→抗氧化酶活性降低→质膜受损。此次实验也出现类似情况。实验结果表明,淹水处理对植株抗氧化系统和MDA含量影响较大,1/4和1/2淹水下植株SOD、CAT、MDA均先增加后降低,实验末期与对照处理相近;而3/4和全淹处理植株SOD、POD持续升高,尤其是全淹处理植株SOD、POD、CAT、MDA等显著高于对照(P<0.05)。实验结果显示,滴水观音在1/4淹水时生长最好,高水位(3/4、全淹)胁迫下则抑制植株生长。因此,在利用滴水观音构建湿地系统时,仅能将其种植在低水位。
[1]潘澜,薛立.植物淹水胁迫的生理学机制研究进展[J].生态学杂志,2011,30(9):2662-2672.
[2]朱启红,夏红霞.淹水胁迫对石菖蒲抗氧化酶系统的影响[J].水生态学杂志,2012,33(4):138-141.
[3]祝宇慧,赵国智,李灵香玉,等.湿地植物对模拟污水的净化能力研究[J].农业环境科学学报,2009,28(1):166-172.
[4]夏红霞,朱启红.锌离子浓度对滴水观音生长合生理特性的影响[J].山西农业科学,2011,39(2):130-132,143.
[5]郭智,贺立源,奥岩松.镉胁迫对龙葵幼苗光合特性和营养元素吸收的影响[J].环境生态学报,2009,18(3):824-829.
[6]何嵩涛,刘国琴,潘卫国.银杏对水涝胁迫的生理反应(Ⅰ)——水涝胁迫对银杏膜脂过氧化作用及保护酶活性的影响[J].山地农业生物学报,2000,19(4):272-275.
[7]刘文革,阎志红,王川,等.西瓜幼苗抗氧化系统对淹水胁迫的响应[J].果树学报,2006,23(6):860-864.
[8]李川,周倩,王大铭,等.模拟三峡库区淹水对植物生长及生理生化方面的影响[J].西南大学学报(自然科学版),2010,33(10):46-50.
[9]刘筱,易守理,高素萍.铅胁迫对紫萼玉簪幼苗SOD,POD和CAT活性的影响[J].安徽农业科学,2011,39(14):8244-8246.
[10]潘澜,薛立.植物淹水胁迫的生理学机制研究进展[J].生态学杂志,2012,31(10):2662-2672.
[11]韩露,张小平,刘必融.香根草对重金属铅离子的胁迫反应研究[J].应用生态学报,2005,16(11):2178-2181.
[12]胡国霞,马莲菊,陈强,等.植物抗氧化系统对水分胁迫及复水响应研究进展[J].安徽农业科学,2011,39(3):1278-1280、1282.
[13]闫成仕.水分胁迫下植物叶片抗氧化系统的响应研究进展[J].烟台师范学院学报(自然科学版),2002,18(3):220-225.
[14]蔡金峰,曹福亮,张往祥.淹水胁迫对乌桕幼苗生长及根系无氧呼吸酶活性的影响[J].中南林业科技大学学报,2013,33(9):5-10.
[15]李玉琴,赵丹丹,余永芳,等.磷胁迫对油菜幼苗Apase·POD·CAT活性的影响[J].安徽农业科学,2011,39(16):9548-9550.
[16]张志远,郭巧生,邵清松.淹水胁迫对药用菊花苗期生理生化指标的影响[J].中国中药杂志,2009,34(18):2285-2289.
[17]张丹凤.淹水胁迫下microRNA介导的玉米不定根生长及抗氧化机制研究[D].河北农业大学,2009.
[18]彭秀.淹水胁迫对香根草生理生化特性的影响[J].四川林业科技,2010,31(1):64-67.
[19]朱启红,夏红霞,李园园,等.铅磷交互作用对石菖蒲抗氧化系统的影响[J].西南农业学报,2015,28(6):2484-2489.
[责任编辑:石坚]
Flooding Stress on Antioxidant System and Malondialdehyde of Alocasia Macrorrhiza
XIA Hong-xia,ZHU Qi-hong*
(Key Laboratory of Water Environment Restoration,Chongqing University of Arts and Sciences,Chongqing 402168,China)
In this paper,the effects of flooding stress on Alocasia Macrorrhiza antioxidant systems and malondialdehyde(MDA)were studied to reveal the flooding resistance of Alocasia Macrorrhiza and to provide an experimental basis for constructing an ideal system of wetland plant.Experimental results showed that plants antioxidant system and MDA,the plant SOD,CAT,MDA of 1/4 and 1/2 flooding treatments increased first,then decreased,and they were close to control at the end of the experiment,while SOD and POD of 3/4 and full-flooded treatments continued to increase,especially SOD,POD,CAT,and MDA of full-flooded treatment were significantly higher than that of control(P<0.05).Experimental results showed that 1/4 treatment grew best and high water(3/4 and full-flooded)stress inhibited plant growth.So,Alocasia Macrorrhiza can only be planted in low water level when used to construct wetland systems.
Alocasia Macrorrhiza;flooding stress;antioxidant system;malondialdehyde
X52
A
2096-2347(2016)03-0040-05
10.19478/j.cnki.2096-2347.2016.03.06
2016-03-15
重庆市自然科学基金项目(CSTC2013JCYJA20024);重庆市教育委员会资助项目(KJ131207)。
夏红霞(1980—),女,四川都江堰人,博士,主要从事环境修复研究。E-mail:287670325@qq.com
*[通讯作者]朱启红(1978—),男,重庆人,博士,教授,主要从事环境修复研究。E-mail:Zhuqh@163.com
