应用激光拉曼光谱判别油菜叶片核盘菌早期侵染
2017-01-17赵艳茹余克强李晓丽
赵艳茹,余克强,李晓丽,何 勇※
(1. 浙江大学生物系统工程与食品科学学院,杭州 310058;2. 西北农林科技大学机械与电子工程学院,杨凌 712100)
应用激光拉曼光谱判别油菜叶片核盘菌早期侵染
赵艳茹1,余克强2,李晓丽1,何 勇1※
(1. 浙江大学生物系统工程与食品科学学院,杭州 310058;2. 西北农林科技大学机械与电子工程学院,杨凌 712100)
病原物核盘菌侵染油菜植株所引发的油菜菌核病严重制约着油菜产业的发展,及早诊断核盘菌的侵染有助于油菜菌核病的早期防治。病原物一般由侵入点向植物寄主四周扩散形成病斑,而与病原物侵染点不同距离的组织区域可代表病害的不同严重程度。该研究采用激光共聚焦显微拉曼光谱仪在800~2 000 cm-1范围内获取健康和染病油菜叶片的拉曼光谱曲线,接着采用小波变换(wavelet transform,WT)进行拉曼光谱的预处理以去除荧光背景的干扰,然后选择主成分因子(principal components,PC-1和PC-2)以及特征参量(1 006,1 156和1 522 cm-1)进行样本间的聚类分析,最后分别基于主成分因子和拉曼特征参量建立最小二乘支持向量机(least squares support vector machine,LS-SVM)进行菌核病侵染油菜叶片不同阶段的判别分析。结果发现采用基于PC-1主成分,1 156和1 522 cm-1处的拉曼强度建立的LS-SVM判别模型可以得到100%的识别率。研究结果表明,通过判别分析油菜叶片菌核病病斑不同区域处的拉曼光谱可以实现核盘菌侵染油菜叶片的早期判别,这为后续探究植物病害的早期监测以及研发油菜叶片菌核病早期诊断拉曼便携仪提供理论参考。
拉曼光谱学;病原物;主成分分析;油菜叶片;菌核病;特征参量;化学计量学方法
0 引 言
油菜菌核病是由核盘菌(sclerotinia sclerotiorum(Lib.) de Bary)引起的植物组织坏死性病害,是一种真菌性病害,菌核病的爆发严重制约着油菜产业的发展。菌核病不仅可以发生于油菜各个生长期,而且可危害油菜植株的不同器官(例如花、叶、茎和果实等)[1-2]。核盘菌首先会通过侵染钉透过叶片表皮角质层侵入油菜叶片,当菌丝通过表皮进入寄主细胞时,会分泌大量的水解酶及毒素进行植物组织(细胞壁、叶绿体等)的瓦解,而叶表皮在菌丝进入植物组织时会发生解离[3]。叶片组织的溃烂会通过病斑来反映。油菜叶片菌核病发病时,病斑初为水渍状,暗青色,后扩大成圆形或不规则形,中间部分成为黄褐色。随着时间的推移,病斑迅速扩大,并长出大量菌丝,叶片也随之腐烂。早期诊断核盘菌侵染对防治油菜菌核病具有重要意义。
酶联免疫吸附技术(enzyme-linked immunosorbnent assay,ELISA)和聚合酶联锁反应(polymerase chain reaction,PCR)技术常用于植物病原物侵染的检测[4]。然而这些方法一般操作复杂,需要专业人员,另外不适用于大规模田间植物病害的检测。近年来,红外光谱由于无损、快速检测的特点已经被广泛用于植物病害的检测中。植物的生理信息在组织受到病原物侵染时会发生相应的改变,例如叶绿素含量降低,酶活性发生变化等[5-12]。而植物一系列的生理变化会影响光谱特性的改变,这也是光谱能够用于植物病害检测的理论基础。然而近红外光谱主要反映的是含氢基团的振动的倍频和合频吸收,并且水的红外吸收很强,这些因素限制了近红外光谱在植物组织检测方面的应用。
拉曼光谱是一种散射光谱,能够体现分子的结构信息,并且水的拉曼散射很弱,这些特点都促进了拉曼光谱在生物样本中的检测应用。被测物质分子的结构和含量等信息均可通过拉曼谱峰的位置、强度和形状来反映[13]。由于拉曼光谱的优越性,其已经开始应用于植物病害检测中。Cialla等[14]直接采用增强拉曼光谱对烟草花叶病毒病原物进行检测。Yeturn等[15]采用激光波长为1 064 nm的便携拉曼光谱仪采集感染菜豆金色花叶病毒的青麻作物的拉曼光谱,并采用单因素方差分析(analysis of variance,ANOVA)对于类胡萝卜素拉曼谱峰位置(1 526 cm-1)的拉曼光谱强度进行显著性分析,结果表明健康、轻微染病与严重染病样本的拉曼光谱强度在P<0.000 1水平上存在显著性差异。Baranski等[16]采用傅里叶变换拉曼光谱成像技术对蔬菜组织中的类胡萝卜素进行原位无损成像发现,病菌侵染会导致植物叶片中类胡萝卜素含量的下降。谭峰等[17]利用拉曼光谱仪在200~3 400 cm-1范围内进行水稻叶片感染稻叶瘟的判别分析,提出双峰(984和994 cm-1;828和851 cm-1)联线的斜率和拉曼光谱散射截面与病害严重程度的良好对应关系。李晓丽等[18]采用共聚焦显微拉曼光谱技术实现了感染炭疽病的茶叶叶片细胞壁结构和化学成分的变化,发现病菌侵染导致细胞壁中纤维素有序机构被破坏,并且纤维素含量降低。植物真菌病害是农业生产的主要病害,而真菌菌丝的生长与几丁质的生成关系密切,有学者采用激光共聚焦拉曼成像技术实现几丁质在菌丝中二维和三维的化学成像图[19]。除此外,拉曼光谱还可用于水果以及树木等植物病害的检测[20-21]。
检测植物病害不仅可以通过直接检测病原物的存在,还可以通过检测由病原物导致的微小病斑来间接进行病原物侵染植物的判别。本研究采用激光共聚焦拉曼光谱特征参量及化学计量学方法进行核盘菌侵染油菜叶片不同严重程度的早期判别分析。
1 材料与方法
1.1 试验样本
本次试验所采用的油菜品种为高油605,核盘菌菌株由浙江大学生物技术研究所提供。具体的病菌接种方法参见文献[5]。选取接种病菌24 h的油菜叶片作为本次试验样本,此时叶片处于核盘菌侵染初期。如图1a为正常样本放大3倍时所拍图片,此时叶片正面尚无明显病斑,叶片背面开始出现轻微的水渍状。但是通过显微镜可以清晰地观察到病斑,如图1b所示。本次试验采用的是菌丝块接种法,菌丝首先会从与叶片接触部分进行侵染,然后再向四周扩散,可以根据病斑的大小范围来初步判定核盘菌的侵染阶段。图1c为病斑放大图,可以发现病斑边缘分界比较明显。图1d为图1c中1区域的10倍显微放大图,可以发现叶片表面已经开始模糊,蜡质层已经大部分被溶解,将其判断为病原物侵染叶片的严重阶段。图1e为图1c中2区域的10倍显微放大图,这时,可以发现油菜叶片表面的蜡质层开始出现溶解,但是叶表皮结构尚较完整,相比图1d,将其判断为病原物侵染叶片的轻微阶段。图1f为健康叶片显微放大图,健康叶片表面的蜡质层完整,表皮细胞充盈。
由于是在20倍显微镜图下获取油菜叶片的表皮的拉曼曲线,因此获取样品相近部位的光谱曲线可以尽量减少样品间光谱的误差,选取如图1中叉号位置处的拉曼光谱曲线。
1.2 仪器及参数
试验仪器:雷尼绍共聚焦拉曼光谱仪(国家海洋局第二海洋研究所)
激发波长:514.5 nm
激光功率:0.5 mW
曝光时间:10 s
光谱扫描范围:800~2 000 cm-1
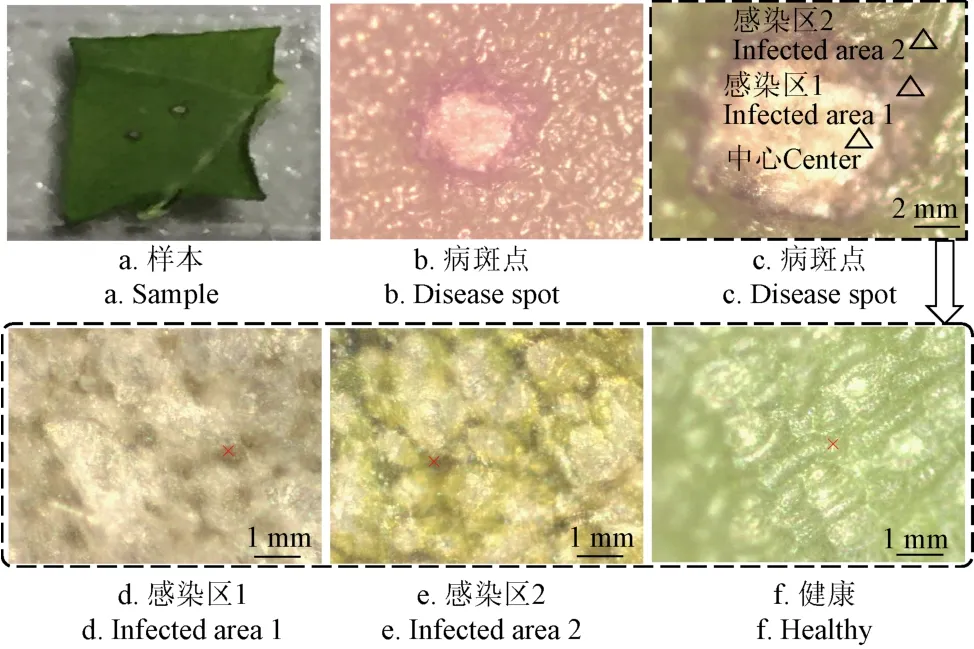
图1 不同感染区域下油菜叶片表面显微图Fig.1 Micrograph of rape leaf within different infected areas
将接种12 h的叶片剪成大约0.5 cm×0.5 cm的方块粘于载玻片上,并置于载物台上。依次将60个病斑样品置于10倍显微镜下,准确找到病斑边缘,如图1c所示,由于病斑中心已经被菌丝覆盖,得不到有效的拉曼光谱曲线。找到病斑后,再在20倍显微镜下,选取病斑中心外围不同的圈作为光谱提取的感兴区,共获得60条拉曼光谱曲线。由于叶片病害组织已经遭到破坏,所含水分较少,因此需要采用较小的激光功率以避免样本烧焦。另外将30个健康样本置于同样条件下获得30条拉曼光谱曲线,最终得到90条拉曼光谱曲线用于进行核盘菌侵染油菜叶片不同侵染阶段的判别分析。本试验采用10%大小的激光光圈以避免鲜叶表面因激光烧蚀产生形变从而影响拉曼光谱的获取。采集拉曼光谱用的软件为Renishaw’s Wire 3.3 software。
1.3 数据分析方法
主成分分析(principal components analysis,PCA)是对样本原始光谱数据中所包含的自变量进行线性组[22]。其主要利用方差最大原则,采用新的低维变量代替原始的高维变量,从而达到数据降维的目的。经PCA变换得到的各主成分之间相互独立,可以有效消除原始数据中的冗余信息。一般采用前几个对偏差量较大的主成分变量代替全部变量进行样本种间聚类判别[23]。
由杂散光和光源引起的噪声会影响拉曼光谱的峰值,谱线宽度等,而可见激光照射有机样品也会造成拉曼信号中荧光背景的干扰,从而造成拉曼光谱信号的漂移以及荧光包[24]。因此,寻求合适的拉曼光谱预处理方法有助于准确地获取试验数据。Baseline算法可以有效去除拉曼光谱的漂移[25]。另外,小波变换(wavelet transform,WT)基于时频域可以对拉曼光谱进行多尺度分解,将被认为成荧光背景的低频率信号置零,然后进行信号的重构,以达到去除荧光背景的目的。
最小二乘支持向量机(least squares support vectormachine,LS-SVM)能够进行线性和非线性的多元建模,能够在少量的训练样本中进行高维特征空间学习,具有较强的泛化能力[26]。在进行LS-SVM运算时,选择合适的核函数参数非常重要[27]。本文采用RBF核函数作为非线性核函数,能够减少训练样本中的计算的复杂度。
本研究中所使用的小波变换和LS-SVM判别模型在MatlabR2009a中完成,Baseline和PCA算法在Unscrambler X10.1(CAMO,Process,AS,Norway)中完成。
2 结果与分析
2.1 拉曼光谱曲线
图2为油菜叶片表面的原始拉曼光谱曲线图,可以发现样本的光谱曲线有明显的3个特征峰,分别为1 006,1 156和1 522 cm-1。1006 cm-1归属于-CH3的面内摇摆振动,1156和1522 cm-1分别归属于C-O-C和C=C双键振动[11]。文献[28]表明1 006,1156和1522 cm-1是类胡萝卜素的特征峰。可能由于核盘菌的侵染导致了油菜叶片中色素的分解,从而影响染病油菜叶片的这3个特征峰处拉曼强度的差异。同时可以发现,图2中染病样本的拉曼光谱曲线发生严重基线漂移现象。
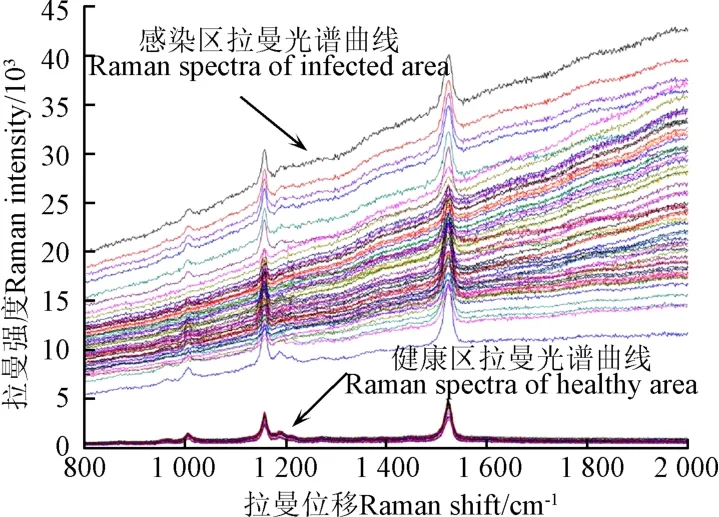
图2 油菜叶片上表皮健康与染病区域的原始拉曼光谱Fig.2 Original Raman spectra of healthy and infected areas on upper epidermis of rape leaves
为了更清晰地探讨核盘菌对油菜叶片的早期侵染机理,将健康样本以及2类染病样本共3类拉曼光谱曲线进行平均取值,得到图3a中的3条平均拉曼光谱曲线。可以直观地发现健康样本几乎没有发生漂移,而染病样本的漂移现象随着染病严重程度的增加而加剧。采用baseline算法进行光谱基线校正,得到图3b。仔细观察发现,感染病害较严重的样本特征峰明显减少,特别是A和B处的拉曼峰几乎消失,不过发现,由于荧光背景信号的影响,经基线校正后的拉曼光谱曲线依然存在漂移现象。接着采用小波变换进行拉曼光谱曲线的预处理。采用bior2.4双正交小波进行7层小波分解后,将最高层的低频系数置零,重构信号后得到图3c。图3c中拉曼光谱曲线中一些细节处的特征峰明显表现出来,而且一些细节处的特征峰也明显表现出来,尤其是1 185 cm-1处的特征峰,其归属于C-N伸缩振动[29]。从图3c可以看出,轻微染病区域的光谱强度与健康样本的拉曼强度值差不多,不过染病严重度高的样本拉曼曲线强度明显较弱。
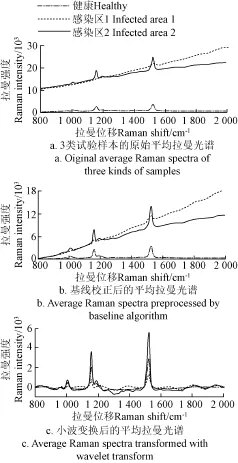
图3 拉曼光谱预处理Fig.3 Preprocessing of Raman spectra
单因素方差分析(one-way analysis of variance,ANOVA)是检验基于一种因素影响,判断两个以上总体的均值相等与否的一种统计方法[30]。本研究采用单因素方差分析对 3 类样本的拉曼光谱曲线强度值进行显著性分析,统计结果如表1所示。可以得出,3个明显特征峰处的拉曼光谱强度值在P<0.05水平处均存在显著性差异。因此可以考虑采用这 3 个特征峰进行油菜叶片核盘菌侵染的早期判别。然而,根据表1发现,这3类样本的拉曼光谱强度值之间没有明显的规律,猜测是由于选取部位病菌侵染较轻,单纯依靠拉曼强度值并不能判断油菜感染菌核病的情况。因此,考虑采用化学计量学方法进行油菜菌核病早期侵染的判别。
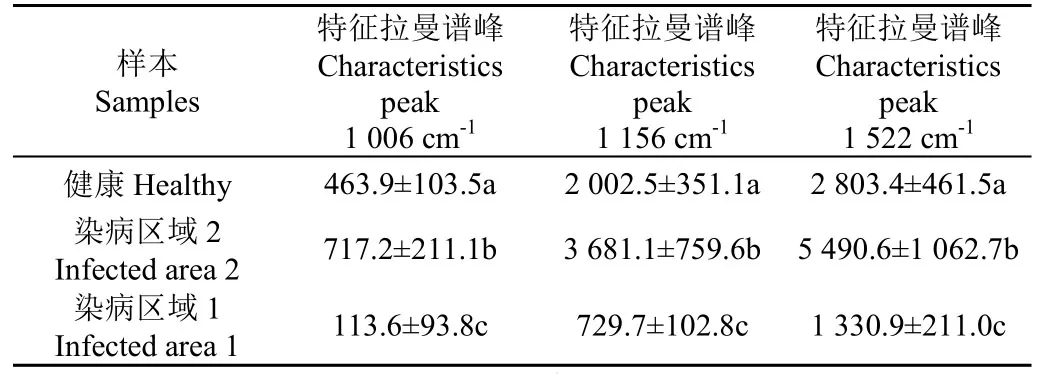
表1 在1 006,1 156和1 522 cm-1处拉曼强度的单因素方差分析结果Table 1 ANOVA statistics results of Raman intensity at 1 006,1 156 and 1 522 cm-1
2.2 样本聚类分析
采用PCA在全谱范围内对样本进行聚类分析,前两个主成分1(PC-1)和主成分2(PC-2)累计可表达93%的原始信息。其聚类结果如图4所示。

图4 3类样品前2个主成分的聚类图Fig. 4 Cluster plot of first two PCs(PC-1 and PC-2)
图4种可以发现3类样本有很好的聚类效果,健康样本与病害严重感染的样本样本集中度较高,并且二者无论在PC-1轴或PC-2轴方向的投影均无重合。而轻微染病样本虽然也能与其他两类样本很好地分开,但是比较分散,而且其在PC-1轴上的投影与健康样本的投影有重合,PC-2轴方向的投影则与严重感染病害的样本有重合。轻微感染病菌的阶段防治病害的有利时期,这个阶段的病症肉眼还无法识别,然而采用拉曼光谱却可以将这个阶段与健康以及严重染病区划分开。如图 4 所示,采用PC-1和PC-2可以得到染病样本间很好的聚类,其中PC-1可表达全部信息的89%,PC-2可表达4%的全部信息,然而整体运算却是基于 7 89个波数,计算过程较为复杂,而且也不利于便携拉曼检测仪的设计。在图3c中可以很清晰地看到 3条特征波段,因此考虑采用这 3个拉曼特征参量进行核盘菌侵染油菜叶片不同阶段的判别。采用这3个波数得到的三维聚类图如图5所示。图5中同样也可以得到 3 类样本间很好的聚类效果,可以看到染病较严重的样本集中于三维块的底部,比较容易判别。但是如表1 所示轻微感染病害样本的拉曼强度值介于健康样本和严重染病之间,图5中健康样本与轻微染病样本的分类没有那么明确。图4和图5表明了单纯依靠无监督聚类并不能判断作物的染病状况,因此需要进一步采用有监督的模式识别方法进行病原物侵染植物的判别。
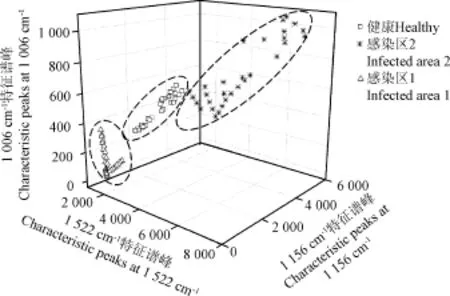
图5 3类样本基于3个特征拉曼谱峰(1 006,1 156和1 522 cm-1)的聚类图Fig.5 Cluster plot with characteristic peaks at 1 006,1 156 and 1 522 cm-1for 3 types of samples
2.3 LS-SVM判别分析
图4和图5中的聚类图可以很好地表达3类样本间的聚类,说明这 3 类样本具有可分性,然而通过聚类图却无法直接判断油菜叶片的染病情况。因此,采用LS-SVM进行油菜叶片核盘菌不同侵染阶段的判别。采用样本的前两个主成分(PC-1和PC-2)以及3个拉曼特征参量(1 006,1 156和1 522 cm-1)和自定义的类值(1,2和3)分别作为LS-SVM模型的输入值进行油菜叶片核盘菌不同侵染阶段的判别。本试验共90个试验样本,随机选取其中的60个样本(每个阶段各20个样本)为建模样本,剩余的30个(每个阶段各10个样本)为预测样本。采用LS-SVM判别模型得到的结果如表2所示。
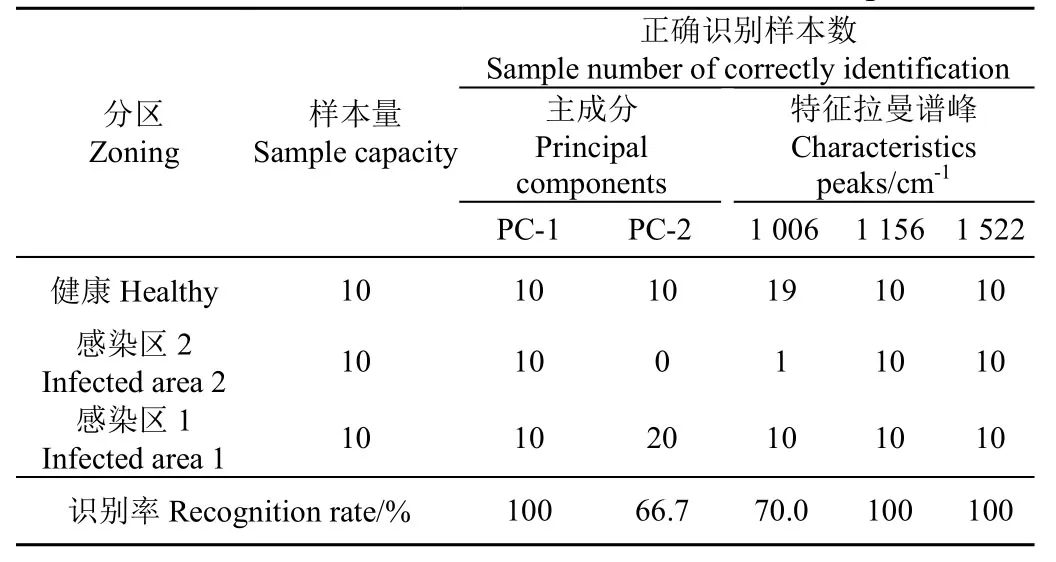
表2 基于主成分和特征拉曼谱峰的LS-SVM模型样本侵染阶段识别结果Table 2 LS-SVM predictive results of sample infection stage based on principal components and characteristics peaks
由表2可得,基于PC-1,1 156和1 522 cm-1建立的LS-SVM判别模型的识别率均为100%。而基于1 006 cm-1和PC-2建立的LS-SVM判别模型仅得到66.7%和70.0%的准确率,其中PC-2-LS-SVM模型中将10个轻微染病样本全部判断成严重染病样本,而1 006 cm-1-LS-SVM判别模型中有 9 个轻微染病样本被判定为健康样本,造成样本判断错误的原因可能为油菜叶片病菌感染初期,叶片表面还未发生明显的变化,而不同的模型对轻微染病样本的判断敏感不同。不过采用1 156与1 522 cm-1均可进行植物染病阶段的判别,而且还避免了寻找大量的特征参量,为油菜菌核病诊断便携仪器的开发提供理论基础。
Yeturn等[15]的试验结果也表明1526 cm-1处的拉曼峰值适用于植物病害的早期检测。但是并不能单纯依靠类胡萝卜素含量的变化就判断病害的种类。造成植物中类胡萝卜素含量的变化有许多原因,例如还有环境因素,非生物胁迫等。
3 结 论
本研究采用激光共聚焦拉曼光谱对接种核盘菌的油菜叶片进行光谱采集,并基于主成分因子与特征参量建立LS-SVM模型,结果表明基于PC-1和1 156 cm-1与1 522 cm-1处的特征参量可以得到100%的识别率;通过判别分析油菜叶片菌核病病斑不同区域处的拉曼光谱可以实现核盘菌侵染油菜叶片的早期判别。在今后的研究工作中可以考虑不同品种的油菜接种不同病害进行病害的早期发现,并辅助其他分子手段进行具体病原物的判别分析。
[1] 郑露,刘友梅,姜道宏,等. 油菜菌核病菌子囊孢子对茎叶的直接侵染研究[J]. 中国油料作物学报,2015,37(5):702-706. Zheng Lu,Liu Youmei,Jiang Daohong,et al. Directly infection of ascospores from Sclerotinia sclerotiorum on leaf and stem of rapeseed[J]. Chinese Journal of Oil Crop Sciences,2015,37(5):702-706.(in Chinese with English abstract)
[2] 吴健,徐江颖,周永明. 甘蓝型油菜抗菌核病研究进展[J].中国油料作物学报,2013,35(5):608-615. Wu Jian,Xu Jiangying,Zhou Yongming. Advances in studies on the resistance to Sclerotinia stem rot in Brassica napus[J]. Chinese Journal of Oil Crop Sciences,2013,35(5):608-615.(in Chinese with English abstract)
[3] 杨谦. 核盘菌侵入油菜超微结构及侵染机制的研究[J]. 植物病理学报,1994,24(3):245-249. Yang Qian. Electron microscopic observation on the ultrastructure of infected oilseed rape by scleroinia sclerotirum(Lib.) de bary and study of the infection mechanism[J]. Acta Phytopathca Sinica,1994,24(3):245-249.(in Chinese with English abstract)
[4] Sankaran S,Mishra A,Ehsani R,et al. A review of advanced techniques for detecting plant diseases[J]. Computers and Electronics in Agriculture,2010,72(1):1-13.
[5] 刘飞,冯雷,楼兵干,等. 基于组合模拟波段的油菜菌核病早期诊断方法研究[J]. 光谱学与光谱分析,2010,30(7):1934-1938. Liu Fei,Feng Lei,Lou Binggan,et al. Study on the early detection of Sclerotinia of Brassica Napus based on combinational stimulated bands[J]. Spectroscopy and Spectral Analysis,2010,30(7):1934-1938.(in Chinese with English abstract)
[6] 杨燕,何勇. 基于高光谱图像的稻瘟病抗氧化酶值早期预测[J]. 农业工程学报,2013,29(20):135-141. Yang Yan,He Yong. Early prediction of antioxidant enzyme value of rice blast based on hyper-spectral image[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE),2013,29(20):135-141.(in Chinese with English abstract)
[7] 谢传奇,冯雷,冯斌,等. 茄子灰霉病叶片过氧化氢酶活性与高光谱图像特征关联方法[J]. 农业工程学报,2012,28(18):177-184. Xie Chuanqi,Feng Lei,Feng Bin,et a1. Relevance of hyperspectral image feature to catalase activity in eggplant leaves with grey mold disease[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE),2012,28(18):177-184.(in Chinese with English abstract)
[8] Xie C ,He Y. Spectrum and image texture features analysis for early blight disease detection on eggplant leaves[J/OL]. Sensors,2016,16(5):676,doi:10.3390/s16050676.
[9] Xie C,Shao Y,Li X,et al. Detection of early blight and late blight diseases on tomato leaves using hyperspectral imaging[J/OL]. Scientific Reports,2015,5:16564,doi:10.1038/srep16564.
[10] Rumpf T,Mahlein A K,Steiner U,et al. Early detection and classification of plant diseases with support vector machines based on hyperspectral reflectance[J]. Computers and Electronics in Agriculture,2010,74(1):91-99.
[11] Xu N,Zhao Y. A band math-ROC operation for early differentiation between sclerotinia sclerotiorum and botrytis cinerea in oilseed rape[J]. Computers and Electronics in Agriculture,2015,118:116-123.
[12] Baranowski P,Jedryczka M,Mazurek W,et al. Hyperspectral and thermal imaging of oilseed rape(Brassica napus) response to fungal species of the genus Alternaria[J/OL]. Plos One,2015,10(3):e0122913.
[13] Gierlinger N,Keplinger T,Harrington M. Imaging of plant cell walls by confocal Raman microscopy[J]. Nature Protocol,2012,7(9):1694-1708.
[14] Cialla D,Deckert-Gaudig T,Budich C,et al. Raman to the limit:Tip-enhanced Raman spectroscopic investigations of a single tobacco mosaic virus[J]. Journal of Raman Spectroscopy,2009,40(40):240-243.
[15] Yeturu S,Vargas Jentzsch P,Ciobotă V,et al. Handheld Raman spectroscopy for the early detection of plant diseases:Abutilon mosaic virus infecting Abutilon sp.[J]. Analytical Methods,2016,8(17):3450-3457.
[16] Baranski R,Baranska M,Schulz H. Changes in carotenoid content and distribution in living plant tissue can be observed and mapped in situ using NIR-FT-Raman spectroscopy[J]. Planta,2005,222(3):448-457.
[17] 谭峰,才巧玲,孙雪成,等. 基于拉曼光谱分析寒地水稻叶瘟病害植株特征[J]. 农业工程学报,2015,31(4):191-196. Tan Feng,Cai Qiaoling,Sun Xuecheng,et al. Analyzing plant characteristics of rice suffering leaf blast in cold area based on Raman spectrum[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE),2015,31(4):191-196.(in Chinese with English abstract)
[18] 李晓丽,罗榴彬,胡小倩,等. 基于共聚焦显微拉曼光谱揭示炭疽病侵染下茶叶细胞壁变化的研究[J]. 光谱学与光谱分析,2014,34(6):1571-1576. LI Xiaoli,Luo Liubin,Hu Xiaoqian,et al. Revealing the chemical changes of tea cell wall induced by anthracnose with confocal Raman microscopy[J]. Spectroscopy and Spectral Analysis,2014,34(6):1571-1576.(in Chinese with English abstract)
[19] 李晓丽,罗榴彬,周斌雄,等. 基于共聚焦显微拉曼的真菌菌丝中几丁质的原位检测研究[J]. 光谱学与光谱分析,2016,36(1):119-124. Li Xiaoli,Luo Liubin,Zhou Binxiong,et al. In vivo study of chitin in fungal hyphae based on confocal Raman microscopy[J]. Spectroscopy and Spectral Analysis,2016,36(1):119-124.(in Chinese with English abstract)
[20] Perez M R,Mendoza M G,Elias M G,et al. Raman spectroscopy an option for the early detection of citrus Huanglongbing[J]. Applied Spectroscopy,2016,70(5):829-839.
[21] Conrad A O,Bonello P. Application of infrared and Raman spectroscopy for the identification of disease resistant trees[J/OL]. Frontiers in Plant Science,2015,6:1152,doi:10.3389/fpls. 2015.01152
[22] Conrad A O,Bonello P,Segtnan V H,et al. Studies on the structure of water using two-dimensional near-infrared correlation spectroscopy and principal component analysis[J]. Analytical Chemistry,2001,73:3153-3161.
[23] He Y,Li X L,Deng X F. Discrimination of varieties of tea using near infrared spectroscopy by principal component analysis and BP model[J]. Journal of Food Engineering,2007,79(4):1238-1242.
[24] Li X L,Sun C J,Luo L B,et al. Nondestructive detection of lead chrome green in tea by Raman spectroscopy[J]. Scientific Reports 2015,5(15729):1-9.
[25] 邵咏妮,蒋林军,潘健,等. 基于显微拉曼检测蛋白核小球藻鉴别丁草胺及草甘膦[J]. 高等学校化学学报,2015,36(6):1082-1086. Shao Yongni,Jiang Linjun,Pan Jian,et al. Identification of glyphosate and butachlor by detecting chlorella pyrenoidosa with raman microspectroscpoy[J]. Chemical Journal of Chinese University. 2015,36(6):1082-1086.(in Chinese with English abstract)
[26] Zhao R U,Yu K Q,He Y. Hyperspectral imaging coupled with random frog and calibration models for assessment of total soluble solids in mulberries[J/OL]. Journal of Analytical Methods in Chemistry,2015,doi:10.1155/2015/343782.
[27] Wu D,He Y,Feng S J,et al. Study on infrared spectroscopy technique for fast measurement of protein content in milk powder based on LS-SVM[J]. Journal of Food Engineering,2008,84(1):124-131.
[28] Baranska M,Schulz H,Rosch P,et al. Identification of secondary metabolites in medicinal and spice plants by NIR-FT-Raman microspectroscopic mapping[J]. Analyst,2004,129(10):926-930.
[29] Haque R A,Lqbal M A,Ahamed M B K,et al. Design,synthesis and structural studies of meta-xylyl linked bis-benzimidazolium salts:potential anticancer agents against‘human colon cancer’[J]. Chemistry Central Journal,2012,6(68):1-14.
[30] 郭萍. 单因素方差分析在数理统计中的应用[J]. 长春大学学报,2014,24(10):1370-1373. Guo Ping. Application of one-way analysis of variance in mathematical statistics[J]. Journal of Changchun University,2014,24(10):1370-1373.(in Chinese with English abstract)
Application of Raman spectroscopy for early detection of rape sclerotinia on rapeseed leaves
Zhao Yanru1,Yu Keqiang2,Li Xiaoli1,He Yong1※
(1. College of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China;2. College of Mechanical and Electronic Engineering,Northwest A&F University,Yangling 712100,China)
Raman spectroscopy technique has been widely used in detecting the physiological information of plants. Due to its unique advantages of simple pre-treating,rapid response,high sensitivity and in-situ,nondestructive detecting,it can be performed to acquire biological information. As an important oil crop,oilseed rape(Brassica napus L.) is widely cultivated all around the world. High energy and protein livestock feed are mainly made from its seeds. It is also partly used as potential raw material in synthesizing biodiesel. However,sclerotinia rot of colza,which is generally caused by fungal pathogens sclerotinia sclerotiorum,seriously limited the development of rapeseed industry. Therefore,early detection of the sclerotinia sclerotiorum infection on rape leaves will helpful to discriminate,prevent and cure the sclerotinia rot of colza on rape plants. In general,plant pathogen spread to the tissue around the invasion point,the different distance between the invasion points on the scab represents different severity of the disease on the host plants. In this study,a total of 90 oilseed rape leaves were collected for this experiment. 90 Raman spectral curves of healthy,mid-infected and severe infected oilseed rape leaves were acquired by confocal micro-Raman spectroscopy in the region of 800-2 000 cm-1. Baseline algorithms were employed to process baseline correction. Wavelet transform based on the time-frequency domain can undertake multi-scale decomposition of Raman spectra,therefore,fluorescent background would be removed by reconstructing the signal without low frequency signal. Herein,wavelet transform was used to remove fluorescence background from the original spectral information. Significant differences at 0.05 level among the three kinds of samples at three characteristic peaks(1 006,1 156 and 1 522 cm-1) were analyzed by one-way analysis of variance(ANOVA) method. Then,principal component analysis(PCA),which can compress the representation of a collection of vectors,was adopted to process cluster analysis. 93% information of the original data was represented by the first two principal components(PC-1 and PC-2). Then,variables of principal components(PC-1 and PC-2) and characteristic peaks(1 006,1 156 and 1 522 cm-1) were employed to process cluster analysis. Finally,least squares support vector machine(LS-SVM) model,which is highly adaptive,was established based on the data of principal components and the characteristic parameters to discriminate the infected severity. The results revealed that LS-SVM models based on the PC-1,1 156 and 1 522 cm-1provided a discriminative accuracy of 100%,LS-SVM discriminative models based on PC-2 and 1 006 cm-1with accuracy of 66.7% and 70.0%,respectively. The results proved that Raman spectra analysis on the disease spot is meaningful for the early detection of disease. Meanwhile,this research provided a theoretical reference for portable Raman instrument designing in disease infection’s early detection. What is more,different varieties of oilseed rape plants infected by different diseases would be detected if Raman spectroscopy technique is applied. Raman spectra coupled with molecular analysis provide a promising way in detecting specific pathogen of plants at early infection stage in future study.
Raman spectroscopy;pathogens;principal component analysis;oilseed rape leaves;sclerotinia;characteristic parameter;chemometrics methods
10.11975/j.issn.1002-6819.2017.01.028
TP391.41;Q945.8
A
1002-6819(2017)-01-0206-06
赵艳茹,余克强,李晓丽,何 勇. 应用激光拉曼光谱判别油菜叶片核盘菌早期侵染[J]. 农业工程学报,2017,33(1):206-211.
10.11975/j.issn.1002-6819.2017.01.028 http://www.tcsae.org
Zhao Yanru,Yu Keqiang,Li Xiaoli,He Yong. Application of Raman spectroscopy for early detection of rape sclerotinia on rapeseed leaves[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE),2017,33(1):206-211.(in Chinese with English abstract)doi:10.11975/j.issn.1002-6819.2017.01.028 http://www.tcsae.org
2016-05-27
2016-10-12
高等学校博士学科点专项科研基金(20130101110104);国家自然科学基金(31471417,31402318)
赵艳茹,女,博士生,研究方向为数字农业信息获取与检测技术的研究。杭州浙江大学生物系统工程与食品科学学院,310058。Email:xiaoru19863804@sina.com.
※通信作者:何 勇,男,教授,博士生导师,研究方向为数字农业,3S技术与农业物联网方面研究。杭州浙江大学生物系统工程与食品科学学院,310058。Email:yhe@zju.edu.cn
