新辅助化疗对进展期胃癌临床分期及肿瘤相关标记物的影响
2017-01-16姚慰峰
姚慰峰
(解放军101医院血液肿瘤科,江苏 无锡 214044)
新辅助化疗对进展期胃癌临床分期及肿瘤相关标记物的影响
姚慰峰
(解放军101医院血液肿瘤科,江苏 无锡 214044)
目的 探讨新辅助化疗对进展期胃癌临床分期及肿瘤相关标记物的影响。方法 按照入院前后顺序将120例进展期胃癌患者分为两组,各60例,观察组术前给予新辅助化疗干预,对照组则直接手术治疗,比较两组手术情况、治疗前后临床分期、肿瘤相关标记物及随访1年复发率。结果 新辅助化疗治疗有效率58.3 %,肿瘤控制率86.7 %。化疗前后观察组患者临床分期比较差异显著(P<0.01)。观察组根治性手术率、随访1年复发率,较对照组的差异有统计学意义(P<0.05);观察组有效率显著高于对照组(P<0.05)。观察组治疗后CEA、CA-199、CA-153阳性表达率均较治疗前明显下降(P<0.05);而对照组治疗前后差异无统计学意义(P>0.05)。结论 新辅助化疗能明显降低进展期胃癌患者术前临床分期及肿瘤相关标记物水平,显著减少肿瘤近期复发。
新辅助化疗; 进展期胃癌; 临床分期; 肿瘤标记物
进展期胃癌在所有胃癌病例中占80 %左右,其治疗以D2根治术为主,能完整切除肿瘤,但术后肿瘤复发几率大[1]。为此术前、术后化疗成为降低术后复发率的重要手段。过去临床辅助化疗通常于手术后进行,对进展期胃癌患者来说效果不是很理想。近年来国内外研究发现新辅助化疗(即术前化疗)可在一定程度上缩小肿块,降低其临床分期,有利于RO切除率提高,进而延长患者生存时间[2]。另外,肿瘤临床分期、肿瘤标记物在进展期胃癌诊断、疗效评定及预后评估中有重要意义。基于此,本资料对我院2012年1月至2014年12月收治的60例进展期胃癌患者术前行新辅助化疗,探讨其对进展期胃癌临床分期及肿瘤相关标记物的影响,为临床预后改善提供依据。报告如下。
1 资料与方法
1.1 纳入及排除标准 纳入标准:(1)影像学(超声、CT)检查、胃镜检查证实为进展期胃癌;(2)Karnofsky评分在60分以上,预计生存期3个月以上;(3)肝功能正常;(4)患者知情同意,均配合完成随访工作。排除标准:(1)肝肾功能严重障碍、合并其他恶性肿瘤;(2)手术及化疗禁忌证;(3)急性胃穿孔、急性并发症及肝脏等器官远处转移;(4)不符合纳入标准者。
1.2 临床资料 选取我院2012年1月至2014年12月收治的进展期胃癌患者120例,按照入院前后顺序将其分为观察组与对照组各60例。观察组中男44例,女16例;年龄36~85岁,平均(60.3±4.8)岁;临床分期:Ⅱb期12例,Ⅲ a期12例,Ⅲb期18例,Ⅲc期18例;肿瘤部位:胃窦部29例,胃体部19例,胃底贲门部12例。对照组中男40例,女20例;年龄38~83岁,平均(60.8±5.0)岁;临床分期:Ⅱb期13例,Ⅲa期14例,Ⅲb期16例,Ⅲc期17例;肿瘤部位:胃窦部28例,胃体部22例,胃底贲门部10例。对比两组年龄、临床分期、肿瘤部位差异无统计学意义(P>0.05),有可比性。
1.3 方法 观察组术前给予化疗,对照组则直接行手术治疗,所有患者术后均给予化疗干预。新辅助化疗选择SOX方案(奥沙利铂+替吉奥):奥沙利铂(南京制药厂有限公司生产,国药准字H20000686)130 mg/m2静滴,第1天;替吉奥胶囊(江苏恒瑞医药股份有限公司生产,国药准字H20100135)第1~14天口服,用药剂量依据体表面积,体表面积在1.25 m2以下者40 mg/次,1.25~1.5 m2者50 mg/次, 1.5 m2以上者60 mg/次, 2 次/d。1周期21 d,干预3周期。围新辅助化疗期间定期行影像、血常规、肝肾功能等相关检查。新辅助化疗干预后1个月左右评估患者手术指征,根据患者情况手术治疗。
1.4 观察指标 (1)化疗效果:分为完全缓解(CR,主要病灶缩小至少50%)、部分缓解(PR,主要病灶缩小28 %~50%)、稳定(SD,病灶缩小28%以下)、进展(PD,病灶增大20 %以上)。有效率=CR率+PR率,控制率=100%-PD率。(2)临床分期,依据美国癌症联合学会(AJCC)制定的临床分期:分为Ⅰ期、Ⅱ期、Ⅲ期及Ⅳ期。(3)手术情况:包括根治性切除术、姑息性手术等。(4)肿瘤标记物:主要包括癌胚抗原(CEA)、癌抗原199(CA-199)、癌抗原153(CA-153)指标,患者清晨空腹抽取静脉血3 mL,常规离心提取上层血清后通过电化学发光免疫分析仪测定上述肿瘤标记物。CEA在5 ng/mL以上、CA-199在39 U/mL以上、CA-153在25 U/mL以上提示阳性。(5)术后随访1年统计两组复发率。

2 结 果
2.1 肿瘤标记物与临床分期关系 不同分期进展期胃癌患者CEA、CA-199、CA-153三者联合检测阳性率明显比各肿瘤标记物单独检测阳性率高(P<0.05)。见表1。

表1 治疗前不同临床分期各肿瘤标记物阳性结果
注:与各肿瘤标记物单独检测比例*P<0.05。
2.2 化疗前后临床分期变化 观察组60例患者新辅助化疗前后临床分期比较差异有统计学意义(H=23.913,P<0.01)。化疗后Ⅰ期从0例上升到3例,Ⅲ期从48例下降至22例。见表2。
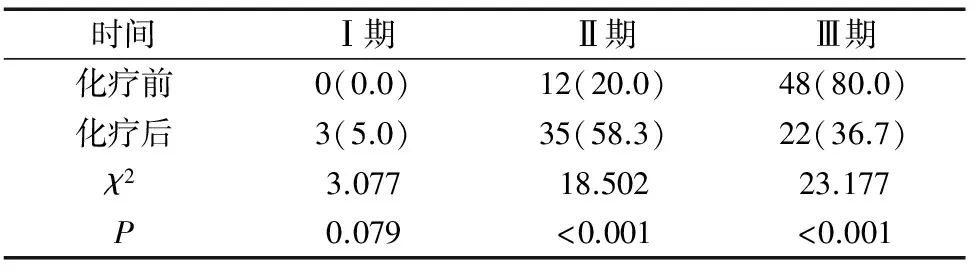
表2 观察组患者化疗前后临床分期比较[n(%),n=60]
2.3 手术情况 观察组根治性手术率86.7 %,姑息性手术率13.3 %;对照组根治性手术率65.0 %,姑息性手术率35.0 %,两组根治性手术率比较差异有统计学意义(P<0.01)。见表3。

表3 两组患者手术情况比较[n(%),n=60]
2.5 治疗后肿瘤标记物阳性情况 观察组治疗后CEA、CA-199及CA-153水平均明显低于对照组,差异有统计学意义(P<0.01)。见表4。

表4 两组患者治疗后肿瘤相关标记物比较±s,n=60)
2.6 随访1年复发情况 观察组随访1年复发6例(10.0 %),对照组复发19例(31.7 %),两组1年复发率比较差异有统计学意义(χ2=8.539,P=0.003)。
3 讨 论
目前临床治疗进展期胃癌以手术为主,以最大限度清除肿瘤及受累区域淋巴结[3],但受操作者技术水平、肿瘤直径、临床分期等多种因素影响,术后复发率较高,为此采取有效措施降低术后复发率成为当下研究的重点。以往一般于术后化疗,但由于手术致使患者大多营养不良,化疗耐受性下降,影响其效果,整体疗效不是很满意[4]。近年来新辅助化疗(即术前化疗)临床应用较多,受到广大医师及患者重视,术前化疗患者耐受性较强,可保持化疗效果,同时对术后化疗干预没有影响。王勇等[5]研究表明新辅助化疗能有效提高进展期胃癌患者手术切除率,有利于其预后改善。本资料观察组术前选择SOX化疗方案干预,其中奥沙利铂作为临床一种新型铂类抗癌药物,可能是通过水化衍生物产生对肿瘤细胞基因作用达到抗肿瘤活性的目的[6];替吉奥属于氟尿嘧啶衍生物,其内含替加氟为5-Fu前体药物,口服生物利用度高,可于人体内转化成5-Fu发挥抗癌作用,相比5-Fu替吉奥具有抗癌活性更强、药物毒性显著减少等特点。本组60例观察组经新辅助化疗干预后有效率58.3 %,肿瘤控制率86.7%。
肿瘤临床分期与癌症病情评估、治疗效果及预后评价密切相关,术前准确临床分期不仅可为新辅助治疗方案可行性分析提供重要依据,而且在很大程度上可直接评价化疗效果[7]。较多研究表明术前肿瘤临床分期越低,根治性切除术成功率越高,预后越好[8]。本组120例进展期胃癌患者为Ⅱ~Ⅲ期,观察组60例患者经新辅助化疗后临床分期明显降低,与化疗前比较差异有统计学意义,表明新辅助化疗能明显降低进展期胃癌患者术前临床分期,与赵群[9]等研究结果基本一致。本资料观察组根治性手术率86.7 %,明显比对照组的65.0 %高,且观察组随访1年复发率明显比对照组低,表明新辅助化疗能有效提高进展期胃癌根治性手术率,改善患者预后,这与新辅助化疗降低术前肿瘤临床分期密切相关。另外,肿瘤标记物在恶性肿瘤诊断、治疗效果评估中有重要意义[10],对于进展期胃癌患者来说,临床常见肿瘤标记物包括CEA、CA-199、CA-153等。其中CEA属于广谱肿瘤标记物,其正常参考值通常在3.4 ng/mL以下;CA-199属于糖类蛋白肿瘤标记物,主要分布于细胞膜上,通常为胰腺癌、结直肠癌肿瘤标记物[11];CA-153临床常用于乳腺癌诊断、疗效观察及预后评估。当肿瘤发生时,CEA、CA-199等肿瘤标记物含量显著上升,主要用于肿瘤性质反映,可帮助肿瘤发生、细胞分化了解,有助于肿瘤诊断、疗效及预后评价[12]。本资料结果显示观察组治疗后CEA、CA-199、CA-153水平明显比对照组低,差异有统计学意义(P<0.05),表明新辅助化疗能明显降低进展期胃癌患者肿瘤相关标记物水平,可见新辅助化疗效果较好,能有效改善其预后。
[1] 李涛,陈凛.SOX方案新辅助化疗应用于进展期胃癌的有效性和安全性研究[J].中华胃肠外科杂志,2011,14(2):104-106.
[2] 刘林,杨新辉,王海江,等.多西他赛联合奥沙利铂及替吉奥治疗进展期胃癌的疗效及对围手术期影响[J].中国肿瘤临床,2013,40(13):788-791.
[3] 黄正明.应用SOX方案新辅助化疗对老年进展期胃癌患者的疗效[J].中国老年学杂志,2015,35(17):4998-4999.
[4] 曲建军,石毅然,刘法荣,等.紫杉醇联合FOLFOX4方案新辅助化疗在进展期胃癌中的临床应用[J].中华胃肠外科杂志,2010,13(9):664-667.
[5] 王勇, 余应筠. 进展期胃癌根治术后患者预后Cox分析[J].贵州医药,2015,39(9):813-815.
[6] 郭涛,姚方,杨爱明,等.进展期胃癌新辅助化疗后超声内镜下TN分期准确率及化疗前后TN期变化与术后病理反应程度相关性的研究[J].中华消化内镜杂志,2011,28(3):122-125.
[7] 崔海滨,葛怀娥,白希永,等.EGFR、HER2、Ki-67、P53在进展期胃癌新辅助化疗疗效预测中的应用[J].中国医药导报,2014,11(2):35-38.
[8] 沈东杰,刘涛,赵恩昊,等.替吉奥联合奥沙利铂治疗进展期胃癌的疗效及对癌组织中MMP-9和VEGF表达的影响[J].实用临床医药杂志,2015,19(5):41-43,47.
[9] 赵群,李勇,檀碧波,等.奥沙利铂联合卡培他滨新辅助化疗方案对进展期胃癌手术切除率及预后的影响[J].中华肿瘤杂志,2013,35(10):773-777.
[10] 俞耀军,祁旦巳,孙维建,等.多西他赛联合奥沙利铂和氟尿嘧啶新辅助化疗治疗进展期胃癌的疗效[J].中华普通外科杂志,2011,26(7):615-616.
[11] 王佳泓,麦聪,洪健,等.外周血CEA和CA19-9在进展期胃癌新辅助化疗中的指导价值[J].中华胃肠外科杂志,2012,15(12):1273-1276.
[12] 张春林,赵林.新辅助治疗在进展期胃癌中的临床应用效果及对预后的影响[J].实用临床医药杂志,2013,17(21):46-49.
R735.2
B
1000-744X(2016)08-0835-03
2016-01-15)
