肉鸡屠宰生产链中的沙门氏菌耐药基因检测及耐药相关性分析
2017-01-14黄秀梅曲志娜王君玮杨瑞梅郑增忍
孙 璐,王 娟,黄秀梅,曲志娜,王君玮,杨瑞梅,郑增忍
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛农业大学,山东青岛 266109)
肉鸡屠宰生产链中的沙门氏菌耐药基因检测及耐药相关性分析
孙 璐1,2,王 娟1,黄秀梅1,曲志娜1,王君玮1,杨瑞梅2,郑增忍1
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛农业大学,山东青岛 266109)
[目的]了解肉鸡屠宰生产链中的沙门氏茵耐药性与耐药基因的相关性。[方法]采用微量肉汤稀释法测定最小抑菌浓度(MIC),对从肉鸡屠宰生产链中分离鉴定的233株沙门氏菌进行13种抗生素药敏实验;采用PCR方法检测15种耐药基因。[结果] 233株肉鸡屠宰生产链中的沙门氏菌对庆大霉素的耐药率最高(100%);对多西环素、氨苄西林、大观霉素、四环素、氟苯尼考、磺胺甲恶唑耐药率分别为84.94%、75.73%、67.78%、56%、52%、50%。233株沙门氏菌中,有231株至少含有1种耐药基因,其中blatem、blaCMY-1、tetB、tetG、tetX、aadA1和cat1基因检出率分别为80.26%、57.94%、54.94%、65.67%、58.37%、63.52%和72.53%。72%的菌株表现为多重耐药,共计57种耐药谱型。[结论]肉鸡屠宰生产链中的沙门氏菌对常见抗生素具有不同程度的耐药性,且耐药基因普遍存在于耐药菌株中;药敏实验结果与耐药基因检测结果有很高的一致性。
沙门氏菌;药敏实验;耐药基因;耐药性
抗生素类药物作为预防、治疗细菌类疾病的首选药物在畜牧生产中被广泛使用,但由于使用不当和用药压力,出现了耐药现象。沙门氏菌是一种常见的人兽共患病原菌,对动物和人都有很大的危害。沙门氏菌在长期进化过程中不断变化,也出现了多重耐药现象[1-3]。禽类是沙门氏菌的主要宿主之一,各种日龄的禽类都能被感染。作为重要的食源性病原菌,沙门氏菌可以通过污染的畜禽肉产品、蛋类、奶类,甚至海洋产品[4-5]等多种渠道感染人类,而感染情况主要取决于细菌血清型和食用者的身体状况。体质低弱的人群极易感染,感染后有多种临床表现,主要以急性肠胃炎为主[6]。本实验对肉鸡屠宰生产链中的沙门氏菌进行了耐药性分析,选择了禽类中常用的抗生素,包括青霉素类、头孢类、氨基糖苷类、四环素类等13种抗生素,设计了15对耐药基因引物,检测沙门氏菌耐药基因携带情况,为研究肉鸡屠宰生产链中沙门氏菌耐药性与耐药基因的关系提供参考,也为控制肉鸡屠宰生产链中的沙门氏菌耐药性提供基础数据。
1 材料
1.1 菌株来源
从山东不同地区的7个大中型屠宰场采样995份,采用PCR方法分离鉴定出233株沙门氏菌,共25种血清型,其中4种为优势血清型,分别为肠炎沙门氏菌、印第安纳沙门氏菌、汤普逊沙门氏菌、德尔卑沙门氏菌。
1.2 主要试剂药品
GoTaq®Green Master Mix酶、DNAMarker DL2000,均购自 TaKaRa 公司;青霉素类(氨苄西林/AM、奥格门丁/A/C)、头孢类(头孢噻呋/EFT)、氨基糖甙类(庆大霉素/GM、大观霉素/SPT)、四环素类(四环素/TE、多西环素/ DOX)、酰胺醇类(氟苯尼考/FFC)、磺胺类(磺胺异噁唑/SF、新诺明/SXT)、喹诺酮类(恩诺沙星/ENR、诺氟沙星/NOR)、粘杆菌素(CLE)等13种药物的96孔药敏板,购自天津市金章科技发展有限公司。
1.3 引物耐药基因引物由上海生工技术有限公司合成。
2 方法
2.1 药敏试验
按照国际通用标准方法——微量肉汤稀释法,测定233株沙门氏菌对8类13种抗菌药的最小抑菌浓度。
2.2 沙门氏菌耐药基因的PCR检测
参照GenBank中耐药基因序列及相关文献,设计了15对引物(表1),其中氨基糖苷类2种、β-内酰胺类4种、四环素类4种、酰胺醇类1种、氟喹诺酮类1种和磺胺类3种。
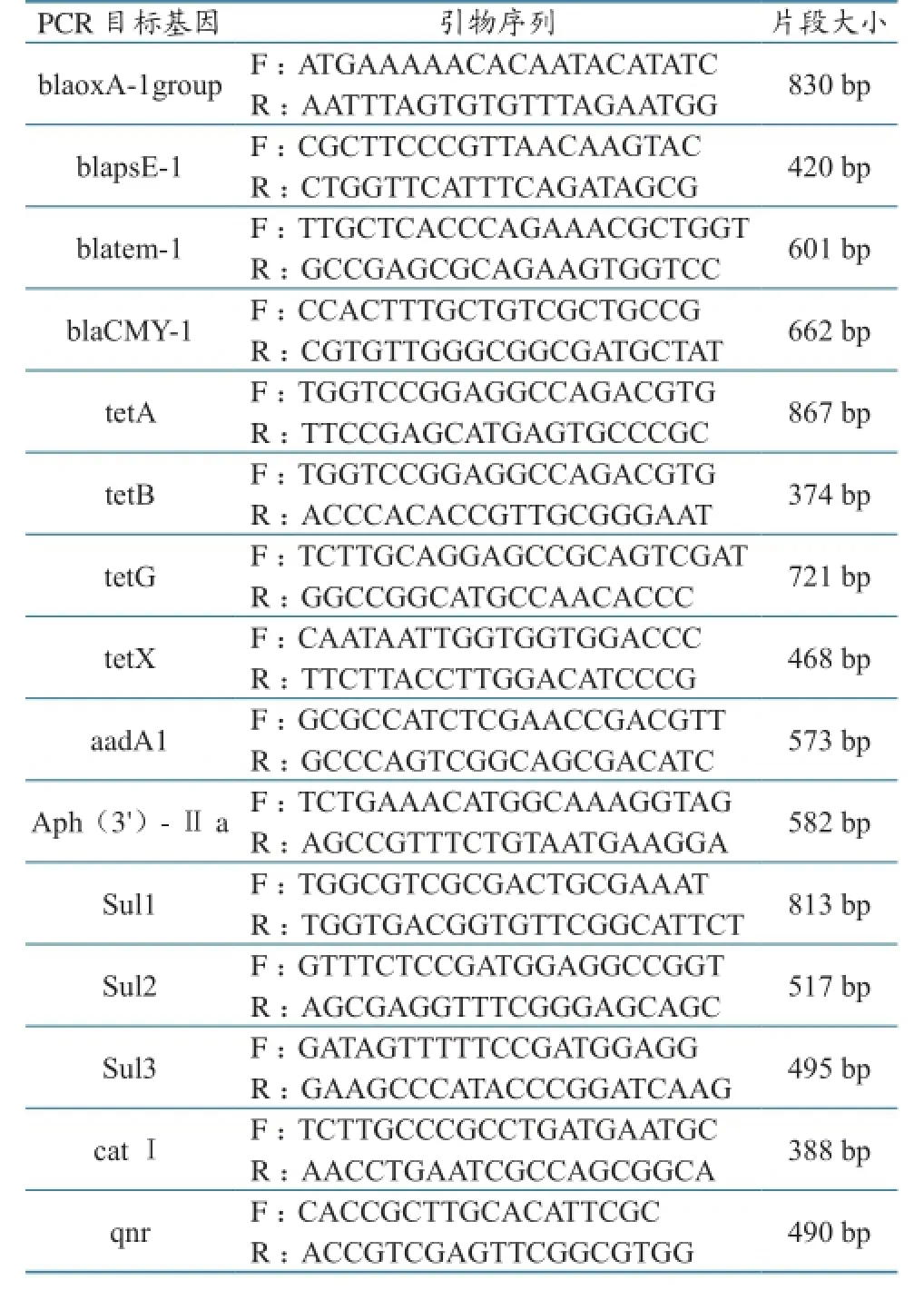
表1 PCR 扩增引物
模板的制备:采用热裂解法提取沙门氏菌DNA。挑取培养18~24 h的沙门氏菌菌落于 1 mL灭菌超纯水中,涡旋均匀后,12 000 r/min 离心5 min,弃上清,加500 µL 灭菌超纯水混匀后置沸水浴中10 min,取出后立即冰浴10 min,12 000 r/ min离心5 min,取上清作为PCR模板,-20 ℃保存备用。
PCR反应体系:25 µL反应体系,模板2.5 µL,上下游引物各2.5 µL,Go Taq®Green Master Mix 12.5 µL,Nuclease-Free Water 9.5 µL。
PCR反应参数:94 ℃ 5 min,94 ℃ 30 s,55~60 ℃ 45 s,72 ℃ 30 s,共30个循环;72 ℃ 10 min;4℃保存。
取5 µL PCR产物,经1.2 %琼脂糖凝胶电泳,于凝胶成像仪上观察、拍照保存结果。
3 结果与分析
3.1 肉鸡屠宰生产链中的沙门氏菌耐药性
233株沙门氏菌对13种药物的耐药程度明显不同。其中,对GM耐药程度最高,为100%,其次为DOX,耐药率为84.94%;对AM、SPT耐药率分别为75.73%和67.78%;对TE、FFC、SXT和SF的耐药率在50%左右;对A/C最为敏感,耐药率仅为5.02%,其次为CLE和NOR,耐药率分别为8.77%和15.81%;对ENR和EFT的耐药率分别为43.93%和42.26%。整体耐药率见图1,耐药种数和耐药菌株数见表2。

图1 233 株沙门氏菌药敏试验结果
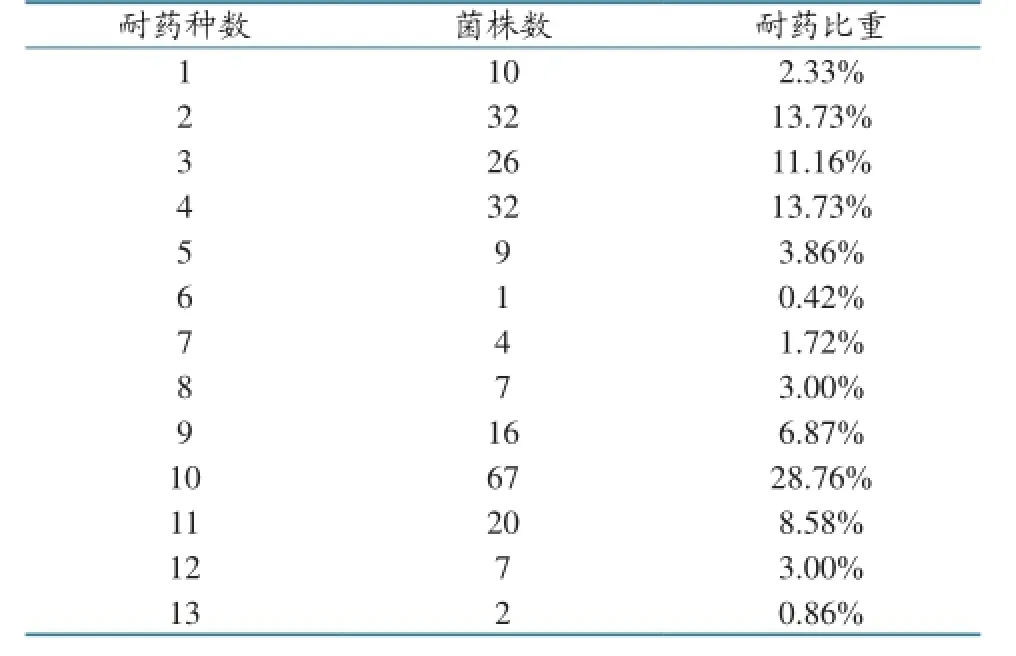
表2 耐药种数与耐药菌株数
233株沙门氏菌中,有2株菌对所有抗生素表现耐药性,未出现全敏感性菌株。223株(95%)沙门氏菌至少可抗2种抗生素,多重耐药率为72.53%;133株菌(57.08%)可抗5种或5种以上抗生素,96株(41.20%)可抗10种或10种以上的抗生素。233株菌产生了57种耐药谱,耐药谱型复杂,主导耐药菌谱是GM-DOX、GM-SPT-DOX-AM、ENR-TE-GM-SPT-DOX-EFT-FFC-SF-SXT-AM。
233株沙门氏菌的多重耐药中检测最多的是7耐,耐药率为37.8%(88株),8耐的有9株,6耐、5耐、4耐和3耐的分别为20株、6株、10株和36株。山东省不同地区沙门氏菌分离株的多重耐药性不同,结果见图2。其中A地区主要表现为3耐(33.8%),B地区主要表现为7耐(70.4%),C地区主要表现为1耐和2耐,D地区主要表现为7耐(68.4%),E地区主要表现为5耐(37.5%),F地区主要表现为2耐(37.8%)。

图2 不同地区沙门氏菌多重耐药率的检测结果
3.2 耐药基因的检测
对233株沙门氏菌进行的15种耐药基因检测中,共检测出14种耐药基因,PCR扩增结果见图3。其中blatem耐药基因的检出率最高,为80.26%(187/233);其次是catI耐药基因,为72.53%(169/233)。blapse-1、blaCMY-1、sul1、sul2、sul3、tetA、tetB、tetG、tetX、Aph(3′)-Ⅱ a、aadA1和qnr的耐药基因检出率分别为25.75%(60/233)、57.94% (139/233)、33.9% (87/233)、12.02% (28/233)、24.89%(58/233)、30.04%(70/233)、54.94%(128/233)、65.67%(153/233)、58.37%(136/233)37.77% (88/233)、63.52%(148/233)和49.36%(115/233)。没有检测到β-内酰胺类的 blaoxA-1 group基因。
3.2.1 β-内酰胺类耐药基因的流行。186株对AM或A/C耐药的沙门氏菌中,有177株扩增到blaspE或blaTEM或blaCMY基因,111株同时扩增到blaTEM和blaCMY基因,50株扩增到blaspE和blaTEM基因,51株扩增到blaspE和blaCMY基因,46株同时扩增到blaspE、blaTEM和blaCMY基因,但是未检测到blaoxA-1基因。表型耐药与耐药基因95%符合。

图3 沙门氏菌耐药基因PCR扩增结果
3.2.2 磺胺类耐药基因的流行。127株对SF或SXT耐药的沙门氏菌中,有125株菌扩增到sull或sul2或sul3基因,118株菌同时扩增到sull、sul2和sul3基因,2株未扩增到sull或sul2或sul3基因,耐药表型与耐药基因型符合率为98%。其中,102株菌扩增到sull和 sul2基因,86株菌同时扩增到sul2和sul3基因,83株菌同时扩增到sull和sul3 基因。
3.2.3 四环素耐药基因的流行。196株对四环素耐药的沙门氏菌中,有142株扩增到tetA或tetB或tetX或tetG基因,表型耐药与耐药基因符合率为72%。其中,42株同时扩增到tetA和tetX基因,25株同时扩增到tetB和tetX基因,20株同时扩增到tetA和tetB基因,15株同时扩增到tetA和tetG基因,27株同时扩增到tetA、tetB和tetX基因,27株仅扩增到tetG基因。
3.2.4 酰胺醇类耐药基因的流行。124株对氯霉素耐药的沙门氏菌中,有80株扩增到catⅠ基因,表型耐药与耐药基因符合率为63%。
3.2.5 氨基糖苷类耐药基因的流行。233株对氨基糖苷类耐药的沙门氏菌中,有158株扩增到aadA1或Aph(3′)-Ⅱa基因,表型耐药与耐药基因符合率为69%,87株同时扩增到aadA1和Aph(3′)-Ⅱa基因。
3.2.6 氟喹诺酮类耐药基因的流行。100株对氟喹诺酮类耐药的沙门氏菌中,有83株扩增到qnr基因,表型耐药与耐药基因符合率为83%。
4 讨论
4.1 沙门氏菌对抗生素的耐药性
近年来,随着抗生素的滥用,世界各地报道的沙门氏菌耐药问题越来越严重,耐药谱不断扩大。本实验对233株沙门氏菌的耐药性检测结果显示,沙门氏菌分离株对庆大霉素、氨苄西林、大观霉素、多西环素、氟苯尼考、磺胺异恶唑耐药率较高,表明该肉鸡屠宰生产链中的沙门氏菌耐药性不容乐观。这与赖海梅等[7]、杨保伟等[8]的研究结果不同,可以看出沙门氏菌对抗菌药物的耐药情况存在一定的地域差异性。本实验中,沙门氏菌对庆大霉素耐药率最高,达100%,这可能与肉鸡养殖过程中相应抗 生素的滥用有关。朱恒文等[9]、张玮等[10]均研究表明沙门氏菌对抗生素的耐药性增强与相应抗生素的大量使用有关。本实验中,233株沙门氏菌中出现2株全抗性菌,95%的菌株至少可抗2种抗生素,57%的至少可抗5种抗生素,41.20%的至少可抗10种或10种以上抗生素,共产生了57种耐药谱,多重耐药率为72.53%,耐药谱型复杂。这与王晓泉等[11]、乐其新等[12]、刘芳萍等[13]的研究结果基本一致,但产生的耐药谱更宽更复杂。同时,Zhang等[14]研究表明,通过肉鸡屠宰加工生产链中的沙门氏菌耐药分析,认为鸡肉产品是多重耐药沙门氏菌的重要载体。细菌耐药性的产生反映了畜禽养殖中抗生素的盲目使用。鸡肉产品通过污染耐药沙门氏菌,可将耐药基因传递到人体,危害人类健康。
4.2 沙门氏菌耐药基因流行
本实验对6类抗生素表型耐药的沙门氏菌携带相应耐药基因的检测结果表明,总体上耐药基因与耐药表型的检测结果基本一致,但存在未检测到耐药基因的情况,这可能是携带其他耐药基因或存在其他耐药机制。本实验的233 株肉鸡屠宰生产链沙门氏菌中,β-内酰胺耐药基因blatem和blaCMY-1,四环素tetB、tetG和tetX,氨基糖苷类aadA1,氟喹诺酮类qnr,酰胺醇类cat1的携带率均≥50%,表明这些耐药基因在该屠宰生产链的沙门氏菌中较为普遍。李郁等[15]对屠宰生猪多重耐药沙门氏菌耐药基因进行检测,结果tetB 和Aph(3′)-Ⅱa基因检出率较高。张玮等[10]对健康猪直肠粪便中的沙门氏菌耐药基因进行检测,结果tetB 和Aph(3′)-Ⅱa基因检出率较高。Ahmed等[16]对分离于埃及病鸡肉中的多重耐药沙门氏菌耐药基因进行检测,结果blaTEM -1、blaCMY-2和tetA基因检出率较高。赵玉林等[17]对鸡源多重耐药沙门氏菌耐药基因进行检测,结果blaTEM-1、tetA和tetB基因检出率最高,且耐药表型与耐药基检测结果基本一致。不同国家和地区的沙门氏菌流行情况及临床抗生素使用习惯,直接导致耐同种药物的沙门氏菌携带的耐药基因不同。
4.3 不同地区耐药性情况分析
本研究选择了山东省的6个地区进行研究发现,不同地区沙门氏菌分离株的多重耐药性不同。这与该地区的饲养条件和饲养环境存在密切关系。A地区位于山东半岛,养殖量较大,肉鸡养殖屠宰标准化、规模化。山东省A地区规模化屠宰场的屠宰环节多,每天屠宰量大,屠宰动物来源为自养,每日由下属的养殖场运输肉鸡到屠宰场进行屠宰,并进行鸡肉的分割和加工,被屠宰鸡的饲养条件相对较好,主要存在的多重耐药为3耐。B地区为山东省畜牧生产大市。该地区的养殖业在全国占有重要地位,肉鸡养殖量很大,屠宰场也相对较多,规模大小参差不齐。本研究中选择了2个中等规模大小的屠宰场,其分离株主要表现为7耐。C地区为山东省的枢纽城市,位于山东省南部,养殖量相对不大,多重耐药情况不严重。D地区位于山东省东部,交通发达,养殖量一般,屠宰来源为自养和周围送宰,其多重耐药性主要表现为7耐。E地区位于山东半岛中部,肉鸡养殖量较大,交通发达。本研究选择了该地区的规模化养殖场,发现其多重耐药性表现为5耐。F地区位于山东省东北部,肉鸡养殖量不大,屠宰场为规模化大型屠宰场,屠宰的动物主要为自养。本研究选择了该地区规模化养殖场,发现其多重耐药率较低。
5 结论
沙门氏菌对常见抗生素具有不同程度的耐药性,且耐药基因普遍存在于耐药菌株中,其药敏实验结果与耐药基因检测结果有很高的一致性。
[1]BUGAREL M,GRANIER S A,WEILL F X,et a1. A multiplex real-time PCR assay targeting virulence and resistance genes in Salmonella enterica serotype Typhimurium[J].BMC microbiology,2011,11(1):151-161.
[2]SONG Y,ROUMAGNAC P,WEIL F X,et a1.A multiplex single nucleotide polymorphism typing assay for detecting mutations that result in decreased fuoroquinelone susceptibility in Salmonella enterica serovars Typhi and Paratyphi A [J].Journal of antimicrobial chemotherapy,2010,65(8):163l-1641.
[3]廖成水,程相朝,张春杰,等. 鸡源致病性沙门氏菌新近分离株的耐药性与耐药基因[J]. 中国兽医科学,2011(7):751-755.
[4] 王娟,郑增忍,王玉东,等. 市售禽肉产品中沙门氏菌污染状况凋齐[J]. 中国动物检疫, 2010,27(7):50-51.
[5] CARVALHO F C T,SOUSA O V,CARVALHO E M R,et al. Antibiotic resistance of Salmonella spp. isolated from shrimp farming freshwater environment in Northeast region of Brazil[J/OL]. Journal of Pathogens,2013(4):1-5. http://10.1155/2013/685193.
[6] 蒋培红. 沙门氏菌的危害及其对畜产品污染的控制策略[J]. 中国动物检疫,2007 (10) : 22-24.
[7]赖海梅,邹立扣,刘书亮,等. 肉鸡屠宰生产链中沙门氏菌耐药基因检测与耐药相关性分析[J]. 食品工业科技,2015(7):187-191.
[8]杨保伟,张秀丽,曲东,等. 2007-2008陕西部分零售畜禽肉沙门氏菌血清型和基因型[J]. 微生物学报,2010(5):654-660.
[9]朱恒文,方艳红,王元兰,等. 肉鸡屠宰加工生产链中沙门氏菌的污染调查及ERIC-PCR溯源[J]. 食品科学,2012,17:48-53.
[10]张玮,李郁,姚健,等. 健康猪直肠粪便中沙门菌I类整合子与耐药基因的检测[J]. 中国微生态学杂志,2010(7):594-598.
[11]王晓泉,焦新安,刘晓文,等. 江苏部分地区食源性和人源沙门氏菌的多重耐药性研究[J]. 微生物学报,2007(2):221-227.
[12]乐其新,李郁,张玮,等. 合肥市生猪肉沙门菌分离株耐药表型与耐药基因的相关性研究[J]. 中国卫生检验杂志,2008,12:2488-2490.
[13]刘芳萍,赵玉林,李昌文,等. 鸡源性沙门氏菌耐药基因检测与耐药相关性分析[J]. 中国预防兽医学报,2013(8):627-630.
[14]ZHANG A Y,WANG H N,TIAN G B,et al. Phenotypic and genotypic characterization of antimicrobial resistance in faecal bacteria from 30 Giant pandas[J]. International Journal of Antimicrobial Agents,2009,33(5):456-460.
[15]李郁,焦新安,魏建忠,等. 屠宰生猪多重耐药沙门菌I类整合子与耐药基因的检测[J]. 中国人兽共患病学报,2008(4):327-330
[16]AHMED A M,SHIMAMOTO T. Genetic analysis of multiple antimicrobial resistance in Salmonella isolated from diseased broilers in Egypt[J]. Microbiology and immunology,2012,56(4):254-261.
[17]赵玉林,刘芳萍,李昌文,等. 鸡源性多重耐药沙门氏菌 类整合子与耐药基因研究[J]. 中国家禽,2012(4):29-32.
(责任编辑:朱迪国)
Drug-resistant Gene Detection of Salmonella in Broiler Slaughtering Production Chain and Correlation Analysis on Drug Resistance
Sun Lu1,2,Wang Juan1,Hung Xiumei1,Qu Zhina1,Wang Junwei1,Yang Ruimei2,Zheng Zengren1
(1. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2. Qingdao Agricultural University,Qingdao,Shandong 266109)
[Objective]In order to recognize the correlation between drug-resistant genes and drug resistance of Salmonella isolated from broiler slaughtering production chain. [Methods] The susceptibility testing of 13 kinds of antibiotics for 233 Salmonella strains were conducted by broth microdilution method which could obtain the minimal inhibitory concentration(MIC)and then 15 kinds of drug-resistant genes were tested by PCR technique. [Results] The drug resistance rate of Salmonella to gentamicin(GM)was the highest(ratio of 100%),and that to doxycycline(DOX),ampicillin(AM),spectinomycin(SPT),tetracycline(TE),florfenicol(FFC),sulfamethoxazole(SF)were 84.94%,75.73%,67.78%,56%,52% and 50%,respectively. At least one drug-resistant gene was detected in 231 Salmonella strains among all of the 233 strains. Besides,the following drug-resistant genes were commonly present,containing blatem,blaCMY-1,tetB,tetG,tetX,aadA1 and cat1,and the detection rates of them were 80.26%,57.94%,54.94%,65.67%,58.37,63.52% and 72.53%,respectively. 72% of the strains showed multiple antibiotic resistance and 56 kinds of drug-resistance profles were identifed. [Conclusion]The Salmonella strains isolated from broiler slaughtering production chain showed drug resistance against common antibiotics in different degree,and drugresistant genes were widely existed in resistant strains. At the end,the two results of susceptibility testing and drugresistant gene detection are in good consistence.
Salmonella;susceptibility testing;drug-resistant gene;drug resistance
book=35,ebook=41
S851.34
B
1005-944X(2017)01-0035-06
10.3969/j.issn.1005-944X.2017.01.010
农业部农产品质量安全风险评估项目(GJFP201500803);科技部科技基础性工作专项(2012FY111000)
郑增忍
